Вирус гриппа А
Вирион имеет сферическую форму и диаметр 80 – 120 нм, его молекулярная масса 250 МД. Геном вируса представлен однонитевой фрагментированной (8 фрагментов) негативной РНК с общей м. м. 5 МД. Тип симметрии нуклеокапсида спиральный. Вирион имеет суперкапсид (мембрану), содержащий два гликопротеида – гемагглютинин и нейраминидазу, которые выступают над мембраной в виде различных шипов (рис. 85). Гемагглютинин имеет структуру тримера с м. м. 225 кД; м. м. каждого мономера 75 кД. Мономер состоит из меньшей субъединицы с м. м. 25 кД (НА2) и большей – с м. м. 50 кД (НА1).
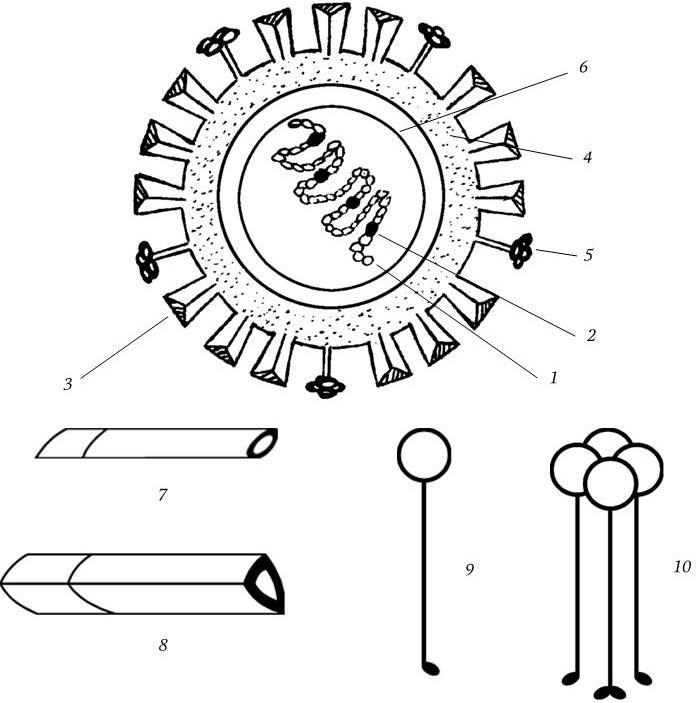
Рис. 85
1 – спираль РНП; 2 – белки РВ1, РВ2, РА; 3 – гемагглютинин; 4 – липидный бислой; 5 – нейраминидаза; 6 – матриксный белок; 7, 8 – мономер и тример гемагглютинина; 9, 10 – мономер и тетрамер нейраминидазы
Основные функции гемагглютинина:
1) распознает клеточный рецептор – мукопептид, имеющий N-ацетилнейраминовую (сиаловую) кислоту;
2) обеспечивает слияние мембраны вириона с мембраной клетки и мембранами ее лизосом, т. е. отвечает за проникновение вириона в клетку;
3) определяет пандемичность вируса (смена гемагглютинина – причина пандемий, его изменчивость – эпидемий гриппа);
4) обладает наибольшими протективными свойствами, отвечая за формирование иммунитета.
У вирусов гриппа А человека, млекопитающих и птиц обнаружено 13 различающихся по антигену типов гемагглютинина, которым присвоена сквозная нумерация (от Н1 до Н13).
Нейраминидаза (N) является тетрамером с м. м. 200 – 250 кД, каждый мономер имеет м. м. 50 – 60 кД. Ее функции: 1) обеспечение диссеминации вирионов путем отщепления нейраминовой кислоты от вновь синтезированных вирионов и мембраны клетки; 2) совместно с гемагглютинином определение пандемических и эпидемических свойств вируса. У вируса гриппа А обнаружено 10 различных вариантов нейраминидазы (N1 – N10).
Нуклеокапсид вириона состоит из 8 фрагментов вРНК и капсидных белков, образующих спиралевидный тяж. На 3'-концах всех 8 фрагментов вРНК имеются одинаковые последовательности из 12 нуклеотидов. 5'-концы каждого фрагмента также имеют одинаковые последовательности из 13 нуклеотидов. 5'– и 3'-концы частично комплементарны друг другу. Это обстоятельство, очевидно, позволяет осуществлять регуляцию транскрипции и репликации фрагментов. Каждый из фрагментов транскрибируется и реплицируется самостоятельно. С каждым из них прочно связаны четыре капсидных белка: нуклеопротеид (NP), он выполняет структурную и регуляторную роль; белок РВ1 – транскриптаза; РВ2 – эндонуклеаза и РА – репликаза. Белки РВ1 и РВ2 обладают основными (щелочными) свойствами, а РА – кислотными. Белки РВ1, РВ2 и РА образуют полимер. Нуклеокапсид окружен матриксным белком (М1-белком), который играет ведущую роль в морфогенезе вириона и защищает вирионную РНК. Белки М2 (кодирует одна из рамок считывания 7-го фрагмента), NS1 и NS2 (кодируются восьмым фрагментом вРНК, который имеет, как и седьмой фрагмент вРНК, две рамки считывания) синтезируются в ходе репродукции вируса, но в его структуру не входят.
Жизненный цикл вируса. Адсорбция вируса на мембране клетки происходит благодаря взаимодействию его гемагглютинина с мукопептидом. Затем вирус проникает в клетку с помощью одного из двух механизмов: 1) слияние мембраны вириона с мембраной клетки или 2) по пути окаймленная ямка – окаймленный пузырек – эндосома – лизосома – слияние мембраны вириона с мембраной лизосомы – выход нуклеокапсида в цитозоль клетки. Второй этап «раздевания» вириона (разрушение матриксного белка) происходит на пути к ядру. Особенность жизненного цикла вируса гриппа заключается в том, что для транскрипции его вРНК необходима затравка. Дело в том, что вирус не может сам синтезировать «шапочку», или кэп (англ. cap) – особый участок на 5'-конце мРНК, состоящий из метилированного гуанина и 10 – 13 прилежащих нуклеотидов, который необходим для распознавания мРНК рибосомой. Поэтому он с помощью своего белка РВ2 откусывает шапочку от клеточной мРНК, а так как синтез мРНК в клетках происходит только в ядре, вирусная РНК должна обязательно проникнуть сначала в ядро. Она проникает в него в виде рибонуклеопротеида, состоящего из 8 фрагментов РНК, связанных с белками NP, PB1, PB2 и PA. Теперь жизнь клетки полностью подчиняется интересам вируса, его репродукции.
Особенность транскрипции. В ядре на вРНК синтезируются три типа вирусспецифических РНК: 1) позитивные комплементарные РНК (мРНК), используемые в качестве матриц для синтеза вирусных белков; они содержат на 5'-конце шапочку, отщепленную от 5'-конца клеточной мРНК, а на 3'-конце – поли-А-последовательность; 2) полноразмерная комплементарная РНК (кРНК), которая служит матрицей для синтеза вирионных РНК (вРНК); на 5'-конце кРНК шапочки нет, на 3'-конце отсутствует поли-А-последовательность; 3) негативная вирионная РНК (вРНК), являющаяся геномом для вновь синтезированных вирионов.
Немедленно, еще до завершения синтеза, вРНК и кРНК вступают в ассоциацию с капсидными белками, которые поступают в ядро из цитозоля. Однако в состав вирионов включаются только рибонуклеопротеиды, связанные с вРНК. Рибонуклеопротеиды, содержащие кРНК, не только не попадают в состав вирионов, но даже не покидают ядро клетки. Вирусные мРНК поступают в цитозоль, где и транслируются. Вновь синтезированные молекулы вРНК после ассоциации с капсидными белками мигрируют из ядра в цитозоль.
Особенности трансляции вирусных белков. Белки NP, PB1, PB2, PA и M синтезируются на свободных полирибосомах. Белки NP, PB1, PB2 и PA после синтеза из цитозоля возвращаются в ядро, где и связываются с вновь синтезированной вРНК, а затем в виде нуклеокапсида возвращаются в цитозоль. Белок матриксный после синтеза движется к внутренней поверхности клеточной мембраны, вытесняя из нее в этом участке клеточные белки. Белки H и N синтезируются на рибосомах, связанных с мембранами эндоплазматического ретикулума, транспортируются по ним, подвергаясь гликозилированию, и устанавливаются на внешней поверхности клеточной мембраны, образуя шипы как раз напротив белка М, расположенного на ее внутренней поверхности. Белок Н подвергается в ходе процессинга разрезанию на НА1 и НА2.
Заключительный этап морфогенеза вириона контролируется М-белком. С ним взаимодействует нуклеокапсид; он, проходя через мембрану клетки, покрывается вначале М-белком, а затем клеточным липидным слоем и суперкапсидными гликопротеидами Н и N. Жизненный цикл вируса занимает 6 – 8 ч и завершается отпочковыванием вновь синтезированных вирионов, которые способны атаковать другие клетки ткани.
Устойчивость вируса во внешней среде невелика. Он легко разрушается при нагревании (при 56 °C в течение 5 – 10 мин), под действием солнечного и УФ-света и легко обезвреживается дезинфицирующими веществами.
Эпидемиология. Источник инфекции – человек, больной или носитель, редко животные (домашние и дикие птицы, свиньи). Заражение от людей происходит воздушно-капельным путем, инкубационный период очень короткий (1 – 2 сут.), поэтому эпидемия распространяется очень быстро и может при отсутствии коллективного иммунитета перерасти в пандемию. Иммунитет – основной регулятор эпидемий гриппа. По мере нарастания коллективного иммунитета эпидемия идет на убыль. Вместе с тем вследствие формирования иммунитета происходит отбор штаммов вируса с измененной антигенной структурой, прежде всего гемагглютинина и нейраминидазы; эти вирусы продолжают вызывать вспышки до тех пор, пока и к ним не появятся антитела. Такой антигенный дрейф и поддерживает непрерываемость эпидемии. Однако у вируса гриппа А обнаружена еще одна форма изменчивости, получившая название шифта, или сдвига. Она связана с полной сменой одного типа гемагглютинина (реже – и нейраминидазы) на другой.
Все пандемии гриппа были вызваны вирусами гриппа А, претерпевшими шифт. Пандемия 1918 г. была вызвана вирусом с фенотипом H1N1 (погибло около 20 млн человек), пандемия 1957 г. – вирусом H2N2 (переболело более половины населения мира), 1968 г. – вирусом H3N2.
Для объяснения причин резкой смены типов вирусов гриппа А предложены две основные гипотезы. Согласно гипотезе А. А. Смородинцева, вирус, исчерпавший свои эпидемические возможности, не исчезает, а продолжает циркулировать в коллективе без заметных вспышек или длительно персистировать в организме человека. Через 10 – 20 лет, когда появится новое поколение людей, не имеющих иммунитета к этому вирусу, он становится причиной новых эпидемий. В пользу этой гипотезы говорит тот факт, что вирус гриппа А с фенотипом H1N1, исчезнувший в 1957 г., когда его вытеснил вирус H2N2, вновь появился после 20-летнего отсутствия в 1977 г.
По другой гипотезе, развиваемой и поддерживаемой многими авторами, новые типы вируса гриппа А возникают вследствие реассоциации геномов между вирусами гриппа человека и птиц, между вирусами гриппа птиц, между вирусами гриппа птиц и млекопитающих (свиньи), чему способствует сегментарная структура вирусного генома (8 фрагментов).
Таким образом, у вируса гриппа А есть два пути изменения генома.
1. Точечные мутации, обусловливающие антигенный дрейф. Им подвержены, прежде всего, гены гемагглютинина и нейраминидазы, особенно у вируса H3N2. Благодаря этому вирус H3N2 за период с 1982 по 1998 г. вызвал 8 эпидемий и сохраняет эпидемическое значение до сих пор.
2. Реассоциация генов между вирусами гриппа человека и вирусами гриппа птиц и свиней. Считается, что именно реассоциация геномов вирусов гриппа А с геномами вируса гриппа птиц и свиней – главная причина возникновения пандемических вариантов этого вируса. Антигенный дрейф позволяет вирусу преодолевать существующий у людей иммунитет. Антигенный шифт создает новую эпидемическую ситуацию: к новому вирусу у большинства людей иммунитета нет, и возникает пандемия гриппа. Возможность такой реассоциации геномов вирусов гриппа А доказана экспериментально.
Установлено, что эпидемии гриппа у людей вызывают вирусы типа А только 3 или 4 фенотипов: H1N1 (H0N1); H2N2; H3N2.
Однако существенную угрозу для человека предсталяет и куриный (птичий) вирус. Вспышки куриного гриппа наблюдались неоднократно, в частности куриный вирус H5N1 вызвал миллионную эпизоотию среди домашних и диких птиц с 80 – 90 %-ной летальностью. От кур заражались и люди; так в 1997 г. от кур заразилось 18 человек, треть из них погибла. Особенно крупная вспышка наблюдалась в январе – марте 2004 г. Она охватила почти все страны Юго-Восточной Азии и один из штатов США и нанесла огромный экономический ущерб. От кур заразилось и погибло 22 человека. Для ликвидации этой вспышки были предприняты самые жесткие и решительные меры: строгий карантин, ликвидация всего поголовья птиц во всех очагах, госпитализация и изоляция больных и всех людей с повышенной температурой, а также лиц, находившихся в контакте с больными, запрет импорта куриного мяса из указанных выше стран, строгий медицинский и ветеринарный надзор за всеми пассажирами и транспортными средствами, прибывающими из этих стран. Широкого распространения гриппа среди людей не произошло потому, что не было реассоциации генома вируса куриного гриппа с геномом вируса гриппа человека. Однако опасность такой реассоциации остается реальной. Всего в течение 2003–2007 гг. в мире переболело 322 человека, из них 195 умерли.
В названии выявляемых штаммов вирусов гриппа указывают серотип вируса (A, B, C), вид хозяина (если им не является человек), место выделения, номер штамма, год его выделения (последние 2 цифры) и фенотип (в круглых скобках).
Например: «A/Сингапур/1/57 (H2N2), A/утка/СССР/695/76 (H3N2)».
Особенности патогенеза и клиники. Инкубационный период при гриппе короткий – 1 – 2 сут. Вирус размножается в эпителиальных клетках слизистой оболочки дыхательных путей с преимущественной локализацией в области трахеи, что клинически проявляется в виде сухого мучительного кашля с болями по ходу трахеи. Продукты распада пораженных клеток попадают в кровь, вызывают сильную интоксикацию и повышение температуры тела до 38 – 39 °C. Повышение проницаемости сосудов, обусловленное повреждением клеток эндотелия, может стать причиной патологических изменений в различных органах: точечных кровоизлияний в трахее, бронхах, а иногда и отека мозга с летальным исходом. Вирус гриппа оказывает угнетающее действие на кроветворение и иммунную систему. Все это может приводить к вторичным вирусным и бактериальным инфекциям, которые осложняют течение болезни.
Постинфекционный иммунитет. Прежние представления о том, что после перенесенного гриппа остается слабый и кратковременный иммунитет, опровергнуты после возвращения вируса H1N1 в 1977 г. Этот вирус вызывал заболевание главным образом у людей не старше 20 лет, т. е. у тех, кто не болел им раньше, до 1957 г. Следовательно, постинфекционный иммунитет достаточно напряженный и продолжительный, но имеет выраженный типоспецифический характер.
Главная роль в формировании приобретенного иммунитета принадлежит вируснейтрализующим антителам, блокирующим гемагглютинин и нейраминидазу, а также секреторным иммуноглобулинам IgAs.
Лабораторная диагностика. Материалом для исследования служит отделяемое носоглотки, которое получают либо путем смыва, либо с помощью ватно-марлевых тампонов, и кровь. Методы диагностики применяют следующие:
1. Вирусологический – заражение куриных эмбрионов, культур клеток почек зеленых мартышек (Vero) и собак (МДСК). Культуры клеток особенно эффективны для выделения вирусов А (H3N2) и В.
2. Серологический – выявление специфических антител и возрастания их титра (в парных сыворотках) с помощью РТГА, РСК, иммуноферментного метода.
3. В качестве ускоренной диагностики используют иммунофлуоресцентный метод, позволяющий быстро обнаружить вирусный антиген в мазках-отпечатках со слизистой оболочки носа или в смывах из носоглотки больных.
4. Для обнаружения и идентификации вируса (вирусных антигенов) предложены методы РНК-зонда и ПЦР.
Лечение. Для лечения, которое следует начинать как можно раньше, и профилактики гриппа и других вирусных ОРЗ применяют дибазол, интерферон и его индукторы амиксин и арбидол по специальным схемам, а для лечения и профилактики гриппа у детей старше 1 года – альгирем (ремантадин) по специальным схемам.
Специфическая профилактика. Ежегодно в мире гриппом болеют сотни миллионов людей, что наносит колоссальный ущерб здоровью населения и экономике каждой страны. Единственным надежным средством борьбы с ним является создание коллективного иммунитета. Для этой цели предложены и используются следующие типы вакцин: 1) живая из аттенуированного вируса; 2) убитая цельновирионная; 3) субвирионная вакцина (из расщепленных вирионов); 4) субъединичная – вакцина, содержащая только гемагглютинин и нейраминидазу.
В нашей стране создана и применяется тривалентная полимер-субъединичная вакцина («гриппол»), в которой стерильный конъюгат поверхностных белков вирусов А и В связан с сополимером полиоксидонием (иммуностимулятор).
Детей от 6 мес. до 12 лет, по рекомендации ВОЗ, следует прививать только субъединичной вакциной как наименее реактогенной и токсичной.
Главная проблема в повышении эффективности противогриппозных вакцин – обеспечение их специфичности против актуального вируса, т. е. того варианта вируса, который вызвал данную эпидемию. Иначе говоря, вакцина должна содержать специфические антигены актуального вируса. Основной путь повышения качества вакцины – использование наиболее консервативных и общих для всех антигенных вариантов вируса А эпитопов, которые обладают максимальной иммуногенностью.