Обязательную маркировку с января 2020 года проходят только лекарственные препараты. Процедура позволяет избежать выпуска в оборот контрафактных и фальсифицированных медикаментов, которые способны причинить вред здоровью человека, за счет отслеживания движения товара от производителя до конечного потребителя.
Маркировка медицинских изделий и оборудования проводится в экспериментальном порядке путем нанесения на упаковку уникальных кодов, предоставляющих потребителю подробные сведения о характеристиках, правилах использования продукции, а также о ее производителе.
Получить помощь в прохождении процедуры можно на портале https://znak.store/.
Законодательная база
Обязательной идентификации подлежат все лекарственные препараты. До 2020 года эти требования касались только дорогостоящих медикаментов, предназначенных для лечения сложных заболеваний. В настоящее время перед выпуском в обращение маркируются все лекарственные средства, в том числе травяные сборы, гомеопатические препараты. Также обязательному кодированию подлежат перевязочные и расходные медицинские материалы: шприцы, катетеры, инвентарь для дезинфекции кожного покрова, медицинская одежда, одноразовые хирургические маски, перчатки, бахилы.
Производители выполняют следующие действия, необходимые для получения и отправки данных о товарообороте в единую базу:
- получают усиленную квалифицированную ЭЦП;
- устанавливают специальное программное обеспечение и сертификат ключа на рабочий ПК;
- проходят регистрацию в системе маркировки «Честный ЗНАК» и на портале оператора (ЦРПТ);
- получают двухмерный штрих-код в формате DataMatrix, приобретают устройства для сканирования кодов.
Поступающие на склад товары сканируются, после чего информация о них сразу поступает в единую базу данных и остается в ней до момента реализации. После продажи напротив кода появляется отметка о выходе изделия из оборота.
Для изделий медицинского назначения, в отношении которых законодательство пока не требует обязательной маркировки, регистрация в ИС «Честный ЗНАК» не нужна. Однако перед выпуском в обращение на рынки они проходят обязательную регистрацию в Росздравнадзоре, по результатам которой производитель получает Регистрационное удостоверение.
Требования к маркировке медицинских изделий
Маркировка предусматривает обязательное наличие следующей информации:
- наименование изделия, область применения;
- сведения об изготовителе с указанием его местонахождения (страны, юридического адреса и т.д.);
- номер серии или партии;
- дата выпуска;
- сроки хранения;
- свойства продукции, порядок ее использования, меры предосторожности;
- указания о стерильности или одноразовом использовании (при необходимости);
- данные о проведенных испытаниях;
- нормативно-техническая документация, требованиям которых должен соответствовать товар;
- гарантийные обязательства производителя, другие сведения, в зависимости от предназначения продукции.
Подробные сведения о товарах медицинского назначения должны содержаться не только в штриховом коде, но и в инструкции по его применению.
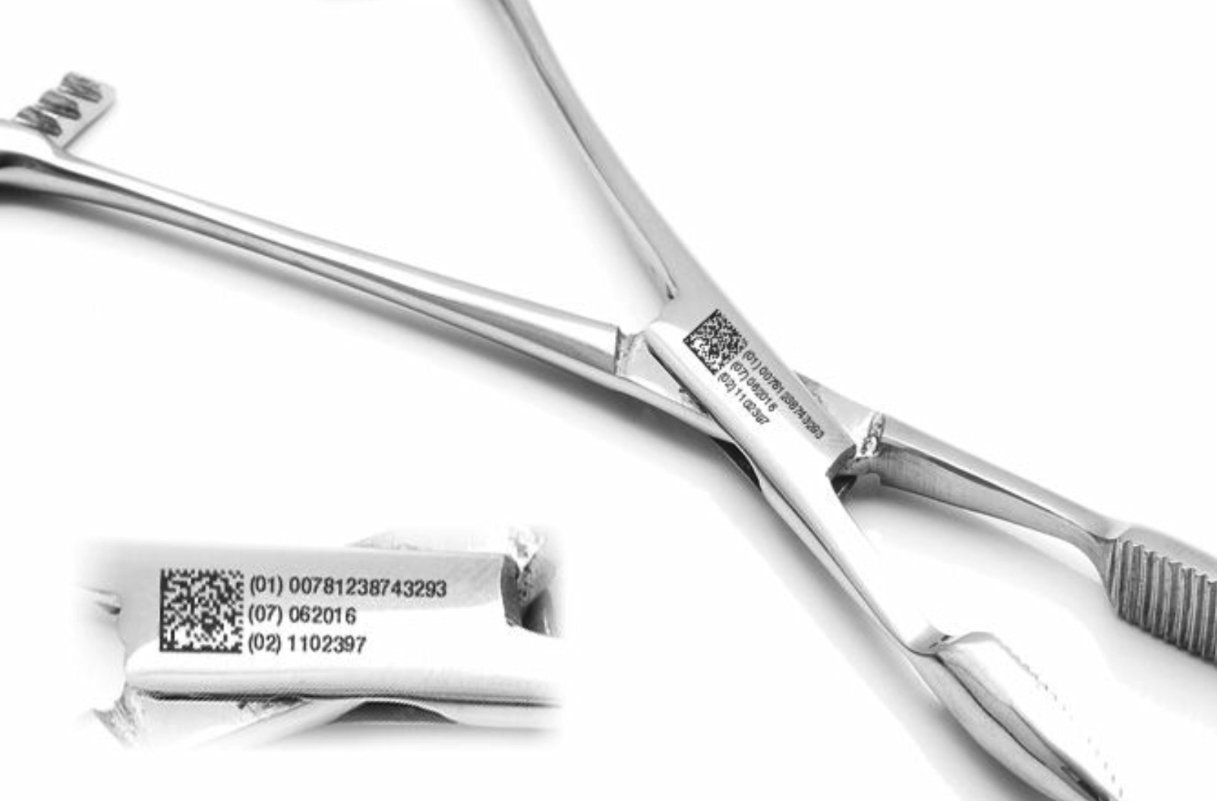
Специальные символы наносятся несколькими способами с использованиями различных технологий: гравировка, штамповка, тиснение, нанесение несмываемой краски. Основным требованиям к изображению является его отчетливость и видимость в продолжении всего срока использования.
Идентифицироваться должна каждая единица товара. Маркировка наносится на этикетку, потребительскую упаковку, транспортную тару. Обозначение должно быть защищено от механического воздействия с целью предотвращения истирания информации. Во время транспортирования должна исключаться возможность воздействия атмосферных осадков и прямых солнечных лучей, низких и высоких температур или агрессивной среды. Информация должна указываться на русском языке.
Если предусмотрены особенные условия эксплуатации медицинского оборудования и других изделий, то на упаковочной таре в видных местах или специальных табличках указываются дополнительные обозначения, необходимые для обеспечения безопасности использования, хранения и транспортировки продукции.
К ним относятся символы, указывающие на:
- технические характеристики товара;
- способы его транспортирования;
- допустимую длительность функционирования;
- необходимость применения средств индивидуальной защиты и другие.
Необходимая документация и этапы проведения процедуры
Для прохождения процедуры, позволяющей присвоить штриховые коды и маркировать товар в соответствии с требованиями законодательства, производитель (поставщик) подает заявку установленного образца и предоставляет:
- учредительную, регистрационную документацию юридического лица или ИП;
- подробные сведения о технических характеристиках и свойствах товаров, коды ОКПД 2 и ТН ВЭД;
- макет этикетки;
- нормативно-техническую документацию, согласно которой производятся изделия.
Импортеры предоставляют контракт на поставку. Также потребуется разрешительная документация, подтверждающая законное осуществление деятельности, качество и безопасность продукции. При необходимости ее оформления проводятся лабораторные испытания.
После всех обязательных мероприятий изделиям присваиваются уникальные коды и наносится маркировка, заявитель приобретает программное обеспечение, средства распознавания и т.д.

