Клинические проявления
Для удобства определения степени тяжести состояния у детей разных возрастов весь их контингент был поделен на три возрастные группы, для каждой группы выраженность поражения иммунной системы определяется количеством клеток лимфоцитов–хелперов в крови.

Клиническое течение ВИЧ–инфекции зависит от путей инфицирования: более раннее инфицирование в период внутриутробного развития приводит даже к гибели плода. Кроме того, такие дети рождаются ослабленными, с явными признаками недоразвитости. Заражение во время родов приводит к более позднему появлению признаков инфицирования.
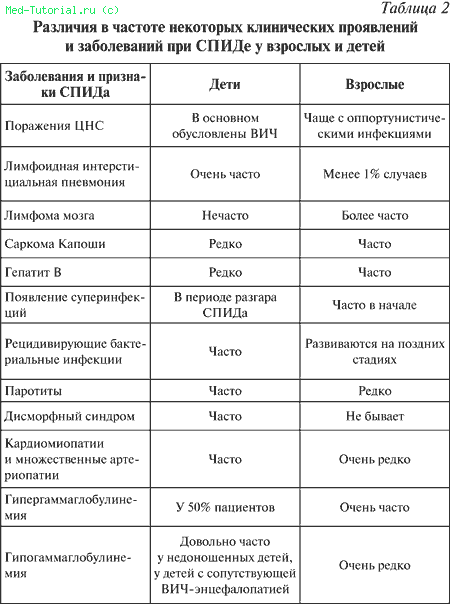
Также были выявлены определенные различия в частоте встречаемости тех или иных осложнений ВИЧ у взрослых пациентов и детей: было замечено, что патогенетически ВИЧ–инфекция в детском возрасте имеет некоторые отличительные черты. Прежде всего это относится к возможности развития патологических проявлений еще в эмбриональном периоде за счет иммунных сдвигов. Так, к примеру, дети у матерей с клинически манифестной формой инфекции болеют чаще и тяжелее в отличие от детей, родившихся у матерей с латентной формой инфекции.
Следует полагать, что причина этого кроется в выраженном воздействии вируса на плазму, в свойствах самого вируса, его репликационной способности и способности к синцитие–образованию. Именно эти характеристики ВИЧ определяют степень выраженности клиники. У женщин с высоким титром вируса в плазме его большее количество проникает в организм ребенка через плаценту или в период родового акта, и у последнего в большей степени выражен патологический процесс.
Выявлено, что, если ребенок заразился ВИЧ во внутриутробном периоде, симптоматика развивается уже в течение первых месяцев жизни, в то время как у инфицированных при переливаниях крови и инъекциях на протяжении нескольких лет обычно длится инкубационный период (в среднем для детей с перинатальной ВИЧ–инфекцией он составляет около 1 года, а для детей, которые были инфицированы при проведении гемотрансфузий, – до 3,5 лет). В среднем более трети детей, инфицированных в стационарах, умирают в течение 1–2 лет после заражения, чуть более половины исследованных прожили после заражения 3–4 года, у 10–12 % пациентов выживаемость составила 5 лет. Внутрибольничное заражение детей происходит обычно в реанимационных отделениях и отделениях грудной хирургии. Наиболее частым вмешательством, приводящим к инфицированию ВИЧ, является катетеризация подключичной вены (являлась причиной заражения почти в 50 % случаев), за ней следуют такие манипуляции, как интубация трахеи (17 % случаев), плевральные пункции (9 %).
Кроме того, было замечено, что чем меньше возраст ребенка, тем раньше у него развивается сероконверсия. Как показали исследования, у 35 % детей до 7 лет спустя полгода после заражения в крови активно циркулировали антитела к ВИЧ, в то время как у пациентов старше 7 лет эта реакция организма развивалась значительно позже. Чем старше ребенок, тем более клиническая картина болезни у него сходна с таковой у взрослых больных, хотя и имеет свои особенности и укороченный по сравнению со взрослыми латентный период – 3–5 лет. В среднем от момента проявления характерной симптоматики СПИДа пациент может прожить еще около 2,5 лет. Если клинические проявления развиваются на первом году жизни, то ребенок его, как правило, не переживает.
Клиника ВИЧ–инфекции при внутриутробном инфицировании развивается спустя полгода после рождения и выражается следующими характерными симптомами: задержка роста наблюдается у 3/4 обследованных, микроцефалия – у половины больных, выступающая коробкообразная лобная часть – в 3/4 случаев, уплощение носа – у 70 % пациентов, слабо выраженное косоглазие – у 2/3 больных, удлиненные глазные щели и голубые склеры – в 60 % случаев, значительное укорочение носа – у 2/3 обследованных. В основном дети умирают от ВИЧ–эмбриопатий.
Более благоприятно протекает заболевание у детей, которые подверглись инфицированию в возрасте старше 1 года, чаще это пациенты, зараженные в ходе проведения переливаний крови или инъекций. СПИД у них развивается через 5,5–7 лет после заражения, диагностируется заболевание обычно через 17 месяцев. Клиника болезни также отличается от взрослых: вместо пневмоцистной пневмонии чаще встречается лимфоидная интерстициальная пневмония (ЛИП), течение которой доброкачественнее. Для этих больных наиболее часты такие вторичные инфекционные заболевания, как грибковое поражение полости рта и пищевода, инфекция, вызванная вирусом Эпштейна–Бара, и другие вторичные поражения.
Время присоединения суперинфекций значительно влияет на характер течения и выраженность клиники у больного ребенка. Для детей с рано выявленными персистирующим кандидозным стоматитом, эзофагитом, пневмоцистной пневмонией показатель выживаемости составляет в среднем около 1 года, в то время как у детей с повторными бактериальными инфекциями или ЛИП этот период колеблется от 50 до 77 месяцев.
Персистирующее распространенное поражение лимфоидного аппарата, увеличение селезенки, снижение массы тела, лихорадка, диарея, отставание в психомоторном развитии, уменьшение количества тромбоцитов с геморрагическими проявлениями, анемия являются наиболее частыми признаками как врожденной, так и приобретенной ВИЧ–инфекции у детей.
Вследствие подавления иммунной системы значительно возрастает восприимчивость организма ребенка к различным инфекциям, течение их затягивается: дети чаще страдают от ОРВИ, у них весьма часто возникают тяжелые бактериальные инфекции со склонностью к затяжному, длительному рецидивирующему течению и генерализации инфекции. Нередко встречаются герпетическая инфекция и токсоплазмоз. Хотя у таких больных реже отмечается микобактериоз, криптоспоридиоз и криптококкоз, однако чаще имеют место поражения кожи и слизистых оболочек грибковыми микроорганизмами, в особенности это относится к развившемуся СПИДу.
Почти каждый второй ребенок страдает бактериальными инфекциями, у них встречаются гнойный отит, менингиты, наблюдаются тяжелые гнойные поражения кожи при сопутствующей экземе, типичны массивные бактериальные пневмонии с абсцедированием и выпотом в плевральную полость, неоднократные эпизоды бактериального сепсиса, встречается бактериальная инфекция костей, суставов. Возбудители этих процессов – стафилококки, пневмококки, Haemophilus influenzae, сальмонеллы, различные грамотрицательные микроорганизмы, в том числе склонные к внутрибольничному распространению. Такие вторичные поражения настолько характерны, что многие отечественные и зарубежные авторы включают их в группу СПИД–ассоциируемых суперинфекций. Таким образом, вторичные инфекционные заболевания у детей являются основными причинами заболеваемости и смертности в отличие от взрослых, у которых вторичные инфекции являются частью вторичных осложнений. Такое течение заболевания напоминает клиническую картину у больных с уменьшением количества альбуминов крови. На основании этого вторичные инфекции у детей были включены в список «индикаторных» болезней, при которых вероятность диагноза ВИЧ–инфекции чрезвычайно высока. Но это более характерно для детей, инфицирование которых произошло только внутриутробно.
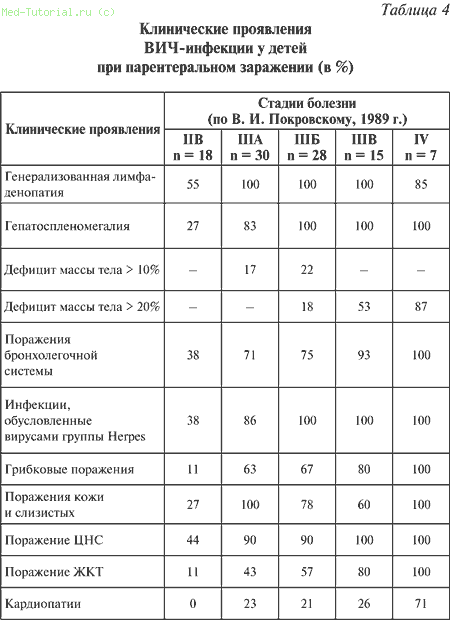
У детей, инфицированных внутрибольнично, особенностью клинической картины является более быстрое прогрессирование патологического процесса в виде преобладания клинически выраженных стадий ВИЧ–инфекции по сравнению с взрослой группой больных ВИЧ. В момент постановки диагноза у 50 % больных детей преобладала клиника вторичных заболеваний, в то время как среди взрослых в стадии вторичных заболеваний находилось только 10 %. Скорее всего, это связано с поступлением большого количества возбудителя одномоментно, ранним возрастом больного в момент заражения и тяжелым преморбидным фоном. Особенности патогенеза ВИЧ–инфекции у детей, развившейся на фоне существовавшей иммуносупрессии, проявились уже в самом начале заболевания – в момент диагностики стадий процесса. Так, треть детей в исследуемой группе уже были в фазе IIB – IIIA и около 20 % – на более поздних стадиях болезни. Характерные для взрослых виды сопутствующих инфекций у детей с ВИЧ–инфекцией развиваются на фоне вторичных бактериальных инфекций. Манифестация клиники оппортунистической инфекции у детей происходит значительно раньше, чем у взрослых, этому в значительной мере способствует наличие бронхолегочной патологии. После парентерального инфицирования ВИЧ в исследуемой группе суперинфекция развилась у 60 % детей в течение 3 лет.
По мере прогрессирования заболевания частота и разнообразие поражений нарастают: наиболее интенсивное развитие оппортунистических инфекций наблюдалось на первом году болезни, почти 30 % больных перенесли те или иные заболевания, и у 20 % больных суперинфекция развилась на втором году с начала заболевания.
По данным многих исследований, у больных ВИЧ–инфекцией детей характерными являются инфекции: пневмоцистная пневмония, кандидоз пищевода, генерализованный ток–соплазмоз, криптококкоз, цитомегаловирусная (CMV), герпетическая (HSV) инфекции и заболевание, вызванное вирусом Эпштейна–Барра (EBV). Из злокачественных новообразований особенно характерны саркома Капоши, возможны также карциномы, В–клеточные лимфомы и др. В то же время среди суперинфекций практически отсутствуют часто встречаемые у взрослых больных различного рода паразитозы. Как показал анализ наших исследований, лидирующей патологией являются заболевания, вызванные вирусом простого герпеса.
На заболевания, вызванные HSV, в структуре всех суперинфекций у детей приходится 22,9 %, на заболевания, этиологически связанные с вирусом Herpes Zoster (герпес Зостер), – 8,15 %, CMV – инфекция составляет 23,7 %. Но клинически выраженные проявления этой инфекции у детей составили 9,1 %, субклинические формы болезни – 14,6 %. К группе герпесвирусных относится лимфоидная интерстициальная пневмония, этиологическим фактором которой является вирус Эпштей–на–Барра.
Помимо вирусных заболеваний у детей нередко присоединяется грибковая инфекция, ее доля в общей массе инфекционных поражений составляет около 1/4 среди суперинфекций (24,7 %). Основным возбудителем являются грибы рода Кандида, поражающие кожу с ее придатками, желудочно–кишечный тракт и мочеполовую систему.
Удельный вес простейших в общей массе суперинфекций невелик, на них приходится всего около 12 % случаев осложнений. Наиболее часто встречается токсоплазмоз, протекающий в основном в скрытой форме, и пневмоцистоз. Наиболее редкими осложнениями у ВИЧ–инфицированных больных остаются проявления неопластических процессов.
Таким образом, ведущим в поражении ребенка ВИЧ является бактериальный бронхолегочный компонент, к которому присоединяются столь характерные для больных ВИЧ/СПИД сопутствующие поражения вирусами, простейшими, грибами и микобактериями, которые, в свою очередь, определяют клинические особенности заболевания в каждом конкретном случае, тяжесть течения и исход болезни.
На начальных этапах заболевания наиболее частыми причинами развития сопутствующих инфекционных осложнений становятся вирусы семейства Herpes viridae и грибы рода Кандида.
В клинике заболеваний хронические формы течения преобладали над острыми проявлениями. Более 2/3 пациентов в течение 2 лет после инфицирования имели картину хронической герпетической инфекции. Нередким является поражение цитомегаловирусом, однако с меньшими выраженностью и интенсивностью.
Всего паротит CMV – этиологии наблюдали у 13,5 % больных ВИЧ–инфекцией детей. По мере прогрессирования заболевания все клинические случаи перешли в хроническую форму с 2–кратными, реже – 3–кратными обострениями в год. В свете изложенного заболевания, вызываемые герпес–вирусами, следует расценивать как начальные признаки инфицирования вирусом иммунодефицита человека детей с бронхолегочной патологией бактериальной этиологии. В течение первого года после инфицирования они присоединяются более чем в трети всех случаев, на третьем году поражают около половины всех заболевших. Тем не менее в ходе исследований выяснилось, что у 50 % заболевших детей кожные проявления инфекции герпес Зостер развивались лишь к 5–8–му году после заражения.
Ведущей причиной смерти детей с синдромом приобретенного иммунодефицита являются поражения легких, основным возбудителем которых считается пневмоциста каринии.
Часто встречающимся клиническим вариантом воспаления легких является лимфоцитарная интерстициальная пневмония (ЛИП), остающаяся патогномоничным осложнением у детей, пораженных вирусом иммунодефицита человека. Этиология пока не установлена. При микроскопическом исследовании выявляется массивный выход и скопление в интерстиции и околобронхиальных зонах плазматических клеток, лимфоцитов, незрелых форм иммунокомпетентных клеток.
В дифференциальной диагностике лимфоцитарно–интерстициальной и пневмоцистной пневмоний важным моментом является клиническая картина. Для ЛИП характерно постепенное медленное начало заболевания, выраженность сухого кашля, смешанной одышки нарастает, больных также беспокоит повышение температуры тела до 37–37,8 °C. При этом аускультативно в легких не отмечается каких–либо нарушений, кроме амфорического дыхания. Типичных для других форм пневмонии влажных хрипов нет.
Еще одной частой причиной развития воспаления легких у детей, пораженных ВИЧ, является грибковая инфекция, поражающая 1 из 5 больных в течение 1–го года после заражения, у 50 % больных это осложнение сопровождалось проявлениями кандидоза на коже.
Фактически все случаи хронического поражения кожи и слизистых у ВИЧ–инфицированных детей (91,5 %) впервые проявились как острые формы на 1–3–м году с момента инфицирования.
Редким в детском возрасте является инфицирование плесневыми грибами и грибами рода Criptococcus. Редким осложнением на первом году после заражения считается и инфекция микобактерией туберкулеза, которая поражает больных чаще через 2–3 года после заражения. Осложнения неопластического характера среди больных ВИЧ в детском возрасте практически не встречаются.
Пневмоцистная пневмония относится к наиболее характерной в СПИД–индикаторной патологии у взрослых. Она присоединяется в период, когда явления иммунодефицита значительно выражены.
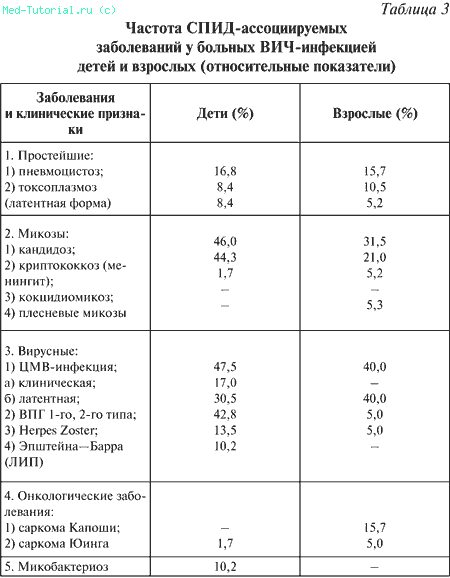
В таблице 3 представлены возбудители, наиболее часто являющиеся причиной осложнений у ВИЧ–инфицированных детей и взрослых. Основные различия связаны с чрезвычайно высокой частотой развития у детей рецидивирующих бактериальных инфекций и патологией, вызванной герпес–вирусами, достигающих 100 % у больных ВИЧ/СПИДом детей.
У детей бактериальные инфекции являются основными проявлениями клинической симптоматики и причиной смертности в отличие от ВИЧ–инфицированных взрослых, среди которых бактериальные инфекции выявлены только у 32,5 % больных и представляют небольшую часть от всего спектра СПИД–ассоциируемых заболеваний. Основными проявлениями рецидивирующих бактериальных инфекций у ВИЧ–инфицированных детей является патология со стороны легочной системы в виде хронических пневмоний (72,3 %), хронических бронхитов (21,5 %), бронхоэктатической болезни (12,2 %).
Другими характерными признаками персистирования в организме ребенка вируса иммунодефицита человека остаются уменьшение массы тела (симптом имеет клиническую весомость особенно в тех случаях, когда дефицит массы тела превышает 1/10; на поздних же этапах типичным признаком ВИЧ–инфекции является кахексия), патологические изменения лимфатических узлов (увеличение и гиперплазия фолликулов, выраженность которых варьирует в зависимости от стадии заболевания), увеличение в объеме печени и селезенки, что может наблюдаться уже на начальных этапах заболевания.
Частым возбудителем инфекционных осложнений с поражением желудочно–кишечного и мочеполового трактов, внешних покровов являются грибы рода Кандида. Они могут также поражать слизистую оболочку ротовой полости, глотку и гортань. По мере прогрессирования заболевания его течение принимает системный, распространенный характер. У взрослых кандидоз развился у 21 % больных в виде поражений ЖКТ и влагалища.
Значительный рост кандидозного поражения желудочно–кишечного тракта начинается со стадии IIIA – почти у 2/3 диагностирован кандидоз желудочно–кишечного тракта, с такой же частотой (2/3 больных детей) он выявлен в стадии ШБ, в стадии IIIB – уже у 3/4 детей и в терминальной стадии заболевания – у всех больных детей.
Проявления кожной патологии выявляются в стадии IIIA в 100 % случаев, в стадии ШБ – в 78 % и в терминальной стадии – у всех детей. Часто наблюдаются на коже и ее придатках хронические персистирующие инфекционные процессы грибковой и бактериальной природы. Кандидозы кожи имеют место почти у 25 % больных детей, себорея встречается у них реже, наблюдается преимущественно на начальных стадиях инфекции. Также для ранних периодов течения СПИДа типичны выраженные и распространенные гнойничковые поражения кожи, чего практически не наблюдается на поздних стадиях.
Весьма распространенным сопутствующим поражением кожи и слизистых оболочек остаются язвенно–некротические дефекты, возникающие, как правило, в терминальной стадии. Они представляют собой язву до 2 см в диаметре, не заживающую в течение продолжительного периода времени. Такие явления настолько часто встречаются у пораженных СПИДом, что их появление указывает на его наличие почти в 100 % случаев. Частым поражением, сопутствующим СПИДу, является волосатая лейкоплакия языка.
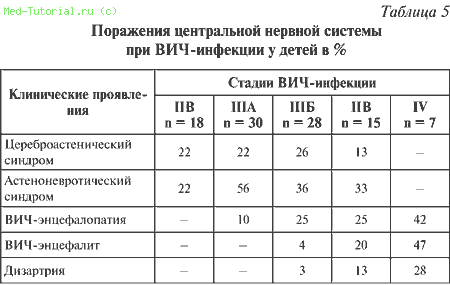
Со стороны центральной нервной системы при поражении ВИЧ имеют место неспецифические проявления, протекающие по типу астеноневротического и цереброастенического синдромов. Они встречаются в основном на начальных этапах заболевания чуть менее чем у половины пораженных и почти у всех больных – в терминальной стадии. Кроме того, на поздних стадиях возможно присоединение энцефалопатии, а также энцефалитов, что ведет к необратимым органическим повреждениям в центральной нервной системе и нередко становится причиной летального исхода заболевания.
Состояние желудочно–кишечного тракта тоже страдает, причем не только вследствие поражения ВИЧ и присоединения вторичных инфекций, но и из–за действия антиретровирусных, антибактериальных, противогрибковых препаратов, применяемых для лечения. Так, если на ранних этапах процесса в стадии ИВ, когда еще не присоединилась оппортунистическая инфекция и не проводилась массивная лекарственная терапия, лишь у каждого десятого ребенка имелись симптомы поражения желудочно–кишечного тракта (ЖКТ). В стадии IIIA патология желудочно–кишечного тракта обнаруживается чуть менее чем у половины больных детей, в стадии ШБ – более чем у половины, в стадии СПИДа – у 4/5 всех заболевших и в терминальной стадии – у 100 % пораженных. Основным проявлением нарушения функций пищеварительной системы являются проблемы, связанные с дисбактериозом кишечника, что выражается в наличии частого жидкого стула с остатками непереваренной пищи, высокими показателями обсеменения патогенными и условно–патогенными микроорганизмами.
С развитием процесса ВИЧ–инфекции в организме ребенка нарастает интенсивность применения антибактериальных препаратов и других лекарственных средств, поэтому увеличивается количество детей с этим видом патологии: в стадии IIIA – у каждого пятого, в стадии ШБ – у каждого третьего, в стадии ШВ – в 60 %, в терминальной стадии – у всех детей.
Очередным органом, который поражается при ВИЧ–инфицировании, является печень, часто поражаемая вирусами гепатита В и С. В клинике имеют место синдромы гепатомегалии и спленомегалии, возможны проявления цитолиза с выходом печеночных трансаминаз в кровь, однако уровень билирубина при этом практически не изменяется и желтуха, как правило, не развивается. В крови характерно наличие типичных серологических маркеров. Однако антитела к вирусам гепатита В и С у ВИЧ–инфицированных детей не определялись на ранних стадиях заболевания, хотя проводилось регулярное тестирование, первые положительные результаты получены через 2–3 года от момента инфицирования.
Однако в целом среднетяжелые и тяжелые осложнения со стороны желудочно–кишечного тракта у пораженных ВИЧ в детском возрасте отмечаются редко. Поражение мочевыделительной системы у ВИЧ–инфицированных детей находит отражение, как правило, в выделении большого количества белка с мочой. Нефротический синдром является проявлением воспалительных изменений в чашечно–лоханочной системе и длится довольно долго. На поздних стадиях явления хронического пиелонефрита уступают место признакам поражения клубочкового аппарата почек.

Так как на данное время у исследователей не имеется убедительных клинических данных, говорящих за эффективность антиретровирусной терапии у детей до 1 года, то вопрос о ее назначении решается индивидуально в отношении каждого конкретного пациента на основании имеющихся клинических проявлений, их степени выраженности, значения лабораторных показателей и т. д.
