Хирургическое лечение
Оперативное лечение ГКМП путем вентрикуломиотомии и (или) миэктомии, как и терапия b-адреноблокаторами, применяется с начала 60-х годов. Впервые внимание хирургов к этому заболеванию привлек Е. Brock (1957). Первая успешная операция — чрезаортальная вентрикуломиотомия была произведена М. Cleland и Е. Bentall в 1958 г., и этот больной прожил после операции 25 лет. В 1961 г. A. Morrow и D. Brockenbrough сообщили о двух больных ГКМП, у которых септальная миэктомия привела к значительному клиническому улучшению и снижению градиента давления в выносящем тракте левого желудочка. Достигнутый эффект, по аналогии с хирургическим лечением стеноза привратника, исследователи отнесли за счет механического рассечения подклапанного мышечного кольца, напоминающего сфинктер. Хотя в последующем многочисленные данные ЭхоКГ опровергли эту концепцию, оперативная коррекция получила широкое распространение в большинстве крупных кардиохирургических центрах мира.
В 70-х годах, показания к хирургическому лечению патологической гипертрофии были относительно широкими и включали все случаи обструктивной ГКМП, даже асимптоматичные, что преследовало цель предотвратить внезапную смерть. После того как было доказано, что систолическая дисфункция левого желудочка не является единственным и основным патофизиологическим механизмом нарушения кардиогемодинамики при этом заболевании, а оперативное лечение не оказывает влияния на внезапную смерть (A. Adelman с соавт., 1972; A. Taijk с соавт., 1974), показания к нему сузились. В настоящее время оно рекомендуется больным с выраженной клинической симптоматикой заболевания и ограничением функционального состояния, соответствующим III-IV классу NYHA, несмотря на активную медикаментозную терапию, при градиенте систолического давления в выносящем тракте левого желудочка в покое свыше 50 мм рт.ст, и при наличии на ЭхоКГ и АКГ увеличения сосочковых мышц и значительной гипотрофии верхней или средней части межжелудочковой перегородки (С. Mclntosh и В. Maron, 1988; A. Millaire с соавт., 1995).
Учитывая отсутствие неопровержимых доказательств, что хирургихеское лечение продлевает жизнь, а также его риск, оно не показано асимптоматичным больным или в случаях умеренной выраженности симптомов даже при значительном внутрижелудочковом градиенте давления. Нерешенным остается вопрос о показаниях к операции при латентной обструкции.
Методы хирургического лечения обструктивной ГКМП, или так называемого мышечного субаортального стеноза, включают чрезаортальную вентрикуломиотомию, миэктомию через аортальный, желудочковый или предсердный доступы, а также протезирование митрального клапана.
Чрезаортальная вентрикуломиотомия по методике W. Bigelow с соавторами (1966) проводится путем рассечения через аортальный доступ патологического утолщения миокарда по линии комиссуры между правой и левой коронарными створками аортального клапана. Разрез углубляется путем разделения мышечных волокон пальцем до появления ощущения более мягкого мышечного слоя под плотной ("резиновой") тканью. В большинстве случаев глубина разреза составляет 1-1,5 см, а длина — 2-3 см. Достаточная глубина разреза обеспечивает ретракцию его краев с образованием углубления U-образной формы и полное разделение патологических мышечных волокон.
Возможные осложнения, непосредственно связанные с операцией, включают перфорацию межжелудочковой перегородки с возникновением небольшого лево-правого шунта, повреждение при продолжении разреза правой коронарной створки аортального клапана с развитием его недостаточности (в 9-11%), требующей в отдельных случаях имплантации протеза клапана, а также нарушения проводимости. Полная атриовентрикулярная блокада встречается у 5-10% больных и обычно носит преходящий характер (В. Heric с соавт., 1995). Чаще приходится сталкиваться с блокадой левой ножки пучка Гиса или ее передне-верхней ветви (в 50-80%) из-за их пересечения.
По мнению W. Bigelow и соавторов (1974), успех операции в значительной мере зависит от выбора оптимального места, глубины и длины разреза мышечной ткани.
В 1960 г. A. Morrow начал сочетать вентрикуломиотомию из аортального доступа с миэктомией, и эта методика завоевала в последующем наиболее широкое признание среди хирургов. Сущность операции состоит в иссечении небольшой полоски ткани из основания межжелудочковой перегородки (обычно от 2 до 5 г) из двух параллельных разрезов длиной около 4 см. Первый разрез выполняют по направлению к верхушке, начиная от основания правой коронарной створки аортального клапана на 2-3 см правее комиссуры между правой и левой створками, а второй — примерно на 1 см правее. Глубина разрезов в наиболее толстой части межжелудочковой перегородки составляет в среднем 1,5 мм, так, чтобы толщина перегородки оставалась около 1 см. При необходимости разрез углубляют путем тупого разделения мышечных волокон. В результате в области межжелудочковой перегородки образуется канал прямоугольной формы (A. Morrow с соавт., 1975).
В последние годы для предотвращения блокады левой ножки пучка Гиса, являющейся частым осложнением операции по A. Morrow, и эксцентрического систолического движения передней створки митрального клапана кпереди в послеоперационном периоде вентрикуломиотомия производится под правой коронарной створкой аортального клапана (W. Williams с соавт., 1987 ) с иссечением мышцы из передней части межжелудочковой перегородки.
По данным некоторых авторов (Т. Agnew с соавт., 1977, и др.), более эффективной является миэктомия из комбинированного доступа через аорту и левый желудочек, который позволяет произвести иссечение мышечной ткани, вдающейся в выносящий тракт желудочка. непосредственно под контролем зрения. Это позволяет также уменьшить риск повреждения митрального и аортального клапанов, пучка Гиса и перфорации межжелудочковой перегородки. Недостатком чрезжелудочкового доступа является возможность развития такого позднего осложнения, как аневризма левого желудочка (в 3-7%), которая у части больных требует иссечения.
Для повышения эффективности хирургической коррекции после выполнения трансаортальной септальной миэктомии по A. Morrow целесообразно интраоперационно измерять внутрижелудочковый градиент давления. В случаях его недостаточного уменьшения и сохранения свыше 30 мм рт.ст, в покое или более 50 мм рт.ст, после провокации дополнительно проводится миотомия по W. Bigelow книзу от комиссуры между левой и правой коронарными створками аортального клапана, или иссекаются участки гипертрофированного миокарда в области боковой стенки левого желудочка и утолщенный эндокард в выносящем тракте желудочка.
Показана эффективность сочетания миэктомии с мобилизацией и частичным иссечением папиллярных мышц, ответственных за систолическое движение створок митрального клапана кпереди (B.Messmer, 1994; F. Schoendube с соавт., 1994).
Другие методы хирургической коррекции нарушения геометрии левого желудочка, как, например, пластика его выносящего тракта с помощью кондуита с искусственым клапаном (Е. Dembitsky с соавт., 1976), из-за значительной технической сложности и отсутствия преимуществ в отношении клинического эффекта не получили дальнейшего распространения.
Ранние осложнения септальной миэктомии аналогичны миотомии по W. Bigelow. Сразу после операции возможно также развитие инфаркта миокарда в области межжелудочковой перегородки (примерно в 6% случаев), что, вероятно, обусловлено повреждением ее кровоснабжения при атипичном расположении артерий или их исходном стенозировании.
У 20-25% больных с обструктивной ГКМП, при наличии показаний к хирургическому лечению, наблюдается значительный кальциноз митрального клапана, что усугубляет выраженность митральной регургитации, связанной с внутрижелудочковой обструкцией, присущей всем таким больным. В подобных случаях повышение общего периферического сосудистого сопротивления при проведении пробы с внутривенным введением ангиотензина или мезатона, которое приводит к резкому снижению внутрижелудочкового градиента давления, не сопровождается уменьшением обратного тока на митральном клапане или даже вызывает его увеличение. У этих больных вентрикуломиэктомию необходимо сочетать с протезированием митрального клапана с использованием низкопрофильного протеза. Риск, связанный с операцией, значительно выше, чем при изолированной миэктомии или протезировании клапана у других категорий больных с митральной недостаточностью. Миэктомии отдают предпочтение при распространенной гипертрофии межжелудочковой перегородки. В этих случаях она чаще обеспечивает адекватную коррекцию патологии и получение хорошего клинического эффекта операции.
Хирургическая летальность в настоящее время составляет около 5%, а в ряде центров даже 1% (С. Seller с соавт., 1991; J. Ten Berg с соавт., 1994; Н. Schulte с соавт., 1995), что сопоставимо с летальностью при медикаментозной терапии — в среднем 2-5% в год. Основной причиной смерти оперированных больных является фибрилляция желудочков, в части случаев спровоцированная развитием инфаркта миокарда, реже нарастание сердечной недостаточности в связи с пароксизмами мерцательной аритмии или неудачной коррекцией патологии и тяжелые тромбоэмболии.
Гибель в отдаленный послеоперационный период отмечается преимущественно в случаях неудовлетворительной хирургической коррекции. Смерть чаще всего наступает внезапно в результате желудочковых аритмий и реже — от прогрессирующей сердечной недостаточности. Эффективность хирургического лечения уменьшается у больных старше 40 лет и при наличии резко выраженной гипертрофии левого желудочка (толщина миокарда свыше 30 мм). Неблагоприятное влияние на ближайшие и отдаленные результаты операции оказывают также пароксизмальная мерцательная аритмия и увеличение кардиоторакального индекса (F. Jault с соавт., 1996).
В 1973 г. D. Cooley предложил использовать для устранения внутрижелудочкового градиента давления у больных обструктивной ГКМП протезирование митрального клапана. Полученные положительные результаты — полное исчезновение градиента во всех случаях — подтверждают важную роль систолического движения створок митрального клапана кпереди в создании препятствия изгнанию крови из левого желудочка.
Существенными недостатками протезирования митрального клапана как метода оперативного лечения мышечного субаортального стеноза являются еще большее уменьшение полости левого желудочка, опасность развития систолического движения кпереди передней створки биологического протеза, находящегося вблизи выносящего тракта, а также повышенный риск поздних тромбоэмболий, связанных с имплантированным протезом, и его дисфункции. Учитывая это, а также эффективность вентрикуломиотомии (миэктомии), рассечение межжелудочковой перегородки является операцией выбора у большинства больных. Протезированию митрального клапана целесообразно отдавать предпочтение в случаях обструктивной ГКМП, когда оперативное вмешательство показано, но выполнение миэктомии трансаортальным доступом затруднено, как, например, при мезовентрикулярной обструкции при относительно небольшом, менее 20 мм, утолщении межжелудочковой перегородки из-за повышенной опасности ее перфорации, а также у больных с неудовлетворительными результатами предшествовавшей миэктомии, то есть при сохранении значительного внутрижелудочкового градиента давления. Протезирование митрального клапана у больных ГКМП в целях ликвидации обструкции производится также в случаях значительной митральной регургитации из-за сопутствующей первичной патологии митрального клапана. Установлено, что более или менее выраженное увеличение площади створок и аномальное прикрепление папиллярных мышц встречаются у 60% больных ГКМП (В. Maron с соавт., 1987). D. Cooley (1974) считает, что протезирование митрального клапана имеет преимущества перед миотомией также при наличии блокады правой ножки пучка Гиса (из-за опасности повреждения при рассечении межжелудочковой перегородки левой ножки с развитием полной атриовентрикулярной блокады) и у больных со значительными нарушениями гемодинамики, особенно в пожилом возрасте, когда особенно важно обеспечить полную ликвидацию препятствия изгнанию крови из левого желудочка.
У больных с терминальной застойной сердечной недостаточностью производится трансплантация сердца.
J. Isner и соавторы (1984) показали возможность септальной миотомии и миэктомии с помощью аргонового лазера с длиной волны 454-514 нм при мощности 1,5 Вт и экспозиции 4 мин. Через аортальный доступ под контролем зрения лучом лазера, направленным на эндокардиальную поверхность межжелудочковой перегородки, производят несколько разрезов в ее утолщенной базальной части. Поглощенная миоглобином световая энергия излучения превращается в тепловую, которая вызывает местное термическое повреждение и испарение мышечной ткани. По мнению исследователей, преимуществом лазерной фототерапии перед общепринятым иссечением миокарда межжелудочковой перегородки является возможность ее проведения на работающем сердце при залитом кровью операционном поле. Весьма перспективным является и чрезартериальный доступ луча лазера с подведением его через оптическое волокно к межжелудочковой перегородке без вскрытия грудной клетки, что было успешно продемонстрировано авторами в эксперименте на собаках. Подобный подход не получил пока, однако, широкого распространения в клинике.
В качестве альтернативы миэктомии изучается эффективность локальной катетерной деструкции гипертрофированной части межжелудочковой перегородки путем селективного внутрикоронарного введения чистого спирта, вызывающего ограниченный инфаркт перегородки (U. Sigwart с соавт., 1995). Показано, что операция обеспечивала стойкой снижение субаортального градиента давления и симптоматическое улучшение более чем в 90% случаев. Летальность составляет около 2-5%. Распространенными осложнениями являются возникновение полной атриовентрикулярной блокады, требующей временной ЭКС у 20-30% больных и постоянной — у 7-10%, а также различных нарушений ритма, связанных с инфарктом миокарда (С. Knight с соавт., 1997; Е. Wigle, 1998, устное сообщение).
Как показывает большой опыт оперативного лечения обструктивной ГКМП, хирургическое рассечение или иссечение утолщенного базального сегмента межжелудочковой перегородки оказывает более или менее выраженное корригирующее влияние на все патофизиологические механизмы нарушений гемодинамики, свойственные этому заболеванию. Приводя к уменьшению толщины межжелудочковой перегородки и расширению выносящего тракта левого желудочка, площадь поперечного сечения которого увеличивается в 1,5-2 раза, оно способствует нормализации изгнания крови: ее поток приобретает направление, параллельное створкам митрального клапана, а экскурсия папиллярных мышц уменьшается (S. Nakatani с соавт., 1996). В результате у подавляющего большинства больных (90% и более) сразу после операции исчезает или значительно уменьшается систолическое движение створок митрального клапана кпереди и связанные с ним градиент систолического давления в выносящем тракте левого желудочка и митральная регургитация. Более чем в 50% случаев заметно снижается конечно-диастолическое давление в левом желудочке, вплоть до его нормализации (В. Maron с соавт., 1987; В. Heric с соавт., 1995; R. Roberts и Е. Stinson, 1996).
Механизмы положительного гемодинамического и клинического эффекта миэктомии не вполне ясны. Вероятно, определенную роль играют устранение препятствия изгнанию крови из желудочка в систолу, увеличение податливости его камеры благодаря уменьшению систолической перегрузки и ликвидация митральной недостаточности. Показатели сократительной функции при этом, как правило, не изменяются. Исчезновение обратного тока на митральном клапане и снижение давления в левом предсердии способствуют уменьшению его размеров и подверженности мерцательной аритмии, поэтому таким больным миэктомия особенно показана. В поздние сроки после операции у части пациентов наблюдается уменьшение выраженности гипертрофии задней стенки левого желудочка, по-видимому, связанное с устранением его перегрузки сопротивлением. Все эти факторы обуславливают достижение значительного и стойкого симптоматического улучшения у большинства оперированных больных (рис. 32).
Основной причиной остаточного внутрижелудочкового градиента давления является неадекватная по объему удаленного миокарда вентрикуломиэктомия и вследствие этого недостаточное увеличение поперечного сечения выносящего тракта левого желудочка. Определенную роль играет также эксцентричность расположения иссеченной полоски ткани по отношению к середине межжелудочковой перегородки (Р. Spirito с соавт., 1984).
При прочих равных условиях наилучшие результаты хирургического лечения достигаются у больных с наименее распространенной гипертрофией левого желудочка по данным двухмерной ЭхоКГ (E.Wigle с соавт., 1985).
Клинический эффект успешной хирургической коррекции внутрижелудочковой обструкции весьма показателен. Так, например, по данным Р. Williams и соавторов (1987), число больных I класса NYHA после миэктомии достигало 65% за счет значительного уменьшения количества больных III и IV классов (соответственно, с 55 до 5% и с 10% до 0).
По данным М. Beahrs и соавторов (1983), функциональное состояние улучшилось на I или более классов NYHA у 81% выписавшихся после операции больных. Согласно наблюдениям В. Losse и соавторов (1987), в нерандомизированных группах больных обструктивной ГКМП улучшение функционального состояния на протяжении 1 года наблюдения имело место у 94% оперированных и лишь у 41% пациентов, получавших достаточно высокие дозы верапамила. Необходимо подчеркнуть стойкость достигнутого в результате хирургического лечения клинического эффекта при длительном — более 10 лет — наблюдении. Например, I-II класс NYHA отмечался у 94% больных, оперированных В. Heric и соавторами (1995). Сохранявшиеся у этих пациентов симптомы были в основном связаны с нарушениями ритма.
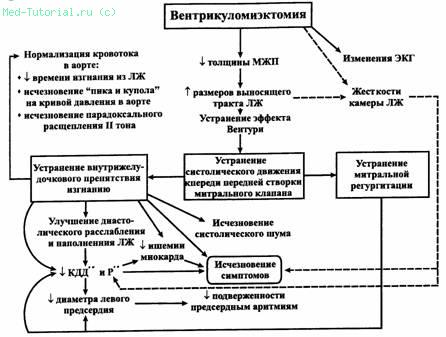
Рис. 32. Механизмы положительного гемодинамического и клинического эффекта миэктомии у больных обструктивной ГКМП. ¯ — уменьшение, — увеличение, МЖП — межжелудочковая перегородка, Рлп _ давление в левом предсердии, ЛЖ — левый желудочек, КДД — конечно-диастолическое давление
Объективным критерием достигнутого в результате операции симптоматического улучшения являются увеличение физической работоспособности и потребления кислорода на завершающем этапе нагрузочного теста, что отмечается в 89-94% случаев (В. Losse с соавт., 1987; R. Cannon с соавт., 1989). Оно сопровождается существенным приростом сердечного индекса и снижением давления в левом предсердии на последней ступени пробы, что отражает повышение насосной функции в результате ликвидации внутрижелудочковой обструкции и, возможно, возросшей диастолической податливости левого желудочка.
В целом, симптоматическое улучшение и положительные изменения гемодинамики в результате хирургической коррекции внутрижелудочковой обструкции по своей выраженности и стойкости существенно превышают эффект любой медикаментозной терапии таких больных.
Как показывают данные актуарного анализа, 5-летняя выживаемость оперированных больных составляет 93% при операционной летальности 1,6% (Р. Williams с соавт., 1987), а 10-летняя — 71-88%, включая 11% операционной летальности. Этому соответствует ежегодная летальность, связанная с основным заболеванием, включая случаи смерти в ранний послеоперационный период — 2-3%, а исключая операционную летальность — 1-2% (L. Cohn с соавт., 1992; Н. Schulte с соавт., 1993; R. Robins и Е. Stinson, 1996). Последние цифры существенно ниже, чем у больных с обструктивной ГКМП, получавших медикаментозную терапию, ежегодная летальность которых составляет около 4% (Р. Shah с соавт., 1974, и др.). Как показали результаты четырехлетних наблюдений этих авторов, летальность оперированных больных составила 6% и была значительно ниже, чем в нерандомизированной группе пациентов, лечившихся пропранололом, — 16%. В 1991 г.С. Seller и соавторы показали улучшение 10-летней выживаемости оперированных больных до 84% по сравнению с 67% в группе лечившихся медикаментозно. Следует отметить, однако, что сложность обеспечения рандомизации в сравниваемых группах больных заставляет относиться к результатам приведенных исследований с известной осторожностью и не спешить с выводом о положительном влиянии хирургического лечения ГКМП на отдаленный прогноз.
Основными причинами поздней летальности оперированных больных являются внезапная смерть и застойная сердечная недостаточность, которые имели место, соответственно, у 11 и 14% больных, наблюдавшихся М. Beahrs с соавторами (1983) в течение 13 лет.
Следует отметить, что хирургическая коррекция, будучи методом выбора у больных с обструктивной ГКМП с тяжелыми клиническими проявлениями, не предотвращает возникновение фатальных желудочковых аритмий и внезапной смерти в позднем послеоперационном периоде даже при полной ликвидации внутрижелудочкового градиента давления и отличном симптоматическом эффекте. Это обусловлено, по-видимому, распространенностью патологического процесса в миокарде левого желудочка и сохранением других патогенетических факторов, таких как диастолическая дисфункция и ишемия, которые определяют тяжесть течения заболевания.
Поскольку подверженность оперированных пациентов нарушениям ритма, включая больных с прекрасными клиническими и гемодинамическими результатами операции, не уменьшается при их дальнейшем ведении, для предотвращения внезапной смерти необходимо уделять большое внимание своевременному выявлению и активному лечению аритмий.
Симптоматичные пациенты нуждаются в продолжении соответствующей медикаментозной терапии b-адреноблокаторами, блокаторами кальциевых каналов и, по показаниям, другими препаратами.
Последовательная двухкамерная электрокардиостимуляция
В последние годы растущий интерес вызывает изучение возможности использования в качестве альтернативы хирургическому лечению больных с обструктивной ГКМП последовательной двухкамерной ЭКС из правого предсердия (в режиме "по требованию") и верхушки правого желудочка. Вызываемое этим изменение последовательности распространения волны возбуждения и сокращения желудочков, которая охватывает вначале верхушку, а затем межжелудочковую перегородку, приводит к уменьшению субаортального градиента давления благодаря расширению выносящего тракта левого желудочка в результате снижения регионарной сократимости межжелудочковой перегородки и уменьшения скорости повышения давления в желудочке (L. Fananapazir с соавт., 1992; A. Slade с соавт., 1996). Этому способствует также запаздывание систолического движения передней створки митрального клапана кпереди и уменьшение его амплитуды. Важное значение имеет подбор наименьшей величины времени задержки нанесения желудочкового импульса после предсердного, которая обеспечивает преждевременную деполяризацию верхушки сердца, не приводя при этом к ухудшению кардиогемодинамики — снижению сердечного выброса и АД. Для этого в ряде случаев приходится прибегать к удлинению времени спонтанной атриовентрикулярной проводимости с помощью терапии b-адреноблокаторами или верапамилом и даже аблации атриовентрикулярного узла (X. Yeanrenaud с соавт., 1992; N. Sadoul с соавт., 1994). Хотя первоначальные неконтролированные наблюдения были весьма обнадеживающими, более поздние рандомизированные исследования показали, что, несмотря на симптоматическое улучшение более чем в 80% случаев, достигаемое при такой ЭКС снижение субаортального градиента давления (на 25-50%) относительно невелико, а существенные изменения физической работоспособности вообще отсутствуют (L. Kappenberger с соавт., 1997, и др.). Не удалось обнаружить и существенного влияния ЭКС на частоту внезапной смерти и прогноз. Обеспокоенность вызывают усугубление нарушения диастолического расслабления миокарда и повышение конечно-диастолического давления в левом желудочке, а также отмечаемое отдельными больными клиническое ухудшение (до 10%). Описан эффект плацебо от имплантации ЭКС без проведения стимуляции (S. Betocchi с соавт., 1996; R. Nishimura с соавт., 1996, 1997). У 4-25% больных ввиду неэффективности ЭКС приходится прибегать к миэктомии (Е. Wigle, 1998, устное сообщение). Очевидно, что до четкого установления положительного влияния ЭКС и предикторов ее эффективности в каждом случае расширенное клиническое применение этого метода в лечении обструктивной ГКМП не рекомендуется.
При попытке применения двухкамерной ЭКС у больных с необструктивной ГКМП, рефрактерных к медикаментозной терапии, были получены отрицательные результаты. Несмотря на симптоматическое улучшение и некоторое увеличение толерантности к физической нагрузке у большинства пациентов в первые 4 мес лечения, при оценке показателей кардиогемодинамики отмечено существенное снижение ударного и минутного объемов сердца, а у части больных также повышение давления в легочной артерии. Последнее может объясняться нарушением диастолического наполнения левого желудочка из-за укорочения систолы предсердия. Клинический эффект ЭКС был нестойким, и спустя год большинство пациентов были вынуждены возобновить медикаментозную терапию (R. Cannon с соавт., 1994).
Особенности лечебной тактики при различных вариантах клинического течения, гемодинамических и морфологических формах гипертрофической кардиомиопатии
Лечение асимптоматичных больных. Вопрос о целесообразности лечения асимптоматичных больных ГКМП без сложных аритмий остается дискуссионным. Целью такого лечения является предотвращение внезапной смерти или прогрессирования заболевания. Поскольку убедительные доказательства эффективности в этом отношении каких-либо препаратов отсутствуют, большинство специалистов считают неоправданным рутинное назначение медикаментозной терапии таким больным, особенно с неотягощенным семейным анамнезом и слабо выраженной гипертрофией левого желудочка по данным ЭКГ и ЭхоКГ. Они должны находиться под врачебным наблюдением, желательно — с систематическим проведением холтеровского мониторирования ЭКГ, избегать значительной физической активности и занятий спортом. Эти рекомендации основываются на известных данных о том, что внезапная смерть у больных ГКМП зачастую наступает во время или сразу после интенсивной физической нагрузки.
Асимптоматичные больные с неизмененной ЭКГ и ограниченной по своей распространенности гипертрофией левого желудочка по данным двухмерной ЭхоКГ, что представляет собой наиболее благоприятный в прогностическом отношении вариант ГКМП, не нуждаются в амбулаторном мониторировании сердечного ритма (Е. Wigle, 1987).
Длительное (годами) лечение пропранололом или верапамилом, даже при отсутствии каких-либо жалоб, рекомендуется больным молодого возраста с отягощенным семейным анамнезом в отношении внезапной смерти, а, по мнению некоторых авторов, также в случаях выраженной гипертрофии межжелудочковой перегородки (ее толщине свыше 35 мм) или высокого внутрижелудочкового градиента давления (Е. Louie с соавт., 1986; В. Maron, 1987). При выявлении серьезных в отношении прогноза аритмий -желудочковой экстрасистолии высоких градаций, пароксизмов желудочковой или суправентрикулярной тахикардии или мерцания предсердий — проводится антиаритмическая терапия. Предпочтение отдают малым дозам амиодарона. У больных молодого возраста во избежание возможных осложнений, связанных с отложением этого препарата в тканях, можно попытаться использовать соталол под контролем данных холтеровского мониторирования ЭКГ.
Лечение симптоматичных больных. Симптоматичные больные ГКМП требуют активного лечения с учетом морфологической формы заболевания даже при отсутствии серьезных осложнений.
При латентной обструкции, как правило, связанной с ограниченной патологической гипертрофией и мало измененным диастолическим наполнением левого желудочка, лечебная тактика направлена прежде всего на предотвращение провокации препятствия изгнанию путем назначения b-адреноблокаторов, которые в данном случае являются препаратами I ряда. С этой целью применяют пропранолол до уменьшения частоты сердечных сокращений в покое до 60 в 1 мин или, реже, кардиоселективные b-адреноблокаторы.
Хотя монотерапия этими препаратами не способна полностью предотвратить возникновение субаортального градиента, в большинстве случаев она оказывает прекрасный клинический эффект. Так, например, если до лечения функциональное состояние 66% наблюдавшихся Е. Wigle (1987) больных соответствовало III-IV классу NYHA, то после назначения b-адреноблокаторов 88% пациентов смогли быть отнесены к 1-11 классу. При неэффективности (редко) или плохой переносимости b-адреноблокаторов их заменяют на дизопирамид или верапамил, рассчитывая на предотвращение провокации обструкции благодаря отрицательному инотропному эффекту этих препаратов. Назначения верапамила, однако, лучше избегать из-за его вазодилатирующего эффекта, который может способствовать возникновению динамического препятствия изгнанию.
Вопрос о целесообразности хирургического лечения симптоматичных больных с латентной обструкцией остается открытым. Вследствие, как правило, ограниченной по протяженности субаортальной гипертрофии межжелудочковой перегородки операция обычно выполняется легче и сопряжена с меньшим риском, чем в случаях более обширной гипертрофии. Это обстоятельство рассматривается некоторыми специалистами как довод в пользу относительно широкого применения ми-эктомии у этой категории больных (A. Morrow с соавт., 1975). С другой стороны, отсутствие в большинстве случаев существенных нарушений гемодинамики в покое, относительно благоприятный прогноз и хороший эффект терапии b-адреноблокаторами позволяют зачастую не поднимать вопрос о хирургической коррекции (Е. Wigle, 1987). Опыт применения двухкамерной ЭКС при латентной обструкции пока невелик и не позволяет сделать каких-либо окончательных выводов о целесообразности ее клинического использования у таких больных.
У симптоматичных больных с асимметричной гипертрофией межжелудочковой перегородки и субаортальной обструкцией в покое лечение обычно начинают с пропранолола. При значительной обструкции он, однако, мало эффективен. При непереносимости или недостаточной эффективности b-адреноблокаторов назначают верапамил. Из-за вазодилатирующих свойств и непредсказуемости действия применение верапамила у таких больных требует особой осторожности, а начинать лечение лучше в стационаре. Применение дигидропиридиновых производных нежелательно. При отсутствии эффекта монотерапии переходят к сочетанию пропранолола с верапамилом. При этом больные должны находиться под тщательным врачебным контролем , так как оба препарата обладают заметным отрицательным инотропным действием. Если клинический эффект по-прежнему не достигнут и субаортальный градиент сохраняется, можно попытаться назначить дизопирамид, с которого некоторые авторы рекомендуют начинать лечение таких больных. Если позволяет частота сердечных сокращений, эффективна комбинация дизопирамица с b-адреноблокаторами, например, с метопрололом, но не с соталолом.
Дополнительно по показаниям назначаются антиаритмические средства, сердечные гликозиды и малые дозы салуретиков, обязательно в сочетании с b-адреноблокаторами.
При сохранении, несмотря на активную медикаментозную терапию, жалоб и высокого внутрижелудочкового градиента давления в покое показано хирургическое лечение — миэктомия или протезирование митрального клапана. В большинстве случаев оно обеспечивает хороший и стойкий клинический и гемодинамический эффект. Перед его проведением можно попытаться наладить двухкамерную ЭКС, которая зачастую оказывается достаточно эффективной и позволяет отсрочить выполнение кардиохирургической операции. Дифференцированные показания к этим вмешательствам, однако, пока не разработаны.
Не выработана и тактика лечения очень редкого варианта обструктивной ГКМП — мезовентрикулярной обструкции. В медикаментозной терапии ведущую роль играют b-адреноблокаторы, при неэффективности которых большинство специалистов рекомендуют хирургическое лечение. Оба подхода, однако, оказывая более или менее выраженный клинический эффект, не способны предотвращать внезапную смерть.
Хирургическая коррекция патологии предусматривает иссечение гипертрофированных папиллярных мышц и (или) септальную миэктомию из чрезпредсердного или чрезжелудочкового доступа. Альтернативными подходами являются протезирование митрального клапана и создание кондуита между верхушкой левого желудочка и нисходящей аортой (R. Falikov с соавт., 1976; A. Burton с соавт., 1978).
Некоторые авторы, однако, считают оперативное лечение ГКМП с мезовентрикулярной обструкцией нецелесообразным из-за технической сложности и отсутствия существенных преимуществ перед медикаментозной терапией (Е. Wingle, 1987). Этот вопрос, вероятно, будет решен при накоплении и обобщении клинических наблюдений.
При необструктивной ГКМП с неизмененной систолической функцией, учитывая важную роль в возникновении симптомов нарушения диастолического расслабления и ишемии миокарда, препаратами выбора обычно являются блокаторы кальциевых каналов, предпочтительнее верапамил. Из-за его отрицательного инотропного и брадикардитического действий лечение начинают с относительно малых доз, постепенно повышая их под тщательным контролем. При появлении признаков систолической сердечной недостаточности осторожно добавляют салуретики и сердечные гликозиды.
У небольшой части больных оказывается эффективен пропранолол, главным образом благодаря улучшению расслабления при уменьшении частоты сердечных сокращений. В плохо поддающихся монотерапии случаях целесообразно попытаться использовать комбинацию нифедипина или верапамила с пропранололом под тщательным контролем за АД и возможным усугублением сердечной недостаточности. Дизопирамид обычно не применяется. При развитии выраженной систолической дисфункции препараты с отрицательным инотропным действием отменяют. В терминальной стадии показана трансплантация сердца.
Лечение нарушений ритма и проводимости. Эктопические желудочковые аритмии являются наиболее распространенным осложнением ГКМП и требуют активного лечения, так как могут вызывать ухудшение состояния и внезапную смерть. Поскольку они часто протекают бессимптомно, для своевременной диагностики желательно проводить холтеровское мониторирование ЭКГ, особенно в случаях наиболее высокого риска.
Пропранолол, даже в больших дозах (свыше 300 мг в сутки) не изменяет частоту желудочковых и суправентрикулярных аритмий ни в покое, ни при физической нагрузке. Среди внезапно умерших пропранолол получали 25% (В. Maron, 1987) и даже 50% (J. Goodwin, 1982). Неэффективен в этом отношении и верапамил. По данным Е. Wigle (1987), у большинства больных частую и (или) высокостепенную желудочковую экстрасистолию и пароксизмы желудочковой тахикардии удается купировать с помощью антиаритмических препаратов I группы. Препараты и их дозы подбираются индивидуально, желательно под контролем длительного ЭКГ мониторинга, так, чтобы достичь оптимального антиаритмического эффекта. М. Canedo и М. Frank (1981) рекомендуют сочетать один из антиаритмических препаратов I группы с b-адреноблокаторами, а при брадикардии — также с ЭКС. Это позволило авторам уменьшить частоту внезапной смерти среди наблюдавшихся в среднем в течение 5,7 лет больных ГКМП с 5 до 0,5% в год.
При безуспешном применении этих средств назначают амиодарон, который принято считать наиболее эффективным антиаритмическим препаратом у таких больных. Однако поскольку эти результаты были получены в исследованиях, не предусматривавших группы сравнения, на них могла оказать влияние определенная тенденциозность в подборе больных.
Не решенным остается вопрос о показаниях к антиаритмическому лечению при выявлении желудочковых эктопических аритмий у асимптоматичных больных ГКМП. Поскольку не существует бесспорных доказательств, что антиаритмическая терапия позволяет предотвращать фибрилляцию желудочков, а длительное применение больших доз всех антиаритмических препаратов чревато серьезными побочными эффектами, рутинное назначение антиаритмических препаратов всем таким больным, по-видимому, не оправдано. Показаниями к их назначению большинство специалистов считают наличие частой и высокостепенной эктопической активности у больных, перенесших остановку кровообращения или имеющих те или иные жалобы. В таких случаях обычно назначают амиодарон или имплантируют автоматический дефибриллятор-кардиовертер (J. Almendral с соавт., 1993), что при наличии значительного внутрижелудочкового градиента давления в покое сочетают с хирургическим лечением или двухкамерной ЭКС. У этих пациентов, а также у больных с пароксизмами желудочковой тахикардии и повышенным риском внезапной смерти для оптимизации выбора антиаритмической терапии целесообразно проводить электрофизиологическое исследование. При отрицательных результатах этого теста и выявлении ишемии миокарда с помощью нагрузочных проб назначают максимально переносимые дозы b-адреноблокаторов или блокаторов кальциевых каналов, в части случаев (для b-блокаторов) в сочетании с амиодароном или имплантацией кардиовертера (дефибриллятора).
Суправентрикулярные аритмии, главным образом мерцание и трепетание предсердий, зачастую вызывают значительное ухудшение течения ГКМП независимо от наличия или отсутствия субаортальной обструкции. В большинстве случаев их возникновение связано со значительной дилатацией левого предсердия (обычно более 50 мм), что в большинстве случаев наблюдается при препятствии изгнанию крови из левого желудочка, но может встречаться и при необструктивной ГКМП с выраженной систолической и диастолической дисфункцией миокарда.
В связи с высоким риском возникновения сердечной недостаточности, синкопе и системных тромбоэмболий быстрейшее восстановление синусового ритма или уменьшение частоты сокращений желудочков является неотложной задачей, требующей активной антиаритмической терапии. С этой целью применяются препараты IA группы (новокаинамид, дизопирамид), b-адреноблокаторы, верапамил, соталол и дигоксин. Наиболее эффективным средством для восстановления и стойкого сохранения синусового ритма у таких больных является, однако, амиодарон (R. Robinson с соавт., 1990;
A. Gosselink с соавт., 1992, и др.). Обычно из-за явлений застойной сердечной недостаточности приходится прибегать к внутривенному введению фуросемида (лазикса). При неэффективности медикаментозной терапии проводят трансторакальную деполяризацию.
При постоянной форме мерцательной аритмии адекватный контроль частоты сокращений желудочков обычно достигается с помощью пропранолола или верапамила в сочетании с дигоксином. Это единственный случай, когда больным с обструктивной формой ГКМП с неизмененной систолической функцией можно назначать сердечные гликозиды, не опасаясь повышения внутрижелудочкового градиента давления.
Поскольку мерцательная аритмия у больных ГКМП связана со столь же высоким риском системных тромбоэмболий, в том числе инсульта, как и при ревматических митральных пороках сердца, после ее развития необходимо сразу же начинать лечение гепарином с переходом на непрямые антикоагулянты. При купировании аритмии прием антикоагулянтов внутрь продолжают в течение нескольких недель, а при переходе мерцания в постоянную форму - неопределенно долго.
Больным с обструктивной формой ГКМП, у которых развивается пароксизмальная или постоянная форма мерцания предсердия, при невозможности сохранения синусового ритма с помощью антиаритмической терапии показано хирургическое вмешательство. У больных моложе 40 лет успешное оперативное лечение способствует стойкому восстановлению синусового ритма за счет уменьшения размеров левого предсердия в результате ликвидации препятствия изгнанию крови из левого желудочка и снижения его давления наполнения. У больных более старшего возраста адекватная хирургическая коррекция патологической гипертрофии также оказывает определенный клинический эффект, позволяя им лучше переносить постоянную форму мерцательной аритмии.
Нарушения функции синусового и атриовентрикулярного узла встречаются реже, чем нарушения сердечного ритма, однако в ряде случаев являются причиной внезапной смерти. Симптоматичные брадиаритмии, включая синдром слабости синусового узла и выраженную синусовую брадикардию, вызываемую приемом b-адреноблокаторов, требуют имплантации постоянного ЭКС. При этом методом выбора является последовательная двухкамерная ЭКС, способствующая уменьшению субаортального градиента и обеспечивающая сохранение систолы предсердий и "предсердной надбавки".
Лечение застойной сердечной недостаточности. Признаки венозного застоя в легких, включая приступы сердечной астмы и отек легких, не являются редкостью при ГКМП. В большинстве случаев они обусловлены диастолической дисфункцией левого желудочка, что можно легко установить с помощью допплер-ЭхоКГ. Таким больным показано лечение b-адреноблокаторами или блокаторами кальциевых каналов в сочетании с небольшими дозами диуретиков. Мочегонные препараты необходимо назначать с большой осторожностью, особенно при обструктивной ГКМП, так как вызываемое ими уменьшение преднагрузки способно ухудшить диастолическое наполнение левого желудочка и повысить градиент систолического давления в его полости. В то же время осторожное применение диуретиков в комбинации с Р-адреноблокаторами или верапамилом способно уменьшать конечно-диастолическое давление в левом желудочке, заклинивающее давление в "легочных капиллярах" и венозный застой в легких. Это оказывает положительный клинический эффект у значительной части больных, независимо от наличия или отсутствия субаортальной обструкции.
Сердечных гликозидов и периферических вазодилататоров следует избегать из-за опасности ухудшения диастолического наполнения, повышения внутрижелудочкового градиента давления и резкого снижения сердечного выброса, вплоть до развития синкопе и внезапной смерти. Исключение составляют случаи мерцания предсердий, при котором пагубный гемодинамический эффект тахиаритмии "перевешивает" непосредственное неблагоприятное действие гликозидов на кардиогемодинамику.
В далеко зашедшей стадии патологического процесса в миокарде у небольшой части больных наблюдаются симптомы застоя в легких вследствие нарушения систолической функции левого желудочка, о чем свидетельствуют прогрессирующее снижение ФВ, дилатация полости желудочка и уменьшение толщины его стенок. При этом внутрижелудочковый градиент систолического давления обычно исчезает или значительно уменьшается, однако изредка может сохраняться. В этих случаях назначают диуретики, сердечные гликозиды и с осторожностью ингибиторы АПФ, иногда на фоне терапии b-адреноблокаторами или верапамилом. При выраженной систолической дисфункции последние, однако, противопоказаны. Сердечная недостаточность у таких больных рефрактерна к медикаментозной терапии, и единственным эффективным методом лечения является трансплантация сердца (J. Shirani с соавт., 1993, и др.).
Профилактика
Учитывая то, что не менее чем у 50% больных ГКМП носит семейный характер, в отдельных семьях целесообразно прибегать к генетическому консультированию. Ввиду генетической гетерогенности заболевания консультирование должно быть индивидуализированным. Хотя риск передачи ГКМП потомству в среднем сравнительно невелик и составляет примерно 20%, в семьях с аутосомно-доминантным типом наследования он достигает 50%. В то же время в семьях, имеющих лишь одного больного, вероятность поражения потомства значительно меньше 20% (В. Магоп с соавт., 1984).
Важное значение для генетического консультирования имеет тот факт, что морфологический субстрат ГКМП окончательно формируется лишь к юношескому возрасту, а возможно, и позже, и для достоверного исключения этого заболевания необходимо выполнение ЭхоКГ после прекращения роста тела. Следует учитывать также возможность асимптоматичного течения ГКМП, что имеет место примерно у 20% пораженных родственников (В. Магоп с соавт., 1987). Отсюда очевидна целесообразность обязательного ЭхоКГ обследования всех членов семьи пробанда для ранней, доклинической, диагностики заболевания.
Комплексная система мер вторичной профилактики ГКМП пока не разработана. С учетом характера основных клинических проявлений и причин смерти таким больным противопоказаны тяжелые физические нагрузки и занятия спортом. Рекомендуется диспансерное наблюдение для обеспечения своевременного выявления и лечения эктопических аритмий, проявлений ишемии миокарда и сердечной недостаточности, профилактики тромбоэмболий и инфекционного эндокардита.
В заключение обсуждения вопросов дифференцированного лечения ГКМП, необходимо отметить следующее. Генез каждого из симптомов этого заболевания может быть связан с несколькими различными патофизиологическими механизмами. Отсюда очевидно, что эффективность той или иной лечебной тактики в каждом конкретном случае будет зависеть от того, какой из патогенетических факторов играет в данной ситуации ведущую роль. Например, если тяжелая стенокардия, одышка или синкопе наблюдаются у больного с выраженной внутрижелудочковой обструкцией в покое, есть все основания ожидать, что наибольшее симптоматическое улучшение будет достигнуто лишь путем радикального устранения динамического градиента давления с помощью операции или ЭКС. С другой стороны, если внутрижелудочковый градиент невелик, эти симптомы с большей вероятностью обусловлены диастолической дисфункцией и (или) ишемией миокарда. Неодинаковая эффективность при этом различных медикаментозных препаратов определяется качественными и количественными составляющими их влияния на отдельные патофизиологические механизмы заболевания. Очевидно, что совершенствование оценки вклада каждого из этих механизмов в генез клинических проявлений ГКМП у конкретного больного в будущем позволит заменить во многом эмпирический подход к ее лечению более эффективным целенаправленным воздействием на ведущее патогенетическое звено.
Актуальными задачами являются также объективизация оценки эффективности различных средств и методов лечения ГКМП с помощью проспективных, строго рандомизированных плацебо-контролированных исследований и уточнение факторов риска внезапной смерти, включая генетические маркеры, что позволило бы разработать действенную программу ее профилактики. Очевидно, что в будущем фундаментальные исследования позволят расшифровать весь спектр генетических механизмов ГКМП и установить связь характера генетического дефекта с течением заболевания и его прогнозом, а генная терапия откроет возможности его полного излечения.
Рестриктивная кардиомиопатия
Рестриктивная кардиомиопатия (РКМП) - это редкое заболевание миокарда с частым вовлечением эндокарда, которое характеризуется нарушением наполнения одного или обоих желудочков с уменьшением их диастолического объема при неизмененной толщине стенок. Вследствие ухудшения диастолических свойств желудочка, после короткого периода быстрого наполнения дальнейшее поступление крови в него практически прекращается, так что объем желудочка в течение второй половины диастолы существенно не возрастает. Таким образом, наполнение желудочков осуществляется почти исключительно в протодиастолу. Сократимость и систолическая функция миокарда обычно сохранены, особенно на ранних стадиях. В основе заболевания лежит распространенный интерстициальный фиброз.
Клинические проявления и характер нарушения кардиогемодинамики у больных РКМП весьма сходны с таковыми при констриктивном перикардите, что представляет подчас значительные трудности для дифференциальной диагностики.
РКМП может быть идиопатической или обусловленной инфильтративными системными заболеваниями, такими, как амилоидоз, гемохроматоз, саркоидоз и др.
К идиопатической РКМП как заболеванию миокарда неизвестной этиологии относят две нозологическое единицы - фибропластический париетальный эндокардит (или эндомиокардиальную болезнь) Леффлера и эндомиокардиальный фиброз. В последнее время для обозначения этих заболеваний используются также термины "эндомиокардиальная болезнь с эозинофилией" и "эндомиокардиальная болезнь без эозинофилии" (Р. Richardson с соавт., 1996).
Сопровождающаяся синдромом гиперэозинофилии эндомиокардиальная болезнь была впервые описана W. Loftier (1930). Она встречается, в основном, в местностях с умеренным климатом и сочетается со стойким повышением содержания эозинофилов в периферической крови (более 1,5•109/л в течение не менее 6 мес), которое не связано с какой-либо известной причиной или системным заболеванием. На ранних стадиях болезни эозинофилы накапливаются в миокарде, вызывая его повреждение.
Эндомиокардиальный фиброз поражает практически исключительно жителей тропиков, реже - субтропиков и протекает без эозинофилии. Он был впервые описан в 1938 г. A. Williams у двух жителей Уганды, страдавших сердечной недостаточностью и митральной регургитацией, у которых на вскрытии были обнаружены крупные очаги фиброза в миокарде, которые исследователь расценил как исход сифилитического миокардита. Спустя 8 лет D. Bedford и G. Konstam (1946) обратили внимание на то, что у некоторых западноафриканских солдат, которые умирали от сердечной недостаточности, выявлялся распространенный субэндокардиальный фиброз, а к расположенному над его очагами утолщенному эндокарду были фиксированы множественные тромбы. Первое подробное описание морфологического субстрата и клинической картины нового заболевания было сделано лишь в 1955 r.J. Davies, который и дал ему название "эндомиокардиальный фиброз".
В 70-е годы Е. Olsen и С. Spry (1985) привлекли внимание к сходству морфологических изменений в миокарде при эндомиокардиальном фиброзе у жителей тропиков и в поздних стадиях эндомиокардиальной болезни Леффлера. В обоих случаях они характеризуются сочетанием поражения миокарда с преобладанием фиброзных изменений с выраженным утолщением эндокарда одного или обоих желудочков, преимущественно на путях притока и в области верхушки, которое вызывает значительное нарушение их наполнения По мнению авторов, это позволяет считать эндомиокардиальную болезнь Леффлера и эндомиокардиальный фиброз Дэвиса различными вариантами одного и того же заболевания миокарда с вовлечением эндокарда, вызываемого токсическим воздействием эозинофилов. Такая унитарная точка зрения получила впоследствии довольно широкое распространение (W. Roberts и V. Ferrans, 1974; С. Rapazzi с соавт., 1993, и др.), хотя и признается не всеми авторами.
Патофизиологические механизмы нарушения гемодинамики.
Нарушения внутрисердечной гемодинамики при РКМП типичны для диастолической сердечной недостаточности и характеризуются развитием так называемого синдрома рестрикции. В его основе лежит резкое повышение эластической жесткости желудочка, из-за чего необходимым условием поддержания адекватного ударного объема становится повышение конечно-диастолического давления.
Нарушение эластических свойств желудочка приводит к патологическим изменениям процесса его диастолического наполнения, что проявляется характерным изменением кривой диастолического давления. Она приобретает форму квадратного корня (рис. 33) со значительным снижением давления в начале диастолы и последующим резким подъемом с переходом в плато. Соответственно изменяется и кривая давления в предсердиях, которая приобретает форму "М" или "W" из-за резко выраженных пиков снижения давления Y и X, которые чередуются с высокоамплитудными и одинаковыми по величине волнами А и V. При этом значительно повышается давление в системных и легочных венах. Увеличивается также систолическое давление в легочной артерии, зачастую более 45 мм рт. ст., однако выраженная прекапиллярная легочная гипертензия не характерна.
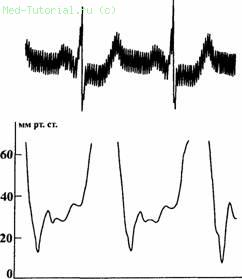
Рис. 33. Кривая диастолического давления в левом желудочке (в мм рт. ст.) у больной Д.
Кроме повышения конечно-диастолического давления, в обеспечении адекватного наполнения левого желудочка и ударного выброса важную роль играет присасывающее действие желудочка в протодиастолу. Как показывает анализ характера кривой зависимости "давление-объем" на протяжении сердечного цикла, у таких больных снижение давления в левом желудочке в начале диастолы сопровождается отчетливым возрастанием диастолического объема, что не свойственно здоровым лицам. Включение этого механизма, по-видимому, имеет важное компенсаторное значение для поддержания насосной функции сердца при нарушении диастолической податливости желудочка.
Несмотря на значительное повышение конечно-диастолического давления, систолическая функция желудочков существенно не нарушена, о чем свидетельствуют неизмененные величины КДО (менее 110 см3/м2) и ФВ (более 50%). Отсутствует и сколько-нибудь выраженная гипертрофия миокарда желудочков.
Следует иметь в виду, что гемодинамический синдром рестрикции неспецифичен для идиопатической РКМП и отмечается также при констриктивном перикардите и целом ряде системных заболеваний миокарда - инфильтративных (амилоидоз, саркоидоз), неинфильтративных (системная склеродермия), болезнях "накопления" (гемохроматоз, гликогеноз, болезнь Фабри), а также при карциноидном, радиационном и некоторых видах токсического поражения миокарда (адриамициновом, антрациклиновом и др.), сопровождающихся также утолщением эндокарда. Поэтому постановка диагноза идиопатической РКМП обязательно требует проведения дифференциальной диагностики с этими заболеваниями.
Клиника. Основные клинические проявления РКМП обусловлены синдромом рестрикции и характеризуются венозным застоем крови на путях притока к левому и правому желудочкам, обычно с преобладанием застоя в большом круге кровообращения. Больных , как правило, беспокоят выраженная одышка и слабость при малейшей физической нагрузке, связанные с усугублением нарушения диастолического наполнения при тахикардии. Быстро нарастают периферические отеки, гепатомегалия и асцит, зачастую рефрактерные к проводимой терапии. При объективном исследовании отмечаются набухание шейных вен и увеличение центрального венозного давления, которое часто усугубляется на вдохе (признак Куссмауля). Может определяться парадоксальный пульс. Обращает на себя внимание несоответствие между тяжестью проявлений сердечной недостаточности и отсутствием кардиомегалии, что еще до выполнения инструментального обследования позволяет заподозрить наличие диастолической дисфункции миокарда. При аускультации сердца отмечаются протодиастолический, пресистолический или суммационный ритм галопа и в значительной части случаев также систолический шум митральной или трикуспидальной недостаточности (М. А. Гуревич и М. О. Янковская, 1988; В. С. Моисеев, 1990). Заболевание часто осложняется мерцанием предсердий и эктопическими межжелудочковыми аритмиями, а также тромбоэмболиями в малый и большой круги кровообращения, источниками которых у большинства больных служат тромбы в желудочках и в случаях мерцательной аритмии — также в предсердиях (С. Chew с соавт., 1977; R. Siegel с соавт., 1984).
Диагностика. При рентгенографии грудной клетки размеры сердца не изменены или немного увеличены. Кардиомегалия может наблюдаться только при развитии гидроперикарда. В зависимости от локализации поражения (левый, правый желудочек или оба желудочка) отмечаются выраженные в различной степени увеличение предсердий и венозный застой в легких.
Изменения ЭКГ отмечаются часто, но они неспецифичны. Могут регистрироваться признаки гипертрофии предсердий и желудочков, блокада левой (чаще) или правой (реже) ножек пучка Гиса, неспецифические нарушения реполяризации, различные нарушения сердечного ритма (N. Tobias с соавт., 1992).
При ЭхоКГ дилатация и гипертрофия желудочков отсутствуют, сократительная способность их не изменена. У части больных полость желудочка может быть уменьшена за счет облитерации верхушечного сегмента. В области верхушки часто определяются тромбы. При выраженном венозном застое в большом круге кровообращения может накапливаться жидкость в полости перикарда. При доплерэхокардиографическом исследовании зачастую выявляется умеренная регургитация крови через митральный и (или) трикуспидальный клапаны, сопровождающаяся дилатацией полостей предсердий, иногда - умеренным фиброзом створок атриовентрикулярных клапанов (A. Macedo с соавт., 1995; F. Cetta с соавт., 1995). Весьма характерны, но неспецифичны свойственные рестриктивному типу диастолической дисфункции увеличение максимальной скорости раннего диастолического наполнения (Е), которая значительно преобладает над таковой в период систолы предсердий (А), (Е/А > 1,0), и укорочение периода замедления скорости раннего наполнения (R. Tello с соавт., 1994).
Другие неинвазивные методы визуализации сердца, такие, как компьютерная и магнитно-резонансная томография, используются в основном для исключения констриктивного перикардита, для которого характерно утолщение перикарда, не свойственное РКМП.
Важное значение для диагностики и дифференциальной диагностики РКМП имеет инвазивное обследование - катетеризация сердца с ЛАГ и в части случаев с ЭМБ. Быстрое наполнение желудочков в ранний период диастолы с резким его замедлением во второй ее половине находит отражение в характерном изменении формы кривой давления в желудочках и предсердиях (см. рис. 33). Нарушение наполнения желудочков определяется также при АКГ, которая позволяет документировать их неизмененные размеры и нормальную ФВ. У большинства больных отмечается та или иная степень регургитации крови через атриовентрикулярные клапаны с различным по своей выраженности увеличением полостей предсердий (J. Bennotti с соавт., 1980).
При ЭМБ в ранней воспалительной стадии эндомиокардиальной болезни Леффлера (см. ниже) можно обнаружить характерные эозинофильные инфильтраты, а в поздней стадии этого заболевания и при эндомиокардиальном фиброзе - более или менее распространенный интерстициальный фиброз без признаков воспаления. Последний, однако, не является специфичным признаком идиопатической РКМП и имеет диагностическое значение только при наличии клинических и гемодинамических критериев синдрома рестрикции. Основная роль ЭМБ при этих заболеваниях состоит в исключении констриктивного перикардита и РКМП вследствие системных и инфильтративных поражений миокарда.
Дифференциальная диагностика. Дифференциальный диагноз РКМП с другими кардиомиопатиями, отличающимися принципиально иными патофизиологическими механизмами (табл.21), обычно не вызывает затруднений. Как и при РКМП, в клинической картине ДКМП доминируют признаки бивентрикулярной сердечной недостаточности, которая, однако, будучи обусловленной систолической дисфункцией миокарда, сопровождается кардиомегалией, дилатацией всех полостей сердца, преимущественно желудочков, и их диффузной гипокинезией. Эти изменения морфофункционального состояния желудочков, легко обнаруживаемые при ЭхоКГ, в корне отличаются от гемодинамических признаков синдрома рестрикции, свойственного РКМП.
Таблица 21. Дифференциальная диагностика КМП
|
Методы исследования |
Признаки |
Дилатационная КМП |
Гипертрофическая КМП |
Рестриктивная КМП |
|||
|
Клиника |
Стенокардии |
Не характерна |
Характерна |
Не характерна |
|||
|
Синкопе |
Не характерно |
Характерно |
Не характерно |
||||
|
Тотальная сердечная недостаточность |
Выраженная |
Отсутствует, реже умеренная |
Выраженная |
||||
|
Рентгенография |
Увеличение сердца |
Выраженное, преимущественно желудочков |
Отсутствует или умеренное, преимущественно левого предсердия |
Отсутствует, реже умеренное, преимущественно предсердий |
|||
|
ЭКГ |
Гипертрофия левого желудочка |
Умеренная |
Выраженная |
Обычно отсутствует |
|||
|
ЭхоКГ |
Размеры желудочков |
Значительно увеличены |
Не изменены или уменьшены |
Чаще уменьшены |
|||
|
Размеры предсердий |
Увеличены |
Возможно увеличение левого |
Увеличены |
||||
|
Гипертрофия желудочков |
Отсутствует или умеренная |
Выраженная, часто асимметричная |
Отсутствует |
||||
|
Индексы сократимости желудочков в фазе изгнания |
Значительно снижены |
Повышены или не изменены |
Не изменены |
||||
|
Систолическое движение передней створки митрального клапана кпереди |
Отсутствует |
Часто |
Отсутствует |
||||
|
АКГ |
Особенности данных вентрикулографии |
Диффузная гипокинезия |
Выраженная гипертрофия межжелудочковой перегородки и папиллярных мышц, щелевидная полость левого желудочка |
Часто облитерация полости в области верхушки |
|||
|
Катетеризация сердца |
Особенности |
— |
Часто градиент систолического давления в полости левого желудочка |
Кривая диастолического давления в желудочках в виде "квадратного корня" |
|
||
У части больных ГКМП, как и при РКМП, при практически не измененных размерах сердца и его полостей и сохраненной систолической функции левого желудочка отмечаются признаки венозного застоя в легких (одышка, изменения на рентгенограмме), повышение конечно-диастолического давления в левом желудочке, давления в левом предсердии и "легочных капиллярах". При этом в пользу ГКМП свидетельствуют отсутствие или относительно слабая выраженность признаков правожелудочковой недостаточности (за исключением терминальной стадии заболевания), частые жалобы на стенокардию и обмороки, признаки выраженной гипертрофии левого желудочка по данным ЭКГ и ЭхоКГ, а при наличии обструкции выносящего тракта левого желудочка -характерные для нее эхокардиографические признаки. Развивающееся у таких больных повышение конечно-диастолического давления в левом желудочке сопровождается пропорциональным увеличением его начально-диастолического давления, что исключает симптом "квадратного корня" (С. Chew с соавт., 1977).
Несмотря на широкое внедрение в практическую кардиологию современных инструментальных методов исследования, весьма сложной задачей остается распознавание идиопатической РКМП от других заболеваний, вызывающих нарушение диастолического наполнения желудочков с развитием клинико-гемодинамического синдрома рестрикции. При этом в первую очередь необходимо проводить дифференциальную диагностику РКМП с констриктивным перикардитом.
При клиническом исследовании у части больных констриктивным перикардитом в анамнезе можно обнаружить указания на туберкулез, травму грудной клетки или перенесенный острый перикардит, у 80% определяется признак Куссмауля (повышение центрального венозного давления на вдохе), примерно у 20% - парадоксальный пульс. В отличие от РКМП систолический шум митральной и (или) трикуспидальной регургитации и ее признаки при допплеровском исследовании не характерны. В связи с негомогенностью поражения миокарда и эндокарда желудочков и их отдельных участков при РКМП, величины конечно-диастолического давления в них обычно неодинаковы и различаются более чем на 5 мм рт. ст. (в левом желудочке обычно выше), тогда как при констриктивном перикардите они идентичны (J. Hirshman, 1978; J. Benotti, 1984). Этот признак РКМП, однако, не является строго обязательным (R. Shabetai, 1990). Подтвердить диагноз констриктивного перикардита, не прибегая к инвазивному обследованию, позволяет обнаружение участков кальцификации перикарда при рентгенографии грудной клетки. К сожалению, они выявляются лишь у 30-60% таких больных, и поэтому отсутствие кальцинатов не исключает диагноз констриктивного перикардита. Более информативными являются современные методы неинвазивной визуализации перикарда - компьютерная и магнитно-резонансная томография. В большинстве случаев констриктивного перикардита (88% по данным Т. Masui с соавт., 1992) они позволяют определить утолщение перикарда, что подтверждает диагноз (I. Suchet и Т. Horwitz, 1992). В особо сложных случаях прибегают к ЭМБ. При этом отсутствие морфологических изменений в биоптатах миокарда у больного с признаками системного венозного застоя, значительно повышенным центральным венозным давлением и "маленьким" сердцем считается весомым доводом в пользу констриктивного перикардита и требует выполнения торакотомии даже при отсутствии утолщения перикарда по данным компьютерной и магнитно-резонансной томографии (N. Spyrou и R. Foale, 1994).
Системные и инфильтративные заболевания миокарда, проявляющиеся синдромом рестрикции, встречаются относительно редко. Среди них дифференциальную диагностику идиопатической РКМП необходимо проводить прежде всего с амилоидозом сердца. Это заболевание, обусловленное отложением в нем аномального белка, в большинстве случаев является частью системного поражения с вовлечением в патологический процесс других органов - языка, кишечника, печени, селезенки, периферических нервов, кожи. Оно возникает, как правило, у лиц старше 40 лет, чаще у мужчин. У большинства больных поражение миокарда проявляется диастолической сердечной недостаточностью со всеми характерными клиническими и гемодинамическими признаками синдрома рестрикции. Реже развиваются систолическая сердечная недостаточность, сходная с картиной ДКМП, и типичная стенокардия. На ЭКГ отмечается снижение вольтажа в отведениях от конечностей, что сочетается с гипертрофией левого желудочка по данным ЭхоКГ (J. Carroll с соавт., 1982). Весьма характерны нарушения проводимости в виде синдрома слабости синусового узла, синоатриальной, атриовентрикулярной и внутрижелудочковых блокад. Нередко определяются признаки крупноочаговых изменений в миокарде левого желудочка, обусловленные замещением групп кардиомиоцитов отложениями аномального белка или истинным постинфарктным кардиосклерозом вследствие поражения амилоидозом венечных артерий. При ЭхоКГ видно увеличение толщины стенок левого и правого желудочков и межжелудочковой перегородки, причиной которого является не истинная гипертрофия кардиомиоцитов, а инфильтрация амилоидом. При этом размеры полости желудочков в большинстве случаев не изменены или уменьшены, а период изоволюмического расслабления удлинен (М. StJohn Sutton и соавт., 1982; Н. Leinonen и S. Pohjola-Sintonen, 1986). При катетеризации сердца из-за повышенного начально-диастолического давления в левом желудочке симптом "квадратного корня" не характерен. Вследствие замедленного наполнения на протяжении всей диастолы обычно не образуется и патологический III тон (С. Chew с соавт., 1977). Диагноз подтверждается при выявлении отложений амилоида в биоптатах слизистой оболочки языка, прямой кишки и, что более надежно, миокарда при окраске ткани конго-рот (J. Benotti, 1984).
Поражение сердца при гемохроматозе, обусловленное отложением железа в сократительном миокарде, проявляется быстро прогрессирующей сердечной недостаточностью - либо преимущественно диастолической с развитием синдрома рестрикции, либо, реже, систолической, сопровождающейся дилатацией желудочков вследствие снижения их сократимости. У части больных отмечаются суправентрикулярные аритмии, неспецифические изменения сегмента ST и зубца Г и патологические зубцы Q на ЭКГ. Характерны нарушения проводимости (М. Fujita с соавт., 1987). При обнаружении характерной триады - пигментации кожи, увеличения печени и сахарного диабета, а также повышения уровня железа в сыворотке крови диагноз гемохроматоза не вызывает сомнений. В неясных случаях следует прибегать к биопсии печени или миокарда.
Поражение сердца при саркоидозе отмечается по секционным данным в 20-30% случаев этого заболевания, однако в клинике диагностируется еще реже (менее чем в 5% случаев). Оно характеризуется особым видом воспаления с образованием специфических гранулем, что проявляется картиной диастолической сердечной недостаточности с синдромом рестрикции, реже - систолической сердечной недостаточностью, напоминающей ДКМП. Заболевание часто осложняется различными нарушениями сердечного ритма и проводимости, которые могут служить причиной синкопальных состояний и внезапной смерти. Ввиду отсутствия специфических клинических и инструментальных признаков, распознавание саркоидоза сердца базируется на обнаружении свойственного этому системному заболеванию поражения других органов и тканей (легких, внутригрудных и периферических лимфатических узлов, печени, селезенки, кожи, глаз) с характерной морфологической картиной, а также воспалительными сдвигами в крови. Верифицировать диагноз позволяет, однако, лишь морфогическое исследование ЭМБ.
Следует подчеркнуть, что, как и в случаях других кардиомиопатий, ввиду отсутствия патогномоничных признаков, в том числе морфологических, диагноз идиопатической РКМП ставится только после исключения инфильтративных и системных заболеваний миокарда.
Случаи РКМП, протекающие с гидроперикардом, требуют дифференциальной диагностики с экссудативным перикардитом. Правожелудочковую форму РКМП следует дифференцировать с другими причинами правожелудочковой недостаточности, особенно сопровождающейся преимущественным увеличением правого предсердия, такими, как его миксома и аномалия Эбштейна, а также с первичной легочной гипертензией и некоторыми врожденными пороками сердца — стенозом устья легочной артерии, тетрадой Фалло, дефектом межпредсердной перегородки. С этой целью широко используют данные доплер-ЭхоКГ инвазивного обследования - АКГ и катетеризации сердца.
В целом, как показывает опыт, несмотря на неспецифичность проявлений идиопатической РКМП и ее сходство с целым рядом заболеваний мио-, эндо- и перикарда, тщательный анализ данных клинического и инструментального обследований и, в сложных ситуациях, морфологического изучения биопсийного материала позволяет в большинстве случае поставить правильный диагноз.
Течение. Для течения идиопатической РКМП характерно неуклонное прогрессирование диастолической сердечной недостаточности, которая служит основной причиной смерти таких больных.
Лечение РКМП исключительно симптоматическое и, в целом, мало эффективно. При значительном повышении конечно-диастолического давления в желудочках и клинических признаках застоя в системных и легочных венах определенное облегчение приносят ограничение жидкости и соли и применение диуретиков. К их назначению, однако, следует подходить более осторожно, чем при систолической дисфункции, и использовать меньшие дозы, поскольку при РКМП, как и при констриктивном перикардите, для поддержания адекватного наполнения левого желудочка и ударного выброса требуется повышенное конечно-диастолическое давление. Это касается и периферических вазодилататоров - нитратов и ингибиторов АПФ, бесконтрольное применение которых может снизить наполнение желудочков и сердечный выброс еще больше. Сердечные гликозиды эффективны только в случаях мерцательной аритмии, позволяя уменьшить частоту сокращений желудочков и, тем самым, удлинить диастолическое наполнение. У больных с синусовым ритмом и сохраненной систолической функцией миокарда назначение этих препаратов, как и негликозидных инотропных агентов, нецелесообразно ввиду их неэффективности. Для профилактики и лечения тромбоэмболических осложнений используют непрямые антикоагулянты.
При выраженном утолщении эндокарда и признаках облитерации полости желудочка у части больных удается выполнить хирургическое лечение - эндокардэктомию, подчас приносящую существенное облегчение. При выраженной митральной и трикуспидальной недостаточности определенный гемодинамический эффект оказывает протезирование или пластика клапанов, что, однако, сопряжено с высокой летальностью - 15-25% (С. Mady с соавт., 1989, R. Nacmth с соавт., 1993, и др.).
