Наружный генитальный эндометриоз (НГЭ) является одной из актуальных проблем современной медицины, оставаясь в ряду самых загадочных и труднообъяснимых заболеваний, приносящих значительный ущерб здоровью женщины. В структуре гинекологической заболеваемости эндометриоз (ЭЗ) занимает третье место после воспалительных процессов и миомы матки. Частота ЭЗ, по данным разных исследователей, варьирует от 2 до 80% у женщин репродуктивного возраста.
Многочисленными исследованиями последних лет доказано, что данный патологический процесс, встречается в любом возрасте независимо от этнической расы и социально-экономических особенностей.
В последние годы появились предложения обозначать термином «эндометриоз» только анатомический субстрат; заболевание же, связанное с этим субстратом, называть «эндометриоидной болезнью». Основной автор этой точки зрения P.R. Koninckx (1999) исходит из того, что эндометриоидные очаги могут возникать на брюшине практически у каждой женщины детородного возраста. Однако, очаги существуют всего несколько дней (может быть, ежемесячно), быстро ликвидируются иммунными защитными механизмами и не успевают вызвать ни необратимых локальных изменений, ни реакции организма в виде каких-либо симптомов или синдромов.
НГЭ — одно из самых часто выявляемых гинекологических заболеваний, при котором наблюдается расположение эндометриоидных гетеротопий на брюшине малого таза, в яичниках, ретроцервикально, во влагалищной части шейки матки и во влагалище. Частота НГЭ составляет до 10-15% в общей популяции, до 40-50% в структуре женского бесплодия и 70-80% — у 14 пациенток с синдромом хронических тазовых болей. Очевидна наметившаяся в последнее десятилетие тенденция к возрастанию частоты НГЭ, в среднем на 12%. Объясняется это, с одной стороны, возросшим интересом к данной патологии и применением различных дополнительных методов исследования для ее выявления на более ранних этапах развития, а так же с другой стороны, — ухудшением экологической обстановки, стрессовыми ситуациями и с их влиянием на нервную, эндокринную и иммунную системы, увеличению частоты хирургических вмешательств, применению внутриматочных контрацептивов, длительным приемом гормонов. Не вызывает сомнений влияние этой патологии на возникновение бесплодия, нарушение менструальной и репродуктивной функции, процессы малигнизации, социальную дезадаптацию женщины.
Выраженный стойкий болевой синдром и альгоменорея заставляют страдать миллионы женщин во всем мире, а отсутствие эффективной терапии вселяет в них чувство безысходности. Значительное поражение эндометриозом гениталий и брюшины малого таза и недостаточный объем оперативного вмешательства; рассматриваются как факторы риска рецидива заболевания. В то же время оперативные методы лечения часто бывают сверхрадикальными для молодых женщин, приводят к кастрационному синдрому пациенток репродуктивного и пременопаузального возраста.
Вышеизложенное побуждает исследовать глубинные механизмы возникновения и распространения ЭЗ и искать новые методы лечения этого тяжелейшего заболевания, названного болезнью цивилизации.
Среди всех локализаций ЭЗ поражение яичников занимает второе место и первое — в группе НГЭ.
Нет никакого сомнения в том, что ЭЗ является гормонозависимым заболеванием. Известно, что развитие различных форм ЭЗ происходит на фоне нарушений функционирования «гипоталамо-гипофизарно-яичниковой» системы. Кроме того, обнаружено, что чувствительность рецепторов стероидных гормонов в эктопических очагах снижена или изменена, что проявляется резистентностью некоторых очагов ЭЗ к действию гормональных препаратов. Обзор литературы показывает, что не менее чем у 52-74% больных, получивших гормональную терапию, отмечается персистенция заболевания.
Наиболее распространённой теорией патогенеза ЭЗ является представление об имплантации жизнеспособных клеток эндометрия в области малого таза при ретроградной менструации. Эндометриоидные гетеротопии в различной степени реагируют на изменения уровня гормонов яичников. Циклические кровотечения из эндометриоидных гетеротопий способствуют возникновению локальной воспалительной реакции и формированию фиброзной ткани, что в дальнейшем приводит к образованию спаек между органами. Локализация эндометриоидных гетеротопий в ткани яичников приводит к формированию «шоколадных» кист или эндометрием. Ретроградная диссеминация клеток эндометрия продемонстрирована во множестве клинических исследований. Тем не менее, этот процесс является физиологическим и происходит у всех женщин вне зависимости от наличия ЭЗ. Однако,, описано выявление ЭЗ у девочек, вступивших в стадию полового созревания, в период от телархе до наступления менархе, что свидетельствует в пользу эмбриональной теории развития заболевания.
Несмотря на большое число клинических и морфологических исследований, посвященных различным аспектам ЭЗ, до сих пор остаются невыясненными многие вопросы этиологии и патогенеза заболевания, особенности клинической картины в зависимости от локализации процесса, отсутствуют данные о сравнительной информативности отдельных методов диагностики заболевания и выявления рецидивов, эффективности различных методов лечения и мониторинга, возможности малигнизации.
Большое значение имеет ранняя:диагностика ЭЯ и радикальное лечение его, так как ЭЗ нередко становится причиной обширного обсеменения органов малого таза, спаечного процесса, может рецидивировать; наблюдается нагноение ЭКЯ или их малигнизация. Ранняя диагностика НГЭ чрезвычайно сложна. Свидетельством этого является тот факт, что 88% женщин, страдающих ЭЗ, до момента установления- истинного диагноза от 1 года до 7 лет наблюдаются с диагнозом «хронический сальпипгоофорит». При этом в лечении используются многократные курсы противовоспалительной терапии, лечебные гидротубации, повторные диагностические выскабливания эндометрия, что снижает вероятность восстановления репродуктивной функции. В современной гинекологии отсутствует диагностический метод, позволяющий заподозрить НГЭ на амбулаторном этапе обследования пациентки с бесплодием.
В связи с неправильно выставленным диагнозом 16,7% больных ЭЗ в течение многих лет получали тепловые процедуры, вызывающие обострение процесса, 46% — противовоспалительную терапию, которая у большинства из них оказывалась мало или неэффективной, а иногда (при ЭЯ) — вызывала ухудшение. 5,7% больных, страдающих бесплодием, получали стимулирующую гормонотерапию, после которой также отмечали ухудшение состояния. В связи с перечисленным выше все авторы, занимавшиеся изучением ЭЗ, указывают на необходимость использования дополнительных методов исследования для уточнения диагноза.
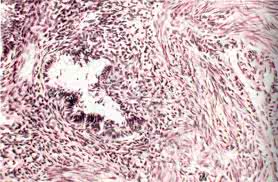
Гистологическое строение ЭЗ характеризуется сочетанием железистого эндометриоподобного эпителия и цитогенной стромы. Соотношение железистых элементов и стромы в очагах ЭЗ может быть различным. Иногда наблюдается преимущественное развитие стромы и наличие единичных желез эндометрия или их полное отсутствие.
Морфологически крупные очаговые эндометриоидные гетеротопии в яичнике (не кисты), локализующиеся на поверхности или в корковом слое яичника, имеют те же признаки, что и ЭЗ других органов и тканей. Среди цитогенной ткани располагаются железы маточного типа, выстланные цилиндрическим эпителием. В строме, окружающей железы, иногда встречаются кровоизлияния и слабо выраженная рассеянная лимфоидная инфильтрация. В различные фазы менструального цикла в эндометриоидной ткани, иногда имеющей типичный вид слизистой оболочки тела матки, наблюдаются морфологические изменения, сходные с изменениями в эндометрии.
В эндометриоидной ткани могут встречаться микроскопической величины и мелкие (до 0,5—1см в диаметре) кисты, обычно с кровянистым содержимым. Выстилающий их эпителий — типично эндометриальный.
Крупные ЭКЯ выстланы цилиндрическим и/или кубическим эпителием. Последний выявляется чаще. В подэпителиальном соединительнотканном слое обнаруживаются цитогенная строма, представленная округлыми и веретенообразными клетками, выраженное микрососудистое русло и круглоклеточный инфильтрат, состоящий из рассеянных плазматических и лимфоидных элементов, иногда приобретающих очаговый характер. Глазматические клетки обычно располагаются по периферии лимфоидной ткани могут встречаться единичные железы или небольшие их группы. В толще стенки кист обнаруживаются свежие и старые кровоизлияния, местами обширные склеротические изменения, которые обычно локализуются под слоем псевдоксантомных клеток. Встречаются макрофаги, гемосидерин, окрашенные в желтый или коричневый цвет пигментсодержащис макрофаги. Последние особенно многочисленные именно в стенке крупных ЭКЯ.
По мнению Борисовой Е.А. (2004) очаги ЭЗ и ЭКЯ являются формами- фазами заболевания. При этом прогрессирование очага ЭЗ ведет в сторону образования ЭКЯ. В то же время существуют клинические наблюдения больных ЭКЯ без формирования эндометриоидной кисты. Полученные данные показывают, что эпителиальные клетки ЭКЯ и очагов ЭЗ и также их строма резко отличаются как морфологически, так и по экспрессии ряда маркеров, следовательно, могут развиваться как независимо друг от друга, по самостоятельным морфогенетическим путям так и в сочетании.
К настоящему времени предложено более 10 классификаций ЭЗ, основанных главным образом, на макро и/или микроскопической визуальной оценке анатомических поражений органов (локализация, глубина инвазии, выраженность спаечного процесса). Следует признать, что на сегодняшний день совершенной и удовлетворяющей клиницистов классификации ЭЗ нет. Современные классификации не способны прогнозировать вероятное наступление беременности или эффективность терапии тазовой боли.
Классификация ЭЗ основана на стандартах Американского общества фертильности (American Fertility Society) (r-AFS) (1985). Различные формы заболевания заново пересмотрены и классифицированы на три типа. Первый тип, слизистый, развивается в ЭКЯ или на поверхности инвагинированиой капсулы яичника. Эти очаги неглубокие, не прорастают в ткань яичника и представляют собой наиболее поверхностный тип. Второй тип, перитонеальный, состоит из микроскопических и ранних активных форм (красные, железистые или везикулярные), прогрессирующих форм (черных и морщинистых) и заживающих форм (белых, фиброзированных, грибоподобных); наблюдаются в начале репродуктивного периода. Третий тип, аденомиома, является узловатой и заключен в матрикс гладкомышечных клеток и фиброзированной ткани в подлежащем аппарате малого таза, включая связки и ректовагинальную перегородку. По мнению Brosens IA. (1993), терминология глубокого ЭЗ, применяемая в пересмотренной классификации Американского общества Фертильности (г-ATS) (1985), неприменима для ЭКЯ, в том смысле, что ЭЯ не проникает внутрь последнего, но остается по большей части снаружи. ЭЗ обладает способностью существенно деформировать структуру яичника. Также, возникает вопрос, является ли ЭКЯ прогрессирующим заболеванием, или же, скорее, это осложнение спаечного процесса в виде образования псевдокисты, аналогично гематометре, образующейся при окклюзии цервикального канала.
В научном центре акушерства, гинекологии и перинатологии РАМН на протяжении многих лет применяют клинические классификации внутреннего эндометриоза тела матки, ЭКЯ и ретроцервикального эндометриоза, позволяющие выделить 4 стадии распространения эндометриоидных гетеротопий. Для ЭКЯ (эндометрием яичников): I стадия — мелкие точечные эндометриоидные образования на поверхности яичников, брюшине прямокишечно-маточного пространства без образования кистозных полостей; II стадия II — эндометриоидная киста одного яичника размером не более 5-6 см с мелкими эндометриоидными включениями на брюшине малого таза. Незначительный спаечный процесс в области придатков матки без вовлечения кишечника; III стадия — эндометриоидные кисты обоих яичников (различной величины — диаметр кисты одного яичника более 5 — 6 см и небольшая эндометриома другого). Эндометриоидные гетеротопии небольших размеров на серозном покрове матки, маточных труб и на париетальной брюшине малого таза. Выраженный спаечный процесс в области придатков матки с частичным вовлечением кишечника; IV стадия — двусторонние ЭКЯ больших размеров (более 6 см) с переходом патологического процесса на соседние органы — мочевой пузырь, прямую и сигмовидную кишку. Распространенный спаечный процесс.
Такое разделение, однако, является условным, поскольку истинная , тяжесть заболевания определяется не размерами образования, а сопутствующим рубцово-спаечным процессом, инфильтрацией тканей вокруг шейки матки, мочеточников, кишечника, крестцово-маточных связок и той клинической картиной, которая характеризуется течением конкретного заболевания.
Колосов Л.Е. (1985 г) предлагает различать следующие гистологические варианты ЭЯ: 1) по локализации: очаговый (внутрикорковый) — 45,3% случаев; диффузный (корковомозговой) — 54,7% случаев. 2) по гистологическому строению: железистый — 26,5%; железистокистозный — 39,4%; кистозный (макро- и микрокистозный) — 34,1%. 3) по морфофункциональной активности: растущий — 19,7%; стабильный — 25,5%; регрессивный — 42,1%; смешанный — 10,4%; по типу атипической гиперплазии — 4,9%.
Объясняя клиническую картину ЭЗ при различных локализациях заболевания, многие авторы вводят понятие функциональной активности очагов. Однако в литературе нет единого мнения о критериях функциональной активности очагов Э.З. Адамян Л.B. и Кулаков В.И. (1998) критериями морфофункциональной активности очагов ЭЗ считают соответствие фазы функциональной активности эпителия эндометрия и эндометриоидных поражений; наличие секреторного или пролиферативного типа выстилающего эпителия и выраженной подэпителиалыюй цитогеннойстромы с развитым сосудистым компонентом; наличие зерен гликогена, гликозаминогликанов и кислых гликозаминоглюкуронгликанов при гистохимическом исследовании и электронной микроскопии.
Рассматривая стромально-мезенхимальные отношения в очагах ЭЗ, Карселадзе А.И. (1990) отмечает выраженную вариабельность стромы эндометриоидных гетеротопий и эпителиального компонента. Metzger D.A. и соавт. (1992), основываясь на количестве стромы, степени фиброзирования вокруг очагов, состоянии железистого эпителия и наличии кровоизлияний в строме, описывают 4 типа эндометриоидных поражений: 1) изолированные железы с вариабельным количеством подлежащей стромы; 2) группы желез с вариабельным количеством стромы; 3) гетеротопии- как кистозно-измененные железы; 4) эндометриоидные кисты.
Для оценки функциональной активности ЭЗ и определения влияния на него эндогенных и экзогенных гормонов может быть использован гистохимический метод исследования. Однако при ЭЯ и обычное гистологическое исследование в значительном числе случаев дает достаточную информацию о функциональной активности эндометриоидных гетеротопий, оценка которой проводится с учетом сведений о менструальной функции. При определении состояния последней основываются на соответствующих данных анамнеза, обследовании больных с помощью тестов функциональной диагностики и/или на результатах гистологического исследования слизистой оболочки тела матки. Циклические структурные изменения в эндометриоидной ткани отмечаются более чем у половины молодых и среднего возраста женщин. Прежде всего, это относится к лютеиновой фазе менструального цикла, при которой в эндометриоидных гетеротопиях наблюдается различной степени выраженности секреторная реакция (несколько реже обнаруживается в ЭКЯ). В фолликулярной фазе цикла структурные особенности эпителиального и стромального компонентов ЭЗ, часто идентичны таковым в слизистой оболочке тела матки стадии пролиферации.
Известно, что эндометриоидные гетеротопии, реагируя на гормоны, во время менструации отделяют кровь, что в дальнейшем приводит к образованию вначале тонкостенных, а затем толстостенных кист. При накоплении крови в кисте целость последней может нарушаться, в результате чего кровь изливается в брюшную полость. При этом возникают резкие боли, а иногда и симптомы острого живота. Следствием излитая того или иного количества геморрагического содержимого кисты является развитие спаечного, а затем и рубцово-снасчного процесса. При самопроизвольном вскрытии кисты вместе с кровью в брюшную полость могут попадать и эндометриальные элементы, которые при определенных условиях могут быть источником возникновения ЭЗ в других местах.
Во время беременности в эндометриоидной ткани может наблюдаться децидуальный метаморфоз стромы. Подобные изменения обнаруживаются не только в яичнике или при других локализациях НГЭ, но и в очагах внутреннего эндометриоза. В редких случаях децудообразная реакция (так называемый псевдодецидуоз) может возникать на поверхности яичника или маточной трубы в отсутствие беременности и без предшествующей гормональной терапии.
Причины возникновения «псевдодецидуоза» неясны. Можно предположить, что появление очаговой децидуообразной реакции в поверхностных отделах яичника объясняется выраженной реакцией стромы, богатой клетками, на прогестерон. Нельзя также исключить влияние стимуляции надпочечников и гипофиза.
В постменопаузе изменения в ЭКЯ свидетельствуют об отсутствии в них функциональной активности, а при наличии гиперэстрогении (в пре- и постменопаузе) эпителий может проявлять пролиферативную активность. О чем свидетельствуют и данные гистохимических исследований.
Исследования ЭКЯ, удаленных в процессе гормонотерапии, показывают, что эпителий во многих участках характеризуется дистрофическими изменениями, о чем свидетельствует и резкое снижение содержание РНК.
Подэпителиальпая строма претерпевает фибробластическис изменения, отмечается склерозирование крупные артерий. Во многих участках обнаруживаются старые кровоизлияния, захватывающие внутренний отдел стенки кисты, относящийся к подэпителиальному слою. В таких участках эпителий обычно отсутствует, наблюдается замещение цитогенной стромы волокнистой соединительной тканью.
Необходимо подчеркнуть, что, несмотря на морфологические изменения в ЭКЯ, которые возникают под влиянием гормонотерапии (местами структурные особенности ЭКЯ подвергаются столь выраженным изменениям), анатомически киста как полостное образование сохраняется.
При изучении морфологических и гистохимических особенностей ЭКЯ, удаленных через 3-6 мес. после отмены гормональной терапии, наряду с малоизмененными структурными» особенностями (сохранение цитогенной стромы, выстилающего эпителия, желез, расширенные мелкие кровеносные сосуды, кровоизлияния) в стенке кист выявляются те же изменения эпителиальных структур и стромы, которые наблюдаются и при лечении. В таких случаях в крупных кровеносных сосудах отмечается облитерация отдельных артерий. В некоторых участках регрессирующая эндометриоидная ткань замещена фиброзной, нередко с формированием гиалина. Что касается кистозного образования в целом, то последнее не претерпевает анатомических изменений. Другими словами, существенных различий анатомо-гистологической картины и функционально-морфологических особенностей ЭКЯ, удаленных во время лечения и через 3-6 мес. после отмены гормонотерапии, не наблюдается.

