Глава IX. Внутренняя среда и стресс
Пожалуй, не было в истории биологии и медицины столь популярного, вошедшего во все области знания понятия, как стресс. Литература по стрессу исчисляется десятками тысяч названий. Но, как ни удивительно, само представление о стрессе, которое несколько приблизительно звучит по-русски как «напряжение», прочно вошедшее не только в научную, но и в повседневную международную терминологию, охватывает различные, подчас взаимно исключающие состояния. За последние годы объем информации по различным аспектам проблемы стресса необычайно расширился, и смысл, вложенный в понятие «стресс» его основоположником Г. Селье, частично потерял первоначальную конкретность чрезвычайного или экстремального происшествия. В лабораторном опыте стресс — состояние крысы, которая бежит часами во вращающемся колесе, плавает с грузом или без него в бассейне, стресс у морской свинки, которую ударили молотком по голове, стресс у кролика, привязанного на несколько часов к станку. Стресс — это комплекс боли и страха у человека, когда бормашина высверливает полость в больном зубе, автомобильная катастрофа, смерть близкого человека и даже семейная ссора. Стресс у бегуна, ставящего мировой рекорд, и стресс у болельщика, который подгоняет своего фаворита криками на трибуне. Стресс у космонавта в состоянии невесомости. Стресс — поцелуй любимой девушки и стресс — удар ножа в уличной драке. Стрессом стали называть почти каждое физическое или психическое возбуждение, отнюдь не укладывающееся в рамки «сильного, сверхсильного, чрезвычайного, экстремального».
Прав П. Д. Горизонтов, утверждая, что понимание стресса у разных авторов не всегда однозначно и поэтому дать ему точное определение не всегда доступно. Во многих отношениях «стресс» как понятие о напряжении всех защитных механизмов живого организма превращается в представление о реакции его на обычные раздражители, подчас искусственные, экспериментальные, нередко обычные, повседневные, не выходящие за пределы физиологических параметров. В основе стрессов могут быть как отрицательные эмоции, так и положительные. Предложено даже называть первые дистрессом, вторые — эустрессом, хотя правильнее понимать под «дистрессом» близкое к патологии расстройство функций.
Специальные исследования охватывают физический, болевой, холодовой, эмоциональный и другие виды стресса. На многочисленных конференциях, посвященных этой проблеме, и поныне обсуждаются социальные, военные, индустриальные, психические, медицинские, космические ее аспекты. Все это вызвано неконкретностью терминологии, отсутствием точной, всеми признанной дефиниции.
Все ли стрессы одинаковы по своему физиологическому значению? Где кончаются неспецифические изменения в живой системе и в чем выражается специфичность различных форм стресса?
В одной из последних работ Г. Селье определяет стресс как совокупность стереотипных, филогенетически запрограммированных, неспецифических реакций организма, первично подготовляющих его к физической активности, т. е. к сопротивлению, борьбе или бегству. Реакции эти могут быть вызваны любым экстремальным воздействием, нарушающим целостность организма (химическим, физическим, психологическим, социальным), и лежат в основе многих патологических расстройств. Отсюда и распространенная формула: стресс — нарушение функций — болезнь.
Еще раньше Селье определял стресс как сумму всех сил (независимо от их природы), действующих против равновесных состояний. При этом стресс, как утверждает Селье, может быть вызван как отсутствием и недостатком раздражений, так и их избытком. Так, например, обездвиживание (гипокинезия) является одним из самых тяжелых видов стресса и у животных и у человека.
Несмотря на множество теоретических и экспериментальных работ, цепные, многозвеньевые механизмы стресс-реакций отнюдь не раскрыты до конца. И вряд ли на современном уровне знаний их можно объединить в виде единой всеобъемлющей теории. В развитии стрессовых реакций принимают участие как физиологические — нервные гуморально-гормональные, барьерные, так и психологические, социальные и иные компоненты. В ходе возникновения и развития реакции на стресс остается неясным вопрос о пусковых механизмах, активирующих и стимулирующих систему гипоталамус — гипофиз — кора надпочечников, которой с первых работ Г. Селье придается особо важное значение во всех исследованиях, посвященных адаптационному синдрому. Общепризнано, что в развитии реакции организма на сильные и сверхсильные раздражения наибольшее значение имеют две системы — симпато-адреналовая и гипоталамо-гипофизарно-надпочечниковая. Как известно, возбуждение их сопровождается накоплением во внутренней среде организма катехоламинов (в первую очередь адреналина и норадреналина), кортикостероидов, тироксина. Однако работами последних лет показано, что в стрессовую реакцию вовлекаются различные гуморально-гормональные механизмы (щитовидная железа, гормоны гипоталамуса, как, например, вазопрессин, окситоцин, гормон роста и т. д.).
О том, что при стрессовых ситуациях в действие приходят сложнейшие центральные и периферические нервные механизмы, в настоящее время не сомневается никто. Особо важную роль в развитии стресс-реакции играет гипоталамус. Гипоталамус через гипофиз направляет, стимулирует и угнетает ряд гуморально-гормональных реакций, характерных для состояния стресса. Нейрогормоны передней доли гипоталамуса (вазопрессин и окситоцин) поступают по гипофизарно-портальному пути в заднюю долю гипофиза, а нейрогормоны задней доли гипоталамуса (статины) регулируют, вернее подавляют, деятельность его передней доли. Это доказано многочисленными исследованиями как отечественных, так и зарубежных ученых. Любой стресс — физический, эмоциональный, вызванный болезнью, потрясением, болью, травмой, вызывает цепную реакцию, начиная с коры головного мозга, кончая субклеточными, молекулярными образованиями. Дыхание стресса проносится по всему организму, и внутренняя среда перестраивает (адаптирует) свой состав, физико-химические и биологические свойства, обеспечивая организму условия наибольшего благоприятствования в борьбе с опасностью.
Невольно приходит в голову, что стрессом следует назвать лишь первичную, нервную реакцию. Все остальные являются уже второй защитной стадией, адаптационным синдромом по Г. Селье. Следует согласиться с П. Д. Горизонтовым, согласно которому под стрессом мы понимаем общую адаптивную реакцию, которая возникает в неблагоприятных жизненных условиях, угрожающих нарушению гомеостаза.
Еще в начале нашего столетия У. Кеннон в своей прозвучавшей на весь мир книге, известной у нас под названием «Физиология эмоций», показал, что при боли, голоде, страхе и ярости, т. е. состояниях, отнесенных впоследствии к стрессовым, содержание адреналина в крови резко повышается. Г. Селье в своих первых работах писал в основном о гипофизарно-надпочечниковой системе, считая ее центральной осью, вокруг которой вращаются остальные механизмы стресс-реакции.
Однако это только схема и, по нашим данным, далеко неполная. Вегетативно-гуморально-гормональные взаимоотношения при стрессе значительно сложнее. В них принимают участие многочисленные биологически активные вещества эрго- и трофотропного ряда, ферментные и связывающие системы, вступающие в действие на разных этапах стресс-реакции. Важную роль, как показали результаты наших исследований, играет гематоэнцефалический барьер и, возможно, другие гистогематические барьеры.
В течение многих лет сотрудники нашей лаборатории изучали различные виды стресса, нарушающие в той или иной форме относительное постоянство внутренней среды и способные вывести организм из состояния гомеостаза. На животных (крысах и морских свинках) исследовалось влияние черепно-мозговой травмы, болевого синдрома центрального и периферического происхождения, длительного обездвиживания, вибрации, холода, физических нагрузок (бег в колесе, плавание). На людях — влияние черепномозговой травмы, гипокинезии укачивания, различных видов нервно-эмоциональной деятельности, гипоксии, лишения сна, спортивной деятельности (тренировок, соревнований). Под наблюдением находились лица различных профессий: летчики, спортсмены, работники железнодорожного транспорта (операторы, диспетчеры, дежурные, машинисты), врачи, инженеры, сотрудники научно-исследовательских лабораторий. Для оценки эрготропных функций организма в крови, моче, органах и тканях определялись адреналин, норадреналин, дофамин, ДОФА, некоторые продукты превращения катехоламинов. Высчитывалось соотношение НА/А как показатель состояния медиаторного и гормонального звеньев симпатоадреналовой системы.
Среди веществ, вызывающих трофотропные реакции в организме, мы исследовали ацетилхолин, гистамин, серотонин, частично инсулин, а также регулирующие их содержание и активность ферментные и связывающие системы. Одновременно изучалось состояние гипоталамо-гипофизарно-надпочечниковой системы, значение которой в развитии стресс-реакций столь исчерпывающе описано Г. Селье и вслед за ним огромным числом советских и зарубежных исследователей. Работы, выполненные нами совместно с рядом сотрудников лаборатории (И. Л. Вайсфельд, Г. Л. Шрейберг, С. Д. Галимов, Н. Н. Шаров и др.), показывают, что при всех формах стресса первично активируется симпатоадреналовая система как в гормональном, так и медиаторном звеньях.
Опыты на животных. Для 1-й фазы стресса (быстро наступающей активации) характерно освобождение норадреналина нервными элементами мозга. Каждое экстремальное воздействие на организм, возбуждая кору и лимбико-ретикулярную систему головного мозга, вызывает освобождение норадреналина из связанной клетками гипоталамуса формы.
Американский ученый Л. Корф показал, что норадреналин освобождается при стрессе из связанной формы не только в гипоталамусе, но и в коре головного мозга, причем это происходит под влиянием содержащих норадреналин клеток особого нервного образования — синего пятна, расположенного недалеко от 4-го желудочка и связанного с высшими отделами центральной нервной системы норадренергическими волокнами. Кратковременное плавание крыс вызывает сначала увеличение, а затем снижение содержания норадреналина в головном мозге. При длительном беге крыс в колесе уровень норадреналина в мозге уменьшается, причем утомление вызывает менее выраженные сдвиги, чем «вхождение в бег». Однако различные виды стрессовых реакций по-разному изменяют содержание норадреналина в гипоталамусе и других отделах мозга. Так, например, болевой синдром, вызванный электрическим раздражением седалищного нерва, характеризуется наиболее выраженным уменьшением уровня норадреналина в гипоталамусе, в то время как в других отделах мозга изменения отсутствуют. При некоторых других видах болевого синдрома количество норадреналина в гипоталамусе не меняется, а в полушариях мозга снижается.
Действуя на чувствительные к катехоламинам элементы ретикулярной формации, норадреналин приводит в состояние повышенной активности норадренергические элементы головного мозга и тем самым усиливает деятельность всей симпатоадреналовой системы. Происходит повышение синтеза адреналина в мозговом слое надпочечников и увеличение его выхода в кровь. В зависимости от активности симпатического отдела вегетативной нервной системы нарастает также содержание норадреналина в крови. Интересно отметить, что уровень адреналина и норадреналина в крови увеличивается особенно отчетливо у тренированных животных, адаптированных к повторным стрессам (бег в колесе, плаванье, гипоксия). В этом периоде, несмотря на повышенный выброс адреналина из надпочечников в кровь, содержание его в самих железах не уменьшается. Они исправно синтезируют гормон и бесперебойно выводят его в кровь. Содержание адреналина в ткани сердца увеличивается вследствие усиленного захвата его из крови. Одновременно в сердце происходит освобождение норадреналина из нервных окончаний симпатической нервной системы, хотя общее содержание его в сердце может как увеличиваться, так и уменьшаться, что зависит от соотношения процессов образования и потребления.
Для 2-й фазы длительной и устойчивой активации характерно продолжающееся поступление адреналина в кровь, сопровождающееся постепенным уменьшением содержания его в мозговом слое надпочечников. Надпочечники понемногу, постепенно, исподволь, переходят в стадию истощения. Эта залог будущей перестройки всей экономики организма, предвестник нарастания трофотропных влияний, перехода в стадию общего истощения и болезни. Пока же увеличивается поступление норадреналина из окончаний симпатических нервов сердца и активируется его синтез из предшественников.
Накопляясь в крови, адреналин через гематоэнцефалический барьер поступает в область адренергических элементов заднего гипоталамуса. Установлено, что в этом отделе центральной нервной системы барьер проницаем для катехоламинов. Поступление их ведет к активации системы гипоталамус — гипофиз — кора надпочечников через ретикулярную формацию и стимулирует образование специальными нейросекреторными клетками кортиколиберина, который, поступая в переднюю долю гипофиза, стимулирует образование адренокортикотропного гормона (АКТГ), что, в свою очередь, активирует синтез и выброс кортикостероидов из коры надпочечников в кровь.
Накопление этих гормонов во внутренней среде представляет, по мнению Г. Селье, решающий фактор в развитии состояния стресса. От их химического строения зависит характер заболевания, возникновение ряда «неспецифических», т. е. общих для любой болезни, но не характерных для отдельной формы патологии, явлений. Нарушение секреции кортикостероидов приводит к возникновению «болезней адаптации», суть которых заключается в потере организмом наиболее важной для его жизнедеятельности способности приспособляться (адаптироваться) к условиям существования.
По нашим данным, существует определенная коррелятивная зависимость между содержанием в крови адреналина и образованием кортикостероидов. Однако зависимости между уровнем норадреналина и выбросом кортикостероидов мы не обнаружили. Это наблюдение имеет важное принципиальное значение. Видимо, при высокой активности нервного отдела симпатоадреналовой системы (норадреналиновый характер стресс-реакции) потребность организма в кортикостероидах ниже, чем при высокой реактивности гормонального отдела симпатоадреналовой системы (адреналиновый характер стресс-реакции).
Работы Г. Л. Шрейберга показали, что между чувствительными к катехоламинам элементами головного мозга и нейросекреторными клетками, образующими кортиколиберин, находится промежуточное звено в виде серотонин- и ацетилхолинергических элементов. Кортиколиберин, поступая в гипофиз, вызывает образование адренокортикотропного гормона, что приводит к повышению активности коры надпочечников и поступлению кортикостероидов в кровь. Как уже указывалось, значение этого процесса в осуществлении стресс-реакции хорошо известно.
Итак, при стрессе адреналин довольно сложным путем через многие промежуточные звенья участвует в процессе образования и поступления во внутреннюю среду гормонов коры надпочечников — кортикостероидов. Казалось бы, мозговой и корковый слои надпочечников, анатомически связанные друг с другом, «общаются» через длинную цепь нервных и гуморальных звеньев регуляции. Но несколько неожиданно выявилась и обратная связь событий. В нашей лаборатории установлено, что у подопытных крыс, плавающих несколько часов подряд, в последней стадии стресса (истощения) почти полностью прекращается образование адреналина. Если же подопытному животному, находящемуся на грани гибели, ввести под кожу гидрокортизон, его надпочечники вновь начинают вырабатывать адреналин. Более того, образование адреналина восстанавливается под влиянием гидрокортизона и в изолированных, растертых надпочечниках «стресс-крысы». Вот пример удивительного единения, необычной гуморальногормональной регуляции физиологических и биохимических процессов в организме в состоянии напряжения. Проникая через гематоэнцефалический барьер в центральную нервную систему, кортикостероиды в одних случаях повышают, в других снижают образование кортиколиберина, который регулирует содержание кортикостероидов к крови. Чем больше кортикостероидов проникло в мозг, тем ниже поступление либерина в гипофиз и, следовательно, тем слабее образование адренокортикотропного гормона и меньше кортикостероидов в крови и моче.
Для 3-й фазы — ослабления и прогрессирующего истощения функций характерно снижение активности симпатоадреналовой системы в гормональном и медиаторном звеньях. Содержание адреналина в надпочечниках быстро падает, уменьшается поступление гормона в кровь, в сердце снижается содержание норадреналина. Во всех тканях уменьшается уровень предшественников катехоламинов (дофамина и ДОФА), при этом значительно увеличивается экскреция метаболитов катехоламинов и нарастает их содержание в органах (в сердце, печени). Это говорит об активации их обмена. Однако у тренированных животных все эти явления выражены значительно слабее. Содержание норадреналина в гипоталамусе снижается, а уровень адреналина непрерывно нарастает во всех отделах мозга, что можно связать с прогрессирующим повышением проницаемости гематоэнцефалического барьера и поступлением адреналина из крови в мозг. Эта фаза стресса заканчивается различными формами нарушения функций организма коллапсом или шоком, при котором, как это показали работы школы Л. С. Штерн, выполненные еще в 40-х годах, имеет место прогрессирующее истощение симпатоадреналовой системы, особенно ее центральных образований.
Качественные и количественные сдвиги в обмене катехоламинов, не только отражающие, но и определяющие состояние симпатоадреналовой системы, не всегда однозначны при различных видах стресса. Они зависят от многих обстоятельств; характера, интенсивности и длительности воздействия, исходного состояния и реактивности центральных и периферических отделов вегетативной нервной системы, времени дня и ночи, наличия или отсутствия резервов (предшественников) катехоламинов, компенсаторных (гомеостатических) механизмов, регулирующих постоянство внутренней среды и устойчивость физиологических функций.
Каждый из указанных факторов в той или иной степени может оказать влияние на течение, последовательность, силу и характер как самой реакции при стресс-воздействиях, так и на состояние внутренней среды. Конечно, опыты на животных далеко не равнозначны исследованиям на людях. Поэтому исследователи как в нашей стране, так и за рубежом вложили немало сил в изучение механизмов стресс-реакции у человека. Особенно интересны в этом плане работы, связанные с эмоциональным стрессом[28].
Одной из особенностей связанного с профессиональными факторами труда работников железнодорожного транспорта является одновременное наблюдение за различными производственными процессами. Требуется быстрое переключение внимания, выдача комапд подчиненному персоналу, причем это происходит при остром дефиците времени. Минимальное отклонение от графика работы, непредвиденные помехи, ошибки, технические неполадки в процессе труда создают аварийные ситуации. Совершенно естественно, что испытуемые находятся в состоянии постоянного нервно-эмоционального стресса.
В нашей лаборатории В. Н. Васильев и др. обследовали телетайпистов, конторских диспетчеров, операторов и дежурных механизированных горок, машинистов и диспетчеров — поездных, маневровых и станционных. Все они работали в производственных условиях с 8 до 20 ч (дневная работа), после чего следовал ночной отдых с 20 до 8 ч. На следующие сутки испытуемые с 8 до 20 ч отдыхали. Затем с 20 до 8 ч они работали (ночная смена). После этого получали двое суток отдыха. Периоды дневного и ночного отдыха на вторые сутки являлись контролем по отношению к ночной и дневной работе.
Одновременно была обследована группа испытуемых, не занятых на сменной работе, — врачей, инженеров, лаборантов, в период дневного и ночного бодрствования и ночной работы (решение арифметических задач, психологические тесты, переводы с иностранных языков при дефиците времени).
Исследования на всех группах испытуемых подтвердили сделанные ранее наблюдения о суточном ритме экскреции катехоламинов как у лиц, не привыкших к ночному труду, так и приученных к нему.
У операторов и дежурных во время дневной работы отмечалось снижение резервных возможностей симпатоадреналовой системы, о чем свидетельствовало увеличение отношения суммы катехоламинов (А+НА+ДА) к ДОФА. У диспетчеров, чей труд отличается наибольшей напряженностью, при дневной работе имело место увеличение экскреции норадреналина и повышение соотношения НА/А, что указывает на преобладание активности медиаторного звена симпатоадреналовой системы над гормональным. При этом у них наблюдалось значительное уменьшение резервных возможностей симпатоадреналовой системы.
Но вот какое существенное наблюдение было сделано. Хотя у операторов и дежурных во время дневной работы специфические изменения выделения катехоламинов с мочой отсутствовали, в ночь отдыха после дневной работы экскреция их значительно нарастала (адреналина на 144%, норадреналина на 700% и ДОФА на 170%). Испытуемые отдыхали, а заведенная во время работы машина продолжала свой безостановочный бег.
При ночной работе у лиц, к ней непривычных (врачи, инженеры, лаборанты), отмечалось 10-кратное увеличение экскреции адреналина, что говорит об активации гормонального звена симпатоадреналовой системы (эмоциональный стресс). У испытуемых, занимающихся в течение многих лет ночной работой, адаптировавшихся к ней, такого резкого нарастания экскреции адреналина не наблюдалось. У них повышалась экскреция норадреналина примерно в 5—6 раз. Соотношение НА/А увеличивалось в 4 раза. Это указывает, что у лиц, привыкших к ночной работе, преобладает активность медиаторного звена симпатоадреналовой системы. Здесь уместно вспомнить о роли и значении норадреналина в регуляции функций организма (стр. 63).
У диспетчеров, работа которых отличается необычайной напряженностью и которые находятся в состоянии постоянного нервно-эмоционального стресса, экскреция адреналина во время ночной смены повышалась в 4,6 раза, а норадреналина в 9,7 раза. Несмотря на то что выделение ДОФА несколько увеличивалось, резервные возможности симпатоадреналовой системы были снижены, что проявлялось в более высоком, чем в норме, соотношении суммы катехоламинов к ДОФА.
При этом в ночной период работы у диспетчеров нарастали все катехоламины, а у операторов и дежурных — преимущественно норадренадин.
Интересно отметить, что обычно ночное снижение экскреции катехоламинов обнаруживается во внерабочее время (состояние относительного покоя) не только у лиц, не приспособленных к ночному труду, но и у железнодорожников со стажем сменной работы 10 и более лет (операторы, дежурные, диспетчеры).
У контрольных испытуемых (врачи, инженеры, лаборанты), бодрствовавших в ночное время (с 20 до 8 ч) без каких-либо нагрузок, экскреция катехоламинов и ДОФА снижалась в такой же степени, как и в тех случаях, когда они спали.
Это позволяет предположить, что в ночное время снижение экскреции катехоламинов зависит от каких-либо сложных регуляторных механизмов, отнюдь не связанных со сном.
В то же время днем во время отдыха у операторов, дежурных, машинистов и диспетчеров экскреция норадреналина была ниже, чем у испытуемых контрольной группы, в которую входили лица, работающие только днем. Видимо, это признак адаптации организма к стрессовым условиям работы. В состоянии относительного покоя адаптированный организм обходится меньшими количествами гормона, что подтверждается исследованиями на группе курсантов школ машинистов с небольшим стажем работы. Экскреция катехоламинов была у них более высокой и достигала уровня, характерного для лиц, не приспособленных к ночному труду.
Таким образом, полученные данные позволяют считать уменьшение экскреции катехоламинов (особенно норадреналина) одним из проявлений приспособления организма к сменному режиму труда. Однако следует подчеркнуть, что даже при многолетней адаптации к однотипной нервно-эмоциональной работе величина экскреции катехоламинов зависит от напряженности труда.
У операторов и дежурных в ночь отдыха после дневной работы экскреция всех катехоламинов не только не уменьшалась, по даже увеличивалась. Таким образом, изменение выделения катехоламинов с мочой у этой группы испытуемых проявлялось не столько во время самой работы, сколько в последующий период отдыха, т. е. происходило как бы «запоздалое» или «отставленное» увеличение экскреции катехоламинов. Подобное же явление наблюдалось у некоторых летчиков, проходивших испытания в барокамере. Как правило, они плохо переносили испытание, и выброс катехоламинов наблюдался у них через какой-то промежуток времени после испытания.
Материалы, полученные при исследовании экскреции катехоламинов при ночной нервно-эмоциональной работе, равной по интенсивности дневной, показывают, что у всех групп испытуемых содержание адреналина, норадреналина и дофамина выше, чем при работе днем. Это наблюдение представляет особый интерес, поскольку уже неоднократно указывалось, во время ночного отдыха экскреция катехоламинов снижается. При отсутствии привычки к сменному труду увеличение экскреции катехоламинов было более выражено, чем при адаптации к ночной работе. Люди так или иначе приспособляются к ночной работе, но организм их адаптируется к ней значительно труднее, чем к дневной. При всех обстоятельствах она является стрессом, и даже восстановление исходного уровня экскреции катехоламинов после ночной работы происходит не сразу, а только на 2-е сутки отдыха.
Серия исследований шведского ученого Л. Леви представляет в этом плане несомненный интерес. Его данные совпадают с нашими. Первичные изменения, возникающие в организме при стресс-реакции, сводятся к мобилизации центральных и периферических отделов симпатоадреналовой системы, что выражается в повышенном поступлении катехоламинов во внутреннюю среду организма.
Значение симпатоадреналовой системы в развитии стресс-реакции общепризнано. Ему посвящено огромное количество экспериментальных исследований, выполненных как в опытах на животных, так и в клинико-физиологической практике. Это универсальный закон, допускающий те или иные индивидуальные отклонения, связанные с вегетативно-гуморальным типом регуляции. У одних стресс вызывает активацию преимущественно гормонального звена (адреналин!), у других — медиаторного (норадреналин!). В некоторых случаях резервные возможности симпатоадреналовой системы высоки, в других они быстро истощаются. Один организм обходится меньшим количеством симпатомиметических метаболитов, другой требует больших. Все может иметь значение: реактивность организма, скорость кругооборота, кинетика синтезирующих и разрушающих ферментных реакций, чувствительность рецепторов, время выведения из организма. И, наконец, важнейшую роль играют «противосистемы», ослабляющие или подавляющие симпатоадреналовые механизмы.
При некоторых видах стресса наряду с эрготропными системами мы изучали также системы трофотропные. Обычно исследователи уделяют им меньше внимания. В первой стадии стресса эти системы затихают, уступая место эрготропным. Образно говоря, они как бы затаились, выжидают, накопляя резервы для последующей атаки. Организм защищается, ему нужны в первую очередь катехоламины и кортикостероиды. Это форпосты обороны, механизмы защиты и экспресс-адаптации. Но приходят вторая и иногда третья стадии стресса. Фаза тревоги сменяется периодом резистентности, а за ними нередко наступают фазы истощения и болезни. И уже в конце первой стадии во внутреннюю среду начинают поступать биологически активные вещества трофотропного ряда.
В нашей лаборатории значению их в развитии стресса уделяется самое пристальное внимание. У крыс мы изучали систему ацетилхолина в покое и при плавании. Плавание в этой серии экспериментов являлось стрессором. Конечно, эти опыты можно рассматривать лишь как модельные для человека, но определенная закономерность все же была выявлена.
Содержание свободного ацетилхолина в крови крыс несколько выше, чем у человека (примерно 1,0 мкг%). Но резервная форма, рыхло связанная с эритроцитами, у крыс отсутствует. Феномен связывания добавленного извне ацетилхолина отсутствует также. При сравнительно небольшом напряжении (2-часовое плавание) уровень свободного ацетилхолина начинает снижаться на фоне усиления инактивирующих механизмов. В крови обнаруживается связанная эритроцитами форма медиаторов и повышается активность расщепляющего фермента ацетилхолинэстеразы. Если учесть, что при этом нарастает содержание катехоламинов, то налицо первая классическая фаза стресс-реакции: активация адренергических элементов наряду с ослаблением холинергических. После более длительного стресс-воздействия (7 ч плавания) биологическая активность крови меняется в другом плане. Постепенно начинает повышаться холинергическая активность крови (компенсирующая реакция). Это выражается в значительном уменьшении активности ацетилхолинэстеразы. И хотя уровень свободного ацетилхолина обычно снижен, холинергические свойства крови нарастают. Содержание гистамина повышается только в икроножных мышцах, а серотонина — в крови и мышцах. Таким образом, во второй фазе стресса происходит усиление трофотропных систем.
Через двое суток после плавания все показатели приходят в норму. Но самое интересное в этих опытах заключается в том, что у тренированных животных после многократных повторных сеансов плавания описанные изменения отсутствуют. Значение холинергической системы в развитии фазовых реакций при стрессе подтверждено многими исследователями (А. В. Кибяков, П. Н. Денисенко, В. Кулагин, Ф. И. Фурдуй и др.), хотя, за немногими исключениями, оценка ей дается по активности ацетилхолинэстеразы.
В другом плане протекали исследования на людях. Группа испытуемых, проходивших врачебно-летную экспертизу, «поднималась» в барокамере на высоту в 5000 м (разрежение 405 мм рт. ст., экспозиция 30 мин). Оказалось, что гипоксия вызывает статистически достоверное повышение экскреции гистамина и 5-оксииндолуксусной кислоты. Постепенно выделение обоих аминов снижается. Однако суточный ритм экскреции нарушается и кривая ее с двумя пиками в физиологических условиях превращается в кривую с одним пиком (рис. 15).
При 2-дневном обездвиживании (гипокинезии) в крови увеличивается содержание гистамина и снижается активность диаминоксидазы. Одновременно уменьшается содержание серотонина. 10-дневная гипокинезия характеризуется нарастающим увеличением уровня гистамина в крови и снижением активности диаминоксидазы. Уровень серотонина падает, преимущественно в ночные часы. Это ведет к нарушению суточного ритма обмена обоих аминов. Таким образом, гипокинезия, которую можно в известной степени рассматривать как стресс «от отсутствия раздражения», протекает на фоне значительного нарушения обмена гистамина и серотонина. Эти изменения особенно четко выявляются в ночные часы и выражаются как в снижении активности расщепляющих ферментов, что, как указывалось выше, характеризует состояние гистаминемии, так и в значительном повышении соотношения гистамин/серотонин.
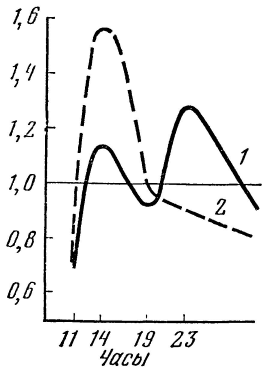
Рис. 15. Изменения суточного ритма экскреции гистамина и 5-оксииндолуксусной кислоты после гипоксии.
1 — до гипоксии, 2 — после гипоксии. Остальные обозначения те же, что на рис. 7.
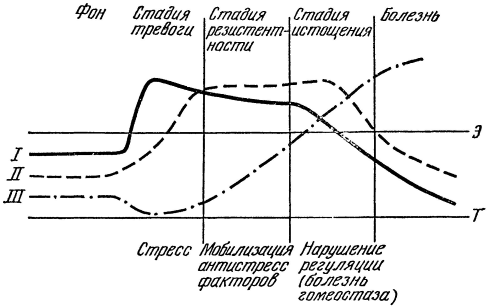
Рис. 16. Схема стрессового состояния при напряженных спортивных соревнованиях.
Объяснения в тексте. Параллельные линии условно разграничивают эрго- (Э) и трофотропные (Т) границы гомеостаза. I — катехоламины; II — кортикостероиды; III — трофотропные метаболиты (ацетилхолин, гистамин, серотонин).
Таким образом, в конце первой фазы стресс-реакции и во время второй соотношение эрго- и трофотропных метаболитов в крови и органах как бы сбалансировано и относительное постоянство внутренней среды не нарушено. Наряду с гуморальными механизмами адаптации (катехоламинами и кортикостероидами) в действие вступают противорегулирующие факторы (в первую очередь система ацетилхолина и гистамина), которые с известной условностью можно назвать антистрессовыми. Усиление трофотропных механизмов, особенно выраженная гистаминемия как в периоде острого стресса, так и в течение длительного времени после него (например, у летчиков, спортсменов-пловцов, испытателей, велосипедистов и др.) является, вероятно, «мерой физиологической защиты», направленной на сохранение гомеостаза (рис. 16). Возможно, что способность организма более легко переносить повторные стресс-раздражения обусловлена мобилизацией антистрессовых механизмов.
В 3-й стадии активность факторов, названных нами антистрессовыми, резко усиливается. Наряду с истощением симпатоадреналовой системы и связанным с ним снижением активности системы гипоталамо-гипофизарно-надпочечниковой происходит усиление трофотропных механизмов. Это ведет к нарушению гомеостаза (вернее, к состояниям, названным нами «болезнями гомеостаза») и лежит в основе ряда нарушений, приводящих к болезни, коллапсу и особенно к шоку.
В этих исследованиях выявилась одна особенность, которую вряд ли мог предвидеть самый проницательный исследователь. В течение длительного периода времени (до нескольких месяцев) после серии сильных и сверхсильных возмущающих воздействий на организм (например, у летчиков, у некоторых спортсменов высокого класса, испытателей и т. п.) сохраняются нарушения обмена гистамина и серотонина. В нашей практике был случай, когда пришлось отказаться от экспериментального обследования нескольких испытуемых-добровольцев через 4 месяца после того, как на них были проведены соответствующие (весьма серьезные) исследования в специальном научно-исследовательском институте.
Одним из бесспорных видов стресса является укачивание. Дурное самочувствие, слабость вплоть до полной потери сил, холодный пот, тошнота, рвота при укачивании известны каждому. Картина морской (а в настоящее время и самолетной) болезни подробно описана и в научной, и в художественной литературе. Вспомним хотя бы «Морскую болезнь» А. И. Куприна. Но ведь моряки (хотя и не все) не укачиваются, капитаны ведут свои корабли сквозь бури и штормы, не испытывая дурноты, не теряя присутствия духа. Чем они отличаются от людей, которых начинает мутить при виде раскачивающегося корабля или накренившегося самолета? Роли гуморально-гормональных факторов в предрасположенности человека к укачиванию посвящена серия исследований, выполненных нами совместно с Б. И. Поляковым. Как известно, скорость, характер, интенсивность укачивания у разных людей различны. Однако причины этих различий мало известны, и почти совсем не изучены при укачивании гуморально-гормональные механизмы регуляции функций. Что происходит во внутренней среде легко укачивающегося, трудно укачивающегося и вовсе не укачивающегося организма? Принято считать, что основное значение имеет устойчивость вестибулярного аппарата. Однако в литературе отсутствуют сколько-нибудь достоверные данные о существовании взаимозависимости между его состоянием и тонусом вегетативно-гуморально-гормонального комплекса, определяемого по соотношению эрго- и трофотропных биологически активных веществ в жидких средах и выделениях организма.
19 здоровых мужчин в возрасте 21—40 лет подвергались пробе с двойным вращением, так называемой пробе КУК по И. И. Брянову. Воздействие продолжали до появления выраженных вестибуловегетативных расстройств, но не более 15 мин. Уровень вестибуловегетативной устойчивости оценивали по времени появления выраженных вегетативных расстройств, характеризующих состояние морской болезни.
В зависимости от уровня вестибуловегетативной устойчивости испытуемые были разделены на две группы: легко подверженные укачиванию — 9 человек, выдерживавшие пробу КУК не более 1—3 мин (условно «слабые») и не подверженные — 10 человек, переносившие пробу в течение 15 мин без каких-либо проявлений укачивания (условно «сильные»).
Оказалось, что в исходном состоянии у «сильных» количество катехоламинов в крови существенно выше, чем у «слабых». В то же время содержание трофотропных веществ (ацетилхолина, гистамина и серотонина) у «сильных» несколько снижено по сравнению с физиологической нормой.
Таким образом, для «сильных», в отличие от лиц, склонных к укачиванию («слабых»), характерно преобладание эрготропных систем и выраженная способность крови инактивировать (расщеплять и связывать) свободный ацетилхолин.
В этой работе был проведен корреляционный анализ изученных показателей эрго- и трофотропной активности. Оказалось, что структура корреляционных связей гуморально-гормональных показателей у людей, предрасположенных к укачиванию, иная, чем у резистентных к нему.
В группе «сильных» симпатоадреналовая система обладает большим количеством связей с остальными показателями, чем в группе «слабых», причем корреляции ее с холинергической системой отрицательны (чем выше активность симпатоадреналовой системы, тем ниже активность холинергической). У «слабых» же эти связи положительные (чем выше активность симпатоадреналовой системы, тем выше — холинергической). Таким образом, у «сильных» адрен- и холинергическая системы как бы находятся в состоянии антагонизма, в то время как у «слабых» они действуют синергически. Усиление одной системы, противодействующей укачиванию, вызывает активацию другой, содействующей ему. В итоге коэффициент полезного действия равен нулю.
В группе «слабых» системы гистамина и ацетилхолина функционируют синергично, усиливая трофотропные эффекты, что отсутствует в группе «сильных».
В группе «слабых» в отличие от группы «сильных» системы гистамина и серотонина имеют множественные и разнообразные связи с остальными показателями. Это, по-видимому, свидетельствует об их более высокой активности в группе «слабых».
Тщательный математический анализ показывает, что подверженность (или, напротив, устойчивость) человека к укачиванию в значительной степени зависит от индивидуальных особенностей гуморально-гормональной регуляции функций, т. е. от состава и свойств внутренней среды. Для людей, склонных к укачиванию, характерно преобладание трофотропных механизмов: 1) относительно более низкая активность симпатоадреналовой системы; 2) синергичные отношения между адрен- и холинергическими системами; 3) более высокая активность холинергической системы; 4) относительно высокая активность систем гистамина и серотонина.
Напротив, для людей, не подверженных укачиванию, характерно преобладание эрготропных механизмов: 1) относительно более высокая активность симпатоадреналовой системы, 2) антагонистические отношения между адрен- и холинергическими системами, 3) более низкая активность холинергической системы, 4) относительно низкая активность систем гистамина и серотонина.
Резюмируя полученные данные, мы в соответствии с нашими представлениями о вегетативно-гуморальном типе регуляции можем высказать предположение, что «сильные», т. е. не укачивающиеся люди, относятся к симпатоадреналовому типу, а «слабые», т. е. укачивающиеся, — к вагоинсулярному.
И наши собственные экспериментальные материалы, и исследования, выполненные в других лабораториях, показывают, что проницаемость гематоэнцефалического барьера для многих биологически активных веществ, в частности для катехоламинов, при некоторых стресс-воздействиях на организм повышается и они начинают проникать в те отделы мозга, вход в которые для них обычно закрыт. Так, например, при черепно-мозговой травме (у людей и животных) содержание адреналина, норадреналина и гистамина в мозге и цереброспинальной жидкости резко повышено. В силу функциональной недостаточности гематоэнцефалического барьера (уменьшение или увеличение его проницаемости по отношению к определенным составным элементам крови) происходит уменьшение или извращение гуморальной информации, поступающей в мозг, и, следовательно, нарушение физиологических взаимоотношений между нервными и нейросекреторными образованиями гипоталамо-гипофизарной системы. Нервные центры перестают получать адекватные сведения о процессах, протекающих в организме, и совершенно естественно — вся система регуляции функций начинает давать опасные для организма перебои. Наступает блокада регуляторных механизмов со всеми вытекающими последствиями. Повышение проницаемости (например, при черепно-мозговой травме) приводит к поступлению из крови веществ в зоны обычно для них закрытые. Возникают своеобразные противоположные антагонистические эффекты — парасимпатические при накоплении катехоламинов в различных отделах мозга или в цереброспинальной жидкости или симпатические при высокой проницаемости барьера для ацетилхолина и гистамина.
Установлено, что значительное повышение тонуса парасимпатической нервной системы при некоторых формах закрытой черепно-мозговой травмы возникает именно в тех случаях, когда в цереброспинальной жидкости нарастало содержание катехоламинов. При черепно-мозговой травме резко повышается содержание кортикостероидов в крови и постепенно в цереброспинальной жидкости. Это и понятно. Стресс ведет к усиленному выбросу кортикостероидов из коры надпочечников во внутреннюю среду. Повышенная проницаемость гематоэнцефалического барьера увеличивает их поступление в мозг и расширяет объем информации, получаемой гипоталамусом. Возникает реакция, цель которой отрегулировать, уменьшить на определенном этапе, снизить образование кортикостероидов.
Но проходит какое-то время и содержание кортикостероидов в цереброспинальной жидкости начинает падать, несмотря на то что в крови оно не только не уменьшается, но продолжает нарастать. В чем же дело? В чем причина столь парадоксальных взаимоотношений между общей внутренней средой и внутренней средой головного мозга? Оказывается, что прекращается торможение образования кортиколиберина, поскольку в крови нарастает содержание особого белка — транскортина, связывающего кортикостероиды. Образующаяся при этом крупная молекула транскортин-кортикостероиды задерживается барьером и не проникает в гипоталамус. Поступление информации об уровне кортикальных гормонов в крови прекращается. Это приводит к непрерывному нарастанию уровня кортикостероидов во внутренней среде. Активность системы гипоталамус—гипофиз—кора надпочечников нормализуется лишь после снижения содержания в крови транскортина и восстановления процесса поступления кортикостероидов в центральную нервную систему.
Таким образом, одной из причин длительной активации функции коры надпочечников при стрессовых состояниях является нарушение саморегулирующих механизмов, в систему которых входит также гематоэнцефалический барьер, обеспечивающих в физиологических условиях торможение системы гипоталамус—гипофиз—кора надпочечников по принципу обратной связи.
Г. Л. Шрейберг и его сотрудники выявили в среднем гипоталамусе наличие серотонинреактивных структур, активирующих нейросекреторные клетки, в которых образуется кортиколиберин. Именно в серотонинреактивных элементах происходит замыкание механизма отрицательной обратной связи при накоплении кортикостероидов в организме. Активирующие влияния, передающиеся через адренергическое звено с ретикулярной формации и заднего гипоталамуса, переключаются на серотонинергическое звено, что приводит к усилению деятельности системы гипоталамус—гипофиз—кора надпочечников. Это может служить доказательством, что регуляция функций этой системы осуществляется по цепи нейронов, имеющих различную медиаторную природу (адрен-, холин-, серотонинергическую). Надо полагать, что каждый медиатор по-разному действует на нейросекреторные клетки гипоталамуса и, вступая в действие при разных видах стресса, оказывает специфическое влияние на образование и выделение либерина. Различие гуморальных эффектов при стрессе можно объяснить дифференцированным поступлением различных медиаторов в разные отделы центральной нервной системы и действием их на те или другие звенья нейрогуморально-гормонально-барьерной цепи, участвующей в реализации стресс-реакции.
Мобилизация различных регуляторных механизмов вносит известную специфичность в развитие общего адаптационного синдрома. При некоторых видах стресса во внутренней среде создаются одни сочетания медиаторов, гормонов, метаболитов, при некоторых — другие. Важное значение для специфики стресса имеют гормоны щитовидной и поджелудочной желез, кинины, простагландины, о которых можно написать отдельную книгу. В одном можно быть уверенным. Вступление в действие различных нейрогуморально-гормональных механизмов при разных видах стресса отнюдь не однотипно и не однозначно.
* * *
Итак, подведем итоги. С самого начала перед исследователями возник вопрос о первичных механизмах стресса, вызывающих реакцию гипофиза и поступление кортикостероидов в кровь. Уже сам Селье говорил о комплексной гипоталамо-гипофизарной системе. Гипоталамус регулирует и контролирует деятельность вегетативной и эндокринной систем. Малейшие нарушения в составе и свойствах внутренней среды организма мгновенно улавливаются его клетками. Информационная емкость его необычайно велика. Безупречно действующая обратная связь молниеносно активирует механизмы, восстанавливающие физиологический баланс.
Но и гипоталамус отнюдь не автономен и не самостоятелен в своих функциях. Его деятельность находится под постоянным и неослабным влиянием вышележащих отделов головного мозга. К ним относятся в первую очередь лимбико-ретикулярная система — сложнейшая по строению и функциям область головного мозга. А лежащий еще выше тонкий слой нервного вещества (кора), покрывающий большие полушария мозга, осуществляет постоянный контроль над всей деятельностью организма. Взаимодействие низших и высших нервных центров создает своеобразные кольцевые ритмы во всех отделах мозга. И, как по мановению палочки дирижера, в игру включаются разные инструменты, разыгрывается целая симфония, в которой рассчитаны каждый звук, каждая нота, каждое изменение, усиление или ослабление тона.
Может ли это продолжаться бесконечно? Когда и почему наступает 3-я стадия стресса — стадия истощения?
Здесь следует еще раз вспомнить об относительном постоянстве состава внутренней среды и основных физиологических функций организма (кровообращения, дыхания, пищеварения, обмена веществ). Живая система отличается необычайной устойчивостью и до последней минуты противостоит возмущающим, а в определенных случаях — угрожающим ее существованию воздействиям. Она сопротивляется всеми доступными средствами, включая одну за другой все новые и новые линии обороны.
Организм — сложная самоуправляющаяся лаборатория. Скорее даже не лаборатория, а целая фабрика. Тысячи реакций, согласованных и взаимосвязанных, поддерживают ее стабильность и оберегают от полома. Красные лампочки зажигаются на каждом шагу и многочисленные реле и рубильники автоматически включаются и выключаются. Бесконечные стрессоры, подстерегающие нас на каждом шагу, в подавляющем большинстве случаев не вызывают необратимого истощения и не приводят к гибели. Если бы этого не было, сама жизнь стала бы невозможной.
Физиологические и химические бури, возникшие под ударами стрессовых воздействий, не угрожая гибелью организму, обычно постепенно затихают. Зыбкое, постоянно колеблющееся равновесие внутренней среды возвращается к исходному, более или менее устойчивому, наиболее приемлемому и выгодному для данной ситуации уровню.
Но что же происходит в живой системе, если сила стресса перешла границы гомеостатических ее возможностей, если стрессор длится слишком долго, если страдание становится невыносимым, если стрессором является неизлечимая болезнь?
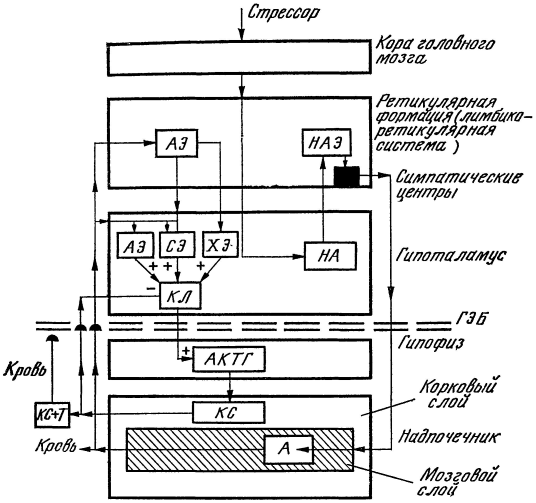
Рис. 17. Схема развития стрессовой реакции (по Кассилю).
Объяснения в тексте.
Наступает момент, когда организм не в состоянии справиться с постоянно возрастающими требованиями и тогда-то возникает последняя стадия стресса — стадия истощения. Здесь кроется начало «болезни адаптации», обусловленной неспособностью организма приспособить свою внутреннюю среду к необычным, большей частью не совместимым с жизнью, условиям существования.
Можно спорить — отражает ли термин «болезни адаптации» сложную сущность состояния организма в этом периоде. Не правильнее ли говорить о нарушении регуляции функции, о расстройстве координации и корреляции физиологических и биохимических процессов, о неадекватных стимулах, о еще менее адекватных ответах, о возникновении хаотических, нерегламентируемых реакций, об изменении состава внутренней среды, о прогрессивно развивающихся болезнях гомеостаза.
Не так-то легко и просто представить себе последовательный ход событий при стрессе. Исследования, выполненные нашей лабораторией, позволили автору этой книги предложить собственную схему развития стресс-реакции (рис. 17).
Возбуждение коры головного мозга при стрессовых воздействиях передается на гипоталамус, где происходит освобождение — переход из связанной в активную форму норадреналина (НА) нервных клеток. Активируя норадренергические элементы (НАЭ) различных отделов центральной нервной системы, в первую очередь ее лимбико-ретикулярной формации, норадреналин через высшие симпатические центры стимулирует деятельность симпатоадреналовой системы. Это ведет к повышению образования и поступлению во внутреннюю среду гормона мозгового слоя надпочечников — адреналина (А). Последний через гематоэнцефалический барьер (ГЭБ) проникает из крови в задний гипоталамус, а возможно, и в другие отделы мозга. Возникающее под влиянием адренергических элементов (АЭ) общее возбуждение мозга в силу противоположной реакции центральных и периферических образований нервной системы на действие одного и того же химического раздражителя способствует повышению активности трофотропных механизмов — серотонинергических (СЭ) и холинергических (ХЭ). Они стимулируют (+) образование нейросекреторными клетками кортиколиберинов (КЛ), которые, попадая в гипофиз, вызывают усиленное поступление в кровь адренокортикотропного гормона (АКТГ). Под его влиянием в коре надпочечников увеличивается синтез кортикостероидов (КС), содержание которых в крови нарастает. Легко проникая через гематоэнцефалический барьер в мозг, кортикостероиды по закону обратной связи тормозят (—) образование кортиколиберинов, что ведет к снижению их уровня во внутренней среде. Однако, как указывалось выше, при длительных и угрожающих жизни стрессовых ситуациях КС связываются с особым белком крови транскортином (Т) и перестают проникать в мозг. Соединение КС+Т задерживается гематоэнцефалическим барьером. В мозг перестает поступать достоверная информация об уровне кортикостероидов в крови, что приводит к нарушению обратной связи и расстройству законов регуляции функций. Непрекращающееся образование и поступление КС в кровь приводит к истощению коры и мозгового слоя надпочечников.
Таким образом, в нашем представлении о механизмах стресса важную роль играют трофотропные механизмы. Их усиление, особенно выраженная гистаминемия (абсолютная и относительная), как в стадии резистентности, так и в процессе восстановления после стрессовой реакции, подчас весьма длительной (например, у летчиков, спортсменов некоторых категорий, испытателей специальных лабораторий), является, возможно, компенсаторной реакцией, «мерой физиологической защиты», направленной на сохранение гомеостаза.
Изучение роли ацетилхолина, гистамина, серотонина, инсулина в развитии гуморально-гормональных процессов при стрессовых состояниях имеет не только теоретическое, но и несомненное практическое значение. Компенсация, протекающая поначалу в границах гомеостаза при продолжающемся стрессе, становится постепенно избыточной, опасной для организма. Возникает стадия гипер- или суперкомпенсации, в которой гомеостатические механизмы подавлены, эрготропные системы истощены, трофотропные доминируют. Развивается дисбаланс в соотношении катаболических и анаболических метаболитов, и, если не приняты соответствующие меры, организм приходит в состояние коллапса, шока с нарушением основных жизненных функций. Расстраиваются взаимоотношения между отдельными компонентами единого нейрогуморально-гормонального барьерного комплекса, стремительно изменяются состав и свойства внутренней среды, перестают действовать гомеостатические механизмы. Конечно, все это происходит при сверхсильных, экстремальных и длительных воздействиях. В большинстве случаев организм справляется с состоянием стресса. Его надежность и защитные силы достаточно велики.
Заслуга Г. Селье в том, что он открыл, изучил и обосновал значение одного из важнейших механизмов защиты организма от подстерегающих его на каждом шагу опасностей. Созданная им концепция сыграла неоценимую роль в развитии теоретической и практической медицины. Значение ее для физиологии, биохимии, патофизиологии, фармакологии неоценимо. Но в то же время она не превратилась, да и не могла превратиться во всеобъемлющую сумму знаний, единую теорию медицины, о которой мечтали и продолжают мечтать многие представители современного естествознания.






