Глава IV. Механизмы гуморально-гормональной регуляции функций
Швейцарский физиолог В. Гесс еще в 1925 г. предложил разделить физиологические функции, или, точнее, физиологические реакции организма, на две большие группы: эрготропные и трофотропные. Теория Гесса получила широкое распространение в биологической науке. Ей посвящено немалое число теоретических и экспериментальных исследований. Впоследствии ее развил, углубил и уточнил один из учеников Гесса — М. Моннье. Однако в своих работах Моннье говорит не столько о функциях, сколько об эрго- и трофотропных функциональных состояниях организма. И, возможно, это не терминологическая поправка, а более углубленное представление о процессах регуляции и координации в организме. Состояния эти смешанные, многоплановые. В них участвуют вегетативные, двигательные, чувствительные и психические элементы. В настоящее время более широкое распространение получило представление об эрго- и трофотропных системах, имеющих довольно строгую анатомическую и биохимическую локализацию. К эрготропным относят обычно адренергические (адренореактивные) механизмы, к трофотропным — холипергические (холинореактивные). Это не всегда одно и то же и нередко и эрго- и трофотропные реакции могут быть вызваны возбуждением других гуморальных систем (например, кортикостероидами, серотонином, гистамином и др.).
Схема, предложенная Моннье (рис. 4), не охватывает всей проблемы, но все же дает определенное представление о взаимоотношении эрго- и трофотропных функций в организме. Эрготропные состояния характеризуются активацией деятельности большинства внутренних органов и физиологических систем под влиянием симпатоадреналовых импульсов. При этом повышается реактивность (готовность к действию) всей соматической, «анимальной» системы (чувствительных, двигательных и психических ее компонентов). Так, например, эрготропные функции резко усиливаются при различных стрессовых состояниях, при физической деятельности (спорт, труд), при эмоциях, боли, охлаждении. Они способствуют приспособлению организма к меняющимся условиям внешней среды, повышают расход энергетических запасов, усиливают катаболические, диссимиляторные процессы в организме.
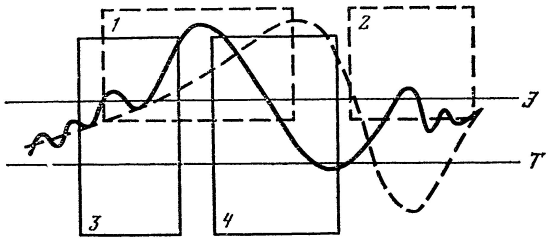
Рис. 3. Зависимость между биохимическими и физиологическими сдвигами во внутренней среде организма при развитии симпатоадреналового криза.
Параллельными линиями отражены границы гомеостаза (Э — эрготропные; Т — трофотропные); сплошная линия — биохимические (гуморальногормональные) сдвиги, прерывистая — физиологические сдвиги при развитии и затухании явлений криза; 2 — фаза снижения симпатомиметической и нарастания парасимпатомиметической активности крови; 3 — фаза постепенного нарастания физиологических проявлений симпато-адреналового криза; 4 — фаза выраженного симпатоадреналового криза с выходом за пределы гомеостаза.
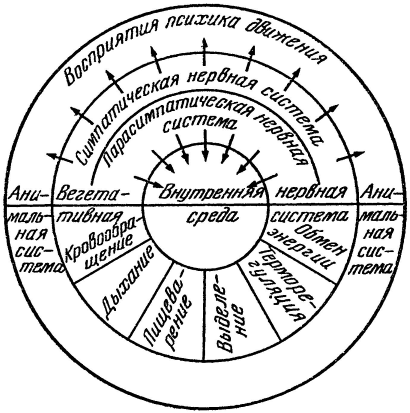
Рис. 4. Схема эрготропных (стрелки направлены от центра) и трофотропных (стрелки направлены к центру) реакции (по М. Моннье).
Вследствие избирательной активации определенных внутренних органов под влиянием симпатической нервной системы происходит повышение реактивности (готовности к действию) соматической нервной системы (эрготропные реакции). Активация определенных внутренних органов под влиянием парасимпатической нервной системы создает оптимальные условия во внутренней среде (ассимиляция, удаление использованных продуктов, трофотропные реакции).
Для трофотропных состояний характерно накопление энергетических запасов, усиление процессов анаболических, ассимиляторных. При этих состояниях активность внутренних органов направлена на поддержание гомеостаза и находится под влиянием вагоинсулярной системы.
Медиаторы. Мысль о том, что передача возбуждения с нервного окончания на клетки органов осуществляется при помощи химических веществ, возникла уже давно. Но доказано это было только в двадцатых годах нашего столетия. Вещества, образующиеся при нервном возбуждении, получили название медиаторов (трансмиттеров) или передатчиков процесса возбуждения. Место их образования (или накопления) — окончания нервных волокон, где они вовлекаются в действие, когда нервный импульс приходит в рабочий орган, например, в мышцу или железистую клетку. Медиаторы образуются также в синапсах, связывающих между собой нервные клетки центральной нервной системы и периферических нервных узлов, а также в нервных стволах.
При электронно-микроскопическом исследовании обнаруживается, что синапс состоит из двух соприкасающихся поверхностей, одна из которых принадлежит аксону, другая — дендриту или телу клетки. При увеличении в несколько десятков тысяч раз синапс представляется в виде щели шириной примерно в 200 ангстремов (ангстрем — одна стомиллионная доля сантиметра). Поверхность аксона, обращенная к синапсу, получила название пресинаптической мембраны (оболочки), а дендрита — постсинаптической.
В окончании аксона электронный микроскоп обнаруживает целое скопление крошечных пузырьков (везикулов), наполненных химическим веществом специального назначения. Вещество это — передатчик, медиатор, посредник нервного возбуждения, осуществляющий переход импульса через синапс.
Чаще всего это ацетилхолин или норадреналин, иногда серотонин, гамма-аминомасляная кислота, гистамин и т. д. (с. 75).
Наряду с другими биологически активными веществами медиаторы, поступая в кровь, принимают участие в регуляции и координации физиологических процессов. Из этого следует, что необходимо различать их роль в медиации и регуляции. Без преувеличения можно сказать, что открытие химической медиации явилось одним из наиболее блестящих, как принято называть, «делающих эпоху» открытий биологии двадцатого века.
Различные нейроны — в зависимости от их расположения, физико-химических свойств, обмена веществ, физиологических функций — возбуждаются или, наоборот, прекращают свою деятельность (затормаживаются) под влиянием тех или других медиаторов.
Отсюда и возникло представление, что существуют возбуждающие и тормозящие медиаторы. Этому вопросу посвящено немалое количество экспериментальных работ и теоретических споров. Одни авторы признают существование тормозящих медиаторов, другие его опровергают.
Нервный импульс представляет сложнейший физикохимический процесс, связанный с перемещением некоторых минеральных веществ, в частности ионов калия и натрия. В состоянии покоя ионы калия находятся преимущественно внутри нервной клетки, ионы натрия — на ее наружной поверхности. В протоплазме нервных клеток ионов калия примерно в 30—40 раз больше, чем в окружающей клетку тканевой жидкости, ионов же натрия в 8—10 раз меньше. В соответствии с этим внутри клетки преобладают отрицательные электрические заряды, вне ее — положительные. В тот момент, когда нервный импульс приходит в окончание аксона (так называемую синаптическую бляшку), пузырьки, содержащие медиатор, лопаются. Химический передатчик изливается в синаптическую щель и изменяет проницаемость постсинаптической мембраны. Это ведет к тому, что ионы калия устремляются из клетки и располагаются на ее поверхности, обращенной к щели, а ионы натрия входят в клетку. Электрический заряд мембраны мгновенно изменяется, возникает разница потенциалов, и импульс переходит с аксона одной клетки на дендрит другой. Как только импульс прошел синапс, медиатор разрушается, ионы калия снова поступают в клетку, а ионы натрия выходят из нее.
Биологически-активные вещества эрготропного ряда
Катехоламины. К веществам, вызывающим и регулирующим эрготропные (адренергические) реакции в организме, в первую очередь относятся катехоламины, составляющие систему гормонов и медиаторов симпатоадреналовой системы. Они создают возможность быстрого, адекватного и устойчивого перехода организма из состояния покоя в состояние длительного возбуждения, регулируя и направляя течение физиологических процессов.
Основной ведущий представитель катехоламинов, наиболее известный и подробно изученный, — адреналин. Он образуется в мозговом слое надпочечников и содержание его во внутренней среде организма характеризует состояние этой важнейшей эндокринной железы нашего организма. Его непосредственный предшественник, отличающийся отсутствием одной метильной группы (СН3), норадреналин, обладает одновременно функциями гормона мозгового слоя надпочечников и медиатора центральных и периферических отделов симпатической нервной системы.
Длившийся несколько десятилетий спор о химической природе симпатического медиатора можно считать законченным. Еще не так давно говорили и писали о каких-то особых химических веществах, симпатинах, отличающихся от адреналина. В 1933 г. бельгийский ученый Бакк высказал предположение, что симпатины в одних случаях являются адреналином, в других его предшественником — норадреналином. Советский биохимик А. М. Утевский предположил, что симпатины — сложная система адреналина, норадреналина и промежуточных продуктов их обмена. Но в настоящее время установлено, что симпатическая медиация осуществляется с помощью норадреналина. Его предшественник — дофамин, один из медиаторов симпатических образований в центральной нервной системе, отсутствие или недостаточное образование которого в некоторых участках головного мозга приводит к тяжелому заболеванию, известному под названием дрожательного паралича, или паркинсонизма. Катехоламины образуются в организме из аминокислот путем последовательного превращения фенилаланина в тирозин и дигидрооксифенилаланин (ДОФА). Помимо прямого медиаторного действия норадреналин, поступая в кровь и тканевую жидкость, принимает самое активное участие в гуморальной регуляции функций.
Катехоламины оказывают необычайно сильное влияние на возникновение, течение и исход буквально всех процессов, совершающихся в организме, действуя и на нервные и гуморальные рецепторы. При этом они вызывают эффект такого же характера, какой возникает при возбуждении симпатической нервной системы, т. е. обладают симпатомиметическими (сходными с симпатическим) свойствами. Содержание их в крови ничтожно, но активность чрезвычайно высока.
Итак, норадреналин — гормон и медиатор центральных и периферических отделов симпатической нервной системы, дофамин — медиатор центральной нервной системы, а фенилаланин, тирозин и ДОФА последовательно участвуют в биосинтезе катехоламинов. Цепь их превращений, начиная с фенилаланина, совершается при участии ряда ферментов, активность которых может иметь особо важное значение для формирования тонуса и реактивности симпатоадреналовой системы, усиливая или ослабляя превращение одних форм катехоламинов и их предшественников в другие.
Однако медиаторная роль адренергических нервных волокон не сводится к одному лишь выделению норадреналина в синаптическую щель. Недавно было открыто явление, прямо противоположное процессу освобождения норадреналина. Оказалось, что симпатические нервные окончания способны обратно захватывать неиспользованный медиатор и этим как бы пополнить запасы катехоламинов. Какая поразительно тонкая феерия разыгрывается в адренергическом синапсе в ту минуту, когда к нему приходит нервный импульс! Содержащийся в везикулах норадреналин изливается в синаптическую щель и вступает в реакцию с постсинаптическими адренореактивными системами. Однако он используется не полностью, часть его остается ненужной, избыточной. И сразу в действие вступают механизмы, инактивирующие излишки медиатора. Этих механизмов несколько и надежность их достаточно велика. Прежде всего это цикл разнообразных биохимических превращений, сложных и многозвеньевых, а кроме того, обратный захват, поглощение (uptake), детали которого подробно описаны в литературе[13]. Однако какое-то количество медиатора ускользает от цепких механизмов инактивации и уносится током крови. Это именно тот норадреналин, который мы определяем в жидких средах и выделениях организма, по уровню которого судим о тонусе и реактивности симпатического (нервного) отдела симпатоадреналового аппарата.
Унесенные кровью, проникшие через гистогематические барьеры в непосредственную среду органов катехоламины вызывают длинную цепь физиологических и биохимических эффектов. Но их действие на клетку осуществляется не непосредственно, а через несколько промежуточных инстанций. Наиболее важной из них является образование циклического 3'5' - аденозинмонофосфата (3'5' - цАМФ), который в настоящее время рассматривается как универсальный «второй передатчик» регуляторных воздействий гормонов и медиаторов, превращающих межклеточные сигналы, поступающие из внутренней среды, во внутриклеточные. Можно считать доказанным, что это соединение выполняет функцию посредника между действием гормонов и ответной реакцией клетки.
В образовании цАМФ важную роль играет группа биологически активных веществ — простагландинов. Вступая в соединение с рецептором клеточной мембраны, гормон (в данном случае адреналин или норадреналин) стимулирует переход в активную форму простагландинов различного действия. Активным началом этих соединений являются ненасыщенные жирные кислоты с 20 атомами углерода. Хотя простагландины делятся на 4 группы, число их, как и спектр физиологического действия, значительно выше. В оболочке клетки простагландины находятся в связанной форме и освобождаются под влиянием норадреналина. В свою очередь, простагландины активируют фермент аденилциклазу, который при участии ионов кальция усиливает образование цАМФ. Другим ферментом, который принимает участие в обмене цАМФ, является фосфодиэстераза. Ее роль заключается в разрушении и тем самым инактивации цАМФ. Интересно отметить, что инсулин — представитель вагоинсулярной системы, тормозит освобождение простагландинов из связанного состояния и тем самым снижает образование цАМФ. Аденилциклаза активируется не только при участии катехоламинов, по и некоторых других биологически активных веществ (гистамина, серотонина, ангиотензина, некоторых гормонов гипофиза и др.). Образование и разрушение цАМФ — сложный и полностью еще не расшифрованный процесс[14].
Таким образом, если катехоламины, попадая из крови в тканевую жидкость, являются внеклеточным химическим посредником между мозговым слоем надпочечников (или адренергическими нервными элементами) и клеткой-мишенью, т. е. объектом действия гормонов, то цАМФ, проникая через клеточную мембрану, вступает во взаимодействие с содержащимися в ней рецептивными образованиями и ферментами, что приводит к возникновению многочисленных биохимических и физиологических реакций в организме.
Роль катехоламинов в реализации гомеостатических механизмов подробно изучена не только в экспериментах на животных, но и на человеке. Катехоламины, их предшественники и продукты превращения определяются в крови и моче при различных физиологических и патологических состояниях организма. Обычно в клинической практике или при исследовании состояния симпатоадреналовой системы у человека в лабораторных условиях определяют катехоламины, их предшественники и продукты превращения в моче, собранной в течение суток (суточная доза) или нескольких часов (порционная моча). Опыт показывает, что содержание катехоламинов в моче, подобно зеркалу, позволяет судить о состоянии симпатоадреналовой системы, хотя в мочу попадает лишь 4—5% их общего количества в организме. В пашей лаборатории принята следующая схема: мочу собирают с 8 до 12 ч, с 12 до 16 ч, с 16 до 20 ч, с 20 до 8 ч. Ночные пробы мочи можно брать в 2 и 5 ч. Эта схема необязательная, существует ряд ее вариантов.
По уровню адреналина в моче можно судить в основном о состоянии гормонального звена симпатоадреналовой системы, т. е. о деятельности мозгового слоя надпочечников, а по уровню норадреналина — медиаторного, т. е. нервного. Количество дофамина и ДОФА характеризует резервные возможности симпатоадреналовой системы. Определение их в крови и моче позволяет оценить возможности симпатоадреналовой системы, наличие в организме строительных материалов, из которых образуются катехоламины. Большое значение уделяется физиологами и клиницистами исследованию продуктов обмена дофамина (гомованилиновой кислоты) адреналина и норадреналина (метанефрина и норметанефрина), а также ванилилминдальной кислоты — основного метаболита адреналина и норадреналина по пути О-метилирования и окислительного дезаминирования. Сопоставление результатов, полученных при изучении экскреции с мочой катехоламинов, их предшественников и продуктов превращения позволяет охватить всю совокупность процессов, протекающих в организме при различных состояниях симпатоадреналовой системы. Так, например, увеличение экскреции ванилилминдальной кислоты указывает на усиление обменных процессов, повышенное использование катехоламинов, а уменьшение экскреции является показателем сниженного обмена адреналина и норадреналина.
Важнейшую, если не главную роль играют катехоламины в осуществлении адаптационно-трофической роли симпатической нервной системы. Этот термин введен советским физиологом Л. А. Орбели. Значение катехоламинов как регуляторов приспособительных механизмов вытекает из способности их быстро и интенсивно оказывать влияние на процессы метаболизма, стимулировать распад гликогена и жиров, повышать уровень глюкозы в крови, способствовать окислению жирных кислот, повышать потребление кислорода тканями, увеличивать работоспособность сердца и скелетной мускулатуры, обеспечивать перераспределение крови для оптимального снабжения тканей энергетическими ресурсами, усиливать возбуждение центральной нервной системы, участвовать в развитии эмоциональных реакций и т. д. и т. д.
Состав и свойства внутренней среды и в еще большей степени состояние организма зависят во многих отношениях от сдвигов в системе катехоламинов, их соотношении и использовании. Возбуждение симпатоадреналовой системы сопровождается, как правило, нарастанием уровня катехоламинов во внутренней среде. В то же время высокое содержание катехоламинов в организме поддерживает напряженный тонус симпатоадреналовой системы. Все эрготропные функции организма усилены. Он приготовился к действию, к бою, достижению цели. Состояние это прекрасно описано Шекспиром в драме «Генрих V» (перевод Е. Бируковой).
Физиолог не ошибется. Перед ним сразу встает знакомая картина возбужденной до предела симпатоадреналовой системы. Если бы каким-то чудом Генриху V удалось заглянуть во внутреннюю среду организма его воинов, он увидел бы истинное «катехоламиновое наводнение».
Существует несколько предположений о значении отдельных катехоламинов для жизнедеятельности организма. Вопрос этот широко обсуждается в литературе, но единого мнения до сих пор нет. Слишком быстро меняется уровень катехоламинов в крови. Они быстро образуются, поступают во внутреннюю среду, выводятся, разрушаются, захватываются клетками, вступают в реакцию и исчезают. Просматривая работы отечественных и зарубежных авторов, подытоживая исследования свои и своих учеников, мы приходим к выводу, что психологические стрессы, выражающиеся в задержке внешних проявлений (ожидание боли, опасности, предчувствие неприятностей, возможного поражения, страх, тревога, сознание собственной беззащитности, депрессия, боязнь смерти), связаны в значительной мере с поступлением в кровь адреналина и в меньшей степени норадреналина, а стрессы, выражающиеся во внешних проявлениях (например, аффект, агрессия, гнев, ярость) состояния, требующие выдержки, выносливости, длительного умственного и физического напряжения, преодоления препятствий, уверенности в победе, сопровождаются накоплением во внутренней среде норадреналина.
В развитие этих представлений можно с известной условностью говорить о норадреналине как «гормоне льва» и адреналине как «гормоне кролика». Автор этой книги считает, что такое деление, предложенное шведским ученым М. Франкенхойзер, следует понимать не в прямом, а в переносном смысле, как противопоставление силы — слабости или храбрости — трусости. Правильнее назвать адреналин, как это сделал Кеннон, гормоном тревоги, а норадреналин — гормоном гомеостаза. Советский ученый С. А. Разумов исследовал содержание адреналина и норадреналина в крови петухов после петушиных боев. По характеру поведения петухи были разделены на агрессивных и пассивных. Оказалось, что у агрессивных петухов содержание норадреналина было в 13 раз выше, чем у птиц пассивных или боящихся драки. В нашей лаборатории определяли катехоламины в крови рысистых лошадей. Оказалось, что победителями в скачках выходили лошади, у которых в крови преобладало содержание норадреналина.
В литературе имеются указания, что поступление во внутреннюю среду норадреналина избирательно повышается в тех случаях, когда требуется сосредоточенное внимание. Английский ученый У. Фридман утверждает, что у темпераментных, честолюбивых людей выделение норадреналина при работе выше, чем у лиц, не обладающих этими чертами характера. По нашим данным, эмоциональное напряжение при полетах на сверхзвуковых самолетах сопровождается резким (в 7—10 раз) увеличением выделения норадреналина мочой. Наиболее высокие показатели летного искусства были отмечены у лиц, экскретировавших большие количества норадреналина, В совместных работах с Н. Н. Артамоновым и Р. С. Веледой мы показали, что испытуемые «норадреналинового типа», т. е. выделяющие преимущественно норадреналин, легко переносят пребывание в барокамере на высоте 5—6 тыс. м, в то время, как испытуемые, у которых экскреция норадреналина снижена или замедлена, не выдерживают даже кратковременного подъема на высоту. Такую же закономерность нам пришлось наблюдать и при спортивной деятельности. Но об этом в специальной главе.
Однако наивно думать, что адреналин и норадреналин во внутренней среде организма как бы противопоставлены друг другу. Можно говорить только о преобладании того или другого представителя этих гормонов-медиаторов комплексной симпатоадреналовой системы. Принято считать, что эмоциональные состояния, особенно возникшие при стрессовых ситуациях, сопровождаются резким нарастанием уровня адреналина в крови. Но вот В. В. Ушаков и Т. И. Лукичева установили, что при сильнейшем эмоциональном стрессе (смерть от утопления) содержание адреналина в трупной крови по сравнению с кровью живых людей было увеличено в 27 раз, а норадреналина — в 31,3 раза, Видимо, при объяснении недоучитывался тот факт, что утопающий мобилизует все свои силы для того, чтобы спастись. В действие вступает вся симпатоадреналовая система, реализующая все защитные механизмы, все жизненные ресурсы погибающего, но не сдающегося организма. В то же время у лиц, погибших без значительного эмоционального стресса (скоропостижная сердечнососудистая смерть), содержание адреналина увеличивалось в 12 раз (вероятно, все же был испуг!), а норадреналина всего в 4,6 раза (мобилизация только началась!).
Оказалось, что сдвиги в обмене катехоламинов, от которых зависит в значительной степени состояние симпатоадреналовой системы, далеко неодинаковы при одних и тех же воздействиях на организм. Они зависят от многих факторов: исходного состояния и реактивности симпатоадреналовой системы, интенсивности и длительности воздействия, времени дня и ночи, наличия или отсутствия предшественников, из которых образуются катехоламины, ответной, компенсаторной реакции со стороны вагоинсулярной системы и т. д.
Количество катехоламинов в крови колеблется в пределах миллионных долей грамма. Данные, приведенные различными исследователями, зависят от метода определения. Предложено много разнообразных методов, в основном спектрофлуорометрических и радиоиммунологических, позволяющих определять в биологических объектах буквально гомеопатические количества катехоламинов. Количество адреналина в плазме крови составляет 0,1—0,4 мкг/л (трииндоловый метод). Содержание норадреналина примерно в 2—4 раза выше. Несколько более высокие цифры получены при определении катехоламинов другими методами. Интересно отметить, что содержание катехоламинов в крови и выделение их с мочой меняется в зависимости от времени дня и ночи. Наиболее высокое количество их обнаруживается во вторую половину дня, наиболее низкое в ночные часы, что соответствует повышению тонуса симпатоадреналовой системы днем и снижению его ночью. Суточный ритм экскреции катехоламинов и их предшественников у здоровых людей изучен многими авторами. В нашей лаборатории получены данные, частично представленные в табл. 1. Любопытно отметить, что для людей, принадлежащих к породе «сов», т. е. привыкших работать в ночные часы или вообще чувствующих себя ночью бодрее, чем днем, характерен перестроенный ритм экскреции катехоламинов — некоторое снижение между 12—16 ч и повышение в 2—3 ч ночи.
Таблица 1. Суточный ритм экскреции катехоламинов и их предшественников (нанограммы в 1 мин) у здоровых людей (по материалам нашей лаборатории)
| Часы обследования | Адреналин | Норадреналин | Дофамин | ДОФА |
|---|---|---|---|---|
| 8—12 | 4,3±0,3 | 8,8±0,9 | 261±16 | 22,4±1,4 |
| 12—16 | 3,0±0,2 | 6,3±0,7* | 226±15* | 16,0±15* |
| 16—20 | 4,8±0,2 | 10,1±1,3 | 240±14 | 24,0±1,3 |
| 20—8 | 2,0±0,1* | 5,0±0,5* | 131±16* | 14,0±1,5* |
* Статистически достоверные различия по сравнению с утренней порцией мочи (Р < 0,05).
О состоянии отдельных звеньев симпатоадреналовой системы (медиаторного и гормонального) можно судить по соотношению норадреналин/адреналин в моче, которое повышается при усилении медиаторного его звена и снижается при усилении гормонального. Для косвенной оценки процессов динамики образования катехоламинов вычисляют отношение их суммы (адреналина, норадреналина, дофамина) к ДОФА — А+НА+ДА/Д, а также отношение суммы адреналина и норадреналина к дофамину — А+НА/ДА. Снижение первого коэффициента и увеличение второго является показателем нарастания резервных возможностей симпатоадреналовой системы (накопление ДОФА и усиленный переход дофамина в норадреналин).
Аналогичные результаты получил Р. В. Беледа, обследуя суточный ритм здоровых летчиков по несколько измененной схеме.
Биологически активные вещества трофотропного ряда
Система ацетилхолина. Ацетилхолин — медиатор парасимпатического отдела вегетативной нервной системы является сложным эфиром холина и уксусной кислоты. Он образуется при участии синтезирующего фермента — холинацетилазы, активность которого в клетках изменяется под влиянием условий среды и тканевого обмена. Ацетилхолин нестоек и срок его существования крайне ограничен. Выполнив свою задачу, ацетилхолин, образовавшийся в нервных окончаниях, мгновенно расщепляется на свои составные части (уксусную кислоту и холин) под влиянием фермента холинэстеразы. До сих пор принято было считать, что ацетилхолин приспособлен для выполнения узкоограниченных, чисто медиаторных задач и действие его сводится к передаче возбуждения с нерва на клетку-мишень. Но теперь, в значительной степени работами нашей лаборатории, установлено, что ацетилхолин поступает из органов и тканей в кровь и принимает активное участие в гуморальной регуляции функций. Его влияние на клетки сходно с действием парасимпатических нервов.
Возьмем обычную медицинскую пиявку и вырежем у нее из спины кусочек мышцы. Если погрузить этот кусочек в раствор ацетилхолина, разведенного в миллион и даже больше раз, мышца пиявки начнет сокращаться. Она отвечает на незначительное количество ацетилхолина, содержащееся в жидкости Рингера, в крови, в вытяжках из тканей.
Немедиаторное действие ацетилхолина в целостном организме представляет один из наименее изученных и наиболее спорных разделов гуморально-гормональной регуляции функций. Установлено, что холинергические (парасимпатомиметические, парасимпатотропные, трофотропные) реакции возникают при действии ацетилхолина (или других соединений холина) на холинорецепторы, субклеточные образования, клетки, ткани, органы или организм в целом. Помимо своего основного (холинергического) действия, ацетилхолин вызывает освобождение калия, связанного белками, повышает или снижает проницаемость биологических мембран, принимает участие в регуляции избирательной проницаемости эритроцитов, изменяет активность отдельных дыхательных ферментов, влияет на активность катепсинов, на обновляемость фосфатной группы в фосфолипидах, на метаболизм макроэргических фосфорных соединений, повышает устойчивость отдельных тканей и организма в целом к гипоксии. Советский ученый X. С. Коштоянц высказал предположение, что, осуществляя медиаторное действие, ацетилхолин вступает в круг тканевых биохимических превращений.
По современным представлениям, ацетилхолин действует на клетки через циклический гуанозин-3'5'-монофосфат (цГМФ), который наряду с цАМФ рассматривается как универсальный внутриклеточный регулятор. Фермент гуанилциклаза, осуществляющий синтез цГМФ, так же как аценилциклаза, входит в состав мембран клеток и активируется ацетилхолином, инсулином и некоторыми другими биологически активными веществами трофотропного ряда.
Но в данном случае речь идет только об ацетилхолине. Этот вездесущий и многообразный участник физиологических и патологических процессов, нейрогормон, посредник нервного возбуждения и одновременно метаболит центральных и периферических клеточных и субклеточных структур, образующийся в процессе жизнедеятельности и мгновенно разрушающийся или инактивирующийся, таит немало загадок и значение его в физиологических реакциях еще далеко не «разложено по полочкам». Не использованный в процессах передачи возбуждения в синапсах ацетилхолин поступает в тканевую жидкость и кровь из элементов нервной системы. Накопление его во внутренней среде вызывает определенные парасимпатомиметические эффекты, охватывающие множество функций. Возникает состояние, характерное для повышенного тонуса всего парасимпатического отдела вегетативной нервной системы. Состояние это сопровождается одновременным немедиаторным (отделенным дистантным) действием ацетилхолина на многие периферические (и, вероятно, центральные) рецепторы и эффекторы (мышечные, секреторные, сосудистые). Проверить действие ацетилхолина в эксперименте нетрудно. Достаточно пропустить его через изолированное сердце лягушки. Опыт прост и легко воспроизводится во всех физиологических лабораториях. Раствор Рингера с добавлением прозерина (для подавления расщепляющих ацетилхолин холинэстераз) вызывает на сердце такой же эффект, как и раздражение парасимпатических нервов.
Но парасимпатомиметическое действие почти полностью отсутствует, если ввести ацетилхолин в организм (под кожу, в вену), будь то морская свинка, кролик, собака и даже человек. Ацетилхолин мгновенно расщепляется холинэстеразами внутренней среды. Попробуем заменить ацетилхолин близким ему по строению и действию карбаминохолином (карбохолином). Этот препарат не расщепляется холинэстеразами и введение его в организм вызывает выраженный, необычайно яркий парасимпатический эффект. Однажды автору этой книги пришлось наблюдать такой случай. Больному с высоким кровяным давлением (около 300 мм рт. ст.), которому не помогали обычные лечебные препараты, ввели под кожу 1 мг карбаминохолина. Буквально через 10 мин можно было наблюдать отчетливый холинергический эффект. Давление снизилось до 200 мм, началось сильнейшее потоотделение, резко усилилась перистальтика кишечника, рот наполнился жидкой слюной, резко сузились зрачки. В течение следующих минут начал развиваться типичный парасимпатический криз (дальнейшее снижение кровяного давления, замедление пульса, спазмы кишечника), который, как по мановению волшебной палочки, прекратился после подкожной инъекции 1 мл раствора атропина (1:1000). Холинорецепторы были заблокированы атропином и действие карбоминохолина почти мгновенно прекратилось.
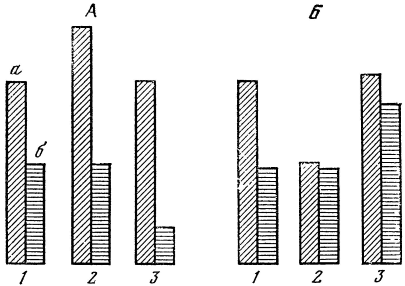
Рис. 5. Соотношение уровня ацетилхолина и активности ацетилхолинэстеразы (схема).
А — при высоком тонусе парасимпатической нервной системы: 1 — исходные соотношения, 2 — повышение содержания свободного ацетилхолина при неизменной активности ацетилхолинэстеразы; 3 — снижение активности ацетилхолинэстеразы при неизменном содержании свободного ацетилхолина; Б — при низком тонусе парасимпатической нервной системы: 1 — исходные соотношения, 2 — снижение содержания свободного ацетилхолина при неизменной активности ацетилхолинэстеразы, 3 — повышение активности ацетилхолинэстеразы при неизменном содержании свободного ацетилхолина; а — уровень ацетилхолина; б — активность ацетилхолинэстеразы.
Уровень свободного ацетилхолина в крови лишь частично отражает процессы холинергической (парасимпатической) регуляции. Еще меньше информаций можно получить при весьма распространенном в клинике и лабораторном эксперименте определении в крови одной лишь активности неспецифической (бутирилхолинэстеразы) или специфической холинэстеразы (ацетилхолинэстеразы).
Здесь следует сделать небольшое отступление принципиального характера. Обычно физиологическая активность того или другого биологически активного вещества (например, ацетилхолина, гистамина, серотонина) расценивается по уровню его в крови. Не учитывается активность фермента, расщепляющего данное вещество. Между тем конечная, суммарная биологическая активность крови зависит не только от количественного содержания того или другого вещества во внутренней среде, но и от скорости (кинетики) его образования и расщепления. Высокий уровень ацетилхолина (ацетилхолинемия) или гистамина (гистаминемия) при высокой активности расщепляющих их ферментов подчас вызывает такой же физиологический эффект, как низкое содержание этих биогенных аминов при низкой активности ферментов.
Так, нами установлено, что снижение активности ацетилхолинэстеразы (при одном и том же уровне свободного ацетилхолина в крови) увеличивает, а повышение ее — уменьшает холинергическую активность жидких сред организма (рис. 5). Однако природа не ограничилась расщеплением ацетилхолина специфическими и неспецифическими ферментами. Накопление его в крови слишком опасно. Оно может привести к непоправимым последствиям. Это легко проверить, если ввести в организм вещество, подавляющее активность холинэстераз, например, прозерин или один из других антихолинэстеразных препаратов. Поэтому организм обезопасил себя открытой нами второй линией обороны. Оказалось, что эритроциты крови способны связывать немедиаторный ацетилхолин и тем самым инактивировать, обезвреживать его. В тех случаях, когда организму необходимо повысить тонус парасимпатической системы, ацетилхолин освобождается из связанной формы и поступает в ток крови, вызывая соответствующий физиологический эффект. Но существует и третий фронт защиты организма от избытка ацетилхолина — прочное связывание его белками крови и тканей. Этот ацетилхолин в отличие от первых двух — реакционноспособных не принимает прямого участия в регуляции функций. Он образует как бы неприкосновенный запас, который выбрасывается во внутреннюю среду лишь в случаях крайней необходимости. Исследование реакционноспособных форм ацетилхолина в крови (свободного и связанного эритроцитами), активность холинэстераз (специфической и в меньшей мере неспецифической), а также способности эритроцитов связывать в пробирке добавленный к крови химически чистый ацетилхолин (так называемый феномен его связывания) позволяет оценить холинергическую активность крови и является одним из методов исследования парасимпатического отдела вегетативной нервной системы.
Установлено большое информативное значение коэффициента распределения — соотношения между свободным и связанным эритроцитами ацетилхолином и холинергического индекса — соотношения между активностью ацетилхолинэстеразы и свободным ацетилхолином. По-видимому, эритроциты представляют депо, нечто вроде хранилища ацетилхолина и принимают участие в его немедиаторном (дистантном) действии. Освобождение ацетилхолина, связанного эритроцитами, происходит в клетках, органах и тканях в зависимости от потребностей организма. Оно увеличивается под влиянием одних веществ, например, калия или гистамина[16], и уменьшается под влиянием других (кальция, катехоламинов, серотонина).
У здорового человека и у некоторых видов животных связывание ацетилхолина эритроцитами является одним из путей его инактивирования (депонирования). При усилении ферментативного расщепления, т. е. при повышении активности холинэстераз, величина связывания уменьшается и увеличивается при ее снижении. В тех случаях, когда обе формы инактивирования ослаблены, например, в первые недели или месяцы беременности, холинергическая активность крови значительно нарастает.
Физиологи уже давно заметили, что в плазме крови свободный ацетилхолин отсутствует. Для определения его используют обычно цельную кровь, к которой добавлено небольшое количество какого-либо препарата, подавляющего активность холинэстераз. По-видимому, весь ацетилхолин крови содержится в эритроцитах в двух состояниях — прочно и рыхло связанном. Немедиаторное (дистантное) его действие обусловлено освобождением из рыхло связанной эритроцитами формы. Его-то мы определяем как «свободный». Прочно связанный эритроцитами (резервный) ацетилхолин освобождается при определенных ситуациях, например, когда организму для поддержания гемеостаза необходимо усиление холинергической активности крови. Чтобы обнаружить его в крови, пробу крови помещают на 1,5—2 ч в термостат.
В пользу высказанного нами предположения говорит тот факт, что в пробах крови удается выявить присутствие ацетилхолина, несмотря на наличие мощных холинэстераз. Учитывая все эти сложные взаимоотношения, мы предложили весь ацетилхолин крови, т. е. свободный и связанный эритроцитами, считать суммарным. Он и представляет реакционноспособный ацетилхолин. Своей способностью воздействовать на эффективные клетки он отличается от ацетилхолина, прочно связанного с белками крови или тканей, для выявления которого необходимы специальные химические методы.
И в заключение об одном удивительном свойстве эритроцитов. Если к пробе крови или к отмытой физиологическим раствором взвеси эритроцитов добавить небольшое количество раствора химически чистого препарата ацетилхолина, то после 24-часового пребывания в холодильнике при 4° количество ацетилхолина в пробе значительно уменьшается. У одних людей на 60—70%, у других на 20—30—40%. Разумеется, действие расщепляющих ферментов необходимо предварительно подавить прозерином или каким-нибудь другим ингибитором. Это явление мы назвали феноменом связывания ацетилхолина. Его следует рассматривать как функциональную пробу, характеризующую потенциальную способность эритроцитов связывать медиатор. Способность связывать добавленный извне ацетилхолин может быть отнесена к физиологическим мерам защиты против его избыточного накопления в крови. Величина феномена связывания зависит от разных причин: физикохимических свойств эритроцитов, мембранной проницаемости, рецепторной функции белково-липоидной оболочки эритроцитов, состава и биологических свойств плазмы и т. д., а также активности холинэстераз. Обычно чем выше активность холинэстераз, тем слабее выражен феномен связывания. Состав плазмы оказывает исключительно сильное влияние на способность эритроцитов связывать добавленный к крови ацетилхолин. Достаточно прибавить к плазме незначительное количество калия или раствор гистамина, чтобы феномен связывания резко снизился. Напротив, кальций, адреналин и норадреналин способствуют его повышению.
Если кровь связывает в пробирке 80—90% добавленного извне ацетилхолина, это косвенно говорит о высокой ее холинергической активности. Но самое важное заключается не в этом. Оказалось, что феномен связывания значительно повышается при некоторых заболеваниях нервной системы, особенно вегетативной (например при различных формах поражения гипоталамуса, при миастении и др.), и, как правило, снижается при нормализации ее тонуса и реактивности.
У здорового человека ацетилхолин, связавшийся эритроцитами в пробирке, освобождается после 2—3-часового пребывания в термостате. Он как бы реактивируется. Однако при некоторых заболеваниях, характеризующихся высокой холинергической активностью крови (например, язвенная болезнь желудка и 12-перстной кишки, болезнь Паркинсона), эритроциты прочно удерживают связавшийся ацетилхолин и реактивация отсутствует.
Таким образом, в организме существует сложная система ацетилхолина, отдельные компоненты которой могут меняться независимо друг от друга (повышаться, снижаться). Схематически холинергическая активность крови увеличивается:
— при повышении содержания в ней общего (суммарного) ацетилхолина; при повышении содержания свободного ацетилхолина;
— при снижении содержания рыхло связанного ацетилхолина в эритроцитах;
— при снижении активности холинэстераз;
— при повышении коэффициента распределения между свободным и связанным эритроцитами ацетилхолином;
— при снижении холинергического индекса.
Холинергическая активность крови уменьшается:
— при снижении содержания в ней общего (суммарного) ацетилхолина;
— при снижении содержания свободного ацетилхолина;
— при повышении содержания рыхло связанного ацетилхолина в эритроцитах;
— при повышении активности холинэстераз;
— при снижении коэффициента распределения между свободным и связанным ацетилхолином;
— при повышении холинергического индекса.
Ниже представлены средние цифры, характеризующие холинергическую активность крови здорового человека. Необходимо учесть, что цифры эти получены при определении ацетилхолина биологическим методом на спинной мышце пиявки. Нет необходимости описывать методику, читатель найдет ее в специальной литературе[17].
Холинергическая активность крови здорового человека:
| Свободный ацетилхолин, мкг% | 0,5—0,7 |
| Связанный эритроцитами ацетилхолин, мкг% | 0,3—0,4 |
| Активность ацетилхолинэстеразы (расщепленного за 30 мин мг ацетилхолина) | 4,0—4,5 |
| Феномен связывания ацетилхолина, % | 30—40 |
| Коэффициент распределения между свободным и связанным ацетилхолином | 1,2—1,5 |
| Холинергический индекс (соотношение между активностью ацетилхолинэстеразы и уровнем свободного ацетилхолина) | 8,0 |
Механизм немедиаторного действия ацетилхолина можно представить в виде следующей схемы. Поступая в кровь из разных органов и тканей, неиспользованный при передаче нервного возбуждения медиатор рыхло связывается эритроцитами и разносится током крови по организму. При соответствующих условиях под влиянием определенных метаболитов, гормонов или солей он освобождается внутри или на поверхности клеток, в органах и тканях или в жидких средах организма из связанной формы и вступает во взаимодействие с холинергическими нервными или гуморальными образованиями, осуществляя свое трофотропное действие. Не исключено, что в крови содержится какое-то вещество, способствующее освобождению рыхло связанного эритроцитами ацетилхолина. Как указывает советский биохимик Н. Н. Демин, в этих случаях проявляется многостороннее, хотя и не во всех случаях ярко выраженное немедиаторное биохимическое действие ацетилхолина.
Таким образом, эритроциты представляют депо ацетилхолина, постоянно пополняющееся и непрерывно освобождающееся. При некоторых состояниях организма динамическое равновесие между связыванием ацетилхолина эритроцитами и его переходом в свободную форму может нарушаться. В одних случаях способность эритроцитов связывать ацетилхолин, поступающий во внутреннюю среду, увеличивается, в других — уменьшается. Точно так же в одних условиях повышается выход ацетилхолина из эритроцитов, что приводит к увеличению холинергической активности крови, в других — освобождение медиатора уменьшается, вследствие чего наступает ее снижение.
С давних пор известны парасимпатомиметические свойства ионов калия. Немецкий ученый Б. Цондек назвал калий «жидким блуждающим нервом». Однако можно предположить, что действие калия, сходное с парасимпатическим, зависит от вытеснения ацетилхолина из рыхло связанной эритроцитами формы, а симпатомиметическое действие кальция («жидкий симпатический нерв» но Б. Цондеку) — с увеличением связывания его красными кровяными тельцами. Это легко проверить в эксперименте, добавляя растворы кальция к пробам крови.
Система гистамина. Гистамин относится к биологически активным веществам трофотропного ряда, но не является холинергическим амином. Он не оказывает сколько-нибудь заметного влияния на холинорецепторы, не влияет на центральные или периферические звенья парасимпатического отдела вегетативной нервной системы. Но при явлениях повышенного тонуса ее содержание гистамина в крови увеличивается. По-видимому, это связано с нарастанием уровня ацетилхолина в жидких средах организма, вызванного способностью гистамина подавлять активность ацетилхолинэстеразы и увеличивать его освобождение из рыхло связанной формы. Надо полагать, что при осуществлении гомеостатических реакций гистамин потенцирует, «подкрепляет» действие ацетилхолина.
Хотя свободного гистамина в организме сравнительно немного, действие его необычайно многообразно и охватывает различные физиологические процессы и функции. Роль гистамина в возникновении некоторых форм патологии (особенно аллергических реакций) хорошо известна, подробно изучено его фармакологическое действие. Большая литература посвящена и его участию в гуморальной регуляции функций. О ней идет речь в этой книге.
Под влиянием гистамина повышается проницаемость сосудистых стенок, расширяются кровеносные капилляры, суживаются артерии, снижается кровяное давление, сокращаются гладкие мышечные волокна, усиливается слезотечение, уменьшается выделение мочи. Установлено, что он участвует в эмбриогенезе. Несомненную роль играет гистамин в цикле смены сна и бодрствования. Гистамин участвует во многих физиологических процессах, регулируя деятельность органов, стимулируя ее в одних случаях и ослабляя в других. Как неотъемлемая составная часть входит он в комплекс биологически активных веществ, циркулирующих в крови или находящихся в тканях.
Особо важное значение имеет гистамин для микроциркуляции крови в органах и тканях. Американский ученый Р. Шейер считает, что он является единственным, независимым от нервной системы регулятором просвета капилляров, прекапилляров, посткапилляров, артериол, венул, в стенках которых непрерывно по мере необходимости образуется, расширяет их или суживает, действуя на соответствующие рецепторы. Микроциркуляция в отдельных органах (головном мозге, сердце, легких, печени) отличается некоторыми специфическими особенностями, причем строение стенки капилляров различно в разных органах. Наряду с микроскопическими выявлены и субклеточные особенности строения. Более подробно этот вопрос освещен в главе о гистогематических барьерах.
Гистамин принимает участие в процессах роста и регенерации тканей, в какой-то мере связан с развитием опухолей. Не так давно были опубликованы материалы о роли гистамина в регуляции деятельности сердца, коронарного кровотока, сократительной способности миокарда. У здоровых женщин гистамин связан с менструальным циклом. Он является одним из сильнейших возбудителей желудочной секреции. В клинике внутренних болезней нередко применяется гистаминовая проба, которая позволяет решить вопрос о состоянии желез желудка. Если после введения гистамина в кровь желудочный сок не выделяется, следовательно, слизистая желудка атрофирована и железы ее либо отсутствуют, либо потеряли способность вырабатывать соляную кислоту и переваривающие пищу ферменты. Это позволяет врачу отличать органические изменения в желудке от функциональных. По-видимому, гистамин играет важную роль в возникновении язвенной болезни желудка. Наблюдающаяся при ней повышенная кислотность желудочного сока в значительной мере связана с высоким содержанием гистамина в крови и тканях[18].
В последние годы методы определения гистамина во внутренней среде в органах, тканях и выделениях организма значительно усовершенствовались. Выявились некоторые новые данные о его роли в физиологических процессах, о распределении в центральной и периферической нервной системе, об участии в химической регуляции физиологических процессов. Присутствие гистамина в нервных окончаниях аксонов корковых клеток головного мозга позволяет предположить, что он является одним из медиаторов нервного возбуждения. В тканях открыты специфические рецепторы Н1 и Н2, реагирующие на действие гистамина. Расположены они на оболочке клеток. Описаны гистаминовые рецепторы в слизистой оболочке желудочно-кишечного тракта, в сердце и сосудах, в мозгу, во многих железах внутренней секреции, в клетках крови и т. д.
Содержание гистамина во внутренней среде зависит от интенсивности процессов его синтеза, разрушения и инактивирования путем связывания. В основном оно определяется активностью соответствующих ферментных систем, участвующих в процессах образования и расщепления гистамина. Отсюда и «система гистамина», т. е. некая функциональная величина, складывающаяся из его количества в крови, активности синтезирующих и расщепляющих ферментов, состояния связывающих механизмов (связывание и освобождение из связанной формы).
Образование гистамина осуществляется путем ферментативного превращения аминокислоты гистидина при участии фермента — гистидиндекарбоксилазы, а расщепление гистамина идет по пути либо окислительного дезаминирования при участии фермента диаминоксидазы с образованием имидазолуксусной кислоты, либо метилирования в имидазольном кольце при участии фермента имидазолметилтрансферазы, последующим окислительным дезаминированием образовавшегося метилгистамина моноаминоксидазой и образованием метилимидазолуксусной кислоты.
Гистамин образуется во многих органах и тканях, например, в печени, почках, поджелудочной железе («эндогенный гистамин»). Особенно интенсивно происходит его образование в кишечнике, при весьма деятельном участии кишечных бактерий («экзогенный гистамин»). Небольшое количество гистамина (примерно около 5%) поступает в организм с пищей — с хлебом, молоком, мясом, некоторыми овощами (шпинатом, помидорами и др.).
Для научных и фармакологических целей гистамин получают из спорыньи (маточных рожков). Интерес к нему очень возрос с тех пор, как его удалось выделить почти из всех органов человека и животных. Гистамин постоянно содержится в крови, преимущественно в базофильных лейкоцитах. Количество его, по данным разных авторов, составляет 0,025—0,05—0,07 мкг/мл. В то же время из 1 кг бычьего легкого удается извлечь 30 мг, а из 1 кг печени 2,5 мг гистамина. Некоторые авторы утверждают, что 1 кг легких взрослого человека содержит до 70 мг гистамина, а 1 кг кожи человека 30 мг. Много гистамина в селезенке, в сердце коровы, в ткани мозга и нервах человека и животных. Наиболее высокое содержание гистамина обнаружено в симпатических нервных волокнах. Но этот гистамин неактивен. Он связан белками и не в состоянии проявить свое действие, пока не освободится из связанной формы. И вот именно освобождение гистамина играет важнейшую роль в возникновении многих заболеваний человека и животных.
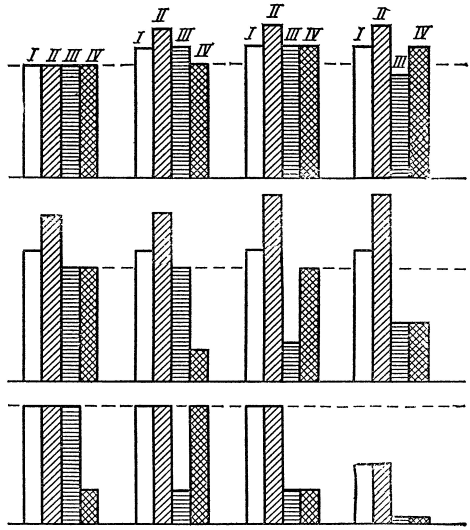
Рис. 6. Различные формы гистаминемии (схема).
I — факторы образования и освобождения, II — уровень гистамина, III — активность диаминоксидазы, IV — гистаминопексический эффект (объяснения в тексте). Слева направо — 1, 2, 3, 4, сверху вниз — а, б, в.
Содержание гистамина в крови, тканевой жидкости и выделениях организма зависит от различных, нередко антагонистических или конкурирующих процессов в организме — интенсивности образования его в кишечнике, тканях и крови из гистидина, освобождения из связанного состояния, интенсивности разрушения ферментными системами и инактивирования путем связывания в крови и тканях. Каждый из этих факторов определяет состояние и физиологическую активность системы гистамина.
По данным нашей лаборатории (И. Л. Вайсфельд), в крови здоровых людей уровень гистамина при определении флуорометрическим методом колеблется в пределах 0,3—0,92 мкг/мл (в среднем 0,58±0,06 мкг/мл). Активность фермента, расщепляющего гистамин, — диаминоксидазы составляет 2,3±0,12 мкг/мл (от 0 до 3,8 мкг/мл) гистамина, расщепляемого за 24 ч. Экскреция гистамина с мочой равна приблизительно 60 мг/24 ч. Содержание гистамина в моче здоровых людей отличается некоторыми особенностями. В двух ее порциях, собранных с 12 до 15 ч и с 18 до 21 ч, количество гистамина выше, чем в остальных. Приводим сведения об экскреции свободного гистамина с мочой у здоровых людей в суточном ритме (по И. Л. Вайсфельд):
| Часы | ||||||
| 6—9 | 9—12 | 12—15 | 15—18 | 18—21 | 21—24 | 24—6 |
| Гистамин, нг/мин | ||||||
| 36,09±4,86 | 32,29±3,76 | 52,03±7,2 | 41,6±4,09 | 60,16±4,09 | 46,24±7,39 | 25,54±6,06 |
Под влиянием сложных и многообразных процессов, совершающихся в организме, вызванных некоторыми внешними воздействиями, например, охлаждением, перегреванием, ожогом, солнечными лучами, гистамин освобождается из связанной формы. Переполненные гистамином тканевые депо, эти «склады», насыщенные неактивным, связанным гистамином, в основном содержащие его базафильные лейкоциты, начинают опорожняться. В кровь поступает свободный и очень активный гистамин. Он повышает проницаемость сосудов, расширяет капилляры, снижает давление крови, усиливает секрецию желудочного сока. Опустевшие депо быстро заполняются вновь образовавшимся гистамином, который, в свою очередь, может легко освободиться и перейти в кровь. Этому «гистаминовому наводнению» организм противопоставляет мощную систему обороны. Но в некоторых случаях поступление превышает разрушение, и тогда-то возникает многообразное болезненное состояние, преимущественно аллергического типа.
Разумеется, нельзя ставить знак равенства между аллергией и гистамином. Проявления аллергии не сводятся к действию одного только гистамина, к гистаминовому отравлению. Но, как правило, без его участия не возникают аллергические явления.
Гистамин активен при разведении в несколько миллионов раз. Тысячные доли миллиграмма способны вызвать сокращение изолированной кишки морской свинки. Накопление сравнительно небольших количеств гистамина в крови и органах человека нередко вызывает у него тяжелые нарушения самочувствия, возникновение расстройств жизнедеятельности организма. Обмен гистамина резко нарушается при некоторых заболеваниях нервной, особенно вегетативной системы. Наши данные показывают, что наиболее важную роль играет при этом гипоталамус. Все без исключения формы поражения этого небольшого по величине, но буквально необъятного по действию участка мозга сопровождаются явлениями гистаминемии.
У больных нарколепсией, внезапно засыпающих днем при самых неожиданных, казалось бы, обстоятельствах, перед засыпанием уровень гистамина в крови значительно повышается, в то время как во время сна он, как правило, несколько снижен. Гистамин нарастает при длительной гипокинезии (обездвижении) и достигает поистине критически высоких цифр после тяжелой черепно-мозговой травмы.
Фармакологическая промышленность наших дней синтезировала несколько десятков препаратов противогистаминного действия (антигистамины). При введении в организм они препятствуют проявлению его токсических свойств. Это легко показать в лабораторном опыте. Если морской свинке ввести димедрол и после него четырехкратную смертельную дозу гистамина, свинка остается в живых. Механизм действия сложен и не всегда ясен. Они действуют на разные функции организма. Одни из них подавляют центральную нервную систему, другие не оказывают на нее сколько-нибудь заметного влияния. Антигистамины блокируют гистаминорецепторы, они как бы закрывают цель, в которую бьет пуля гистамина. Многие из них выключают также холино- и адренорецепторы. Некоторые препараты препятствуют синтезу гистамина в клетках, другие активируют ферменты, разрушающие гистамин, третьи способствуют его связыванию. Физиологическая классификация антигистаминов отсутствует и, быть может, этим объясняется неэффективность их при некоторых аллергических заболеваниях.
Появление антигистаминных препаратов на фармакологическом рынке сыграло огромную роль в лечении многих заболеваний. Но в начале шестидесятых годов было сделано неожиданное открытие. Оказалось, организм вырабатывает собственные, естественные антигистамины. Тонкими лабораторными исследованиями удалось показать, что кровь здорового человека способна нейтрализовать, обезвредить добавленный к ней гистамин. Открытие это принадлежит французскому ученому Ж. Л. Парро, который назвал описанное им явление гистаминопексией, а самый эффект связывания гистамина — гистаминопексическим.
Феномен гистаминопексии зависит от наличия в нормальной сыворотке крови особого белка — плазмапексина I, который по своему химическому строению относится к псевдо-гамма-глобулинам. Содержание его в крови равно 0,4—0,7% всех белков сыворотки. Плазмапексин связывает не только гистамин, но также и другие биологически активные вещества (ацетилхолин, серотонин, окситоцин). Установлено, что избыток ионов калия тормозит, а ионов кальция усиливает связывание гистамина плазмапексином. Работы в этой области интенсивно продолжаются. По-видимому, способностью связывать гистамин, превращая его в неактивную форму, обладает не только белок крови, но и гликопротеиды, липиды, нуклеиновые кислоты, а также некоторые другие составные части крови.
Низкий гистаминопексический эффект в сыворотке больных с различными аллергическими заболеваниями зависит не только от отсутствия плазмапексина I, но и от появления в крови плазмапексина II, неспособного связать гистамин в крови, и антипексина, подавляющего связывание гистамина плазмапексином I.
В нашей лаборатории подробно изучен гистаминопексический эффект при различных заболеваниях. Полученные данные совпадают с результатами исследований Парро. При некоторых заболеваниях сыворотка крови теряет способность связывать в пробирке добавленный к ней гистамин. Это наблюдается у больных бронхиальной астмой, вазомоторным ринитом, крапивницей. Сыворотка крови не в состоянии нейтрализовать гистамин. И хотя содержание в крови свободного гистамина нередко в норме или даже ниже нормы, из-за отсутствия гистаминопексического эффекта он отличается особой активностью и даже в низких концентрациях способен вызвать аллергические явления.
В известной степени это явление сходно с описанным нами феноменом связывания ацетилхолина. Это зависит во многих случаях от недостаточности механизмов, инактивирующих гистамин во внутренней среде и, по-видимому, в тканях. Можно считать доказанным, что отсутствие гистаминопексического эффекта или снижение активности диаминоксидазы приводит к значительному усилению действия гистамина на физиологические процессы, протекающие в организме. Организм становится как бы беззащитным к действию гистамина. По мере образования и поступления в кровь ничем не инактивируемый гистамин вызывает серию специфических реакций, нередко находящихся на грани между физиологией и патологией. Так, например, в ночные часы активность диаминоксидазы резко снижается, в то время как содержание гистамина в крови практически не меняется. Это ведет к относительной гистаминемии и, быть может, способствует засыпанию. Но при некоторых аллергических состояниях, например, при крапивнице, бронхиальной астме, эксудативном диатезе гистаминопексический эффект равен нулю, в то время как содержание гистамина в крови может оставаться в пределах физиологической нормы.
На рис. 6 представлены различные варианты, характеризующие состояние системы гистамина. Они условно определяют физиологические и патологические особенности процессов и явлений, известных под названием гистаминемии. Первый ряд рисунка (а) соответствует нормальным физиологическим взаимоотношениям в организме. Факторы образования и освобождения из связанной, неактивной формы уравновешиваются факторами расщепления и связывания (1). Повышение уровня гистамина во внутренней среде, вызванное усиленным образованием или повышенным освобождением из связанной формы, компенсируется активацией расщепляющего фермента — диаминоксидазы (2), либо увеличением связывания (4), либо одновременным нарастанием активности расщепляющих и связывающих механизмов (3).
Второй ряд рисунка (б) характеризует взаимоотношения внутри системы при абсолютной гистаминемии. Высокий уровень гистамина не компенсируется инактивирующими механизмами. Усиление синтеза или повышенное освобождение из связанной неактивной формы не сопровождается повышением гистаминопексии или активацией диаминоксидазы, ведет к их ослаблению — раздельному (2, 3) или одновременному (4). Третий ряд (в) характеризует взаимоотношения внутри системы при относительной гистаминемии. Уровень гистамина не изменен или даже снижен. Факторы синтеза и освобождения из связанной формы находятся в пределах нормы. Ослаблены только инактивирующие механизмы. Гистаминопексический эффект ниже нормальных величин (1) пли полностью отсутствует, активность диаминоксидазы уменьшена (2). Особенно отчетливо проявляются признаки относительной гистаминемии при ослаблении всех инактивирующих механизмов (3). В этих случаях даже невысокий уровень гистамина может вызвать явления, характерные для выраженной гистаминемии (4).
Рис. 7. Суточный ритм экскреции гистамина и 5-оксииндолуксусной кислоты у здоровых людей.
1 — гистамин; 2 — 5-оксииндолуксусная кислота. График рассчитан путем приравнивания среднего арифметического суточного выделения за 1 мин. к единице.
Система серотонин (5-окситриптамин) — 5-оксииндолуксусная кислота. В середине нашего столетия трое американских ученых — М. Рапорт, А. Грин и У. Пейдж выделили из бычьей сыворотки вещество, способное повышать кровяное давление. Оно и было названо ими серотонином, т. е. веществом, выделенным из сыворотки (по латыни serum) и повышающим кровяное давление. Несмотря на большую литературу, посвященную роли серотонина в регуляции функций, значение его в системе регуляторных механизмов изучено недостаточно. Серотонин обладает отчетливым влиянием на гомеостатические механизмы не только здорового, но и больного организма. Он энергично вмешивается в физиологические и биохимические процессы, протекающие в сердечно-сосудистой, дыхательной, выделительной системах. В известной степени содержание серотонина в мозгу определяет состояние возбуждения, торможения и, как теперь установлено, имеет важное значение для цикла: сон — бодрствование. Серотонинергические механизмы мозга принимают участие в реализации медленного сна. Можно считать установленным, что серотонин истинный медиатор. Он отвечает всем требованиям, предъявляемым к этому типу биологически активных веществ, подобно норадреналину, ацетилхолину, гистамину. Серотонин осуществляет передачу импульсов с одной нервной клетки на другую. Принято считать, что серотонин является медиатором трофотропных систем ствола мозга и лимбико-ретикулярного комплекса.
В организме серотонин образуется из аминокислоты — триптофана. Под влиянием фермента моноаминоксидазы он окисляется и превращается в 5-оксииндолуксусную кислоту (5-ОИУК), которая выделяется с мочой.
Систему серотонина при оценке нейрогуморальных взаимоотношений в организме несколько условно составляют серотонин крови и его основной метаболит — 5-оксииндолуксусная кислота в моче. По экскреции 5-ОИУК можно судить об интенсивности обмена серотонина. Однако при некоторых патологических нарушениях нормальные соотношения перестраиваются. Несмотря на то что содержание серотонина в крови повышено, выделение 5-ОИУК с мочой может оказаться сниженным, и наоборот.
В течение многих лет ученые разных стран пытаются разгадать роль серотонина в осуществлении процессов жизнедеятельности отдельных органов или всего организма. Ведутся эти исследования и в нашей лаборатории. Несомненно, серотонин принимает участие в регуляции деятельности головного и спинного мозга, двигательной, сердечно-сосудистой, пищеварительной, выделительной и многих других физиологических систем. Обычно он находится в тканях в виде связанной, неактивной формы. Под влиянием различных воздействий и особенно при введении некоторых лекарственных препаратов, например раувольфии, серотонин освобождается из связанной формы. Но существование его, как правило, непродолжительно. Почти во всех тканях содержится фермент моноаминоксидаза (типа А и Б), довольно быстро инактивирующая серотонин[19].
Вероятно, правильнее было бы систему серотонина представить себе в виде соотношения уровня его в крови и активности моноаминоксидазы. Проблема эта мало разработана. Известно, что активность моноаминоксидазы в крови увеличивается при одних патологических состояниях (например, при хронической сердечной недостаточности) и резко падает при других (ожоги). В какой мере это отражается на уровне серотонина, неизвестно. Вопрос требует дальнейшего изучения.
С недавних пор пристальное внимание исследователей привлекает значение серотонина в возникновении и развитии инфаркта миокарда. И хотя в этом вопросе еще далеко нет полной ясности, при сердечных болях нередко назначают препараты, способные повысить уровень серотонина в крови. Имеются указания, что накопление серотонина в миокарде предотвращает развитие инфаркта. Впрочем, это требует проверки.
Недостаточно изучено также влияние серотонина на вегетативную нервную систему. В одних случаях при введении его препаратов в организм усиливаются симпатические реакции, в других — парасимпатические. Не исключено, что это зависит от дозы препарата, а быть может, от исходного состояния, вернее настройки центральных и периферических отделов комплексной вегетативно-гуморально-гормональной системы. Несомненно, важную роль играет серотонин при физических нагрузках. Об этом более подробно в соответствующей главе.
Количество серотонина в крови составляет 0,03—0,15 мкг/мл (в среднем 0,076±0,06 мкг/мл), причем основная масса его находится в тромбоцитах. Интересно отметить, что тромбоциты содержат также наиболее активную моноаминоксидазу. Экскреция с мочой — в среднем — 4,9 мг/24 ч. При различных физиологических и патологических состояниях эти цифры могут колебаться как в сторону уменьшения, так и увеличения. Некоторые формы вегетативной неустойчивости, то, что принято называть вегетативной дистонией, сопровождаются нарушением нормального соотношения во внутренней среде гистамина и серотонина либо содержанием серотонина в крови и 5-ОИУК в моче. По-видимому, существуют какие-то антагонистические отношения между уровнем в крови гистамина и серотонина. У здоровых людей коэффициент соотношения гистамина и серотонина в крови равен, по данным И. Л. Вайсфельд, 1,42. При различных физиологических и патологических состояниях этот коэффициент может повышаться или снижаться. Так, например, у мастеров спорта — велосипедистов он равен 5,0, у лыжников 3,0, у борцов 2,0, у бегунов 1,4. Повышение соотношения гистамин/серотонин выявлено у больных паркинсонизмом.
Содержание серотонина меняется не только в крови. Опыты на животных показывают, что в различных органах и, следовательно, в их непосредственной питательной среде уровень серотонина может колебаться в широких пределах. Так, например, у подопытных крыс после 8-часового изнурительного плавания и особенно при вибрации мышца сердца почти полностью свободна от серотонина и соотношение гистамин/серотонин увеличивается с 1,4 до 4 и выше.
В литературе имеются указания, что серотонин обладает противосудорожными и успокаивающими свойствами. Накопляясь в центральной нервной системе, он подавляет ее активность. Не случайно так много внимания уделяет медицинская наука изучению обмена серотонина у больных с различными психическими заболеваниями.
Несомненно также участие серотонина в возникновении ряда заболеваний внутренних органов. Видимо, избыточное содержание его во внутренней среде способствует развитию язвенной болезни желудка и 12-перстной кишки. Установлено, что некоторые злокачественные опухоли, например, феохромоцитома, содержат целые «залежи» серотонина. Нередко в моче больных, страдающих злокачественными опухолями, обнаруживается в большом количестве 5-оксииндолуксусная кислота.
И, наконец, весьма важную роль играет серотонин в возникновении и развитии болевого синдрома.
В заключение несколько слов о многочисленных и разнообразных гормонах коры надпочечников — кортикостероидах. Содержание их в жидких средах и выделениях организма характеризует состояние одной из наиболее важных нейрогуморально-гормональных систем — гипоталамо-гипофизарно-надпочечниковой. О ней написано так много, особенно в связи с исследованиями Г. Селье в области физиологии, патофизиологии и биохимии стресса, что в этой книге можно ограничиться лишь кратким изложением современных представлений, непосредственно связанных с проблемой внутренней среды.
Важнейшие гормоны коры надпочечников делят на три основные группы: минералокортикоиды, глюкокортикоиды и половые гормоны. В нашей лаборатории разработан метод тонкослойной хроматографии, позволяющий определить в одной порции мочи целую гамму стероидных гормонов, их предшественников и продуктов превращения. Уже давно стало очевидным, что гормоны коры надпочечников принимают непосредственное участие почти во всех физиологических процессах, протекающих в организме. Сфера их влияния охватывает обмен белков, углеводов и жиров, образование фонда аминокислот — строительных материалов, из которых формируются белки, пептиды, ферменты. Кортикостероиды влияют на деятельность сердечно-сосудистой системы, поддерживают тонус сосудов, усиливают сократительную функцию миокарда. Они обеспечивают выход энергии, способствуют более экономному расходованию ресурсов организма при повышенной потребности в них. Помимо этого они обладают так называемым пермиссивным действием, т. е. создают необходимые условия для осуществления реакций, вызываемых катехоламинами. Если катехоламины можно считать пусковой системой организмов, то для стероидов характерны длительные, долгосрочные реакции.
Минералокортикоиды (альдостерон и дезоксикортикостерон) оказывают влияние на обмен электролитов (натрия и калия). Глюкокортикоиды (кортизон, гидрокортизон, он же кортизол, кортикостерон) регулируют углеводный обмен, участвуют в обмене белков и жиров, влияют на ряд других физиологических функций организма. Роль и значение их в реакциях стресса подробно освещены в литературе. К группе половых гормонов, вырабатываемых корой надпочечников, относятся андрогены, эстрогены и прогестерон.
Особый интерес для проблемы нейрогуморально-гормональной регуляции функций представляют многоступенчатые механизмы, осуществляющие образование и поступление во внутреннюю среду кортикостероидных гормонов. Нервные импульсы, поступающие в гипоталамус и ретикулярную формацию мозга, активируют в нем холино- и серотонинореактивные элементы. Под их влиянием происходит образование в гипоталамусе кортиколиберинов, о которых более подробно написано в гл. 7. Поступая из мозга в гипофиз, кортиколиберин стимулирует образование адренокортикотропного гормона, который, вступая в сложные биохимические процессы, протекающие в коре надпочечников, способствует биосинтезу кортикостероидов различного строения и действия.






