Глава 4
Печень и обмен холестерина
Эволюционная роль холестерина заключается в том, что он служит каркасом клеточных мембран человека. Все цитоплазматические мембраны и мембраны органелл клеток млекопитающих и человека в основном состоят из фосфолипидов, гликолипидов и холестерина. Фосфолипиды являются пластичной, жидкой и фунциональной частью мембран, взаимодействуют с включенными в мембрану ферментами и рецепторами (рис. 12). Холестерин образует каркас клеточной мембраны, занимая свободное пространство между нерастворимыми в воде хвостами фосфолипидов и не позволят им изгибаться. Мембраны с низким содержанием холестерина — более гибкие и функционально активные, с высоким содержанием холестерина — более жесткие и инертные. Свободный (не этерифицированный и не связанный с липопротеидами) холестерин может свободно проникать в клеточные мембраны и образовывать эфиры с жирными кислотами, входящими в состав фосфолипидов, нарушая их функциональное состояние. Именно образование этого резервного компартмента холестерина, как и дефицит эссенциальных фосфолипидов, приводит к снижению вязкости и текучести, «старению» клеточных мембран и коррелирует с выраженностью атеросклероза. Таким образом, борьба с излишками холестерина в тканях и циркуляцией свободного холестерина в плазме для человека является эволюционной задачей, которую здоровый и молодой организм успешно решает путем его этерификации, включения в ЛПВП и транспортировки в печень для утилизации.
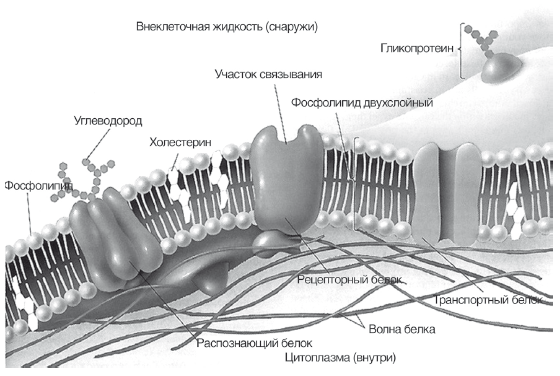
Рис. 12.
Рис. 13.
В 1769 году Пулетье де ла Саль из желчных камней получил плотное белое вещество («жировоск»), обладавшее свойствами жиров. В 1815 году Мишель Шеврёль также выделил это соединение и назвал его холестерином («холе» — желчь, «стерин» — жирный). Однако формулу и химические свойства холестерина установил Антуан Франсуа де Фуркруа. Холестерин и фосфолипиды (98 % их — фосфатидилхолин) составляют липидный комплекс желчи.
В сухом остатке желчи фосфатидилхолин (ФХ) составляет 22 %, а ХС — 4 %. В сутки через каналикулярную мембрану гепатоцита путем активного транспорта переносчиком фосфолипидфлиппазой (MDR3) или в составе фосфолипиднохолестериновых пузырьков и мицелл переносится 1,8–8,2 г ФХ. В кишечнике ФХ желчи расщепляется до лизофосфолипидов и реабсорбируется. Основная функция ФХ заключается в солюбилизации практически нерастворимого в воде ХС путем формирования ядра устойчивых простых (ФХ + холестерин, диаметр до 3 нм) или смешанных мицелл (ФХ + холестерин + желчные кислоты, диаметр 3–6 нм), а также везикул (ФХ + холестерин + желчные кислоты, диаметр 25-130 нм).
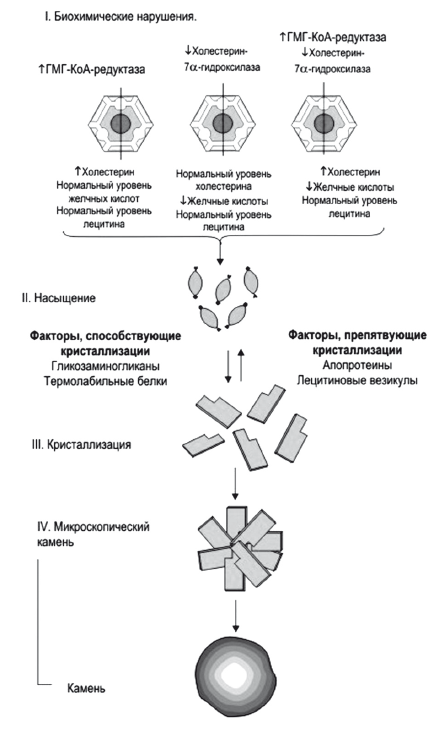
Рис. 14.
Потребность в холестерине в организме и печени зависит от активности человека — настройки симпато-адреналовой системы — человеку холестерин жизненно необходим для синтеза прогестерона, стероидных и половых гормонов, деятельности синапсов головного мозга, выработки витамина D. При стрессе и длительном напряжении в организме печень синтезирует много холестерина, который не весь расходуется на синтетические процессы и остается в виде эфиров в цитоплазме гепатоцита. Кроме того, длительное физическое и нервно-психическое напряжение может создать избыток холестерина в тканях преимущественно в форме ЛПНП. Высокое содержание (> 2 %) холестерина в пище также увеличивает фракцию ЛПНП и ЛПВП. При высоком содержании холестерина в пище синтез эндогенного холестерина в печени и других тканях ингибируется по механизму обратной связи.
В норме утилизация избытка холестерина касается только ЛПНП. Захват печенью циркулирующих в плазме ЛПНП — процесс активного транспорта через синусоидальную мембрану гепатоцита. После захвата ЛПНП скавендер-рецепторами гепатоцита они транспортируются в лизосомы, где из них высвобождается свободный холестерин, который используется для синтеза желчных кислот, стероидных гормонов и нейтральных стероидов или секретируется в желчь. Активная экскреция в желчь является основным физиологическим способом выведения избытков холестерина у человека (рис. 15). В сутки у человека образуется 500-1000 мл желчи. При относительно постоянном дебите желчи из организма человека в норме выводится до 1 г продуктов метаболизма холестерина в сутки.
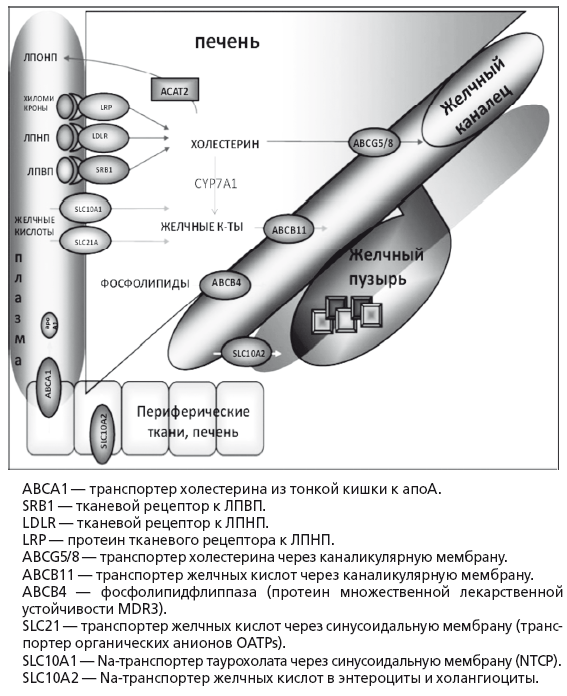
Рис. 15.
Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты, оставшаяся часть представляет собой нейтральные стероиды. Холестерин секретируется в желчь активно, в желчные канальцы его переносит специальный насос ABCG5/8 (25). Поскольку холестерин не растворим в воде, его удержание в жидкой фракции желчи прямо зависит от концентрации эмульгирующих его желчных кислот и эссенциальных фосфолипидов — преимущественно ФХ, который обеспечивает его растворимость путем образования мицелл. При недостатке желчных кислот образуются более крупные частицы — везикулы, состоящие из лецитина и холестерина. При недостатке ФХ происходит кристаллизация холестерина и образуется желчный камень. Дефицит ФХ в желчи возникает при низком поступлении эссенциальных фосфолипидов или основной функциональной части — незаменимых полиненасыщенных жирных кислот (ПНЖК) в рационе питания. Относительный дефицит эссенциальных фосфолипидов также создается при их высоком потреблении гепатоцитами или другими тканями организма в печени при хронических воспалительных заболеваниях или интоксикациях, в частности, при хронической алкогольной интоксикации. Секреция в желчь холестерина, желчных кислот и ФХ — это энерго- и взаимозависимый, сложный процесс, который может нарушаться при первичном токсическом и аутоиммунном поражении гепатоцитов и холангиоцитов, а также лекарственном или инфекционном холестазе. Увеличение содержания холестерина в желчи форсирует синтез и секрецию в желчь эссенциальных фосфолипидов и базовых желчных кислот, без которых в желчи невозможно поддержание холестерина в растворимой форме и последовательно приводит к увеличению содержания всех этих веществ в тонкой кишке, крови воротной вены и фекалиях.
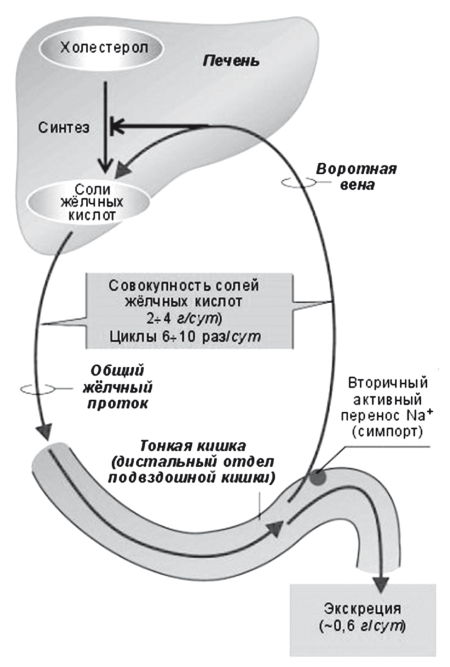
Рис. 16.
В процессе пассажа химуса по ЖКТ на всем протяжении кишечника всасывается до 90 % «съеденного» холестерина и реабсорбируется около 98 % желчных кислот и около 50 % холестерина, экскретированного с желчью. Оставшееся количество под действием микрофлоры толстой кишки превращается в стеролы, либо выводится с фекалиями, потому что связано с плохо растворимыми желчными кислотами (например, с литохолевой). Энтерогепатическая циркуляция желчных кислот протекает настолько эффективно, что суточная потеря желчных кислот с фекалиями составляет не более 500-1000 мг. Для восполнения потери первичные желчные кислоты — у человека холевая и хенодезоксихолевая кислоты — посредством фермента 7?-гидроксилазы (СУР7А1) постоянно синтезируются из холестерина в эндоплазматическом ретикулуме гепатоцитов, конъюгируются с глицином или таурином и активно секретируются в желчные канальцы (рис. 15). При помощи CYP7a в гепатоцитах из холестерина ежедневно синтезируются около 500 мг новых желчных кислот взамен тех, что были выведены с фекалиями (около 5 % общего пула). Этот метаболический путь является основным не только для синтеза желчных кислот, но и для утилизации избытков холестерина, поскольку приводит к утилизации около 80 % холестерина, циркулирующего в плазме (рис. 17).
Вторичные и третичные желчные кислоты: дезоксихолевая, литохолевая (около 1 % от общего пула желчных кислот) и урсодезоксихо-левая (< 3 % от общего пула желчных кислот) кислоты (УДХК) образуются из первичных желчных кислот под действием бактерий в толстой кишке и также частично реабсорбируются. Этот процесс тонко регулируется по механизму обратной связи — желчные кислоты синтезируются в гепатоците в точном соответствии с их потерей с фекалиями в энтерогепатической циркуляции. Интересно, что синтез желчных кислот более активно протекает в гепатоцитах III зоны печеночной дольки. Напротив, желчные кислоты, реабсорбируемые из кишечника и плазмы, концентрируются в гепатоцитах перипортальной зоны [36].
При увеличении потребности в синтезе нового холестерина в гепатоците активируется ген, кодирующий активность ключевого фермента ГМГ-КоА-редуктазы (рис. 17). Синтез первичных желчных кислот резко уменьшается. Это приводит к уменьшению секреции желчных кислот в желчь и снижению растворимости холестерина в желчи, притом что его концентрация в желчи увеличивается. В общем смысле этот механизм всегда сопутствует прогрессирующему атерогенезу, пожилому возрасту и терапии статинами. Таким образом, неудивительно, что у европейцев с сердечно-сосудистой патологией частота ЖКБ в 1,5 раза превышает среднюю во взрослой популяции, а в возрасте старше 71 года ЖКБ болеют около 14,3 % населения Европы и чаще — мужчины с ССЗ [36]. У представителей некоторых рас и этнических групп возможно также генетически детерминированное увеличение активности ГМГ-КоА-редуктазы: например, известна зависимость частоты ЖКБ от степени экспрессии американо-индейского гена. Накопление холестерина в гепатоцитах также может происходить при DOWN-регуляции CYP7a/
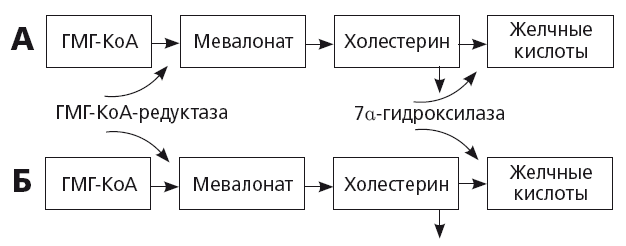
Рис. 17.
Установлено, что активность CYP7a увеличивается при уровне холестерина в рационе более 2 %, и происходит это посредством активации ядерных рецепторов LXR, регулирующих экспрессию гена, кодирующего активность этого фермента. Напротив, активная реабсорбция желчных кислот из кишечника тормозит CYP7a и синтез желчных кислот по механизму отрицательной обратной связи и приводит к накоплению холестерина в гепатоцитах. Цель этого тонкого механизма — защита гепатоцитов и холангиоцитов от избыточного накопления желчных кислот, обладающих токсичным детергентным действием.
На первый взгляд, это плохо и тоже должно увеличивать литогенность желчи вследствие снижения секреции желчных кислот. Однако in vivo так не происходит. Изучение молекулярных механизмов ауторегуляции синтеза желчных кислот недавно привело к более тонкому пониманию ключевого регулирующего влияния желчных кислот на метаболизм холестерина, триглицеридов и самих себя. В 1999 году две независимые группы исследователей: в Японии — Makishima М. и соавторы и в Великобритании — Parks D.J. и соавторы почти одновременно опубликовали результаты исследований, впервые показавших, что соли желчных кислот являются прямыми активаторами ядерных рецепторов FXRa (NR1H4), которые регулируют экспрессию генов, участвующих в секреции, транспорте и метаболизме первичных желчных кислот, холестерина и триглицеридов как в гепатоцитах, так и в плазме. Посредством активации FXR желчными кислотами, поступающими из энтерогепатической циркуляции, и происходит подавление синтеза новых желчных кислот в цитозоле гепатоцита (рис. 18).
Активация FXR предотвращает накопление ТГ и ЛПОНП в печени, висцеральной клетчатке и плазме. При этом в печени действительно накапливается холестерин, который в данный момент «не нужен» для синтеза желчных кислот. Однако одновременно стимуляция FXR активирует экскрецию не этерифицированного холестерина в желчь при помощи переносчика ABCG5/8 [60]. Стимуляция FXR также увеличивает скорость захвата желчных кислот из плазмы посредством переносчиков ОАТР (SLC21) и NTCP (SLC10A1) и активирует экскрецию солей желчных кислот в первичные желчные канальцы переносчиком BSEP (АВСВ11). Одновременно стимуляция FXR активирует переносчик MDR3, секретирующий в желчь ФХ.
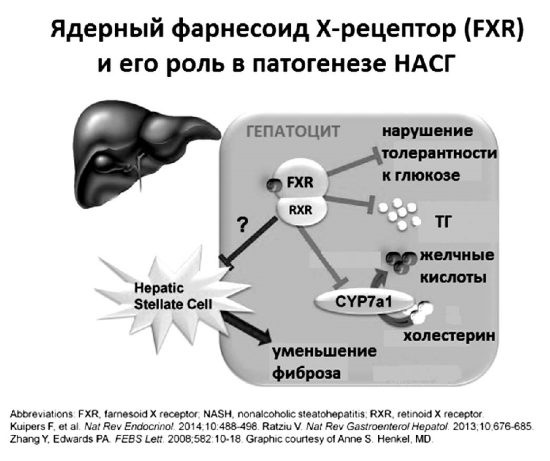
Рис. 18.
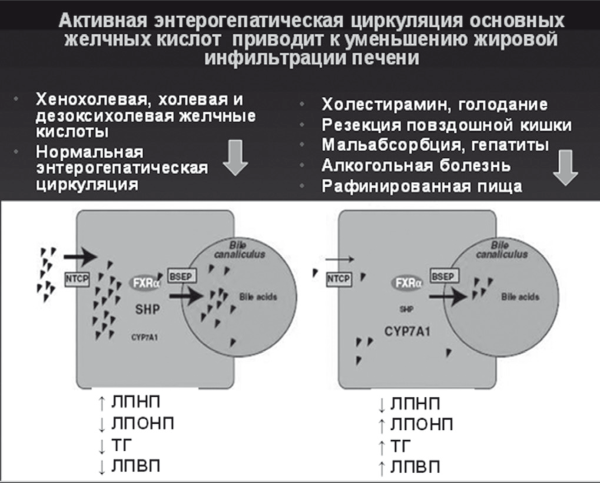
Рис. 19.
Интегрально-активная энтерогепатическая циркуляция обеспечивает включение многокомпонентного механизма защиты гепатоцитов от токсичности желчных кислот при одновременном уменьшении сатурации холестерина в желчи и снижении риска образования желчных камней [60]. Позднее было установлено, что эндогенные желчные кислоты также являются сигнальными молекулами для синергичных FXR рецепторов TGR5 к G-протеину, которые находятся в тонкой кишке и опосредуют секрецию инкретинов. Стимуляция TGR5 желчными кислотами активирует активность щитовидной железы и энергообмен посредством увеличения секреции глюкагонподобных пептидов, которые препятствуют инсулинорезистентности [61]. В эксперименте на мышах оказалось, что добавление холевой кислоты к высококалорийному рациону позволяет предотвратить ожирение и развитие инсулинорезистентности путем увеличения липолиза в бурой жировой клетчатке. Таким образом, высокая реабсорбция желчных кислот при активной физиологической энтерогепатической циркуляции — как это происходит после приема холегенной и богатой жирами пищи — приводит к уменьшению синтеза желчи и накоплению в гепатоците ЛПНП, при одновременном уменьшении содержания ТГ и ЛПВП. Напротив, уменьшение всасывания желчных кислот (например, при голодании, применении секвестрантов, диарее любого происхождения) является сигналом к увеличению синтеза желчных кислот, для чего гепатоцит активно накапливает ТГ, ЛПОНП и ЛПВП. Другими словами, сбалансированный рацион питания, содержащий пищевые жиры и холеретики, служит надежной профилактикой образования желчных камней и развития жировой инфильтрации печени с дислипидемией и инсулинорезистентностью [60, 61].






