Дифференциальная диагностика
Если у новорожденного отмечается персистирующая гипогликемия, необходимо установить причину данного состояния. Прежде всего, нужно провести тщательную оценку клинического состояния новорожденного. Необходимо помнить, что неонатальная гипогликемия может быть проявлением наследственных синдромов, которые далеко не всегда дают развернутую клиническую картину в неонатальный период. Это относится даже к хорошо известным заболеваниям. Например, синдром Беквита-Видемана. Масштабные исследования показывают [186], что этот синдром является очень гетерогенным как клинически, так и генетически. Встречается он с частотой 1 на 13700, но указывают, что вполне вероятно у части больных с не ярко выраженными клиническими проявлениями он вообще не диагностируется. У больных, кроме гипогликемии в неонатальный период, могут отмечаться макросомия, макроглоссия, спланхомегалия (включая печень, почки, надпочечники, поджелудочную железу), «эмбриональные опухоли» (опухоль Вильмса, нейробластома, рабдомиосаркома и др.), врожденные пороки развития (пупочная грыжа, почечные структурные аномалии, диастаз прямых мышц живота) и т. д.
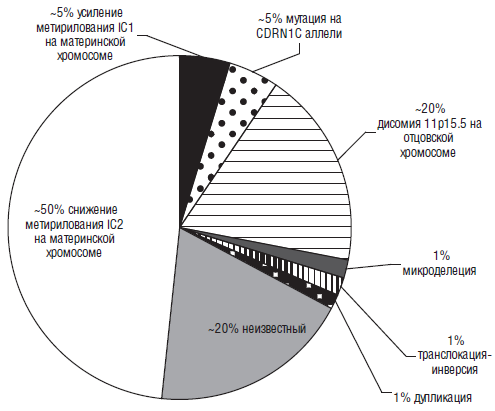
Рис. 9.
Но при рождении вся вышеперечисленная симптоматика встречается, повторимся еще раз, далеко не всегда. Например, макроглоссия и макросомия обычно присутствуют при рождении, но иногда начинают проявляться после рождения. Темпы роста начинают замедляться в возрасте около семи-восьми лет и т. д. Примерно 85 % больных с синдром Беквита-Видемана имеют спорадическую мутацию. 15 % детей имеют аутосомно-доминантный тип наследования, связанный с различными нарушениями на 11 хромосоме (11р 15.5). Наиболее часто выявляются следующие мутации (рис. 9). Интересно, что повышенный риск заболевания имеют дети, зачатые в результате методов вспомогательных репродуктивных технологий (ЭКО, ИКСИ).
И, на примере синдрома Беквита-Видемана, обратим внимание еще на один, возможно, один из важнейших аспектов неонатальной медицины: каждый ребенок, имеющий любое отклонение, даже самое незначительное, в неонатальный период как клинических, так и лабораторных показателей должен быть обследован в катамнезе. Он не должен исчезать из поля зрения врача, лучше того учреждения, где он родился или куда был переведен для лечения.
Детям с синдромом Беквита-Видемана рекомендуют [186] ежегодное ультразвуковое исследование почек до подросткового возраста для исключения нефрокальциноза, ультразвуковое исследования каждые три месяца органов брюшной полости для исключения опухолей, исследование концентрации альфа-фетопротепна каждые два-три месяца в течение первых четырех лет жизни с целью раннего выявления гепатобластомы и т. д. Представляется, что такие декретированные сроки и объем обследования должны быть определены для всех заболеваний, возникших в неонатальный период.
В последние десятилетия описано несколько форм семейного гиперинсулинизма, связанного с хромосомными и/или геномными мутациями [84, 94]. Сейчас этот термин заменил то, что раньше называлось «низидиобластоз», хотя и в настоящее время этот термин широко используется. Это название происходит от греческого «nesidion» — островок, «blastos» — зародышевые клетки, а также «osis» — опухоль. Этот термин подчеркивал, что при гистологическом исследовании имеется явное увеличение количества изолированных ?-клеток и дезорганизация островков Лангерганса. Многочисленные исследования и сопоставление с контрольными группами показали, что указанные изменения не являются специфичными для данного заболевания, что привело к замене термина «низидиобластоз» на новый — «гиперинсулинизм».
Семейный гиперинсулинизм нередкое заболевание. В настоящее время оно зарегистрировано среди всех этнических групп. В Европе его частота составляет 1 случай на 15000 населения, а в центральной Финляндии и в Саудовской Аравии почти в 7 раз чаще (1:2500).
Заболевание характеризуется гипогликемией, которая может начинаться в неонатальный период, а иногда и позже, например в детском возрасте, с достаточно скудной симптоматикой, а, соответственно, и обусловленной этим сложностью диагностики. У новорожденных, как правило, заболевание манифестирует в течение первых двух суток жизни и протекает от выраженных форм с развернутой клинической симптоматикой гипогликемии до бессимптомных форм, когда лабораторные находки (снижение концентрации глюкозы крови) заставляют начать обследование ребенка. Даже в пределах одной семьи у ближайших родственников течение заболевания может варьировать от легкой до тяжелой степени. Иногда клиника связана с формой мутации.
Больные с аутосомно-рецессивной формой семейного гиперинсулинизма, обозначаемой в зарубежной литературе как FHI-KATФ, вызванной мутациями в АВСС8 или KCNJ11 , как правило, рождаются крупными к сроку гестации, развивают тяжелую гипогликемию в первые 48 часов жизни, резистентную к медикаментозной терапии и требуют для достижения нормогликемии хирургического лечения (резекции поджелудочной железы).
Больные с аутосомно-доминатной формой семейного гиперинсулинизма, в англоязычной литературе обозначаемой как FHI-GCK, вызванной мутациями в GCK , чаще всего манифестируют в возрасте одного года (диапазон от 2 дней до 30 лет). Как правило, данная форма, чаще всего протекает мягче, чем аутосомно-рецессивная, хотя некоторые больные нуждаются в агрессивной терапии.
Форма, сочетающая семейный гиперинсулинизм с гипераммониемией, чаще всего, протекает с умеренной гипераммониемией и поздним началом гипогликемии, как правило, не в периоде новорожденности [33, 140].
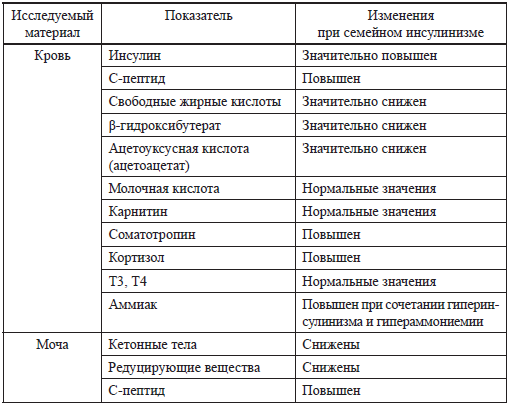
Таблица 9 Лабораторные тесты при семейном гиперинсулинизме (В. Glaser, 2010) [84]
Имеются и еще более редко встречающиеся формы гиперинсулинизма у новорожденных детей. У 40 % больных с семейным гиперинсулинизмом вообще, по крайней мере на сегодня, не удается идентифицировать мутации ни в одном из генов, связанных с развитием этого заболевания.
При всех формах гиперинсулинизма необходима консультация хирурга (после генетического и лучевого исследования) по поводу возможного оперативного лечения (необходимость тотальной или субтотальной резекции поджелудочной железы) и обследование на врожденные наследственные дефекты метаболизма (см. ниже).
В лабораторной диагностике, позволяющей подтвердить диагноз семейного гиперинсулинизма, имеют значение следующие тесты (табл. 9).
При гистологическом исследовании поджелудочной железы при семейном гиперинсулинизме выделяют два основных гистологических типа:
Диффузный — увеличение количества ?-клеток по всей поджелудочной железе. Встречается примерно у 60–70 % больных. При этом сохранена архитектура поджелудочной железы. В-клетки имеют большие ядра, выраженную цитоплазму и гистологические признаки повышенной метаболической активности.
Фокусная аденоматозная гиперплазия поджелудочной железы. Встречается примерно у 30–40 % больных с семейным гиперинсулинизмом. Отмечаются очаговые изменения в тканях поджелудочной железы, а остальные ткани железы являются функционально и гистологически нормальными. В отличие от опухолей (истинных аденом) макроскопически фокальные изменения не видны. В-клетки, вне очагов поражения, имеют маленькое ядро и цитоплазму, достаточно редко в них имеются гистологические признаки, свидетельствующие о том, что они функционально подавлены и не могут вырабатывать инсулин. Сканирование с помощью позитронно-эмиссионной томографии успешно используется для предоперационной локализации очаговых поражений [165, 152].
В настоящее время возможна пренатальная и предимплантационная генетическая диагностика для выявления заболевания у эмбриона или плода, но для этого необходима предварительная идентификация мутаций у родителей.
Дифференциальную диагностику семейного гиперинсулинизма необходимо проводить с рядом заболеваний, сопровождающихся гипогликемией.
Около 30 % детей с синдромом Беквита-Видемана имеют гиперин-сулинизм, приводящий к развитию гипогликемии, но она обычно течет менее злокачественно, по-сравнению с синдромом семейного инсулинизма, и поддается медикаментозной терапии.
Врожденные дефициты кортизола или гормона роста могут иметь в клинической картине эпизоды гипогликемии, но она также обычно хорошо реагирует на заместительную гормональную терапию. Гипогликемия у новорожденных может проявляться как один признаков адреногенитального синдрома (дефицит 21-гидроксилазы). При этом необходимо помнить, что гипогликемия может быть одним из ранних симптомов при неклассических формах адреногенитального синдрома (дефицит 21-гидроксилазы с поздним началом).
Инсулиномы. Эти опухоли чрезвычайно редко встречаются у детей до года. Некоторые авторы [178] рассматривают семейные инсулиномы, как сложные эндокринные неоплазии 1-го типа, но они также редко встречаются у младенцев. Инсулиномы резко отличаются гистологически от низидиобластоза. Они являются истинными аденомами и состоят только из ?-клеток.
Наследственные дефекты, связанные с нарушением продукции глюкозы. Эти заболевания, связанные с мутациями в генах, кодирующих ферменты, ответственные за продукцию или распад гликогена, в том числе гликогенсинтетазы (гликогеноз 0-го типа) или глюкоза-6-фосфатазы (гликогеноз 1-го типа). Оба эти заболевания проявляются гипогликемией, развивающейся натощак. У новорожденных детей клинические признаки развиваются в связи с поздним прикладыванием ребенка к груди или большими перерывами между кормлениями. Хотя клиническая картина очень вариабельна и во многом зависит от характера конкретной мутации.
Аналогично, мутации генов, кодирующих ферменты, участвующие в глюконеогенезе, также могут проявляться в клинической картине гипогликемией. Например, дефицит фруктоза— 1,6-дифосфатазы проявляется ацидозом и гипогликемией. Гипогликемия при указанном заболевании обычно менее выраженная, чем при гликогенозах и проявляется при голодании или интеркуррентных заболеваниях.
Дефекты метаболизма жирных кислот. В-окисление жирных кислот является важным источником энергии, особенно при голодании или острых патологических состояниях, например асфиксии новорожденных. Нарушения окисления жирных кислот, встречаются достаточно редко, но проявляются гипогликемией в неонатальный период [111, 135]. В процесс Р-окисления жирных кислот в митохондриях вовлекается целый каскад ферментов и коферментов (рис. 10). Нарушение этого процесса на любом уровне приводит к нарушениям усвоения жирных кислот, а, соответственно, к изменениям синтеза кетоновых тел. При возросшей потребности в кислороде, голодании, экстремальных состояниях окисление жирных кислот является основным субстратом энергии в мышцах, в том числе сердечной и гладкомышечных. Напротив, как мы уже отмечали, энергетические потребности нейронов, удовлетворяются прежде всего глюкозой и только при необходимости окислением кетоновых тел.
У больных с нарушением окисления жирных кислот имеются как гипогликемия, так и гипокетонемия, Они являются, таким образом, наиболее склонными к развитию «энергетического голодания» нейронов, а, соответственно, повреждению ЦНС. Конкретный биохимический механизм, приводящий при нарушениях окисления жирных кислот к гипогликемии не до конца ясен, но предполагают совместное влияние двух факторов:
• увеличенное потребление глюкозы тканями, прежде всего, мышечными, из-за отсутствия жирных кислот и кетонных тел, как альтернативных источников энергии, быстро исчерпывает запасы гликогена печени и нарушает глюконеогенез;
• глюконеогенез в печени нарушается не только из-за отсутствия источников энергии, но и из-за нарушения синтеза пируват карбоксилазы, первого фермента гликогенолиза, так как для его нормального синтеза необходим ацетил-КоА.
Клиническое течение большинства наследственных нарушений синтеза жирных кислот схоже. Необходимо предположить данные нарушения обмена тогда, когда у больного имеется гипогликемия, гипокетонемия и нормальное или сниженное содержание инсулина. Достаточно часто у больных имеются кардио— и/или миопатии. Заболевание может ярко манифестировать при голодании или остром заболевании, например ОРВИ и т. д.
Как правило, лабораторно диагноз может быть подтвержден при изменении концентрации карнитина или ацилкарнитина плазмы крови, а также анализом на содержание в моче органических кислот [125, 179].
Мутации в генах, кодирующих рецептор инсулина. О мутации в гене, кодирующем рецептор инсулина, ассоциированной с глубокой реактивной гипогликемией сообщили Hojlund К. et al. в 2004 году [107]. Ген картирован на 19р13.3-р13.2. Мутация приводит к увеличению клиренса инсулина и увеличению соотношения инсулпн/С-пептид. Исследований, описывающих клиническую манифестацию в периоде новорожденности, мы не встретили. Как правило, клинически данное заболевание проявляется у детей при введении прикормов.
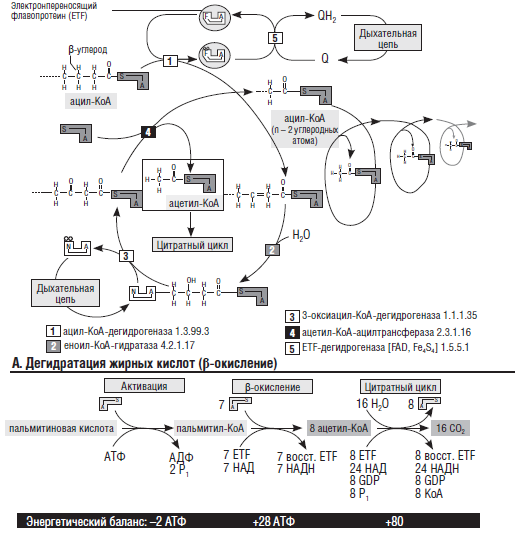
Рис. 10.
Имеются и более редкие мутации (например, мутации в гене, кодирующем транспортный белок 1 монокарбоксилазы и т. д.), приводящие к гиперинсулинизму и гипогликемии. Большинство из этих мутаций в настоящее время картированы, занесены в международные базы данных, представленные в сети Интернет. Соответственно, возможна, как пренатальная, так и постнатальная диагностика с достаточно четким выявлением прогноза, как для здоровья, так и для жизни ребенка. К сожалению, в нашей стране на сегодняшний день иногда затруднительно произвести необходимые генетические исследования, даже при подозрении на конкретное заболевание. Но, наш опыт показывает, что обращение к зарубежным коллегам, как правило, в конкретном случае помогает решить проблему. Конечно, необходимо развивать и совершенствовать диагностику генетических нарушений в нашей стране, но при этом необходимо помнить, что существуют заболевания, встречающиеся достаточно редко, и которыми занимаются не все центры даже в богатых западных странах. Экономически не выгодно. Поэтому, на наш взгляд, если мы можем (пусть теоретически) оказать помощь конкретной семье, конкретному ребенку в постановке диагноза, то необходимо обращение в эти центры.
В приложении 2, как клинический пример, мы приводим выписку из истории болезни новорожденного ребенка с гиперинсулинизмом, находившемся на лечении в нашем Центре в 2011 году.
В заключение заметим, что если у ребенка имелся длительный эпизод гипогликемии, то он не может быть выписан домой без обследования и постановки диагноза, а также без достижения нормогликемических показателей, сохраняющихся, по крайней мере, в течение 72 часов [180].
В приложении 1 приведены данные, опубликованные экспертами ВОЗ, касающиеся лечения и профилактики неонатальных гипогликемий.