Влияние гипогликемии на нервнопсихическое развитие
В настоящее время существуют определенные противоречия, касающиеся влияния гипогликемии, возникшей в неонатальный период, на возникновение отдаленных психоневрологических расстройств, особенно это касается «бессимптомной гипогликемии», то есть не имеющей выраженных клинических проявлений.
Уже в ранних работах [95] указывалось, что неврологические проблемы возникают у 35 % детей, имеющих клинические признаки, и у 20 % новорожденных с бессимптомной гипогликемией. Хотя другие исследователи как в 1960-1970-е гг. [88], так и позже не обнаружили таких закономерностей.
Koivisto М. с соавторами [124] ретроспективно обследовали 151 ребенка в возрасте 4 лет, перенесших неонатальную гипогликемию (которую определяли как снижение уровня глюкозы менее 1,67 ммоль/л). Группу контроля составили 56 детей, не имевших лабораторных или клинических признаков неонатальной гипогликемии. Оказалось, что 94 % из 66 детей, имевших бессимптомную гипогликемию, и 95 % из группы контроля к 4 годам имели нормальное неврологическое развитие. Среди 85 детей, имевших клинические признаки гипогликемии, ситуация была иной. У 50 % детей, развивших судорожный синдром, отмечены отдаленные неврологические расстройства. Если же судорог при гликемии не было, то нормальное развитие к 4 годам отмечено у 88 % пациентов. В заключение работы авторы отметили несущественное влияние бессимптомной гипогликемии на возникновении неврологических нарушений. Подобные выводы были сделаны также Singh М. с соавторами [45] после исследования, охватившего 107 детей, перенесших неонатальную гипогликемию.
Все эти наблюдения привели к тому, что в литературном обзоре, посвященном неонатальным гипогликемиям, Cornblath М. с соавторами [57] пришли к убеждению, что в настоящее время нет исследований, демонстрирующих «категорическую» связь между наличием гипогликемии и последующим нервно-психическим развитием. Авторы отмечают, что необходимы дальнейшие рандомизированные исследования на этот счет, и подчеркивают, что создание единой строгой классификации неонатальных гипогликемий, включающей бессимптомные и клинически значимые формы, крайне затруднительно.
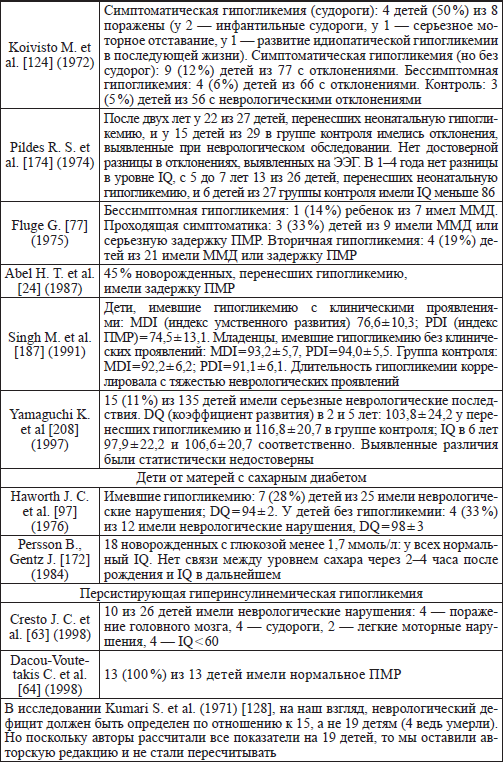
В июне 2006 года в журнале «Pediatrics» Boluyt N. с соавторами [43] из Нидерландов опубликовали обзорную работу, посвященную нервно-психическому развитию детей, перенесших неонатальную гипогликемию. Они проанализировали все опубликованные работы, посвященные данной проблеме с 1966 по 2006 гг. Из 5200 публикаций независимые эксперты согласно общепринятым критериям достоверности (наличию группы сравнения, долговременного катамнеза и т. д.) отобрали всего 18 работ, охвативших 1583 детей, перенесших гипогликемию в неонатальный период. Анализируя данные работы, авторы приходят к заключению, что некоторые исследователи не обнаружили никаких различий между детьми, перенесшими неонатальную гипогликемию и не перенесшими, некоторые обнаружили эти различия (табл. 10). Более того, неизвестна продолжительность гипогликемии, влияющей на нервнопсихическое развитие, а также ее глубина. В заключение авторы указывают, что анализ данных работ не позволяет сделать каких-либо определенных клинических рекомендаций и необходимы дальнейшие масштабные исследования на эту тему. Опять, казалось бы, такой простой вопрос, но как непросто он решается.
В 2008 году на страницах американского журнала «Pediatrics» разгорелась дискуссия, связанная с обсуждаемой нами проблемой. Она началась с публикации Burns С. М. с соавторами [48], обследовавших 35 доношенных новорожденных детей, перенесших гипогликемию (средняя концентрация глюкозы менее 1 ммоль/л) в неонатальный период. Ни один из детей не перенес гипоксии. Всем проводилось МРТ. Группа контроля составила 229 детей. Срок «катамнеза» составил 18 месяцев. У 94 % детей, перенесших гипогликемию, имелись признаки поражения головного мозга по данным МРТ, при этом у 43 % — значительные. Кортикальные поражения отмечены у 51 % новорожденных, 30 % детей имели кровоизлияние в белое вещество, у 40 % — поражены базальные ганглии и/или таламус. У троих детей обнаружен инфаркт в бассейне средней мозговой артерии.
Таблица 10 Влияние неонатальной гипогликемии на нервно-психическое развитие (суммарные литературные данные) (Boluyt N. et al., 2006, с изменениями)
У 65 % детей сохранялись выраженные нарушения в возрасте 18 месяцев. Авторы приходят к выводу, что полное обследование, в том числе МРТ должно быть проведено у всех детей, перенесших неонатальную гипогликемию, в том числе и бессимптомную. В последующем были опубликованы комментарии [114] к данному исследованию в целом поддержавшие позиции Burns С. М. Более того, даже заключившие «…экспериментальные и клинические данные подтверждают, что гипогликемия (уровень глюкозы крови менее 45 мг%) изолированная или в сочетании со средней тяжести гипоксией, вредна для мозга новорожденного…». Но в одном из комментариев Hey W. W. et al. [106] подчеркивают, что, с одной стороны, данное утверждение не подтверждено ни клиническими, ни экспериментальными данными, а с другой стороны, научная литература и клинический опыт подтверждают, что подавляющее большинство здоровых детей не имеют каких-либо неврологических нарушений, несмотря на часто встречающиеся низкие концентрации глюкозы крови. Они предупреждают, что такие необоснованные заявления могут привести к не нужным инвазивным вмешательствам, включая забор крови, отделение ребенка от матери, внутривенное вливание декстрозы, отлучение ребенка от груди, беспокойство родителей и другие осложнения гипердиагностики и избыточного лечения. Кроме того, это может приводить к необоснованным судебным искам.
Индийские педиатры [200], обследовав в 2009 году 100 трехлетних детей, болеющих эпилепсией, установили, что 23 % из них в неонатальном периоде перенесли тяжелую гипогликемию.
В 2011 году Nadeem М. с соавторами [156] опубликовали данные, проведенного ими исследования, касающегося нервнопсихического развития детей в возрасте двух лет, перенесших при рождении интранатальную гипоксию и нарушения обмена глюкозы в неонатальный период. Нарушения обмена глюкозы выявлены у 16,2 % детей. Примерно поровну отмечена гипогликемия и гипергликемия: 51,3 % и 48,7 % соответственно. У 28,2 % детей гипогликемия и у 32,4 % детей гипергликемия зарегистрированы в течение первых 30 минут жизни. Более того, гипогликемия, как правило, сохранялась в течение 72 часов. Авторы показали, что перенесенная ранняя гипогликемия (в первые 6 часов жизни) была статистически незначимо связана с неблагоприятным исходом постгипоксической энцефалопатии в возрасте 24 месяцев жизни. Поздно возникающая гипогликемия и гипергликемия в любом возрасте, согласно данным указанных авторов, не связаны с тяжестью гипоксически-ишемической энцефалопатии.
Несмотря на недостаточность клинических доказательств того, что гипогликемия приводит к неврологическим нарушениям, экспериментальных работ, указывающих, что выраженная п/пли длительная гипогликемия коррелирует с неврологическими повреждениями, достаточно много. Например, в литературном обзоре Auer R. N. и Siesjo В. [30] указывается, что кора головного мозга, гиппокамп и хвостатое ядро — те области, на которые преимущественно влияет экспериментальная гипогликемия. Эти авторы указывают на специфичность поражения при этом процессе, так как при ишемии мозга повреждение будет локализоваться в других областях. С помощью электронной микроскопии доказано, что поражение нейронов — результат не просто метаболического истощения, но активного повреждения.
Конечно, у конкретного ребенка, особенно с бессимптомной гипогликемией, достаточно сложно с большой уверенностью утверждать о повреждении мозга, тем более что установлены компенсаторные механизмы, препятствующие развитию повреждений ткани ЦНС. Считают, что, прежде всего, к этим механизмам относится использование альтернативных субстратов энергии.
Hernandez М. J. с соавторами [103] еще в 1980 продемонстрировали, что при экспериментальной гипогликемии у новорожденных собак утилизация лактата тканями ЦНС увеличилась на 50 %. Исследования Amiel S. А. [26] показали, что, как и у взрослых, при гипогликемической коме нейроны головного мозга новорожденных в повышенном количестве потребляют лактат. Интересно, что при некоторых вариантах гипогликемии развившийся лактат-ацидоз является протективным для нейронов. По крайней мере, такой факт доказан для I типа гликогеновой болезни (дефицит глюкозо-6-фосфатазы) [76].
Имеется также достаточно большое количество исследований [72, 129, 157], продемонстрировавших, что мозг новорожденного лучше, чем мозг взрослого (достаточно быстро и в большом количестве) может усваивать кетоновые тела. Кетоновые тела могут обеспечивать до 10 % энергетических потребностей мозга новорожденного. Некоторые исследователи даже считают, что, в отличие от взрослых, именно кетоновые тела и, прежде всего, гидроксибутират, а не лактат, являются для нейронов новорожденного ребенка основным альтернативным источником энергии. Например, продемонстрировано, что при голодании уже в первые сутки жизни организм доношенного новорожденного увеличивает образование кетоновых тел до 17 нмоль/кг-мин.
Такое значительное образование кетоновых тел возможно у взрослых после длительного периода голодания. Обнаружена высокая корреляция между уровнем кетоновых тел и концентрацией свободных жирных кислот у младенцев. Kalhan S. С. с соавторами [119] указывают, что при гиперинсулинизме нейроны ЦНС новорожденного увеличивают утилизацию жирных кислот на 50 %. Таким образом, данные литературы позволяют сделать вывод о том, что организм новорожденного ребенка при недостатке глюкозы может мобилизовать жирные кислоты, а также формировать и утилизировать кетоновые тела. Возможно, что при гипогликемии задействованы и другие механизмы. Например, в ряде работ [172, 101] доказано, что нейроны ЦНС новорожденных щенков могут окислять аминокислоты и лактат. Вышесказанное хорошо подтверждают результаты исследования английских авторов [59], проведенного в Непале (табл. 11).
Таблица 11
Метаболический статус у новорожденных в первые 48 часов жизни
(de L Costello М. A. et al., 2000) [59].
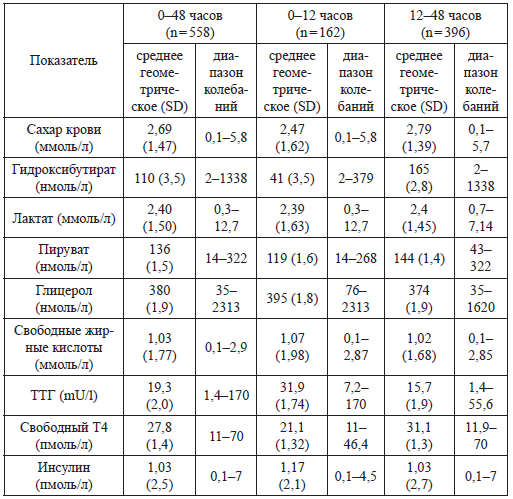
Из таблицы 11 видно, что у новорожденных детей в первые 48 часов жизни достаточно высоки концентрации альтернативных источников энергии. Кроме того, в этом диапазоне происходит их смена: снижается концентрация лактата, но зато увеличивается пируват.
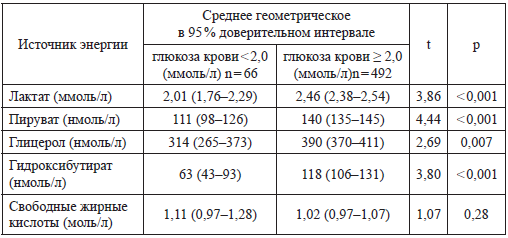
Абсолютно другие лабораторные показатели отмечаются при низкой концентрации глюкозы (табл. 12). Все альтернативные источники энергии (лактат, пируват и т. д.), кроме свободных жирных кислот низки. Вероятно, они интенсивно потребляются.
К защитным механизмам при гипогликемиях также относят увеличение объемной скорости мозгового кровотока. Особенно значительно она увеличивается у недоношенных новорожденных детей при концентрации глюкозы менее 1,7 ммоль/л [188].
Таблица 12
Метаболический статус у новорожденных с гипогликемиями
(de L Costello М. A. et al. 2000) [59].