Терапия
Не смотря на более чем 25-летнее использование инсулина в неонатальной практике для коррекции гипергликемии, в большинстве центров первым решением врача при выявлении повышенной концентрации глюкозы в плазме крови у новорожденных является снижении скорости или концентрации инфузируемой глюкозы (декстрозы) [139].
В доступной литературе имеются указания на различные концентрации глюкозы, требующие назначения инсулина. Наверное, здесь необходимо коснуться данного вопроса более подробно, поскольку с данным препаратом связывались определенные надежды в практике интенсивной терапии. Дело в том, что в последнее десятилетие многие научные исследования были связаны с попытками разработки стратегий, позволяющих предотвращать или купировать развитие полиорганной недостаточности, в том числе при тяжелом сепсисе и септическом шоке. Одна из этих стратегий — так называемая интенсивная терапия инсулином. К сожалению, большинство из них не показало положительных результатов. Что касается стратегии, связанной с лечением инсулином, на наш взгляд, она тоже уходит в прошлое, но об этом судить читателю, приведу только факты.
До 2001 года гипергликемию у больных, находящихся в критическом состоянии, рассматривали как компенсаторную реакцию, связанную с усиленным поступлением глюкозы в инсулиннезависимые ткани, и прежде всего ЦНС. Кроме того, умеренная гипергликемия рассматривалась как буфер против гипогликемии, повреждающей нейроны. В 2001 году появилось большое, рандомизированное, знаменитое исследование Van den Berghe G. с соавторами [41], показавших, что предотвращение даже умеренной гипергликемии во время развития критического состояния существенно улучшает результат. Кроме снижения летальности в 2 раза у больных в ОРИТ интенсивная терапия инсулином даже незначительной гипергликемии, по результатам многочисленных исследований [40, 46, 126, 147, 151, 201, 206], снижала частоту тяжелых госпитальных инфекций, ОПН, дисфункции печени и т. д.
Приведем более подробно результаты только одного исследования, выполненного коллективом исследователей под руководством Van den Berghe G. [41]. Они показали, что в хирургических отделениях интенсивной терапии применение инсулина снижает летальность в 2 раза (рис. 11).
Особенно существенно снижается летальность при сепсисе. Кроме того, внутрибольничная летальность снижается на 34 %, частота ОПН, требующая проведения гемодиализа или гемофильтрации — на 41 %, частота переливания эритромассы — на 50 %. Исследование было проспективным, рандомизированным и включало 1548 больных.
Чтобы не утомлять читателя (а при желании найти работы на эту тему не составляет труда), мы не будем приводить других данных. Укажем только на то, что за 6–7 лет были уточнены и открыты многочисленные эффекты инсулина (некоторые из них мы описали выше): нейропротективный, анаболический, антивоспалительный, устранение дислипопротеинемии, предотвращение эндотелиальной дисфункции и гиперкоагуляции, антиапоптический и т. д. Казалось, что в результате всех этих исследований родилась новая стратегия, которая позволит, регулируя метаболизм у больных, находящихся в критическом состоянии, снизить летальность прежде всего за счет профилактики развития ПОН. Но…
В 2006 году указанные авторы [41] провели еще одно проспективное, рандомизированное исследование, включившее более 1600 больных с гипергликемией, находящихся в ОРИТ. Было выделено две группы больных: первая — использование инсулина начиналось при концентрации глюкозы крови равной 4,4–6,1 ммоль/л («группа интенсивной инсулинотерапии»); вторая — использование инсулина начиналось при концентрации глюкозы крови более 12 ммоль/л. Оказалось, что «интенсивная инсулинотерапия» приводит к нормогликемии, уменьшает длительность ИВЛ, пребывание больного в ОРИТ и в стационаре, частоту ОПН, но никак не влияет на летальность. Так, внутрибольничная летальность была 37,7 % во второй группе и 40,0 %) — в первой.
Таким образом, указанные авторы в двух полностью сравнимых по дизайну исследованиях получили достаточно противоречивые результаты. Конечно, публикация данных 2006 года говорит об их высокой научной честности и мужестве, но служит еще одним предупреждением о необходимости многократной проверки новых методов лечения. Ярким примером этого положения является еще одна значительная работа, касающаяся данного вопроса.
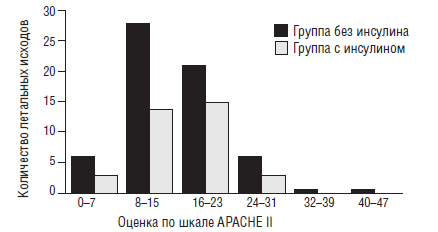
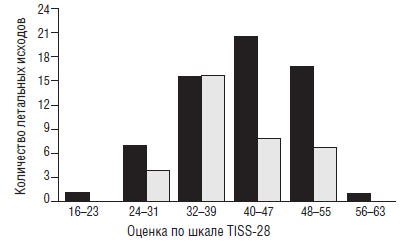
Рис. 11.
В 2008 году были опубликованы результаты исследования Brunk-horst F. М. с соавторами [46], по применению инсулина у больных с гипергликемией в структуре сепсиса. Исследование было многоцентровым, «двойным слепым», рандомизированным, включало 537 больных. Оказалось, что хоть применение инсулина и приводит к нормогликемии, но не влияет на летальность и частоту развития синдрома полиорганной недостаточности. Более того, применение «интенсивной терапии инсулином» приводит к длительному пребыванию больных в ОРИТ, что привело к необходимости досрочного прерывания исследования. С другой стороны, применение инсулина более чем в 4 раза учащает развитие тяжелой гипогликемии. Именно с эффектами гипогликемии (ухудшением функции ЦНС и сердца) авторы связывают увеличение длительности пребывания больных в ОРИТ. Они также указывают, что заранее спрогнозировать развитие гипогликемии у конкретного больного невозможно. Может быть, развитие гипогликемии является маркером тяжелого течения основного заболевания, а не только результатом инсулинотерапип. Интересно, что кроме оценки терапии инсулином, авторы сравнили влияние низкомолекулярного раствора гидроксиэтилкрахмала и раствора Рингера. Оказалось, что терапия гидроксиэтилкрахмалом достоверно чаще вызывала развитие ОПН и необходимость замещения почечных функций. С увеличением количества доз токсичность гидроксиэтилкрахмала увеличивается (рис. 12), то есть у него отмечается явно выраженный кумулятивный эффект.
Нам представляется, что эти данные должны иметь для российских врачей определенный интерес, поскольку ГЭК широко представлен в наших стационарах, а вот, к сожалению, крупных и тщательно спланированных исследований в нашей стране по изучению их влияния проведено явно недостаточно.
Мы не призываем врачей не применять данную группу препаратов, но данные Brunkhorst F. М. с соавторами [46] диктуют необходимость определиться, когда, где, у кого и как долго, и не на основе «личного мнения» пусть даже авторитетных врачей в России и за рубежом, а на основе тщательно спланированных научных исследований.
Что касается новорожденных, то установлено, что назначение инсулина детям, родившимся с ЭНМТ и имевшим гипергликемию, приводит к нормализации уровней глюкозы крови, а также улучшению прибавок веса. Нет корректных исследований, позволяющих сделать такие же выводы, касающиеся детей с массой тела более 1000 г и нет работ по «интенсивной терапии инсулином» у новорожденных детей в настоящее время. Данные большинства исследований (доступных нам), посвященных применению инсулина у новорожденных детей представлены в таблице 15.
Последнее большое исследование, посвященное применению инсулина у глубоконедоношенных детей и доступное нам, было закончено в 2008 году Beardsall К et al. [38]. Это результаты большого рандомизированного многоцентрового (центры новорожденных в Англии, Бельгии, Голландии, Испании) исследования, включившего 389 недоношенных детей. Терапия инсулином была начата у 69 новорожденных в течение первой недели жизни, если концентрация глюкозы была более 10 ммоль/л (180 мг%), еще 125 детей стали получать инсулин позже. Инсулин вводился в дозе
0,05 ЕД/кг/час с дополнительной 20 % декстрозой для поддержания нормогликемии (целевые значения равны 4–8 ммоль/л). Если у детей сохранялась гипергликемия, то уменьшали концентрацию декстрозы или вводили дополнительное количество инсулина. У всех детей, включенных в исследование, проводился непрерывный мониторинг глюкозы с помощью внутрикожного электрода. Гипергликемию определяли, как содержание глюкозы более 10 ммоль/л, гипогликемию — менее 2,6 ммоль/л.
Основным результатом при раннем назначении инсулина, по идеи авторов работы, был эффект терапии на смертность новорожденных. Также учитывались длительность пребывания детей на отделении интенсивной терапии, заболеваемость сепсисом в первые две недели жизни, рост, вес в 28 дней жизни, заболеваемость язвенно-нектротическим энтероколитом (ЯНЭК), ретинопатией недоношенных, частоту ВЖК.
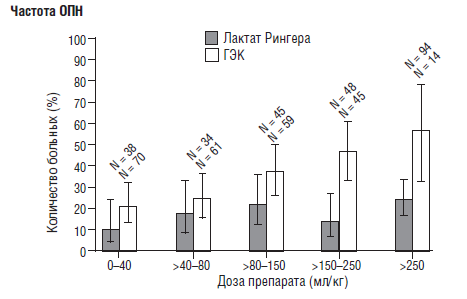
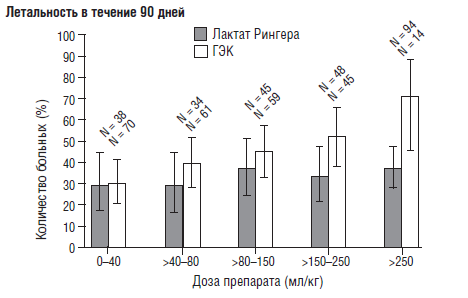
Рис. 12.
Результаты исследования показали, что дети, получавшие инсулин, имели более низкие уровни глюкозы по сравнению с контрольной группой: 6,2±1,4 ммоль/л (112±25,2 мг%) и 6,7±2,2 ммоль/л (121 ±39,6 мг%) соответственно. У большего количества детей в группе новорожденных, получавших инсулин, отмечены эпизоды гипогликемии (29 % против 17 % в контрольной группе). При этом количество детей, у которых развилась гипергликемия, было больше в контрольной группе (33 % и 21 % соответственно).
Таблица 15 Сводные литературные данные и основные результаты применения инсулина у новорожденных детей
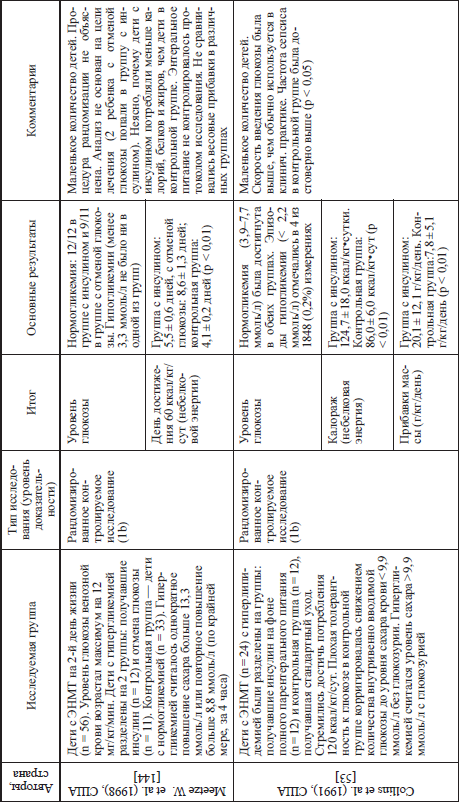
В течение раннего неонатального периода значительно больше углеводов внутривенно получили дети, находившиеся на инсулинотерапии, по сравнению с контрольной группой (51 ± 13 ккал/кг и 43 ± 10 ккал/кг соответственно). По дотации белка или жировых эмульсий дети обеих групп не отличались. Группы также не отличались по весу и заболеваемости на 28-й день жизни, но… летальность в группе детей, получавших инсулин, на 28-й день составила 14 %, а в группе контроля — 9 %, после 28 суток летальность составила 11,9 % и 5,7 % соответственно. Исследование было остановлено. Были повторно проанализированы истории болезни и протоколы ультразвукового исследования головного мозга. У детей, получавших инсулин, выявились как паренхиматозные, так и перевентрикулярные изменения головного мозга. Например, перевентрикулярная лейкомаляция была выявлена у 8 детей (5,5 %) из 146, получивших инсулин, по сравнению с 1 (0,7 %) ребенком из 151 контрольной группы.
В заключение авторы работы указывают, что результаты исследования показывают, что тактика раннего применения инсулина имеет отрицательные результаты. Однако оно показало важность непрерывного мониторирования глюкозы у глубоконедоношенных детей. Возможно, в будущем, долгосрочные результаты нервнопсихического развития детей, родившихся глубоконедоношенными, позволят выяснить роль инсулиноподобного фактора роста 1, его значение для развития тканей ЦНС и риска развития ретинопатии. Тем более, заметим от себя, что такие работы уже имеются и частично их проводила все та же группа исследователей [37].
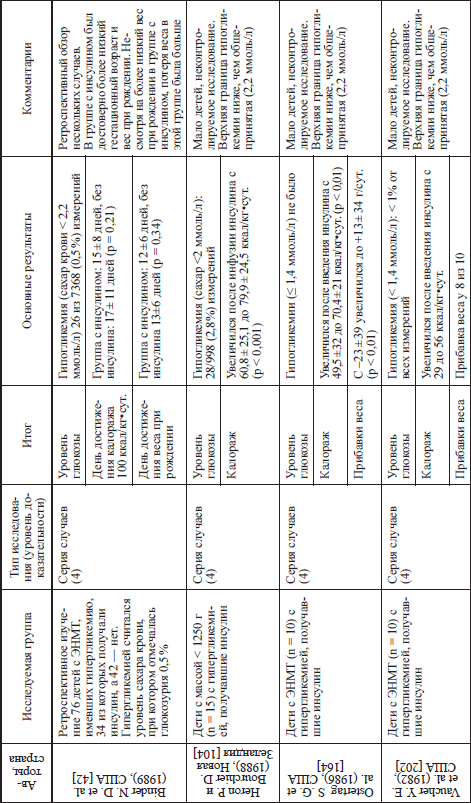
Когда все же необходимо назначать инсулин при гипергликемии новорожденных? В большинстве зарубежных руководств присутствуют указания на концентрацию глюкозы более 12–13 ммоль/л. Имеются рекомендации и их достаточно много [38], что инсулин должен назначаться при концентрации глюкозы более 10 ммоль/л.
Hey Е. [106] считает, что у глубоконедоношенных детей концентрация глюкозы крови, требующая коррекции инсулином, 15 ммоль/л, потому что именно при такой концентрации в крови концентрация в моче глюкозы составляет 2 %. Это приводит к «осмотическому» диурезу и дегидратации. При указанном уровне глюкозы, после уменьшения скорости введения и концентрации вводимой глюкозы, назначается инсулин в дозе с 0,05-0,1 ЕД/кг-час с увеличением при необходимости. Необходимо помнить о том, что назначение инсулина требует мониторирования (лучше постоянно с помощью внутрикожных датчиков) уровня глюкозы крови. При отсутствии возможности постоянного мониторирования концентрации глюкозы, первый анализ должен быть произведен не более чем через 30–40 минут после начала введения инсулина.
NB! Подчеркнем, что поскольку инсулин далеко не безобидный препарат, то лучше не доводить больного до состояния гипергликемии, что, к сожалению, нередко случается в повседневной практике, а для этого необходимо тщательно рассчитывать углеводные нагрузки, получаемые ребенком.
В заключение указываем калорийность и осмолярность различных растворов глюкозы:
1 мл 5 % р-ра глюкозы=0,17 ккал, 278 мосм/л;
1 мл 10 % р-ра глюкозы=0,34 ккал, 523 мосм/л;
1 мл 15 %) р-ра глюкозы=0,51 ккал, 801 мосм/л;
1 мл 20 % р-ра глюкозы=0,68 ккал, 1079 мосм/л;
1 мл 40 %) р-ра глюкозы = 1,36 ккал, 2158 мосм/л.