Глава 1
Особенности обмена глюкозы у новорожденных
Хорошо известно, что у плода примерно 50 % всей энергетической потребности организма обеспечивает глюкоза. Еще половину — аминокислоты и лактат. Глюкоза трансплацентарно попадает к плоду по градиенту концентрации, поэтому уровень глюкозы в плазме крови плода в норме составляет примерно 70–80 % от концентрации глюкозы в плазме матери (беременной женщины).
Потребление глюкозы плодом достаточно высокое и составляет приблизительно 7 г на 1 кг веса в сутки, или 5 мг/кг в минуту. Интересно, что указанная величина примерно равна эндогенному образованию глюкозы после рождения. Установлено, что ферментативные системы, участвующие в глюконеогенезе и гликогенолизе, имеются в печени плода, по крайней мере, в III триместре беременности [65,180], но остаются в эмбриональный период неактивными, если не оказывают действие дополнительные факторы, например, голодание матери. Хотя печень плода содержит в 3 раза больше гликогена, чем печень взрослого человека, при рождении печеночный гликоген составляет всего около 1 % общих запасов энергии. Таким образом, плод практически целиком зависит от уровня глюкозы в крови матери, так как сам активно ее образовывать не может.
Если же потребности тканей плода не могут быть обеспечены из-за гипогликемии у матери или плацентарной недостаточности, то плод может использовать альтернативные источники энергии, такие как кетоновые тела, полученные при окислении жирных кислот.
При длительно сохраняющемся низком поступлении глюкозы ткани плода начинают продукцию глюкозы, сначала путем гликогенолиза, а затем и глюконеогенеза. Кроме того, происходят комплексные изменения в метаболизме глюкозы, влияющие на рост и развития плода и имеющие непредсказуемые метаболические изменения в последующем [98, 205].
Инсулин не проходит трансплацентарно, и поэтому его уровень у плода не зависит от уровня у матери. ?-клетки поджелудочной железы плода только в последний триместр беременности становятся чувствительными к концентрации глюкозы. Именно в этот момент они заметно увеличиваются в объеме.
Другая ситуация возникает при низком поступлении глюкозы к плоду. Повышается чувствительность тканей к инсулину и усиленное поступление глюкозы внутрь клеток. Продолжающийся дефицит глюкозы приводит к нарушению функций ?-клеток поджелудочной железы и снижению выработки ими инсулина. Кроме того, на этом фоне возникает блокирование «проксимального» сигнала инсулина в печени, приводящего к повышению активности фосфоэнолпируват карбоксиназы (фермента глюконеогенеза) и повышению синтеза глюкозы, а соответственно возникновению гипергликемии [68, 132, 133].
Таблица 1 Метаболические эффекты инсулина
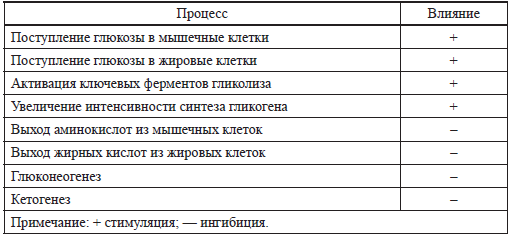
При этом необходимо учитывать, что длительная гипергликемия, подобно тому как это происходит при гестационно зависимом сахарном диабете у женщин, может вызвать как снижение синтеза инсулина, так и снижение чувствительности тканей к нему [50]. Вышеперечисленное, отчасти объясняет склонность детей с задержкой внутриутробного развития (ЗВУР), как к гипо-, так и гипергликемиям.
Как известно, инсулин стимулирует поступление глюкозы в мышечные и жировые клетки (табл. 1), особенно в последний триместр беременности, создавая запасы энергии к рождению ребенка.
В настоящее время хорошо известно, что кроме метаболических эффектов, инсулин обладает множеством других (рис. 2). Он вызывает пролиферацию клеток, обладает антиапоптическим, антилиполитическим, анти-катаболическим (подавляет гидролиз белков, уменьшает липолиз и т. д.), анаболическим (усиливает поглощение клетками аминокислот, стимулирует поступление в клетки ионов калия, магния и фосфатов, увеличивает репликацию ДНК и биосинтез белка) эффектами и т. д.
Инсулин вырабатывается ?-клетками островков Лангерганса поджелудочной железы. При максимальной стимуляции в минуту может вырабатываться 1,3 х 106 молекул инсулина. Молекула инсулина образована двумя полипептидными цепями, содержащими 51 аминокислотный остаток: A-цепь состоит из 21 аминокислотного остатка, В-цепь образована 30 аминокислотными остатками. Полипептидные цепи соединяются двумя дисульфидными мостиками через остатки цистеина, третья дисульфидная связь расположена в A-цепи (рис. 3).
Синтез инсулина проходит в несколько этапов. На первом этапе в рибосомах шероховатой эндоплазматической сети синтезируется молекула препроинсулина (рис. 4), состоящая из 110 аминокислотных остатков и включающая в себя, расположенные последовательно: L-пептид (сигнальный пептид), В-пептид (В цепь), С-пептид и А-пептид (А цепь).
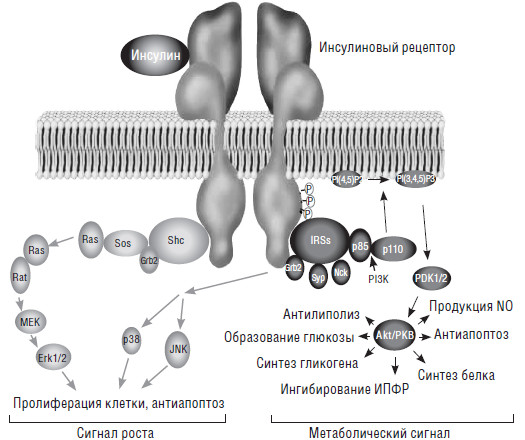
Рис. 2.
Как и другие гормоны, свое действие инсулин осуществляет через белок-рецептор. Инсулиновый рецептор представляет собой сложный белок клеточной мембраны, состоящий из двух субъединиц, каждая из которых образована двумя полипептидными цепочками. Связывание инсулина с внеклеточной областью инсулинового рецептора вызывает конформационные изменения, приводящие к автофосфорилированию рецептора и тирозинсвязанных внутриклеточных белковых молекул. Имеются два основных каскада. Один из сигнальных путей (слева), ведущий к каскадной активации Grb2/Sos, приводящей к пролиферации клетки и замедлению апоптоза. Из-за их митогенного эффекта это действие инсулина может быть охарактеризовано, как эффект «фактора роста». Второй путь (справа), активация киназ (р85/р110) так называемым «путем протеинкиназы В». Этот путь условно называется метаболическим
В последующем, практически сразу же после синтеза в эндоплазматической сети, от молекулы препроинсулина отщепляется L-пептнд (сигнальный), состоящий из 24 аминокислот. Считают, что расщепление молекулы и деградация сигнального пептида необходимы для прохождения молекулы проинсулина через липидную мембрану эндоплазматической сети. Далее проинсулин транспортируется в комплекс Гольджи, в цистернах которого происходит «созревание» инсулина. Под «созреванием» понимают комплекс последовательных реакций, в результате которых от молекулы проинсулина отщепляется С-пептид, состоящий из 31 аминокислоты и соединяющий В-цепь и A-цепь. Образуется молекула инсулина, как мы уже отмечали, состоящая из двух цепей, соединенных дисульфидными связями (рис. 3). Инсулин и С-пептид хранятся в зрелых секреторных гранулах и выделяются в эквимолярных количествах [190].
Рис. 3.
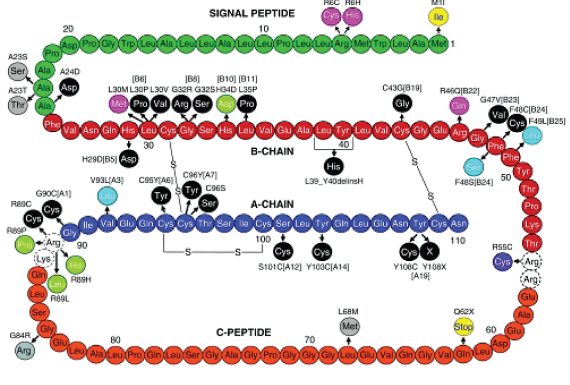
Рис. 4.
Обратим внимание читателя, что хотя инсулин и С-пептид выделяются в эквимолярных количествах, но их концентрации в крови тесно коррелируют, но не совпадают. Время полураспада С-пептида (около 20 минут) в крови длиннее, чем у инсулина (около 4 минут). Соответственно соотношение С-пептид/инсулин составляет 5:1. Аномально низкие уровни С-пептида могут свидетельствовать о снижении выработки инсулина, излишне высокие — говорить о возможном наличии инсулиномы, что необходимо учитывать при трактовке лабораторных показателей.
По мнению большинства исследователей, концентрация С-пептида в плазме крови является более стабильным индикатором секреции инсулина, чем быстро меняющийся уровень самого инсулина. Еще одно преимущество определения С-пептида состоит в том, что он позволяет отличить эндогенный инсулин от инсулина, введенного в экзогенно, потому что в отличие от инсулина, С-пептид не вступает в перекрестную реакцию с антителами к инсулину. Учитывая, что лечебные препараты инсулина не содержат С-пептид, его определение в сыворотке крови позволяет оценивать функцию ?-клеток поджелудочной железы у больных сахарным диабетом, получающих инсулин.
Мониторинг содержания С-пептида особенно важен у больных после оперативного лечения инсулиномы, обнаружение повышенного содержания С-пептида в крови указывает на метастазы или рецидив опухоли.
При патологии печени и почек соотношение концентраций С-пептида и инсулина в крови может изменяться, что необходимо учитывать при трактовке лабораторных показателей.
Упоминая об инсулине невозможно не вспомнить о нашем великом соотечественнике Леониде Васильевиче Соболеве (рис. 5).
Позволим себе две цитаты. Одна из книги выдающегося немецкого эндокринолога П. Транделенбурга «Гормоны» опубликованной в 1930 году, а в 1932 году переведенной на русский язык [16]: «Его [Соболева Л. В.] замечательные практические предложения по получению вещества из островкового аппарата поджелудочной железы остались незамеченными, причем лабораторная техника и методы химических исследований были еще недостаточно развиты для их осуществления». Вторая цитата из работы Д. М. Российского [11]: «На основании работы Л. В. Соболева можно сказать, что честь открытия инсулина должна быть приписана и русскому ученому Л. В. Соболеву, работа которого дала основные данные для дальнейшей разработки этого вопроса и выводы которого, спустя четверть века, так блестяще подтвердились дальнейшими исследованиями Бантинга и Беста».

Рис. 5.
В другой своей работе [12] Д. М. Российский еще более категоричен: «Среди многочисленных и ценных научных исследований наших ученых по изучению роли и функции поджелудочной железы мы должны всегда помнить огромные заслуги нашего выдающегося соотечественника — Леонида Васильевича Соболева, установившего за нашей родиной приоритет в открытии инсулина и давшего основные установки для понимания сущности и правильного лечения такого тяжелого заболевания, каким является сахарный диабет». Мы не будем подробно останавливаться на описании жизни и научной деятельности Л. В. Соболева. Отошлем заинтересованного читателя к блестящей статье Л. А. Сорокиной [13], вышедшей в 2010 году. Единственное, что хотелось бы отметить, что он впервые в мире показал, что островки Лангерганса являются железами внутренней секреции, а их функция — регуляция углеводного обмена, при нарушении которой развивается сахарное мочеизнурение. В результате гистологических исследований тканей поджелудочной железы ряда животных (кошек, собак, кроликов) после перевязки ее протока, а также на основании эмбриологических и патологоанатомических (исследования поджелудочной железы больных, умерших от сахарного диабета) данных разработал гипотезу о существовании вещества, регулирующего сахарный обмен; указал на возможность разрешения вопроса о терапии сахарного диабета, использованием поджелудочной железы молодых телят. Заметим, что свою диссертацию Л. В. Соболев защитил в 1901 году, ровно за 20 лет до открытия Бантингом инсулина. Подведем резюме словами известного болгарского историка науки В. Чолакова [17]: «Молодой канадский ученый Бантинг первым понял, почему не удавалось получить эффективную вытяжку из поджелудочной железы. Он решил воспользоваться методом, разработанным русским ученым Л. В. Соболевым». Правда, без упоминания его имени, но редкость ли это, особенно по отношению к русским ученым? Как здесь не вспомнить…
Вернемся к основной теме нашего повествования, к нарушениям обмена глюкозы. Известно, что концентрация глюкозы у человека регулируется в намного более узком диапазоне, чем концентрация других источников энергии (лактат, пируват и т. д.). Печень является основным местом синтеза эндогенной глюкозы, хотя при длительном голодании до 10 % общей глюкозы могут образовываться в почках. Глюкоза в организме может образовываться двумя путями: во-первых, из гликогена (гликогенолиз), а во-вторых, синтезироваться из глицерола, лактата, пирувата, аминокислот, основной из которых в количественном отношении для синтеза глюкозы является аланин (глюконео-генез). Гликоген также может синтезироваться двумя путями: из глюкозы или из других предшественников (лактата, пирувата, глицерола).
Баланс между глюконеогенезом и гликогенолизом поддерживается с помощью ферментов: глюкогенсинтетазы и фосфорилазы соответственно. Протеинкиназы, активируя повышение цАМФ в гепатоците, стимулируют активность печеночной фосфорилазы и инактивируют гликогенсинтетазу. Таким образом, повышение уровня цАМФ в гепатоците стимулирует гликогенолиз, а снижение — глюконеогенез.
Изменение уровня цАМФ в гепатоцитах зависит от гормонов, регулирующих метаболизм глюкозы. Это инсулин и так называемые контринсулярные (противорегулирующие) гормоны (глюкагон, соматотропный гормон, катехоламины, кортизол). Основными контринсулярными гормонами являются глюкагон и адреналин. Адреналин стимулирует выброс из клеток лактата и аланина, стимулируя периферические ?-рецепторы. Другие гормоны действуют пермиссивно, а кортизол имеет очень кратковременный эффект на уровень глюкозы крови.
Выработку инсулина стимулирует повышение глюкозы крови. Уровень цАМФ в гепатоците снижается в присутствии инсулина, таким образом, стимулируя синтез гликогена.
В большинство тканей, в том числе и в мозг, глюкоза поступает по градиенту концентрации, но мышечные, жировые клетки, а также гепатоциты являются инсулинозависимыми. Внутриклеточная глюкоза фосфорилиро-вана. Когда в клетках происходит окисление жирных кислот цитоплазматической глюкозо-6-фосфатазой, ее концентрации возрастают, ингибируя активность гексокиназы и уменьшая способность клетки фосфорилировать глюкозу. В целом, окисление жира в клетках снижает образование глюкозы в них и стимулирует глюконеогенез в печени.
Таким образом, в организме поддерживается баланс между образованием глюкозы и ее использованием. В последние 30 лет появилась возможность, используя глюкозу, меченную радиоактивными изотопами, оценить продукцию глюкозы у новорожденных. Так, Kalhan S. С. с соавторами [117. 118, 120], исследуя образование глюкозы у детей, начиная со вторых суток жизни, получили величины 4,3–8,5 мг/кг-мин. Другие исследователи приводят меньшие значения глюкогенеза (3,8–4,9 мг/кг-мин).
Доказано [195], что инфузия глюкозы у взрослых подавляет эндогенное образование глюкозы за счет увеличения синтеза инсулина. Такое же явление доказано у здоровых новорожденных, а у больных — указанный эффект менее выражен, особенно у глубоконедоношенных детей. Эти исследования доказывают вариабельность контррегулирующего ответа у больных и недоношенных новорожденных.
Еще один интересный факт, доказанный в последнее десятилетие [44]: высокое потребление экзогенной глюкозы в третьем триместре беременности беременной женщиной приводит к развитию гипокальциемии. Этот эффект связывают со стимуляцией глюкозой синтеза энтероглюкагона и гастрина, приводящих к высокой продукции кальцитонина, с последующим снижением концентрации кальция в крови. Согласно этим же наблюдениям, прием глюкозы не влияет на концентрацию магния в крови. С другой стороны, показано, что у женщин, имевших транзиторную гипогликемию во время беременности, чаще развивается преэклампсия [177].
При рождении у новорожденного должно произойти достаточно резкое переключение на самостоятельное образование глюкозы. Создание нормогликемии зависит от достаточного количества гликогена, зрелости механизмов глюконеогенеза и гликогенолиза, а также интегрированного эндокринного ответа. Большое значение в нем отводится катехоламинам, активирующим, совместно с глюкагоном, печеночную фосфорилазу, стимулирующую гликогенолиз. Катехоламины также стимулируют липолиз и ферменты, участвующие в глюконеогенезе. Повышение секреции кортизола стимулирует печеночную глюкозо-6-фосфатазу и выброс гепатоцитами глюкозы [78, 83].
Достаточно давно известно [127], что эндокринологическая перестройка первых часов жизни приводит к увеличению уровня глюкозы и мобилизации жира из жировых тканей за счет высокого уровня адреналина и быстрого снижения отношения инсулин/глюкагон. На вопрос, снижается ли концентрация инсулина фактически — однозначного ответа нет. Так, Hawdon J. М. с соавторами [92] не подтвердили этого факта относительно как доношенных, так и недоношенных детей. Они же, но несколько позже [93] обнаружили, что концентрация как инсулина, так и глюкозы остается высокой у недоношенных.
В постнатальном периоде поддержание гомеостаза глюкозы зависит от баланса между синтезом глюкозы печенью и потреблением ее тканями. У доношенных новорожденных глюкоза потребляется со скоростью от 4 до 6 мг/кг/мин, у плода в III триместре беременности и у недоношенных детей приблизительно в два раза больше (8–9 мг/кг/мин). Некоторые патологические процессы, возникающие в неонатальном периоде, приводят к увеличению потребления глюкозы тканями. Например, при гипоксии — из-за неэффективного анаэробного гликолиза, или при холодовом стрессе — из-за активации симпатической нервной системы и повышенной продукции гормонов щитовидной железы [98]. С другой стороны, при полноценном энтеральном питании глюкоза, путем глюконеогенеза, происходит из аминокислот и глицерина, галактоза, образовавшаяся путем гидролиза лактозы в кишечнике, увеличивает синтез печеночного гликогена. Энтеральное питание также способствует образованию кишечных пептидов (инкретинов), стимулирующих секрецию инсулина. Инсулин тормозит образование глюкозы гепатоцитами, способствуя образованию гликогена.
Что касается данных относительно концентрации других метаболических субстратов, то в обзоре литературы, опубликованном ВОЗ (1997), обращается внимание, что таких исследований относительно немного, и сделаны они в то время, когда у новорожденных детей соблюдалась «голодная пауза» и начало грудного вскармливания было отложено на несколько часов. Результаты этих исследований показали, что снижение концентрации глюкозы, во-первых, зависит от продолжительности голодания, а во-вторых, что концентрация других энергетических метаболитов (свободных жирных кислот, кетоновых тел, глицерина) повышается.
Так, Beard A. G. с соавторами [36] изучали две группы доношенных и недоношенных детей. Детей первой группы прикладывали к груди в первые 6 часов жизни, а детей второй группы — через 72 часа после рождения. Оказалось, что у доношенных детей первой группы средняя концентрация глюкозы была 3,8 ммоль/л, а у детей второй группы — 2,2 ммоль/л. У 58 % недоношенных детей второй группы концентрация глюкозы была менее 1,4 ммоль/л, в то время как в первой группе таких детей было всего 4 %. Кроме того, у голодающих младенцев повысилась концентрация жирных кислот, у 50 % из них зарегистрирована кетонурия. Самые высокие значения указанных метаболитов отмечены у детей с самыми низкими концентрациями глюкозы. Необходимо отметить, что, несмотря на низкие концентрации глюкозы, у детей не отмечено клинической симптоматики гипогликемии. Как справедливо отмечают эксперты ВОЗ в уже упоминавшемся обзоре, также цитирующие эту статью, нельзя сравнивать детей тридцатилетней давности с сегодняшними новорожденными. Вполне возможно, что тогда новорожденные, даже недоношенные, были более «зрелые», чем сегодня, и их адаптивные возможности были лучше развиты.
Таким образом, упомянутые исследования показали, что недоношенные дети имеют более низкие концентрации глюкозы, чем полновесные дети. Правда, в те годы этот факт рассматривался как «физиологическое явление», хотя не имелось никаких доказательств, что недоношенные более стойки к гипогликемии, чем доношенные. Как известно, недоношенные дети имеют многочисленные причины для развития гипогликемии.
Во-первых, у них меньше энергетические запасы (гликоген печени и жир). Во-вторых, они имеют более высокие концентрации инсулина. В-третьих, у недоношенных новорожденных гораздо хуже развиты механизмы глюконеогенеза. Например, Hume R. и Burchell А. [110] установили низкую концентрацию микросомальной глюкозо-6-фосфатазы в печени у детей, родившихся на сроке гестации 24–36 недель. Интересно, что низкие концентрации указанного фермента в данной группе сохранялись до 1 года.
Кроме того, у недоношенных снижены концентрации других метаболических субстратов (жирных кислот) [92], а некоторые исследователи обнаружили у недоношенных детей низкие концентрации глюкагона [145]. Вышеуказанные изменения еще более характерны для детей, «незрелых к сроку гестации» [92, 93, 117]. Кроме недоношенности и незрелости к сроку гестации, имеется еще достаточно большое количество состояний неонатального периода, сопровождающихся гипогликемией. Наиболее частые причины — перенесенная асфиксия, сепсис, гипотермия, полицитемия, наличие сахарного диабета у матери и т. д.