Плацентарная недостаточность
Наиболее частой причиной нарушений состояния плода во время беременности является плацентарная недостаточность – клинический синдром, обусловленный морфофункциональными изменениями в плаценте и нарушениями компенсаторно-приспособительных механизмов, обеспечивающих функциональную полноценность органа. Она представляет собой результат сложной реакции плода и плаценты на различные патологические состояния материнского организма; проявляется комплексом нарушений транспортной, трофической, эндокринной и метаболической функций плаценты, лежащих в основе патологии плода и новорожденного. В процессе развития беременности функции плаценты и плода тесно связаны, поэтому нередко используют термин "фетоплацентарная система".
Степень и характер влияния патологических изменений плаценты на плод определяются многими факторами: сроком беременности, длительностью воздействия, состоянием компенсаторно-приспособительных механизмов в системе мать-плацента-плод.
Классификация.
В зависимости от того, в каких структурных единицах преимущественно возникают патологические процессы, различают три формы плацентарной недостаточности:
1. гемодинамическую, проявляющуюся нарушением маточно-плацентарного и плодово-плацентарного кровообращения;
2. плацентарно-мембранную, характеризующуюся снижением способности плацентарной мембраны к транспорту метаболитов;
3. клеточно-паренхиматозиую, связанную с нарушением клеточной активности трофобласта и плаценты.
Выделяют первичную плацентарную недостаточность, возникающую до 16 нед беременности, и вторичную, наблюдающуюся в более поздние сроки.
Первичная недостаточность плаценты развивается в период имплантацйи, раннего эмбриогенеза и плацентации под влиянием разнообразных факторов (генетические, эндокринные, инфекционные и т.д.), действующих на гаметы родителей, зиготу, бластоцисту, формирующуюся плаценту и Половой аппарат женщины в целом. Первичная плацентарная недостаточность проявляется изменениями строения, расположения и прикрепления плаценты, а также дефектами васкуляризации и нарушениями созревания хориона.
Вторичная плацентарная недостаточность развивается под влиянием экзогенных факторов и наблюдается во второй половине беременности.
Плацентарная недостаточность (первичная и вторичная) имеет острое или хроническое течение.
Острая плацентарная недостаточность возникает как следствие преждевременной отслойки нормально расположенной плаценты с образованием ретроплацентарной гематомы или отслойки предлежащей плаценты, в результате чего наступает гибель плода.
Хроническая плацентарная недостаточность наблюдается у каждой третьей беременной из группы высокого риска развития перинатальной патологии. Хроническая плацентарная недостаточность развивается рано и протекает длительно вследствие нарушения компенсаторно-приспособительных механизмов в сочетании с циркуляторными расстройствами, инволютивнодистрофическими изменениями, воспалением или обострением, связанными с заболеваниями женщины во время беременности. Хроническая плацентарная недостаточность может приводить к гипоксии плода, задержке его роста и развития, возможна внутриутробная гибель плода.
Этиология и патогенез.
Плацентарная недостаточность чаще развивается при осложненном течении беременности или экстрагенитальных заболеваниях. Высокая степень риска развития плацентарной недостаточности отмечена у беременных с сочетанным гестозом, преимущественно развивающимся на фоне сердечно-сосудистой патологии (гипертоническая болезнь, некоторые пороки сердца с гипертензией), заболеваний эндокринной системы (сахарный диабет, гипери гипофункция щитовидной железы и надпочечников), почечной патологии с гипертензивным синдромом, иммуноконфликтной беременности, беременности, сопровождающейся угрозой прерывания, переношенной беременности.
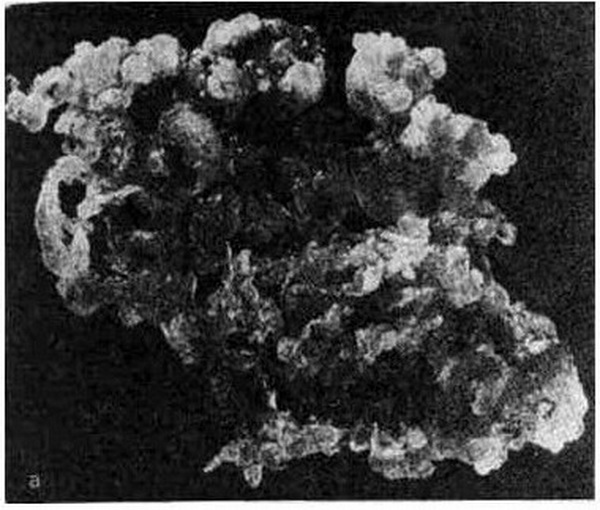
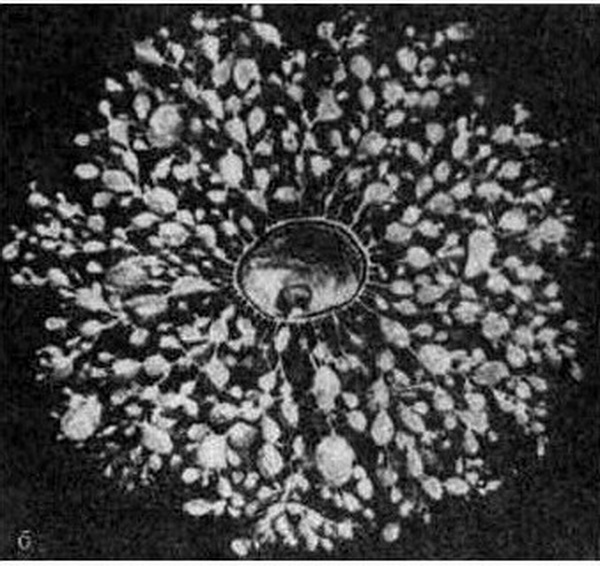
Рис. 16.5. Пузырный занос, а – препарат; б – схема.
В группу беременных со средней степенью риска нарушений фетоплацентарной системы относятся женщины с генитальным инфантилизмом I-II степени, многоплодной беременностью.
Группу низкого риска составляют первородящие женщины до 18 лет и старше 28 лет, беременные с умеренным многоводием.
Патогенез плацентарной недостаточности определяется морфологическими изменениями и расстройствами функции плаценты. Морфологическим субстратом плацентарной недостаточности являются изменения, связанные с нарушением имплантации и плацентации: патологическое строение, расположение и прикрепление плаценты, а также дефекты васкуляризации. В развитии плацентарной недостаточности основными и нередко первоначальными причинами являются гемодинамические микроциркуляторные нарушения. Изменения плацентарного кровотока, как правило, сочетанные:
1. снижение перфузионного давления в матке, проявляющееся либо уменьшением притока крови к плаценте в результате системной гипотензии у матери (гипотензия беременных, синдром сдавления нижней полой вены, локальный спазм маточных сосудов на фоне гипертензивного синдрома), либо затруднением венозного оттока (длительные сокращения матки или ее повышенный тонус, отечны синдром);
2. инфаркты, отслойка части плаценты, ее отек;
3. нарушения капиллярного кровотока в ворсинах хориона (нарушение созревания ворсин, внутриутробное инфицирование, тератогенные факторы);
4. изменения реологических и коагуляционных свойств крови матери и плода.
В результате гемодинамических и морфологических изменений первично нарушается трофическая функция плаценты и лишь позднее изменяется газообмен на уровне плацентарного барьера.
Поддержание жизнедеятельности плода при нарушениях функции плаценты происходит с помощью компенсаторных механизмов, действующих не только на тканевом уровне (увеличение числа резорбционных ворсин, капилляров ворсин и функционирующих синцитиальных узелков, образование синцитиокапиллярньгх мембран), но и на клеточном и субклеточном уровнях (увеличение числа митохондрий и рибосом, повышение активности ферментов, переключение на анаэробный тип дыхания).
Клиническая картина плацентарной недостаточности зависит от того, развивается она остро или постепенно (хроническая плацентарная недостаточность). Острая плацентарная недостаточность является следствием преждевременной отслойки предлежащей или нормально расположенной плаценты. Считается опасным для жизни плода выключение из кровообращения более Уз площади плаценты. Клинические проявления преждевременной отслойки плаценты разнообразны и зависят от расположения плаценты (нормальное, низкое), локализации участка отслойки (центральное, по краю плаценты), размера отслоившейся части плаценты (см. разделы 21.1, 21.2).
Хроническая плацентарная недостаточность имеет некоторые общие проявления, несмотря на крайне слабовыраженную клиническую симптоматику. Как правило, жалоб беременные не предъявляют. Изменения в плаценте (структурные и функциональные) можно определить лишь с помощью объективных методов исследования.

Рис. 16.6. Инвазивный пузырный занос, разрушивший стенку матки.
Основными клиническими проявлениями хронической плацентарной недостаточности являются внутриутробная задержка роста плода, внутриутробная гипоксия и их сочетание.
Диагностика.
Плацентарная недостаточность в ранние сроки беременности в основном обусловлена недостаточной гормональной активностью желтого тела, сопровождается низким уровнем прогестерона и хорион ического гонадотропина. Во II и III триместрах беременности плацентарная недостаточность сопровождается патологическими изменениями плаценты: малыми ее размерами, появлением некрозов. В последующем возникает задержка роста плода, в ряде случаев недостаточность плаценты может привести к антеили интранатальной гибели плода.
Наиболее информативными в определении функции плаценты являются следующие методы:
1. определение и сопоставление уровней гормонов фетоплацентарной системы (эстрогенов, прогестерона, плацентарного лактогена);
2. определение в крови активности ферментов – окситоциназы и термостабильной щелочной фосфатазы;
3. ультразвуковое сканирование (локализация плаценты, ее структура и величина);
4. допплерометрическое исследование кровотока в маточных артериях и сосудах плода.
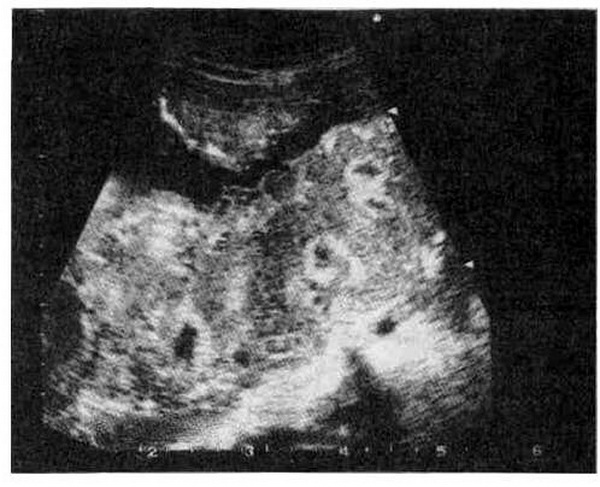
Рис. 16.7. Преждевременное созревание плаценты с ее кистозной дегенерацией.
Кроме того, необходимо проводить оценку роста плода путем тщательного измерения высоты дна матки и окружности живота беременной, ультразвуковую биометрию плода, оценку состояния плода посредством изучения его двигательной активности и сердечной деятельности.
Ранним признаком недостаточности плаценты является снижение синтеза всех гормонов фетоплацентарной системы (эстрогенов, прогестерона, плацентарного лактогена).
Наиболее ценную информацию о состоянии плаценты дает ультразвуковое исследование плаценты, которое позволяет не только определить ее локализацию, но и оценить структуру и величину. Появление III степени зрелости плаценты до 36-37 нед беременности свидетельствует о ее преждевременном старении и является признаком плацентарной недостаточности. В ряде случаев при ультразвуковом исследовании выявляют кисто я юсизменение плаценты. Кисты плаценты определяются в виде эхонегативньл образований различной формы и величины. Они чаще возникают на плодовой стороне плаценты как следствие кровоизлияний, размягчения, инфарктов и других дегенеративных изменений (рис. 16.7). Мелкие, даже множественные кисты могут не оказывать влияния на развитие плода, в то время как большие кисты нередко приводят к атрофии ткани плаценты и нарушению состояния плода.
В зависимости от патологии, осложняющей течение беременности, не-достаточность функции плаценты проявляется уменьшением или увеличением толщины плаценты.
Для гестозов, угрозы прерывания беременности, внутриутробной задержки роста плода характерна "тонкая" плацента (до 20 мм в III триместре беременности), при гемолитической болезни и сахарном диабете о плацентарной недостаточности свидетельствует "толстая" плацента (до 50 мм и более). Истончение или утолщение плаценты на 0,5 см и более указывает на необходимость проведения лечебных мероприятий и повторного ультразвукового исследования. Важным является определение площади плаценты, которая в сочетании с толщиной дает представление об ее объеме. Эти параметры дополняют сведения о состоянии плаценты, ее компенсаторных возможностях.
Не вызывает затруднений диагностика плацентарной недостаточности, сопровождающейся внутриутробной задержкой роста плода. Рост и развитие плода во время беременности определяют с помощью наружного акушерского исследования (измерение и пальпация) и ультразвукового сканирования. Скрининговым методом является сопоставление высоты дна матки (ВДМ) над лобком с окружностью живота, массой тела и ростом беременной. Однако значительно больше информации дает ультразвуковая биометрия плода, которая позволяет уточнить гестационный срок с точностью до 1/2-1 нед и определить размеры отдельных органов плода. Ультразвуковая диагностика задержки роста плода основана на сопоставлении фетометрических показателей, полученных при исследовании, с нормативными показателями для данного срока беременности.
Достоверными признаками задержки роста плода являются несоответствие размеров плода фактическому сроку беременности, а также нарушения взаимоотношений между размерами головки плода и его туловища. Различают два основных типа внутриутробной задержки роста плода.
1. Симметричная задержка роста, при которой отмечается пропорциональное уменьшение размеров плода, встречается в 10-30 % случаев. Соотношение БПР/ДЖ при этом такое же, как у здоровых плодов аналогичного гестационного возраста, и не превышает 1. Правильная диагностика симметричной задержки роста возможна при установлении точного срока беременности или при динамической эхографии. Эта форма нарушения роста плода, как правило, связана с его наследственными заболеваниями и хромосомными аберрациями (трисомия по 18-й паре хромосом, синдромы Дауна и Тернера), инфекционными заболеваниями (краснуха, токсоплазмоз, герпес, сифилис, цитомегаловирусная инфекция), аномалиями развития (микроцефалия, единственная артерия пуповины, синдром Поттера, врожденные пороки сердца и т.д.). В связи с этим для исключения наследственной и генетической патологии при выявлении симметричной формы задержки роста плода следует провести амниоцентез и соответствующие исследо-вания околоплодных вод (хромосомный анализ). Целесообразно также обследование беременной на носительство вирусной и бактериальной инфекции. Причиной развития симметричной формы задержки роста плода могут быть также вредные привычки у матери (курение, алкоголизм, наркомания), недостаточное питание и др.
2. Асимметричная задержка роста, для которой характерно отставание размеров туловища при нормальном БПР головки и, следовательно, увеличении соотношения БПР/ДЖ выше 1, наблюдается в 70 – 90% случаев Нарушений роста плода. Диагностика такого типа задержки роста плода не Представляет трудностей и возможна уже при первом ультразвуковом исследовании. В большинстве наблюдений асимметричная форма задержки роста плода развивается в более поздние сроки беременности и обусловлена заболеваниями матери и осложнениями беременности, приводящими к плацентарной недостаточности (гипертоническая болезнь, сахарный диабет, коллагеноз, гестоз, многоплодная беременность, патологические изменения плаценты, кровотечения во время беременности). На основании результатов ультразвукового исследования можно определить степень за-держки роста плода. При I степени отмечается отставание показателей фетометрии от нормативных показателей на 2 нед, при II – на 3-4 нед, при III – более чем на 4 нед. Степень внутриутробной задержки роста плода коррелирует со степенью тяжести плацентарной недостаточности и неблагоприятными перинатальными исходами. С целью контроля за ростом плода используют перцентильный подход, который позволяет в каждый конкретный срок беременности точно определить соответствие размеров плода гестационному возрасту, а также степень отклонения их от нормативных величин.
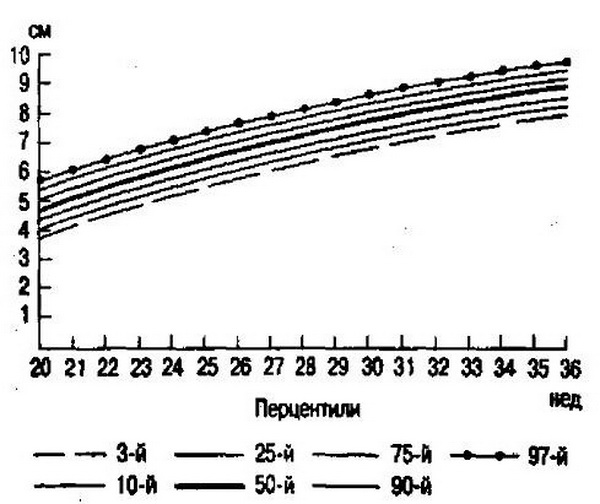
Рис. 16.8. Перцентильные нормативы БПР.
При построении перцентильных кривых все измерения, проведенные в течение беременности (ВДМ, БПР, ДЖ, ДГ и т.д.), разбивают на интервалы по гестационному сроку (рис. 16.8). Для каждого интервала образуют и упорядочивают по возрастающим величинам вариационные ряды и определяют характерные перцентильные уровни. Уровень показателя (в сантиметрах, граммах или других единицах), ниже и выше которого находится 50 % всех выявленных показателей, называют медианой или 50-м (50 %) перцентилем. Соответственно уровень, ниже которого находится 25 % всех показателей, именуют 25-м перцентилем и т.д. На диаграммах приведены перцентильные нормативы БПР и ДЖ. Диагноз ВЗРП устанавливают в том случае, если размеры плода ниже 10-го перцентиля для данного срока беременности.
Определенную ценность в диагностике задержки роста плода имеет ультразвуковое исследование мочевыделительной функции почек плода по одночасовой экскреции мочи. Последнюю определяют по разнице между объемом мочевого пузыря плода во время первого обследования и повторного его измерения через 1 ч. Одночасовая экскреция мочи при внутриутробной задержке роста плода снижается до 15-18 мм (при норме 24-27 мм).
Наиболее информативным объективным методом диагностики плацентарной недостаточности и определения компенсаторных возможностей единой системы мать-плацента-плод является допплерометрия кровотока в маточно-плацентарных и плодово-плацентарных сосудах. Разработана классификация гемодинамических нарушений в системе мать-плацента-плод по оценке кривых скоростей кровотока в маточных артериях и артерии пуповины [Стрижаков А.Н. и др., 1989]. Патологическими значениями СДО в маточных артериях после 18-20 нед беременности считаются 2,4 и более, в артерии пуповины после 32 нед – 3,0 и более. При I степени нарушения отмечаются изменения только маточного (1А) или только плодового (1Б) кровотока. При П степени нарушается как маточный, так и плодовый кровоток, но не отмечаются их критические значения. При III степени нарушения кровотока в артерии пуповины достигают критического уровня, выражающегося нулевым или отрицательными значениями диастолического компонента кровотока.
Беременные с нарушениями маточно-плацентарно-плодового кровообращения 1а и II степени нуждаются в динамическом наблюдении с допплерометрическим и кардиомониторным контролем. При III степени нарушения маточно-плацентарно-плодового кровообращения в связи с декомпенсированной плацентарной недостаточностью требуется досрочное родоразрешение.
Диагностика гипоксии плода как одного из основных проявлений плацентарной недостаточности возможна при кард иото ко графи и (см. Гипоксия).
Лечение.
Основным звеном в нормализации функции плаценты является улучшение маточно-плацентарного кровотока, что достигается применением комплекса сосудорасширяющих средств и методов либо препаратов, расслабляющих матку, в сочетании с мероприятиями, направленными на нормализацию микроциркуляции и реологических свойств крови. Физические методы воздействия (электрорелаксация матки, электрофорез магния, назначение тепловых процедур на околопочечную область) рефлекторно расслабляют миометрий и приводят к расширению сосудов. Абдоминальная декомпрессия снимает излишнюю работу мускулатуры матки по преодолению тонуса мышц передней брюшной стенки, что приводит к усилению интенсивности кровотока в матке и улучшению плацентарной перфузии.
Гипербарическую оксигенацию применяют для улучшения функции плаценты и состояния плода, особенно у беременных с пороками сердца. Она обеспечивает сохранение активности дыхательных ферментов, способствует нормализации углеводного обмена.
Из сосудорасширяющих средств применяют эуфиллин, который может быть введен внутривенно струйно и капельно. С этой же целью используют ксантинола никотинат (компламин, теоникол). Следует отметить возможность повышенной чувствительности беременных к этим препаратам, в связи с чем требуется индивидуальный подбор доз. Значительное улучшение маточно-плацентарного кровотока вызывает вазоактивный препарат трентал (пентоксифиллин). Он оказывает сосудорасширяющее действие, снижает периферическое сопротивление сосудов, усиливает коллатеральное кровообращение. Трентал улучшает реологические свойства крови и микроциркуляцию, может быть применен в условиях стационара и женской консультации. В стационаре лечение тренталом следует начинать с его внутривенного введения, а затем переходить только на прием внутрь. Длительность терапии в зависимости от эффекта составляет от 4 до 6 нед. Ввиду значительного сосудорасширяющего действия возможно уменьшение кровоснабжения ряда органов, в том числе матки (синдром обкрадывания), для предотвращения которого трентал следует принимать через 30 мин после так называемой жидкостной нагрузки (предварительного введения жидкости, лучше реополиглюкина) и предварительного внутривенного введения 1 мл 0,06 % раствора коргликона. В амбулаторных условиях трентал назначают в виде таблеток.
С целью расслабления матки и улучшения плацентарного кровотока целесообразно использовать малые дозы препаратов токолитического действия (бета-миметики), которые снижают сопротивление сосудов на уровне артериол. При этом происходит перераспределение крови в организме матери и может наступить уменьшение оксигенации плода, поэтому данные препараты следует применять в сочетании с кардиотоническими средствами и инфузионной терапией. Для усиления маточно-плацентарного кровотока можно сочетать введение малых доз бета-миметиков с сигетином. Применение токолитических средств требует тщательного врачебного контроля, поскольку могут наблюдаться, особенно в начале лечения, некоторые нежелательные эффекты: нарушения деятельности сердечно-сосудистой системы в виде тахикардии, гипотензии; тремор пальцев рук, озноб, тошнота и рвота, головная боль, некоторая возбудимость. Индивидуальный подбор дозы препаратов и скорости их введения позволяет предотвратить возникновение этих побочных явлений. Одновременное применение папавериноподобных соединений, а также альфа-блокаторов приводит к уменьшению частоты возникновения побочных явлений – нарушений деятельности сердечно-сосудистой системы. Одним из условий проведения токолиза является положение женщины на боку, До начала введения препарата в течение 30 мин следует ввести один из растворов (глюкоза, реополиглюкин) и кардиотонические средства (коргликон, изоланид). Одновременно с началом приема бета-миметиков внутрь принимают 1 таблетку верапамила (изоптин, финоптин). Противопоказаниями к применению бета-миметиков являются кровотечения во время беременности, заболевания сердечно-сосудистой системы, сахарный диабет, тиреотоксикоз и нарушения свертывания крови.
Большую роль в нарушении гемодинамики плаценты играют реокоагуляционные расстройства. Для их коррекции проводят инфузию низкомолекулярных декстранов (реополиглюкин). Под влиянием инфузии реополиглюкина в конце беременности кровоток в различных органах меняется неоднозначно: он значительно увеличивается в плаценте, несколько меньше – в мозге и сердечной мышце. Лучший результат отмечается при сочетанием введении реополиглюкина и гепарина. Важным свойством гепарина является его способность расширять кровеносные сосуды. Это в значительной мере относится и к сосудам плаценты. При лечении плацентарной недостаточности гепарин используют для улучшения микроциркуляции и предотвращения избыточного отложения фибрина. Он не проходит через плаценту и не оказывает повреждающего действия на плод. Лечение следует проводить под контролем реологических и коагуляционных свойств крови в комплексе
с другой терапией. Развитию сосудистого ложа миометрия и плаценты, нормализации микроциркуляции способствует длительное подкожное введение низко молекулярного гепарина – фраксипарина в сочетании с антиагрегантами (трентал, теоникол, курантил или дипиридамол). Лечение проводят только по строгим показаниям во II-III триместрах, его длительность составляет от 10 дней до 7 нед. Используемые дозировки гепарина (15.000-20.000 ЕД в сутки) относительно безопасны в отношении геморрагических осложнений, но, несмотря на это, требуется регулярный контроль за состоянием свертывающей системы крови не реже 2 раз в неделю. За 2-3 сут до родоразрешения гепарин следует отменить. При этом кровопотеря в родах или при кесаревом сечении в случае правильного применения фраксипарина не превышает физиологическую. У новорожденных геморрагические осложнения также отсутствуют.
Для улучшения маточно-плацентарного кровотока применяют дипиридамол (курантил), который, проникая через плаценту, оказывает положительное влияние на плод. Важной особенностью препарата является его тормозящее воздействие на агрегацию эритроцитов и тромбоцитов,. Для улучшения маточно-плацентарного кровообращения используют сигетин, при этом следует учитывать кратковременность его действия. Препарат можно вводить с партусистеном и гепарином, усиливая тем самым их терапевтический эффект.
В комплексную терапию плацентарной недостаточности следует включать средства, улучшающие газообмен и метаболизм в плаценте. К. ним относятся оксигенотерапия, энергетические смеси, аминокислоты, витамины и препараты железа в сочетании с нестероидными анаболическими препаратами. При этом следует отметить, что глюкоза является основным энергетическим продуктом, утилизируемым при экстремальных состояниях. Хорошее действие на метаболическую функцию плаценты оказывает калия оротат, который участвует в синтезе белковых молекул и является стимулятором белкового обмена.
Длительность терапии плацентарной недостаточности должна составлять не менее 6 нел (в стационаре с продолжением лечения в условиях женской консультации).
В случаях выраженных ВЗРП и внутриутробной гипоксии плода единственно правильным является досрочное родоразрешение. При критическом состоянии плода родоразрешение необходимо проводить путем кесарева сечения.
Схемы лечения
1. В условиях стационара
• лечение основной патологии беременности;
• оксигенотерапия: вдыхание увлажненной кислородно-воздушной смеси в течение 30-60 мин 2 раза в день;
• препараты, влияющие на энергетический обмен:
– глутаминовая кислота по 0,1 г 3 раза в день или метионин по 0,5 г 3 раза в день,
– галаскорбин по 0,5 г 3 раза в день,
– железо в виде ферроплекса по 2 драже 4 раза в день,
– кокарбоксилаза по 100 мг внутримышечно ежедневно;
• вазоактивные препараты: трентал, курантил, партусистен, эуфиллин внутривенно (на растворе натрия хлорида или глюкозы) или внутрь. Курс лечения 4 – 6 нед, из них в течение 5-7 дней проводят инфузионную терапию, в остальные дни препараты назначают внутрь;
• реополиглюкин по 400-500 мл 10 % раствора внутривенно капельно 3-4 раза ежедневно или 2-3 раза в неделю;
• свежезамороженная плазма – 150 мл внутривенно капельно при низком содержании белка в крови (ниже 60 г/л);
• при введении больших доз глюкозы ее применяют с инсулином в количестве 1 ЕД на 4 г сухого вещества глюкозы.
• В условиях женской консультации
• диатермия околопочечной области (до 10 сеансов) в чередовании с УФО (10 сеансов);
• диета, богатая белком (отварное мясо, рыба, творог) и витаминами;
• внутривенное введение 20 мл 4 0 % раствора глюкозы с 0,5 мл 0,06 % раствора коргликона внутривенно медленно ежедневно или через день (10 инъекций);
• кокарбоксилаза внутримышечно по 50 мг ежедневно в течение • 10-14 дней;
• эуфиллин (или но-шпа, папаверин) по 0,15 г внутрь 2 раза в сутки и по 0,2 г в свечах на ночь в течение 14 дней;
• трентал по 1 таблетке 3 раза в сутки или изадрин по 0,005 г (под язык) 3 раза в сутки в сочетании с финоптином (изоптином);
• калия оротат по 0,5 г 3 раза в сутки;
• ферроплекс (конферон) по 1 драже (капсуле) 3 раза в сутки,
• метионин по 0,5 г 3 раза в сутки;
• аскорутин по 1 таблетке 3 раза в сутки.
В отсутствие эффекта в течение 10-14 дней показана госпитализация.
Профилактика плацентарной недостаточности
1. Исключение влияния вредных факторов, особенно в первые дни и недели беременности: а) курение, прием алкоголя и медикаментозных средств без назначения врача, б) до и во время беременности санация очагов инфекции, лечение хронических заболеваний.
2. С наступлением беременности разъяснение роли сбалансированного питания, полноценного и несколько более продолжительного отдыха и сна.
3. Выявление и взятие на диспансерный учет беременных из группы высокого риска развития плацентарной недостаточности. К ним относятся женщины, у которых длительно существует угроза прерывания беременности, с гестозами, миомой матки, хроническим пиелонефритом, гипертонической болезнью, сахарным диабетом, изосерологической несовместимостью крови матери и плода, многорожавшие женщины, в анамнезе которых имеется антенатальная гибель плода или рождение детей с гипотрофией,
4. Проведение профилактических мероприятий трижды в течение беременности у женщин из группы высокого риска, особенно в сроки до 12 нед и в 20-22 нед. Женщины этой группы риска должны быть направлены в стационар с целью активизации компенсаторно-приспособительных механизмов организма.






