Методы исследования околоплодных вод
Для оценки течения беременности и диагностики состояния плода важное значение имеет определение следующих характеристик околоплодных вод: количество, цвет, прозрачность, биохимический, цитологический, гормональный состав.
Определение количества околоплодных вод. Определение объема амниоцетической жидкости при УЗИ может быть субъективным или объективным. Опытный специалист может оценить количество околоплодных вод путем визуального осмотра при тщательном продольном сканировании (большое количество жидкости между плодом и передней брюшной стенкой беременной при многоводии, резкое уменьшение количества пространств, свободных от эхоструктур, при маловодий).
Существуют более объективные полуколичественные эхографические критерии для неинвазивного определения количества околоплодных вод. О маловодий свидетельствует наличие свободных участков жидкости глубиной менее 1-2 см, а о многоводии – обнаружение вертикального диаметра кармана околоплодных вод свыше 8 см. Более точным методом определения объема околоплодных вод является вычисление при УЗИ индекса амниотической жидкости (ИАЖ) – суммы максимальных карманов с жидкостью в 4 квадрантах полости матки: 0-5 см – очень низкий индекс (выраженное маловодие), 5,1-8 см – низкий индекс (умеренное маловодие), 8,1-18 см – норматьный индекс, более 18 см – высокий индекс (многоводие).
Амниоскопии – трансцервикатьный осмотр нижнего полюса плодного пузыря. При амниоскопии обращают внимание на цвет и консистенцию околоплодных вод, примесь мекония или крови, наличие и подвижность хлопьев казеозной смазки.
Показаниями к амниоскопии являются подозрение на хроническую гипоксию, перенашивание беременности, изосерологическая несовместимость крови матери и плода.
Для проведения амниоскопии беременную укладывают в гинекологическое кресло и производят влагалищное исследование для определения проходимости канала шейки матки. При необходимости производят осторожное пальцевое расширение его. В асептических условиях по пальцу или после обнажения шейки зеркалами в шеечный канал за внутренний зев вводят тубус с мандреном. Диаметр тубуса подбирают в зависимости от раскрытия шейки (12-20 мм). После извлечения мандрена и включения осветителя тубус располагают таким образом, чтобы была видна преддежащая часть плода, от которой отражается световой луч. Если осмотру мешает слизистая пробка, ее осторожно удаляют с помощью тупфера. При низком расположении плаценты на плодных оболочках четко виден сосудистый рисунок. При предлежании плаценты все поле зрения имеет темно-красный цвет, в этом случае исследование необходимо немедленно прекратить!
Противопоказания к амниоскопии: воспалительные процессы во влагалище и шейке матки, а также предлежание плаценты.
Амниоцентез – операция, целью которой является получение околоплодных вод для биохимического, гормонального, иммунологического, цитологического и генетического исследований, позволяющих судить о состоянии плода.
Показаниями к амниоцентезу являются изосерологическая несо-вместимость крови матери и плода, хроническая гипоксия плода (перенашивание беременности, гестоз, экстрагенитальные заболевания матери и т.д.), установление степени зрелости плода, антенатальная диагностика пола, необходимость кариотипирования при подозрении на пороки развития плода, микробиологическое исследование.
В зависимости от места пункции различают трансвагинальный и транс-абдоминальный амниоцентез. Операцию всегда выполняют под ультразвуковым контролем, выбирая наиболее удобное место пункции в зависимости от расположения плаценты и мелких частей плода.
При трансабдоминальном амниоцентезе (рис. 4.36) после обработки передней брюшной стенки антисептиком производят анестезию кожи, подкожной клетчатки и подапоневротического пространства 0,5 % раствором новокаина. Для выполнения процедуры можно применять иглу, как для спинномозговой пункции. Для исследования берут 10-15 мл околоплодных вод. Непригодными считаются пробы, загрязненные кровью или меконием. У беременных с Rh-сенсибилизацией, когда необходимо исследование оптической плотности билирубина (ОПБ), пробу амниотической жидкости следует быстро перенести в темный сосуд, для того чтобы избежать изменения свойств билирубина под влиянием света. Место пункции на передней брюшной стенке обрабатывают антисептиком и накладывают асептическую наклейку.
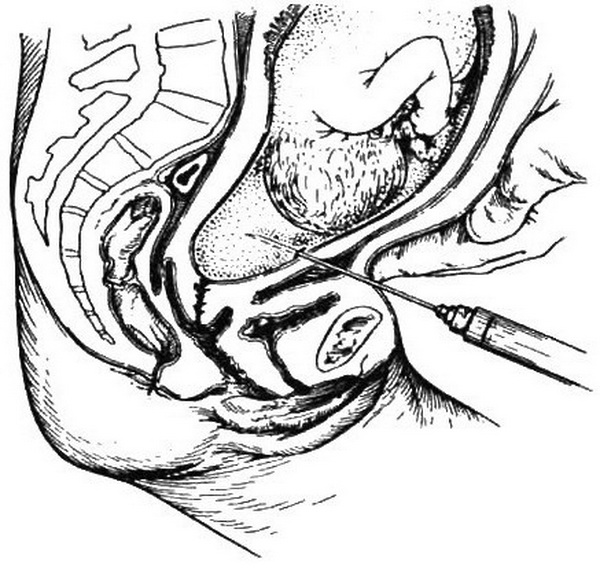
Рис. 4.36. Амниоцентез в III триместре бере-менности, надлобковый доступ.
Трансвагинальный амниоцентез производят через передний свод влагалища, канал шейки матки или задний свод влагалища. Выбор места введения пункционной иглы зависит от расположения плаценты. После предварительной санации влагалища шейку матки фиксируют пулевыми щипцами, смещают вверх или вниз в зависимости от выбранного метода и производят прокол стенки влагалища под углом к стенке матки. При попадании пункционной иглы в полость матки из нее начинают выделяться околоплодные воды.
Осложнения, возможные при амниоцентезе: преждевременное излитие околоплодных вод (чаще при трансцервикальном доступе), ранение сосудов плода, ранение мочевого пузыря и кишечника матери, хориоамнионит. Осложнениями амниоцентеза также могут быть преждевременный разрыв плодных оболочек, преждевременные роды, отслойка плаценты, ранение плода и повреждение пуповины. Однако благодаря широкому внедрению ультразвукового контроля проведения этой операции осложнения встречаются крайне редко. В связи с этим изменились противопоказания к амниоцентезу: практически единственным противопоказанием к нему является угроза прерывания беременности.
Амниоцентез выполняется только с согласия беременной.
Определение степени зрелости плода. С этой целью проводят цитологическое исследование околоплодных вод. Для получения и исследования осадка околоплодные воды центрифугируют при 3000 об/мин в течение 5 мин, мазки фиксируют смесью эфира и спирта, затем окрашивают по методу Гарраса-Шора, Папаниколау или, чаще, 0,1 % раствором сульфата нильского синего, при этом безъядерные липидсодержащие клетки (продукт сальных желез кожи плода) становятся оранжевого цвета (так называемые оранжевые клетки). Процентное содержание в мазке "оранжевых клеток" соответствует зрелости плода: до 38 нед беременности их количество не превышает 10 %, свыше 38 нед – достигает 50 %.
Для оценки зрелости легких плода определяют концентрацию фосфолипидов в околоплодных водах, в первую очередь соотношения лецитин/сфингомиелин (Л/С). Лецитин, насыщенный фосфатидилхолин, является главным действующим началом сурфактанта. Интерпретация величины соотношения Л/С должна быть следующей:
1. Л/С = 2:1 или более – легкие зрелые. Только 2% новорожденных подвержены риску развития респираторного дистресс-синдрома;
2. Л/С = 1,5-1,9:1 – в 50 % случаев возможно развитие респираторного дистресс-синдрома;
3. Л/С = менее 1,5:1 – в 73 % случаев возможно развитие респираторного дистресс-синдрома.
Практическое применение нашел метод качественной оценки соотношения лецитина и сфингомиелина (пенный тест). С этой целью в пробирку с 1 мл околоплодных вод добавляют 3 мл этилового спирта и в течение 3 мин встряхивают пробирку. Образовавшееся кольцо из пены свидетельствует о зрелости плода (положительный тест), отсутствие пены (отрицательный тест) указывает на незрелость легочной ткани.
Диагностика излития околоплодных вод.
Одним из методов диагностики излития околоплодных вод во время беременности является цитологическое исследование свежих окрашенных препаратов. На предметное стекло наносят каплю влагалищного секрета, добавляют каплю 1 % раствора эозина и накрывают покровным стеклом. Под микроскопом на розовом фоне видны ярко окрашенные эпителиальные клетки влагалища с ядрами, эритроциты, лейкоциты. При отошедших водах видны большие скопления неокрашенных "чешуек" кожи плода.
Кольпоцитологическое исследование
Цитологическая картина отделяемого из влагалища во время беременности имеет особенности в связи с отсутствием циклических изменений в организме, замедлением процесса пролиферации влагалищного эпителия и массивной продукцией гормонов. По количеству поверхностных, ладьевидных, промежуточных и парабазальных клеток, эозинофильному и пикнотическому индексам судят о готовности к родам. При нормальном течении II и III триместров картина мазка постоянна и изменяется только в последние 1-2 нед перед родами. Начиная с 39-й недели беременности выделяют четыре цитологические картины влагалищных мазков: I – поздний срок беременности (за 10-14 дней до родов); II – незадолго до родов (за 6-8 дней до родов); III – срок родов (за 1-5 дней до родов); IV – несомненный срок родов (роды наступают в тот же день или в ближайшие 3 дня).
Рентгенологическое исследование
В настоящее время, учитывая отрицательное воздействие ионизирующей радиации на эмбрион и плод, рентгенологическое исследование применяют редко. В конце беременности радиочувствительность плода снижается, в связи с чем рентгенологические исследования в это время менее опасны. В акушерской практике для уточнения изменений костного таза иногда прибегают к рентгенопельвиометрии.
Определение тканевого рО2 у плода
Напряжение кислорода (Р0 ) в тканях плода можно определить полярографическим методом в процессе родов в отсутствие плодного пузыря. Это позволяет осуществить раннюю диагностику внутриутробной гипоксии (острой и хронической) плода. Можно применять внутрии чрескожный полярографические методы определения Р0 в тканях.
Для внутрикожного определения PQ используют открытые микроэлектроды, которые легко и без осложнений вводят в ткани. Метод внутритканевого полярографического определения Р0 обладает известным преимуществом, так как электроды при этом быстрее реагируют на изменеР(32 обладают меньшей инертностью, чем электроды для чрескожного измерения рО2.
Рабочий игольчатый электрод вводят под кожу головки плода на глубину 0,5-0,6 мм после излития околоплодных вод и открытия шейки матки на 4 см и более, электрод сравнения вводят в задний свод влагалища.
Исследование крови плода и новорожденного
Важнейшую информацию о состоянии плода могут дать результаты непо-средственного исследования его крови, полученной из пуповины или его головки.
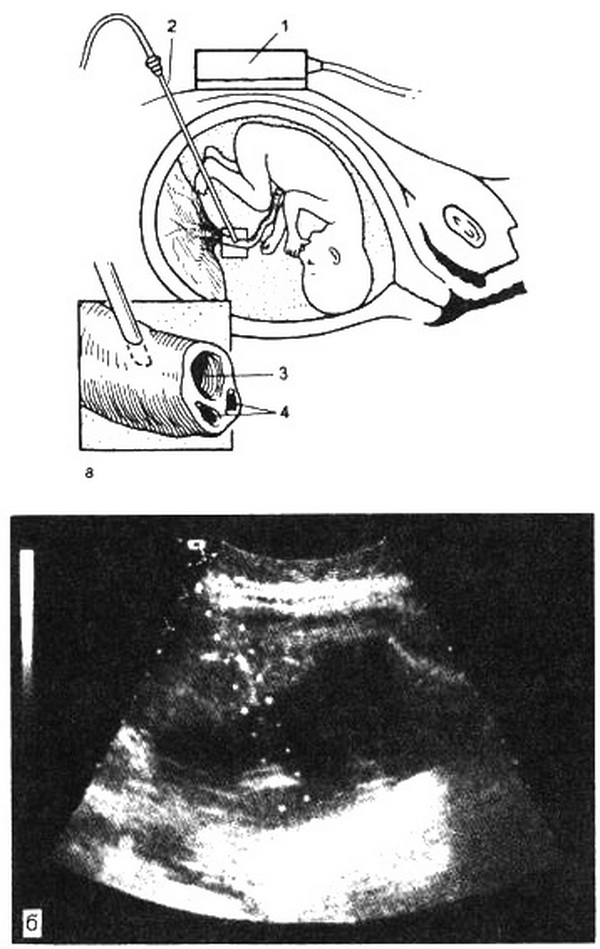
Рис. 4.37. Кордоцентез.
а – схема проведения кордоцентеза: 1 – датчик, 2 – пункционная игла, 3 – пупочная вена, 4 – артерии пуповины; б – выбор направления иглы под контролем УЗИ (пункционная игла).
Кордоцентез (рис. 4.37).
Методика кордоцентеза представляет собой получение крови из сосудов пуповины путем внутриутробной пункции ее под ультразвуковым контролем.
Показания к кордоцентезу разнообразны и включают в себя диагностику врожденной и наследственной патологии (кариотипирование плода), внутриутробного инфицирования, гипоксии плода, анемии плода при иммуноконфликтной беременности. Помимо широкого спектра диагностических задач, использование кордоцентеза позволяет решить и некоторые важные проблемы внутриутробной терапии при гемолитической болезни плода.
Кордоцентез производят после 18 нед беременности. Операцию забора крови плода начинают с установления локализации плаценты и места отхождения пуповины. В случае расположения плаценты на передней стенке матки иглу для аспирации крови проводят трансплацентарно, в случае заднестеночной локализации плаценты иглу вводят трансамнионально, и пуповину пунктируют вблизи места ее отхождения от плаценты. При высокой двигательной активности плода, мешающей проведению пункции, рекомендуется внутримышечное или внутривенное введение плоду препаратов, обеспечивающих его полное, но кратковременное обездвиживание. Для этого используют мышечный нейроблокатор пипекуроний (ардуан) в количестве 0,025-0,25 мг/кг. Объем пробы крови зависит от показаний к кордоцентезу; обычно требуется не более 2 мл.
Риск развития осложнений при проведении кордоцентеза для беременной невысок. Среди осложнений для плода следует отметить преждевременное излитие вод (0,5 %), кровотечение из пунктируемого сосуда (5-10 %), как правило, не длительное и не опасное для жизни плода. Уровень перинатальных потерь не превышает 1-3 %.
Противопоказания к проведению кордоцентеза такие же, как и к амниоцентезу.
Определение кислотно-основного состояния (КОС) крови. В динамике родового акта капиллярную кровь у плода получают из предлежащей части по методу Saling. С этой целью в родовые пути после излитая околоплодных вод вводится металлический тубус амниоскопа с волоконной оптикой. При этом отчетливо виден участок предлежащей части головки или ягодицы, кожу которой с целью создания гиперемии протирают марлевым тампоном. Специальным скарификатором производят пункцию кожных покровов на глубину до 2 мм, после чего собирают кровь (кроме первой капли) в стерильный гепаринизированный полиэтиленовый ка-пилляр без прослоек воздуха и примеси околоплодных вод. Исследование микродоз крови по методу Saling позволяет быстро получить информацию о состоянии плода, однако этот метод является весьма трудоемким и не всегда выполним.
Для определения КОС крови у новорожденного забор крови производят из сосудов пуповины сразу же после рождения или используют капиллярную кровь из пятки ребенка.
При исследовании КОС крови учитывают следующие показатели:
рН – концентрация свободных водородных ионов;
BE – дефицит оснований или избыток кислот;
Рсо2 ~ парциальное напряжение углекислого газа;
Ро2 – парциальное напряжение кислорода.
Биопсия (аспирация) ворсин хориона
Операция, цель которой заключается в получении клеток ворсинчатого хориона для кариотипирования плода и определения хромосомных и генных аномалий (в том числе определение наследственно обусловленных нарушений метаболизма), определения пола плода. Взятие проб проводят трансцервикально или трансабдоминально в сроки от 8 до 12 нед беременности под контролем ультразвука (рис. 4.38). В полость матки вводят стерильный полиэтиленовый гибкий катетер (длиной 26 см и внешним диаметром 1,5 мм) и осторожно, под визуальным контролем, продвигают его к месту локализации плаценты и далее между стенкой матки и плацентарной тканью. Затем шприцем вместимостью до 20 мл, содержащим 3-4 мл питательной среды и гепарин, аспирируют хориальную ткань, которую в дальнейшем исследуют. Возможно взятие проб хориальной ткани и в случаях бихориальной двойни.
Осложнениями биопсии ворсин хориона могут быть внутриматочная инфекция, кровотечения, самопроизвольные выкидыши, образование гематом. К более поздним осложнениям относятся преждевременные роды, малая масса новорожденных (менее 2500 г), пороки развития плода. Перинатальная смертность достигает 0,2-0,9 %.
Противопоказаниями к проведению биопсии хориона могут служить наличие инфекции половых путей и симптомы угрожающего выкидыша.
Фетоскопия
Фетоскопия – непосредственный осмотр плода – используется для выявления врожденной и наследственной патологии. Метод позволяет осмотреть части плода через тонкий эндоскоп, введенный в амниотическую полость, и через специальный канал взять для анализа образцы крови, эпидермиса. Фетоскопия осуществляется как конечный этап генетического обследования при подозрении на врожденную аномалию плода.
Методика введения фетоскопа: после соответствующей обработки кожи под местным обезболиванием в стерильных условиях производят небольшой разрез кожи и троакар, находящийся в канюле, вводят в полость матки. Затем троакар извлекают, получают пробу амниотической жидкости для исследования и в канюлю вводят эндоскоп. При необходимости можно определить глубину введения эндоскопа с помощью ультра-звукового датчика. По достижении плаценты врач может осмотреть сосуды плаценты и произвести забор крови из сосудов пуповины; при невозможности получить пробы крови плода можно взять аспират из плаценты. Ввиду ограниченности поля зрения эндоскопа обычно невозможно осмотреть весь плод за одну процедуру. В связи с этим рекомендуется производить целенаправленный осмотр какой-либо части плода. При необходимости после осмотра плода специальными щипцами производят биопсию нужного участка кожи. По окончании операции инструменты извлекают из матки, проводят кардиомонигорный контроль за состоянием плода и наблюдение за беременной в течение 24 ч.
К осложнениям фетоскопии относятся излитие околоплодных вод, прерывание беременности. Такие осложнения, как кровотечения и развитие инфекции, образование небольших поверхностных гематом на конечностях плода, крайне редки. В связи с возможностью прерывания беременности фетоскопия применяется редко.
Исследование гормонального профиля
Биологические методы диагностики беременности. Среди наиболее распространенных биологических реакций на беременность можно назвать гормональную реакцию Фридмана, Ашгейма – Цондека, гормональную реакцию на лягушках (реакция Галли – Майнини).
Реакция Фридмана. Крольчихе в ушную вену вводят мочу женщины. Если моча содержит ХГ, то через 12 ч после введения мочи у крольчихи происходит овуляция.
Реакция Галли – Майнини, Основана на способности самцов лягушек выделять сперму в эякуляторные протоки под влиянием ХГ, содержащегося в моче беременных женщин.
Тест Ашгейма – Цондека. После инъекции мочи беременной женщины, в которой содержится ХГ, инфантильным самкам мыши массой 6-8 г в их яичниках наблюдают кровоизлияния в фолликулы и формирование желтого тела.
В настоящее время биологические методы диагностики беременности утратили свою ведущую роль и предпочтение отдается иммунологическим методам.
Иммунологические методы диагностики беременности. К иммунологическим методам относятся различные методы определения в сыворотке и в моче хорионического гонадотропина (ХГ) или его р-субъединицы (р-ХГ). Предпочтение отдают радиоиммунологическому методу количественного определения р-ХГ в сыворотке крови, так как он обладает высокой специфичностью и чувствительностью. Положительную оценку заслужили иммуноферментные методы выявления ХГ в моче, а также другие варианты иммунологических тестов (капиллярные, пластиночные). Имеют право на существование такие широко известные серологические методы определения ХГ в моче, как реакция торможения агглютинации эритроцитов или осаждения частии латекса.
Все лабораторные методы диагностики беременности высокоспецифичны: правильные ответы наблюдаются в 92-100 % случаев уже с 9-12-го дня после оплодотворения яйцеклетки. Однако эти методы позволяют установить лишь факт существования беременности без уточнения ее локализации, поэтому не могут быть использованы для дифференциальной диагностики маточной и эктопической беременности.
Агглютинация, или тест фиксации латексными частицами, – метод определения уровня ХГ в моче. ХГ выделяется с мочой уже через 8 дней после оплодотворения. Несколько капель мочи пациентки смешивают с AT и ХГ, затем к этой смеси добавляют латексные частицы, покрытые ХГ. Если ХГ присутствует в моче, он связывается с AT; если ХГ отсутствует, то AT связывается с латексными частицами. Этот экспресс-тест положителен в 95 % случаев, начиная с 28-го дня после оплодотворения.
Радиоиммунологический тест. Исследуемым материалом служит кровь. Определяют количественное содержание бета-субъединиц ХГ в плазме крови.
Радиологический метод. Исследуют кровь. Определяют количество р-субъединиц ХГ, конкурирующего с меченым ХГ за связывание с рецепторами ХГ клеток желтого тела коровы. Эта экспресс-проба достаточно чувствительна, но не столь специфична, как радиоиммунологический тест.
Методы оценки состояния плаценты и плода. В процессе беременности для оценки функции плаценты и состояния плода проводится определение следующих гормонов: хорионического гонадотропина (ХГ), плацентарного лактогена (ПЛ), прогестерона, эстрогенов, пролактина, дегидроэпиандростерона сульфата (ДГЭАС), тиреоидных гормонов и кортикостероидов.
Для определения уровня гормонов используются следующие методы:
1. однократный анализ мочи;
2. анализ суточной мочи (компенсирующий суточные колебания секреции гормонов);
3. исследование крови беременной;
4. определение содержания гормонов в амниотической жидкости.
В настоящее время содержание большинства гормонов в биологических Жидкостях определяется радиоиммунологическим методом. Содержание ХГ в крови и моче можно определять биологическим, иммунологическим и радиологическим методами. Иммунологические (в том числе радиоиммунологические) тесты обладают более высокой специфичностью и чувствительностью, чем биологические методы.
Знание нормальных показателей содержания гормонов (см. Физиология беременности) необходимо для выявления патологии беременности и степени риска развития осложнений для плода. При этом необходимо учитывать суточные колебания уровня гормонов. Дефицит ряда гормонов, необходимых для нормального течения беременности, может быть скорригирован их экзогенным введением.






