Строение ферментов
Каждый фермент имеет определенное строение. Как и у всех белков, оно зависит от его первичной структуры, которая определяет третичную и четвертичную структуры, т. е. форму глобулы и ее пространственную конфигурацию. Результаты исследований показали, что молекулы ферментов во много раз больше, чем молекулы веществ, которые они активируют в реакциях. Ферменты, как правило, являются глобулярными белками. Часто они образуют комплексы с небелковыми компонентами: металлами (цинком, железом, марганцем, медью и др.), низкомолекулярными органическими соединениями, витаминами. Например, в состав каталазы входит железо; витамин B3 (или PP) является компонентом окислительно-восстановительных ферментов; витамин В, входит в состав ферментов, отщепляющих углерод от молекул органических соединений.
Ферменты, как вещества белковой природы, имеют большую молекулярную массу, которая колеблется от нескольких тысяч до миллиона. Например, трипсин имеет молекулярную массу 40 000, а синтетаза высших жирных кислот (ВЖК), катализирующая синтез жирных кислот, относится к ферментам-гигантам с молекулярной массой более 1 000 000. Она состоит из целого конвейера белков, объединенных в одну суперструктуру. Как правило, для высокомолекулярных ферментов характерна четвертичная структура. Например, фермент каталаза, расщепляющий пероксид водорода, состоит из шести субъединиц.
В ферменте различают три центра: субстратный, активный и регуляторный (рис. 5). Непосредственно в реакции участвует лишь небольшая часть белковой молекулы, состоящая обычно от 3 до 15 остатков аминокислот. Это каталитический, или активный, центр фермента. Остальные аминокислоты белка определяют конфигурацию молекулы, связывают субстрат, присоединяют дополнительные ионы. Активный центр является главной частью фермента. Здесь происходит видоизменение субстрата, собственно реакция, образуются продукты или продукт. В некоторых случаях функции активного центра выполняет небелковый компонент, например витамин, который в этом случае связан с ферментом и составляет единое целое.
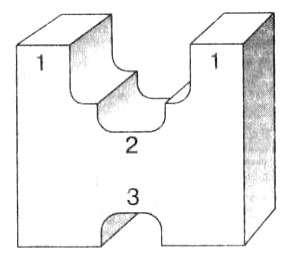
Рис. 5. Строение фермента: 1 — субстратный центр; 2 — активный центр; 3 — регуляторный центр
Субстратный центр служит «якорной» площадкой для соединения фермента с субстратом. При этом между ними возникают определенные связи, позволяющие ферменту удерживать субстрат. Активный и субстратный центры ферментов часто находятся рядом или совпадают.
Для работы этих центров, т. е. присоединения субстрата и катализа реакции, необходима определенная форма белка-фермента. Фермент сохраняет свою активность до тех пор, пока в нем поддерживается специфическая конфигурация каталитического центра, что связано с третичной и четвертичной структурами белка.
Конфигурация белковой молекулы может изменяться таким образом, чтобы обеспечить быстрый доступ веществ в активный центр или, наоборот, затормозить реакцию. Эту функцию выполняет регуляторный центр фермента. К нему могут присоединяться неорганические ионы, низкомолекулярные вещества, которые видоизменяют форму молекулы фермента таким образом, чтобы способствовать быстрому соединению с субстратом или, наоборот, невозможности соединения.






