Строение транспортной РНК и кодирование аминокислот
Транспортные РНК (тРНК) представляют собой небольшие молекулы с количеством нуклеотидов от 70 до 90. На долю тРНК приходится примерно 15 % всех РНК клетки. Функция тРНК зависит от ее строения. Изучение структуры молекул тРНК показало, что они свернуты определенным образом и имеют вид клеверного листа (рис. 20). В молекуле выделяются петли и двойные участки, соединенные за счет взаимодействия комплементарных оснований. Наиболее важной является центральная петля, в которой находится антикодон — нуклеотидный триплет, соответствующий коду определенной аминокислоты. Своим антикодоном тРНК способна соединяться с соответствующим кодоном на иРНК по принципу комплементарности.
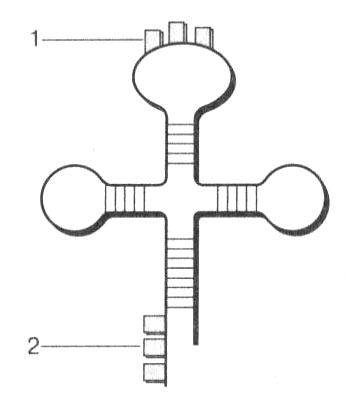
Рис. 20. Строение молекулы тРНК: 1 — антикодон; 2 — место присоединения аминокислоты
Каждая тРНК может переносить только одну из 20 аминокислот. Значит, для каждой аминокислоты имеется по меньшей мере одна тРНК. Так как аминокислота может иметь несколько триплетов, то и количество видов тРНК равно числу триплетов аминокислоты. Таким образом, общее число видов тРНК соответствует числу кодонов и равно 61. Трем стоп-кодам не соответствует ни одна тРНК.
На одном конце молекулы тРНК всегда находится нуклеотид гуанин (5'-конец), а на другом (3'-конце) всегда три нуклеотида ЦЦА. Именно к этому концу идет присоединение аминокислоты (рис. 21). Каждая аминокислота присоединяется к своей специфической тРНК с соответствующим антикодоном. Механизм этого присоединения связан с работой специфических ферментов — аминоацил-тРНК-синтетазами, которые присоединяют каждую аминокислоту к соответствующей тРНК. Для каждой аминокислоты имеется своя синтетаза. Соединение аминокислоты с тРНК осуществляется за счет энергии АТФ, при этом макроэргическая связь переходит в связь между тРНК и аминокислотой. Так происходит активирование и кодирование аминокислот.
Этапы биосинтеза белка. Процесс синтеза полипептидной цепи, осуществляемый на рибосоме, называется трансляцией. Информационная РНК (иРНК) является посредником в передаче информации о первичной структуре белка, тРНК переносит закодированные аминокислоты к месту синтеза и обеспечивает последовательность их соединений. В рибосомах осуществляется сборка полипептидной цепи.
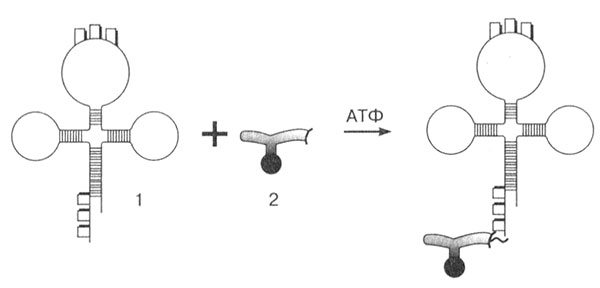
Рис. 21. Активирование и кодирование аминокислоты: 1 — тРНК; 2 — аминокислота
В рибосоме имеются три центра, с которыми связываются молекулы РНК: один центр для иPHК и два — для тРНК. Одна тРНК с аминокислотой удерживается в аминоацильном центре, а другая — в пептидном центре, где идет рост полипептидной цепи.
Первый этап — инициация. Синтезированная в процессе транскрипции иPHК выходит из ядра и направляется в цитоплазму к месту синтеза белка — рибосоме. За счет различных белковых факторов и энергии АТФ происходит соединение иPHК и двух субъединиц рибосом, которые до этого момента находились в диссоциированном состоянии. Прежде чем рибосома начнет синтез полипептидной цепи, к иРНК должна присоединиться особая молекула — инициаторная тРНК с аминокислотой. С нее всегда начинается синтез белка. По принципу комплементарности тРНК своим антикодоном соединяется с кодоном на иРНК и входит в рибосому. Этот кодон на иPHК называется старт-кодоном.
В результате взаимодействия всех компонентов образуется комплекс: рибосома — иРНК — тРНК-инициатор — аминокислота.
Вторая стадия — элонгация. Это стадия роста полипептидной цепи. Далее начинается сборка полипептидной цепи. Следующая тРНК с аминокислотой по принципу комплементарности антикодона с кодоном соединяется с иPHК и входит в рибосому. Первая тРНК закрепляется в пептидном центре, а вторая тРНК — с аминокислотой в аминоацильном центре. Аминокислоты сближаются друг с другом, между ними возникает пептидная связь, и образуется дипептид. При этом первая тРНК освобождается и, покидая рибосому, тянет за собой иPHК, которая продвигается на один триплет.
Вторая тРНК с дипептидом перемещается в пептидный центр, а в рибосому входит третья тРНК с аминокислотой (рис. 22). Весь процесс далее вновь и вновь повторяется. иРНК, последовательно продвигаясь через рибосому, каждый раз вносит новую тРНК с аминокислотой и выносит освободившуюся тРНК. Постепенно идет наращивание полипептидной цепи. Весь процесс обеспечивается деятельностью ферментов и энергией макроэргических соединений (АТФ и др.).
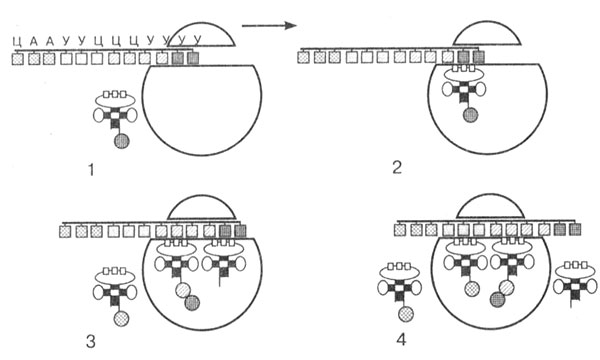
Рис. 22. Схема биосинтеза полипептидной цепи. Стрелкой показано направление движения иPHК
Последний этап — терминация. Как только в аминоацильный центр попадает стоп-кодон, синтез прекращается. Место тРНК занимает в этом случае специфический белок-фермент, который осуществляет гидролиз связи между последней тРНК и синтезированным белком. Рибосома снимается с иPHК и распадается на две субъединицы, последняя тРНК также освобождается и попадает вновь в цитоплазму. Синтезированная молекула белка поступает в ЭПС или цитоплазму, где претерпевает изменения и приобретает соответствующие структуры.
Процесс трансляции обычно осуществляется многократно. Одна иPHК может соединяться с несколькими рибосомами, образуя поли рибосому.; или полисому, на которой идет одновременно синтез многих молекул одного белка (рис. 23).
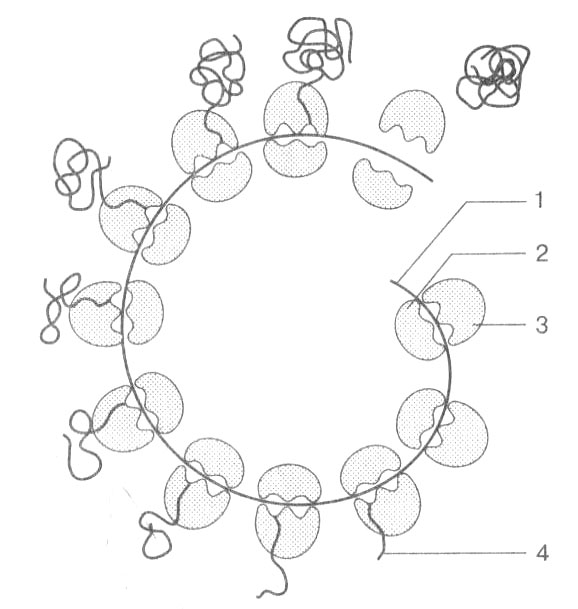
Рис. 23. Полисома: 1 — иPHК; 2 — малая субъединица рибосомы; 3 — большая субъединица рибосомы; 4 — синтезируемая полипептидная цепь
Если синтез происходит на гранулярной эндоплазматической сети, то поли пептидная цепь поступает в канальца эндоплазматической сети. Здесь она приобретает свою окончательную структуру и превращается в молекулу белка. Далее белок поступает в аппарат Гольджи и выносится из клетки. Если синтез происходит на рибосомах в цитоплазме, то синтезированные молекулы остаются и используются клеткой.
Весь процесс синтеза одного белка длится от 20 до 500 с и зависит от длины полипептида. Например, в рибосоме кишечной палочки белок из 300 аминокислот синтезируется приблизительно за 20 с.






