Вирусная инфекция
В последние годы наибольшее распространение получило представление о вирусной этиологии ДКМП, которая рассматривается, тем самым, как исход вирусного миокардита, главным образом энтеровирусного. Это предположение было впервые высказано V. Sanders (1963) и G. Burch (1964) и снискало в последующем многочисленных приверженцев.
Основаниями для гипотезы о связи возникновения ДКМП с энтеровирусной инфекцией служат:
— данные проспективных клинических наблюдений случаев развития ДКМП после перенесенного вирусного миокардита,
— результаты ретроспективных серологических исследований,
— непосредственное выявление вирусной РНК в миокарде больных ДКМП,
— создание экспериментальной модели ДКМП у мышей как
исхода миокардита, вызываемого вирусами.
Клинические наблюдения развития ДКМП после перенесенного вирусного миокардита. Заподозрить связь ДКМП с вирусной инфекцией позволяют многочисленные клинические наблюдения, согласно которым вирусоподобное заболевание с лихорадкой предшествует появлению симптомов поражения миокарда в 20-50% случаев (Ю. И. Новиков, 1988; R. Fowles с соавт., 1979;
V. Fuster с соавт., 1981, и др.). Среди наблюдавшихся нами (Е. Н. Амосова, 1988) 224 больных ДКМП это имело место у 27%. Следует учитывать также возможность асимптоматичного течения вирусной инфекции, что отмечается не менее чем у 50% зараженных (N. Grist, 1978). Так, при длительном наблюдении за практически здоровыми лицами, у которых в смывах из носоглотки были выделены вирусы Коксаки группы В, Е. Orinius (1968) в 2% случаев наблюдал беспричинное развитие застойной сердечной недостаточности, что могло служить проявлением ДКМП.
Сохранение или прогрессирование кардиомегалии, застойной сердечной недостаточности и патологических изменений на ЭКГ у отдельных больных, перенесших острый вирусный мио/пери/ кардит, отмечено рядом авторов (табл. 2). Описывая проявления дисфункции миокарда в подобных случаях, большинство исследователей не пользовались, однако, термином "ДКМП", что было связано с отсутствием до начала 80-х годов унифицированного определения и критериев диагностики этого заболевания и недостаточным знакомством с ним врачей. Как видно из табл.2, большинство этих исследований базируются на небольшом материале, не превышающем 50 случаев, без применения таких информативных методов исследования, как эхо- или ангиокардиография. С другой стороны, существует мнение о доброкачественном течении острого вирусного миокардита у взрослых с наступлением полного выздоровления (Ю. И. Новиков, 1988; N. Grist, 1980, и др.). Подобная разноречивость обусловлена, по-видимому, недостаточной надежностью клинических критериев диагностики миокардита без подтверждения результатами ЭМБ.
Убедительные доказательства возможной связи ДКМП с вирусным миокардитом были получены при обнаружении в ЭМБ части таких больных признаков так называемого заживающего миокардита (Н. Aretz с соавт., 1987). Согласно Далласским критериям 1984 г., они включают в себя скудную воспалительную клеточную инфильтрацию в интерстиции, преимущественно состоящую из лимфоцитов, в сочетании с различными по своей глубине дистрофическими изменениями соседних мышечных волокон, вплоть до некроза, а также умеренной гипертрофией кардиомиоцитов и интерстициальным фиброзом.
Таблица 2. Частота развития ДКМП у перенесших острый вирусный миокардит
|
Источник |
Критерии диагноза миокардита и ДКМП |
Частота ДКМП,% |
|
|
G. Sainani с соавторами (1968) |
22 |
Клинические |
9 |
|
W. Smith (1970) |
42 |
» |
7 |
|
У.КИаигаиН.МоШа(1979) |
11 |
» |
27 |
|
М. Hayakawa с соавторами (1983) |
20 |
» |
10 |
|
К. Daly с соавторами (1984) |
12 |
» |
17 |
|
S. Das с соавторами (1985) |
18 |
» |
11 |
|
М. Billingham и Н. Tazelaar (1986) |
20 |
Данные ЭМБ |
40 |
|
Р. Quigley с соавторами (1986) |
23 |
» |
52 |
|
G. Levy с соавторами (1988) |
68 |
Клинические |
16 |
|
J. Jiang с соавторами (1992) |
35 |
» |
37 |
Верифицировать развитие ДКМП как исхода острого миокардита позволил ряд наблюдений с использованием морфологического анализа биопсийного материала в динамике (К. Daly с соавт., 1984; Y. Zu-xi с соавт., 1984; G. Dee с соавт., 1985; V.Regitz с соавт., 1985). В более крупном исследовании М. Billigham и Н. Tazelar (1986) из 20 больных с патогистологически подтвержденным диагнозом острого миокардита у 8-40% при повторном исследовании ЭМБ через 6-12 мес были обнаружены изменения, соответствовавшие диагнозу ДКМП. Клинически у всех этих пациентов отмечалась выраженная застойная сердечная недостаточность, по поводу чего троим больным была выполнена трансплантация сердца. Развитие клинико-морфологических признаков ДКМП в течение 5 лет после подтвержденного с помощью ЭМБ миокардита было отмечено также Р. Quigley с соавторами (1986) у 12-52% из 23 наблюдавшихся больных .
Результаты ретроспективных серологических исследований.
Косвенным доказательством связи ДКМП с вирусной инфекцией может служить обнаруженная в ряде исследований повышенная частота выявления в крови таких больных, по сравнению со здоровыми и пациентами с другими сердечно-сосудистыми заболеваниями, нейтрализующих и комплементсвязывающих антител к кардиотропным вирусам, преимущественно энтеровирусам Коксаки группы В (табл. 3). Согласно результатам проведенных нами (В. П. Широбоков, Е. Н. Амосова, О. Н. Корнюшенко, 1987) исследований сероконверсии в отношении вирусов Коксаки В 1-6, в группе больных ДКМП (n=33) по сравнению с донорами (п=25) значительно большее распространение имели уровни нейтрализующих IgG антител к сероварам В1, В3, В4 и В6 в титрах > 1:64 (рис. 1). Эти титры принято считать диагностически значимыми в отношении текущей или перенесенной вирусной инфекции (Т. А. Кравченко с соавт., 1984, и др.). Особого внимания заслуживало обнаружение у больных ДКМП типоспецифических антител к трем из шести сероваров в титрах > 1:128, которые у здоровых лиц практически не встречались (рис.1).
Таблица 3. Частота обнаружения антител к энтеровирусам у больных ДКМП и лиц контрольной группы
|
Источник |
Вид антител |
Частота,% |
Р |
||
|
ДКМП |
Контрольная группа |
||||
|
C.Kawai(1971) |
IgG |
62 |
46 |
25 |
<0,05 |
|
A. Fatase с соавторами (1979) |
IgG |
96 |
72 |
52 |
<0,05 |
|
G. Cambridge с соавторами (1979) |
IgG |
100 |
30 |
2 |
<0,01 |
|
Y.Kitaura(1981) |
IgG |
126 |
42 |
24 |
<0,05 |
|
Р. Muir с соавторами (1996) |
IgM |
78 |
56 |
28 |
< 0,005 |
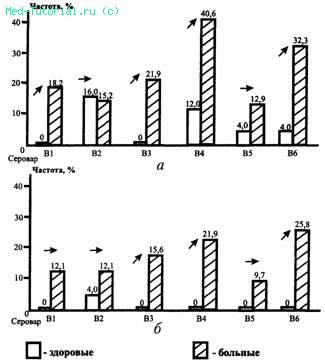
Рис. 1. Частота обнаружения антител к вирусам Коксаки В 1—6 в титрах > 1/64 (а) и > 1/128 (б) у больных ДКМП и здоровых лиц
В целом повышение уровней антител к одному или более серовару вирусов Коксаки В в титре более 1:64 зарегистрировано у 87,9% больных и лишь 36,0% доноров, в титре более 1:128 — соответственно у 66,7 и 8,0% и в титре свыше 1:256 - у 45,5 и 0% (все Р<0,001).
Увеличение встречаемости антител к вирусам Коксаки В у обследованных нами больных ДКМП сопровождалось значительным повышением средних уровней этих антител: к серовару В6 — в 4 раза, к ВЗ — в 2,5 раза, к В1 — на 71% и к В4 — на 62, 5% (все Р<0,001). Следует подчеркнуть, что отмеченная нами повышенная выявляемость у больных ДКМП сравнительно высоких титров нейтрализующих антител — более 1:64 и особенно 1:128, практически не встречавшихся у лиц контрольной группы, может служить более убедительным доказательством в пользу этиологической связи этого заболевания с Коксаки инфекцией, чем данные ряда авторов (С. Kawai, 1971; Т. Takatsu, 1978; G. Cambridge с соавт., 1979), касающиеся относительно низких уровней антител — 1:16-1:32.
Стойкость сохранения повышенных титров противовирусных антител в крови больных ДКМП, несмотря на давность заболевания, подчас исчисляющуюся несколькими годами, может объясняться как персистенцией в организме вирусной инфекции, так и реинфекцией. Существенным ограничением серологической диагностики является значительная популяционная частота вирусоносительства среди проживающих на одной территории и обследованных в одно и то же время. Так, Р. Keeling с соавторами (1994) не удалось обнаружить никаких различий выявляемости IgM антител к вирусам Коксаки В у больных ДКМП по сравнению как со здоровыми лицами, обслуживаемыми теми же врачами, так и родственниками этих больных, ведущих общее хозяйство.
Выявление энтеровирусной РНК в миокарде больных ДКМП.
Большое внимание уделялось поискам доказательств присутствия вирусного возбудителя в миокарде больных ДКМП. За обнадеживающими сообщениями о двух случаях обнаружения в ЭМБ этих пациентов вирусоподобных частиц (M. Gardner с соавт. 1967, Р. Lowry с соавт., 1982) и в одном — вирусного антигена (С. Kawai, 1971) последовали, однако, многочисленные отрицательные результаты (Т. Takatsu, 1978; Н. Bolte с соавт., 1982; К. Daly с соавт., 1984, и др.).
Следует отметить, что отсутствие вируса в миокарде не дает достаточных оснований для исключения вирусной этиологии заболевания, поскольку, как было показано в экспериментальной модели Коксаки В миокардита мышей, возбудитель определяется в миокарде только в первые 5-7 дней после заражения (Е. Ф. Бочаров и О. П. Шестенко, 1984; A. Matsumori и С. Kawai, 1982;
M. Reyes и A. Lerner, 1985, и др.). Существенное значение имеет также несовершенство рутинных морфологических методов выявления вирусных частиц, что было блестяще доказано более поздними исследованиями с использованием современных технологий молекулярной биологии.
Первые прямые доказательства связи ДКМП с вирусной инфекцией были получены N. Bowles с соавторами (1986) при помощи специально синтезированной клонированной ДНК, комплементарной к РНК вирусов Коксаки группы В, что позволило обнаружить в биоптатах миокарда примерно 50% больных острым миокардитом и ДКМП вирусспецифическую РНК. Сходные результаты были получены у больных с ДКМП другими исследователями (V. Wiegand с соавт., 1990; L. Archard с соавт., 1991), использовавшими более специфические молекулярные маркеры к вирусам Коксаки В2 и ВЗ. При этом вирусная РНК не была обнаружена ни в одном из исследованных здоровых сердец.
Более чувствительным методом выявления нуклеотидов является гибридизация in situ, позволяющая обнаруживать отдельные инфицированные вирусами клетки в массе непораженных. При этом комплементарная ДНК или РНК инкубируется непосредственно со срезами ткани миокарда, а не с предварительно выделенной из нее РНК (Р. Keeling и S. Тгасу, 1994). С помощью этого метода энтеровирусная РНК была выявлена как в кардиомиоцитах, находящихся в очагах хронического воспаления, так и в мышечных волокнах с признаками дистрофии и гипертрофии при отсутствии в ЭМБ явлений активного воспаления (R. Kandolf с соавт., 1991), что подтверждает возможность перехода острого или подострого вирусного миокардита в ДКМП.
Еще большую точность обнаружения вирусной РНК в ЭМБ обеспечивает использование ферментативного усиления клонированной ДНК, комплементарной к РНК вирусов Коксаки, содержащихся в ткани сердца, с помощью термостабильной ДНК-полимеразы.
С использованием этого метода, получившего в последние годы все большее распространение, вирус-специфическая РНК была обнаружена в ЭМБ 7-30% больных миокардитом, в том числе в стадии заживления, и примерно такой же части больных ДКМП — 12-67% (табл. 4), что может свидетельствовать о персистенции вируса. В то же время имеются также сведения об отрицательных результатах попыток обнаружения вирусной РНК в ЭМБ больных ДКМП, что, возможно, связано с очаговым характером инфицирования. С другой стороны, описаны и случаи выявления вирусного генома у здоровых лиц и больных другими сердечно-сосудистыми заболеваниями, в частности, ИБС. Последнее свидетельствует о том, что обнаружение вирусной РНК в миокарде не может служить неопровержимым доказательством активной инфекции или патогенности и может быть связано с интеркуррентной инфекцией, что поднимает вопрос о необходимости дифференцировать кардиовирулентные кардиотропные возбудители от авирулентных.
Имеются сведения о выявлении в ЭМБ больных ДКМП также последовательности нуклеотидов, специфичных для цитомегаловирусов (в 14-22%, по данным: G. Friman с соавт., 1995 и U. Schonian с соавт., 1995) и РНК вируса гепатита С (A. Matsumori и S. Sasayama, 1996).
Персистенция энтеровирусов в миокарде больных ДКМП при отсутствии морфологических признаков воспаления, по-видимому, обусловлена образованием мутантов, утративших способность к ресинтезу структурных белков и репликации, возможно, в результате изменения специфичности РНК-полимеразы (L. Archard с соавт., 1991). Это, вероятно, отчасти объясняет невозможность выделения вирусов из биопсийного материала.
Представляет интерес обнаруженное относительно недавно неблагоприятное прогностическое значение наличия энтеровирус пой РНК в миокарде больных ДКМП. Так, по данным N. Bowles с соавторами (1989), вирусная РНК чаще выявлялась у больных с резко выраженной застойной сердечной недостаточностью, которым выполнялась трансплантация сердца. Н. Why с соавторами (1994) отметил связь ее обнаружения с повышенной летальностью в течение последующих 11-50 мес (25% по сравнению с 4% больных, у которых вирусная РНК не определялась). Подобное неблагоприятное влияние наличия в миокарде больных ДКМП вирусспецифической РНК на прогноз, возможно, связано с ее способностью вызывать повреждение кардиомиоцитов и, тем самым, прогрессирование миокардиальной дисфункции. Об этом может свидетельствовать выявление вирусной РНК у 4 из 16 больных ДКМП, у которых обнаруживалась фиксация в миокарде меченых индием-111 моноклональных антимиозиновых антител, при отсутствии случаев определения этой РНК среди аналогичных пациентов, у которых захват данного изотопа отсутствовал (V. Marti с соавт., 1996).
Таблица 4. Частота обнаружения специфичной для энтеровирусов РНК в миокарде больных ДКМП, миокардитом и в контрольной группе здоровых и больных другими сердечно-сосудистыми заболеваниями
|
Источник |
Метод определения |
Частота обнаружения вирусной РНК,% |
||
|
ДКМП |
Миокардит |
Контрольная группа |
||
|
N. Bowles с соавторами (1989) |
Клонирование |
6/21 (29%) |
1/19(5%) |
|
|
L. Archard с соавторами (1991) |
» |
35/82 (43%) |
21/47 (47%) |
0/39 (0%) |
|
V. Wiegand с соавторами (1990) |
» |
1/16 (17%) |
0/8 (0%) |
|
|
A. Easton и R.Eglin(1988) |
Гибридизация |
6/13 (46%) |
||
|
R.Kandolf и P.Hofschneider (1989) |
» |
18/80 (23%) |
0/53 (0%) |
|
|
0. Jin с соавторами (1990) |
Ферментативное усиление с помощью ДНК-полимеразы |
3/20 (15%) |
2/28 (7%) |
0/9(0%) |
|
L. Weiss с соавторами (1992) |
» |
5/11 (45%) |
9/24(38%) |
|
|
Р. Keeling с соавторами (1992) |
» |
6/50 (12%) |
13/75(17%) |
|
|
J. Petitjean с соавторами (1992) |
» |
30/45 (67%) |
3/10 (30%) |
25/50 (50%) |
|
Н. Koide с соавторами (1992) |
» |
8/25 (32%) |
3/9 (33%) |
|
|
Р. Muir с соавторами (1993) |
» |
4/18 (22%) |
2/15(13%) |
|
|
М. Satoh с соавторами (1994) |
» |
17/35 (49%) |
0/10(0%) |
|
|
S. Fujoka с соавторами (1996) |
» |
6/31 (19%) |
5/28 (18%) |
5/23(22%) |
|
J. Liljeqvist с соавторами (1993) |
» |
0/35 (0%) |
(0%) |
|
|
М. Grasso с соавторами (1992) |
» |
0/21 (0%) |
0/20 (0%) |
|
Экспериментальная энтеровирусная модель ДКМП. Как впервые показали W. Abelman с соавторами (1975) и С. Adesanya с соавторами (1976), у части мышей, перенесших острый миокардит, вызванный заражением вирусами Коксаки группы В, через 6-12 мес сохранялась стойкая дисфункция сердечной мышцы. При морфологическом исследовании миокарда этих животных при отсутствии воспалительной инфильтрации определялись гипертрофия мышечных волокон, фиброз и заместительный склероз, то есть изменения, сходные со структурным субстратом ДКМП человека (М. Reyes с соавт., 1981; J. O'Connell, 1983; С. Kishimoto с соавт., 1985, и др.). При этом в миокарде животных стойко сохранялась вирусспецифическая РНК (В. Куй с соавт., 1992; L. Wee с соавт., 1992). Аналогичная животная модель ДКМП получена при заражении мышей вирусом энцефаломиокардита (A. Matsumori и С. Kawai, 1982) и кроликов коронавирусами (L. Alexander с соавт., 1992). При этом воспалительная инфильтрация миокарда, сопровождавшая признаки застойной сердечной недостаточности в острой и подострой стадии заболевания, сменялась развитием дилатации и умеренной гипертрофии миокарда желудочков с распространенным интерстициальным фиброзом. Эти данные позволяют предполагать, что ДКМП может развиваться уже спустя 3 мес после вирусной инфекции.
Выраженность вирус-индуцированного поражения сердца у мышей отличается, однако, значительной вариабельностью, и для возникновения глубокого поражения миокарда, сходного с его изменениями при ДКМП человека, требуется ряд дополнительных факторов. Кроме вирулентности вируса, к ним относятся пониженное питание и повышенная физическая активность животных, а также генетическая предрасположенность и, вероятно, определенный эндокринный фон. Так, экспериментальная модель вирусного миокардита с исходом в ДКМП воспроизводится лишь у мышей строго определенных линий, преимущественно самцов, кастрация которых приводит к уменьшению глубины поражения миокарда. С другой стороны, введение самкам тестостерона, а также прогестерона, дает эффект, аналогичный вирусному поражению самцов, за счет увеличения количества инфицированных вирионами кардиомиоцитов и повышения концентрации в них вирусных частиц (S. Huber с соавт., 1982; A. Ansar с соавт., 1985).
В целом за последние 10 лет накопились достаточно убедительные экспериментальные и клинические данные о вероятной вирусной этиологии, по крайней мере, части случаев ДКМП, в которых это заболевание можно рассматривать как исход острого вирусного миокардита. При этом вирус, инициировав патологический процесс, длительно сохраняется в миокарде, по-видимому, способствуя усугублению его поражения.
