Аллергия пищевая
По замечанию Р.А. Грегори (1981), желудочно-кишечный тракт «является самым большим и наиболее сложным эндокринным органом», в котором эндокриноподобными клетками нарабатываются разнообразные пептиды. Нейросекреторные гранулы в составе нейронов, G-, D-клетки секретируют разнообразные нейропептиды в виде гастрина, соматостатина, бомбезина, нейротензина, вещества Р, энкефалинов, простагландинов и др. (Д.М. Полак, С.Р. Блум, 1981, и др.).
Среди многочисленных нейропептидов следует выделить те, которые обеспечивают саморегуляцию такой сложной системы, как желудочно-кишечный тракт. В их числе: соматостатин — мощный ингибитор высвобождения гастрина и секреции кислоты в желудке; холецистокинин — стимулятор сокращения желчного пузыря и секреции ряда ферментов поджелудочной железы, моторики желудка и кишечника; вазоактивный кишечный пептид — мощное сосудорасширяющее средство, ингибитор секретообразующей функции желудка, обусловленной гистамином, и стимулятор выброса инсулина на фоне гипергликемии; вещество Р — усиливающее перистальтику кишечника, секрецию слюнных желез; бомбезин — стимулятор выброса гистамина, ферментов поджелудочной железы, двигательной активности кишечника, желчного пузыря; энкефалины (эндорфины) — эндогенные опиаты, контролирующие болевые ощущения; различные гетерогенные гастрины — мощные стимуляторы желудочной секреции (с различной функциональной активностью G-клеток и большой вариабельностью их распределения — рецепторов гастрина); простагландины — мощные ингибиторы желудочной секреции, обеспечивающие процессы регенерации слизистых оболочек и защиту их от агрессивной среды. Наряду с этим в желудке существует самостоятельная система гистаминообразования с Н2-гистаминорецепцией, которая является одним из каскадов регуляции пищеварения.
В связи с этим проблема пищевой аллергии ассоциируется со сложной анатомо-физиологической системой пищеварения, роль которой в развитии различных системных реакций крайне велика (отеки Квинке разной локализации, рецидивирующая крапивница, неспецифические ложноаллергические реакции в виде нейродермита, ипохондрии, неврозоподобных и сердечно-сосудистых расстройств).
Этиология
Этиология пищевой аллергии сложна и противоречива. Никто не сомневается, что пищевая аллергия есть, но наряду с ней существует непереносимость пищевых продуктов в виде различных преходящих и непреходящих состояний, связанных с врожденными и приобретенными ферментопатиями, с генетически детерминированными заболеваниями в виде лактазной, галактазной недостаточности, целиакии (глютеновой энтеропатии) или в виде гистаминолиберации при употреблении клубники, земляники и др., продуктов, богатых тирамином, — например консервированной рыбы (Р.С. Барнетсон, М.Х. Лессоф, 1986; А.М. Ногаллер, 1983, и др.).
В связи с этим А.М. Ногаллер (1983) отмечает, что провоцировать похожие клинические проявления могут пищевые аллергены в виде продукта питания (пищевая аллергия), химические примеси в качестве пищевой добавки к продукту питания (алиментарная аллергия) или пыльца злаковых растений, например, в хлебобулочных изделиях (дигестивная аллергия) — см. Пищевые аллергены.
Кстати, при дигестивном типе реакций желудочно-кишечный тракт часто рассматривается с позиции «шокового органа» в случаях системных проявлений при сывороточноподобной реакции, сывороточной болезни, глистной инвазии, дисбактериозе, ферментопатии и др.
Эрль Лиз (1994) оригинально замечает, что пищевая аллергия «подобна зыбучему песку», может весьма варьировать и зависит от многих внешних обстоятельств — стрессов, непереносимости пищевого продукта, т. е. может быть не связана с проблемой сенсибилизации к конкретному пищевому продушу, тем более что клинические проявления пищевой аллергии и пищевой непереносимости практически идентичны. Особенно ярко это проявляется с первого года жизни ребенка.
Видимо, неслучайно в данной проблеме особое место занимает описание различного генеза реакций на молоко. Это наглядно продемонстрировано в монографии С. П. Бахна, Д.К. Хейнер (1985) «Аллергия к молоку».
На примере аллергических реакций к аллергенам цельного молока можно видеть сложный спектр его сенсибилизирующих компонентов — бета-лактоглобулин, казеин, альфа-лактоглобулин, гамма-глобулин, сывороточный альбумин, включая различные потенциальные примеси в виде разнотравья (амброзия, примула, тимофеевка и др.), лекарственных добавок, используемых при лечении маститов или при приготовлении комбикорма. Аллергия на компоненты молока в одних случаях может запускаться следовыми количествами бета-лактоглобулина в виде тяжелых реакций, в других — при больших количествах аллергена, не сопровождаясь положительными реакциями на тест при аллергологическом тестировании.
Весьма распространен аллергенный компонент яиц в виде термостабильного овомукоида и термолабильных овальбумина, лизоцима, включая противогриппозную вакцину и вакцину против клещевого энцефалита, содержащие примесь тканей куриного вибриона, а также различного вида сдобу с наличием термостабильного овомукоида.
Аллергены рыбных продуктов, устойчивые к тепловой и ферментативной обработке, в виде саркоплазматических белков опасны для сенсибилизированных лиц не только при употреблении их в пищу, но и при соприкосновении с ними в виде водяных паров при варке рыбы, аэрозолей при механической переработке. Большая часть аллергенных субстанций не видоспецифична с высокоспецифичной широкораспространенной перекрестной сенсибилизацией, особенно это касается ракообразных — креветок, устриц, раков, крабов, лангуста, омаров.
Среди аллергенных компонентов мясных изделий обращает на себя внимание глобулин бычьей сыворотки, который по химическому строению и иммунологическим свойствам близок к бета-лактоглобулину коровьего молока. Вот почему столь часто встречается непереносимость говядины и коровьего молока. Кстати, белки и глютеин как компоненты аллергенов из злаков, образующих клейковину, также часто имеют перекрестную сенсибилизацию с лактоглобулином молока.
Многие аллергены из злаков вызывают перекрестную сенсибилизацию, в частности рис и кукуруза, рожь, пшеница и кукуруза, бобы и горох.
Что касается семейства пасленовых (картофеля, помидоров, баклажанов, перца), то их аллергенные компоненты содержатся в алиментарных токсинах, представленных в помидорах томатином, в картофеле — соланином. Наряду с этим томаты сами содержат большое количество гистамина и отдельные их белковые фракции могут высвсбождать биологически активные вещества, способные активировать комплемент.
На неспецифической основе обладают гистаминолиберацией такие пищевые продукты, как клубника, цитрусовые, бананы, кофе, лимоны и др.
Актуальную проблему в алиментарной аллергии представляют многочисленные пищевые добавки в виде красителей (тартразин, обозначаемый символом Е102), антиоксидантов и консервантов (сульфиты — бисульфит натрия, салицилаты и др.), вкусовых и ароматических добавок (нитриты и нитраты в составе сосисок, сарделек, ветчины), синтетических подсластителей, осветлителей, желирующих веществ. Пищевые добавки способны вызвать аллергические реакции в виде крапивницы, отека Квинке, бронхиальной астмы, диспепсидерматологический, диспепсиреспираторный синдромы. Сульфитные компоненты провоцируют полиаллергические реакции.
При алиментарной аллергии целесообразно обращать внимание и на добавки, используемые для очистки питьевой воды, в частности соли алюминия, хлора, фтористые соединения, а также различные другие экологические загрязнители.
Чем больше индукторов аллергии в пищевом продукте, тем сложнее пищевой аллергологический анамнез, тем больше указаний пациента на непереносимость ряда пищевых продуктов, поскольку многие пищевые вещества имеют общие антигенные детерминанты и наблюдается перекрестная сенсибилизация к ряду пищевых продуктов, например к мясу лошади и кролика, к хлебным злакам и пыльце злаковых трав (овсянице, тимофеевке), к пыльце амОрозии и салату, к цитрусовым и ягодам и др., см. таблицу перекрестной сенсибилизации (табл. 5, с. 36).
Патогенез
А. Фергюсон, С. Стробел (1986) справедливо замечают, что «невозможно отделить функции пищеварения от иммунологической функции кишечника». Это касается как содержимого кишечника, так и пищевых веществ, которые в него поступают. Известную роль в поддержании иммунологического гомеостаза играют нормальные, физиологические обитатели, составляющие микрофлору толстого кишечника, защищающие от суперинфекции и обеспечивающие адекватный иммунологический гомеостаз.
Пищевые вещества — это гетерогенная антигенная масса, которая под влиянием сложной физиологической системы пищеварения с участием ферментов и многочисленных нейропептидов, гормональных пептидов теряет свою гетерогенную антигенность. Однако при наличии дисрегуляторных расстройств в желудочно-кишечном тракте и виде гастрита, энтеропатий, патологии гепатобилиарной системы гетерогенность пищевого комка резко возрастает — возникают аллергические пищевые и дигестивные реакции. Это ярко проявляется с первого года жизни ребенка. Ведь первая встреча грудного ребенка с пищевыми продуктами — прикормом ершу же ставит эту проблему в виде диспепсического (ребенок плохо спит, или содержимое каловых масс — консистенция, запах, окраска не адекватны возрасту) или диспепсидерматологического, диспепсиреспираторного синдромов, которые свидетельствуют о возникновении реакций у малышей как на аллергической, так и на ложноаллергической основе (Сушил, 1986).
Природа предусмотрела в связи с этим в желудочно-кишечном тракте мощную иммунную защитную систему, представленную в виде: узелковой лимфоидной ткани (групповые лимфатические фолликулы), рассеянного множества отдельных лимфоидных клеток — Т-лимфоцитов, плазматических и тучных клеток. Плазматические клетки (трансформирующиеся из В-лимфоцитов) продуцируют IgA, IgM, IgG в интересном соотношении 82–16—2 с преобладанием IgA, т. е. секрет кишечника, богатый иммуноглобулином А, обеспечивает надежную местную защиту от чужеродной микрофлоры. В дополнение к этому в кишечник постоянно поступает IgA (до 10 % от содержимого) из гепатобилиарной системы и циркулирующий IgA из кровотока.
Предполагается, что в случае пищевой аллергии при наличии гиперпролиферативного ответа — повышения IgE к пищевым антигенам — имеет значение дефицит IgA. Ferguson (1976) подтвердил, что при дефиците IgA у больных с изъязвлением и воспалением слизистой оболочки кишечника выявляются антитела типа IgM и IgG по отношению ко многим пищевым белкам.
Продуцирование IgE по отношению к пищевым антигенам, в частности к молоку, у атопиков коррелирует с длительностью и количеством потребления его (Firer et al., 1981).
Избыточное поступление антигенов в слизистую оболочку кишечника приводит к образованию аллергических антител IgE. При взаимодействии высокоспецифичных IgE с пищевым антигеном тучные клетки обильно секретируют биологически активные вещества (гистамин, серотонин и др.), в значительной мере добавляя к функционирующим нейропептидам активную биологическую массу, что ведет к дисрегуляции пищеварения — повышению возбудимости гладкомышечных элементов желудка и кишечника, к изменению секреторной функции пищеварительных желез, к снижению контакта пищевого комка с рядом ферментов и к еще большему воздействию гетерогенных, aнтигенных индукторов на иммунологический гомеостаз желудочно-кишечного тракта. Способность циркулирующих специфических антител IgE оседать на тучных клетках при пищевой аллергии в других системах и органах предрасполагает к аллергическим реакциям за пределами желудочно-кишечного тракта и в силу анатомо-физиологических особенностей его, с наличием столь разнообразных высокоактивных нейропептидов, ведет к полисистемным реакциям — вегетативной дисфункции, неврозоподобному и другим синдромам.
При пищевой аллергии часто формируется иммунокомплексный тип реакции при участии IgA (Levinsky et al., 1981) или IgG и IgE (Brostoff et al., 1979).
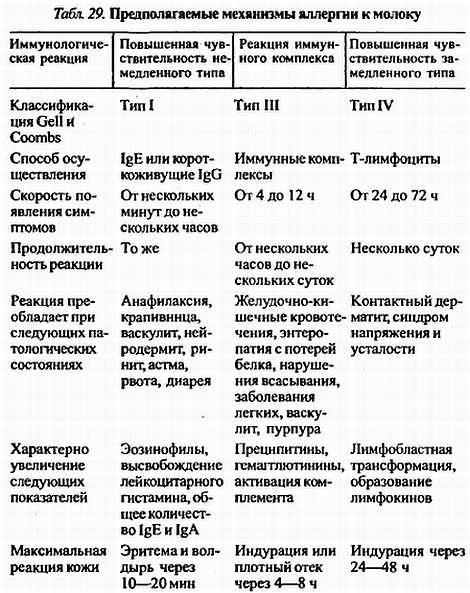
Как считают С.JI. Бахна, Д.К. Хейнер (1985), только при аллергии к молоку могут наблюдаться, в соответствии с классификацией механизмов аллергии Gell, Coombs (1975), реакции как реагинового, так и иммунокомплексного и даже клеточного типа.
М.Х. Лессоф (1986) отмечает, что, «хотя изменения иммунологического характера интерпретировать трудно, они явно имеют важное значение во многих случаях при непереносимости пищи». Идентификация различных типов реакций с большой вероятностью осуществляется с учетом клинических проявлений пищевой аллергии и лишь частично с помощью лабораторных маркеров дифференциации их. Среди существующих лабораторных методов диагностики наиболее надежно определение специфических IgE к пищевым аллергенам.
Алиментарная и дигестивная аллергия излагается в литературе с определенными противоречиями и часто рассматривается в рубрике ложноаллергических реакций или ферментопатий, в других же случаях — как реакции. развивающиеся на иммунологической основе.
Предполагается, что некоторые пищевые добавки могут выполнять роль гаптенов — азокрасители (тартразин), особенно в присутствии производных пиразолона. Существование специфических антител класса IgE против тартразина продемонстрировали в эксперименте Moneret-Vautrin et al. (1979), против таких красителей, как амарант красный, зеленый, оранжевый, желтый — Brighton (1981).
Даже при глютеновой энтеропатии (целиакии) — непереносимости глиадина (клейковины зерновых), связанной с наследственной ферментопатией, Holmes et al. (1976) констатировали наличие сенсибилизированных лимфоцитов к глютену. O’Donoghue et al. (1979) наблюдали значительное увеличение клеток с IgE после экспозиции к глютену с параллельной дегрануляцией тучных клеток и увеличением числа эозинофилов. При целиакии отмечается также повышенное образование иммунных комплексов и активация комплемента параллельно с повреждением слизистой оболочки (Feisberg et al., 1977, и др.).
При пищевой аллергии часто наблюдаются ложноаллергические реакции — готовность многочисленных тучных клеток, диффузно рассеянных по слизистой оболочке желудочно-кишечного тракта и, по-видимому, за пределами его отвечать на неспецифические раздражители выбросом биологически активных веществ. Этим можно объяснить столь частое проявление рецидивирующей крапивницы, отеков Квинке при отсутствии явного аллергологического анамнеза, но при наличии неблагополучия со стороны желудочно-кишечного тракта: по анамнезу или при углубленном обследовании пациентов с использованием фиброгастродуоденоскопии, с помощью УЗИ паренхиматозных органов брюшной полости. Эти состояния могут быть обусловлены снижением дезактивационной функции биологически активных веществ, избыточным поступлением гистамина с пищевыми продуктами. Например, это может наблюдаться при употреблении в пищу тунца, который содержит 400 мг гкг. тамина на 100 г продукта, при избыточном потреблении пищевых веществ, богатых тирамином (пивных дрожжей, маринованной селедки), при употреблении некоторых красных и белых вин с высоким содержанием гистамина, при избыточном эндогенном продуцировании путем синтеза тирамина кишечной флорой вследствие суперинфекции (Д.А. Монере-Вотрин, 1986).
Ложноаллергические реакции в виде покраснения кожи туловища, лица с появлением чувства жара и головной боли часто возникают на пищевые добавки: бензоаты, азокрасители — тартразин, хинолин желтый и др.
Клинические проявления
А.М. Ногаллер (1983) отмечает, что клинические проявления пищевой аллергии относятся преимущественно к гиперчувствительности немедленного типа и чаще в связи с этим развиваются в короткие сроки после приема пищи — через 5—10 мин или 3–4 ч (отсроченно-немедленная).
Подобные симптомы в связи с этим возникают внезапно и могут протекать остро, чаще с преобладанием общих реакций — падением артериального давления, тахикардией, зудом кожных покровов, внезапной общей слабостью, повышением температуры тела (анафилактический или анафилактоидный тип). При бурном развитии пищевой аллергии возможны рвота, болезненные ощущения в области живота с явлениями диареи.
У таких пациентов четко прослеживается пищевой аллергологический анамнез в виде непереносимости того или иного пищевого продукта, аллергические реакции исчезают через несколько часов после изъятия из пищи аллергена, при оказании неотложной помощи у них высокоэффективны адреналин — 0,1 % раствор (0,5–1,0 мл) на изотоническом растворе хлорида натрия внутривенно, солу-медрол — до 60—120 мг в зависимости от необходимости, антигистаминные средства.
У пациентов без ярко выраженной реакции на пищевой аллерген в случаях неоднократного приема его как пищевого продукта могут сформироваться стертые аллергические реакции, сопровождающиеся хронизацией процесса, формированием патологических изменений в желудочно-кишечном тракте.
Представляют интерес наблюдения А.М. Ногаллера (1983), приведенные в табл. 28, из которой следует, что наиболее часто подобная патология возникает в виде гастроэнтероколита, хронического колита. Обращает на себя внимание и тот факт, что на фоне пищевой аллергии могут отмечаться изменения со стороны гепатобилиарной системы. По мнению А.М. Ногаллера, при пищевой аллергии возникают диффузные изменения в гепатоцитах с развитием гепатомегалии, холестатического синдрома. Изменения паренхиматозных органов брюшной полости (печени и поджелудочной железы) чаще наблюдаются при аллергии к продуктам животного происхождения, при сенсибилизации к молоку преобладают изменения в виде энтеропатий и колита (С.Л. Бахна, Д.К. Хейнер, 1985), что может сопровождаться рвотой, болями в животе, диареей, стеатореей, даже кишечными кровотечениями, т. е. энтеропатией с синдромом нарушения всасывания, энтероколитом, язвенным колитом, прокталгией, стоматитом, отеком губ.
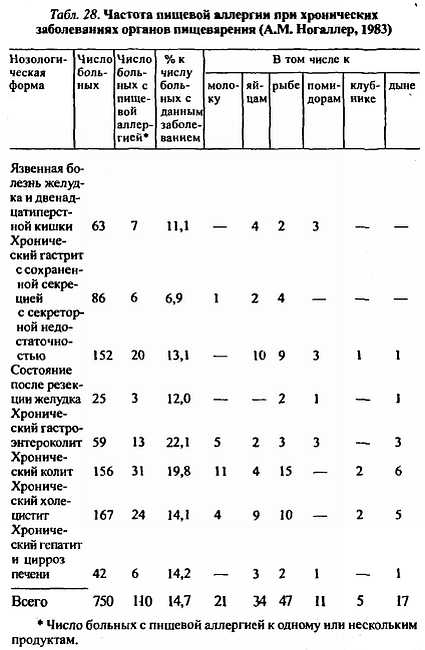
При аллергии к молоку возможно развитие через несколько минут после его приема отечности губ и языка, регрессирующей через несколько часов при отсутствии каких-либо других изменений.
Весьма пестрой может быть палитра клинических аллергических реакций вне желудочно-кишечного тракта с поражением дыхательных путей (ринит, бронхит, астма, «хронический кашель»), кожных покровов (нейродермит, крапивница, отек Квинке, себорейные высыпания, перианальная сыпь, пурпура, герпетиформный дерматит), кроветворной системы (анемии, тромбоцитопении, эозинофилии), центральной нервной системы («аллергический синдром напряжения и усталости»), мочевыводящих путей (непроизвольное мочеиспускание, Цистит, нефротический синдром).
C.Л. Бахна, Д.К. Хейнер (1985) указывают на задержку развития, синдром внезапной смерти у детей моложе одного года во время сна вследствие сенсибилизации их к коровьему молоку. Синдром внезапной смерти можно объяснить развитием анафилактического шока после вечернего приема молока или регургитацией содержимого желудка с последующей аспирацией его в бронхиальные пути.
Диагноз
В диагностике пищевой аллергии определяющее значение имеют: аллергологический анамнез; клинические проявления; аллергологическое тестирование — проведение элиминационных и провокационных проб, накожное тестирование с пищевыми аллергенами, лабораторные методы специфической диагностики, определение специфических антител (IgE) к пищевым аллергенам.
Аллергологический анамнез. У пациентов с пищевой аллергией в раннем детстве часто прослеживается непереносимость пищевых продуктов, которая может проявляться беспокойным сном и периодическим изменением стула — легкой преходящей диареей, изменением консистенции, запаха и цвета кала (диспепсический синдром). Эти явления могут отмечаться от начала прикорма или даже на этапе кормления сцеженным грудным донорским молоком.
В анамнезе таких пациентов в годовалом возрасте наряду с диспепсическим синдромом часто отмечаются проявления экссудативного диатеза (диспепсидерматологический синдром) или ринита, конъюнктивита (диспепсиреспираторный синдром), которые на втором-третьем году жизни подвергаются инволюции при соблюдении определенного отработанного практикой режима питания или могут трансформироваться и приобрести характер нейродермита или экземы.
Важны при этом указания на периодические различные нарушения со стороны желудочно-кишечного тракта при изменении режима питания, несоблюдении гипоаллергенной диеты, употреблении с пищей подозреваемого аллергена и ухудшении течения заболевания или при его рецидивах.
Проведение элиминаццонных и провокационных проб. При подобном «тестировании» целесообразно ведение пищевого дневника с указанием пищевой нагрузки в течение суток и описанием клинических проявлений заболевания. При проведении элиминации — исключения определенного продукта в течение недели тщательно, подробно анализируются и регистрируются субъективные и объективные реакции пациента. Подобное тестирование осуществляется вначале с предполагаемым пищевым аллергеном, а затем с вероятностным неподозреваемым — молоком, яйцом, рыбой и т. д.
Если этого недостаточно для идентификации пищевого аллергена, то приступают к провокационным пробам — после элиминации подозреваемого пищевого продукта в течение пяти дней осуществляется его прием в утреннее время в количестве до 100 г. При наличии у пациента аллергологических реакций немедленного типа пробы проводятся под контролем врача в условиях стационара. На фоне проведения провокационной пробы с пищевым продуктом оцениваются клинические проявления (со стороны желудочно-кишечного тракта и вне его), гематологические сдвиги (лейкоциты, эозинофилы, тромбоциты периферической крови), гемодинамические показатели (параметры артериального давления, частота пульса).
Провокационная проба с пищевыми аллергенами считается положительной при обострении проявлений пищевой аллергии, снижении числа эозинофилов, тромбоцитов более 20 %, снижении параметров АД на 15–20 мм рт. ст., ускорении частоты пульса более 10 ударов в минуту, регистрируемых через 30 и 90 мин после провокационной пробы.
Накожное тестирование с пищевыми аллергенами. В зависимости от способа приготовления пищевого аллергена накожное тестирование может осуществляться с помощью скарификационных или внутрикожных проб — см. Диагностические аллергены.
Лабораторные методы специфической диагностики. Тест деструкции тучных клеток, определение специфических IgE— см. Специфическая диагностика.
Исследование иммунологического гомеостаза позволяет осуществлять дифференциальную диагностику типа аллергической реакции при пищевой аллергии с учетом изменений иммунных комплексов, активации комплемента, спектра иммуноглобулинов.
С учетом предполагаемых механизмов аллергии к молоку, обобщенных С.Л. Бахна и Д.К. Хейнер, 1985 (см. табл. 29), приводим некоторые критерии дифференциации различных типов аллергических реакций при пищевой аллергии.
Дифференциальный диагноз
Дифференциальная диагностика осуществляется исходя из общепринятых представлений, что наряду с пищевой следует различать алиментарную аллергию к компонентам пищевых веществ в виде различных пищевых добавок в составе продуктов питания, дигестивную аллергию, когда желудочно-кишечный тракт является объектом реагирования вследствие сенсибилизации к пыльцовым аллергенам, содержащимся в виде примесей в составе пищевых веществ или в виде загрязнителей лекарственными веществами, например пенициллина в молоке, тетрациклина, кормовых витаминов группы В и др.
При дигестивных реакциях возможны проявления, похожие на аллергию, вследствие ферментопатии, гистаминолиберации или из-за избытка гистамина в составе пищевых веществ.
При подозрении на алиментарную или дигестивную аллергию должно проводиться углубленное исследование, направленное на исключение скрытой патологии со стороны желудочно-кишечного тракта, так как наличие изменений в этих органах часто бывает определяющим в появлении реакций, похожих на аллергию (крапивницы, отека Квинке), вне желудочно-кишечного тракта и, естественно, становится приоритетным в адекватном лечении данной патологии.
Дифференциальная диагностика гастрита осуществляется с учетом «новой его классификации», опубликованной в 1989 г. Выделены: аутоиммунный (тип А); бактериально обусловленный (тип В); смешанный (тип А и В); химико-токсический индуцированный (тип С); лимфоцитарный, эозинофильный; особые формы (А — аутоиммунный гастрит, В — бактериальный, С — химически опосредованный — рефлюкс-гастрит).
Л.И. Аруин (1993) считает, что 70 % всех гастритов приходится на поверхностный, диффузно-антральный гастрит, ассоциированный с Helicobacter pylori, наиболее распространенный, гиперсекреторный тип В гастрита, который обычно встречается в организованных коллективах вследствие контактного инфицирования. Это чаще активный гастрит с нарастающей нейтрофильной инфильтрацией собственной пластинки и эпителия слизистой оболочки желудка с образованием криптогенных микроабсцессов, при вскрытии которых могут образовываться дефекты (повреждения) слизистой оболочки за счет активации нейтрофильной миелопероксидазы, нейтрофильной эластазы. Индуктором формирования нейтрофильных инфильтратов являются опосредованные реакции, связанные с колонизацией слизистой оболочки инфекционными агентами, активацией комплемента при содействии IgG и IgM. Если заражение — инфицирование Helicobacter pylori — происходит, когда в фундальном отделе желудка сформировался гастрит, то бактерии заселяют фундальный и антральный отделы и гастрит из поверхностного трансформируется в атрофический, т. е. тип А + В.
У 15–18 % больных, чаще имеющих генетическое предрасположение, развивается атрофический фундальный диффузный или мультифокальный (тотальный) гастрит, нередко ассоциированный с пернициозной анемией.
У 10 % больных гастриты развиваются на фоне приема нестероидных противовоспалительных препаратов или глюкокортикоидов, у 5 % встречается рефлюкс-гастрит, который ассоциируется исключительно с оперированным желудком.
У 1 % лиц развиваются особые формы гастрита — лимфоцитарный, эозинофильный, аутоиммунный — гранулематозный (болезнь Крона) и др.
В большинстве случаев гастрит не является активным и морфологические изменения слизистой оболочки характеризуются наличием избыточной клеточной (лимфоидно-плазматической) инфильтрации за счет преобладания плазматических клеток в соотношении при поверхностном гастрите 1:7,5, атрофическом — 1:11,5 (при норме 1:4,3). Следует отметить, что избыточная плазматическая инфильтрация слизистой оболочки при гастрите, обусловленном Helicobacter pylori, сопровождается увеличением продукции IgA в 4,5 раза, IgM — в 5 раз, a IgG — даже в 16 раз (Л.И. Аруин, О.Л. Шаталова, 1981). При атрофическом гастрите заметно снижено количество IgA и существенно повышено — IgG.
При эозинофильных гастритах в анамнезе 25 % больных констатируются аллергические заболевания в виде астмы, экземы или гастроэнтеропатии. В слизистой оболочке наблюдаются пролиферативные изменения, представленные эозинофильными инфильтратами, лимфоцитами, макрофагами, IgE-плазматическими клетками.
У пациентов с системными заболеваниями — склеродермией, дерматомиозитом также наблюдается развитие эозинофильных инфильтратов, которые захватывают более глубокие отделы желудка без проявления эозинофилии в периферической крови.
При болезни Крона гранулематозные изменения в желудке характеризуются развитием эпителиоидноклеточных гранулем, иногда с примесью гигантских многоядерных клеток либо явлениями фиброза, приводящего к деформации и стенозу привратника желудка.
Лимфоцитарный гастрит — одна из разновидностей реакции на Helicobacter pylori, пищевые ингредиенты или результат целиакии. Лимфоцитарный, инфильтративный гастрит, как правило, сопровождается эрозированием слизистой оболочки желудка.
При пищевой аллергии наиболее часто встречаются проявления, укладывающиеся в представления энтеропатии, которые предусматриваются в классификации хронических энтеритов. Следует отметить, что при хронических энтеритах довольно часто наблюдаются различные изменения кожных покровов, даже при отсутствии пищевой аллергии. Наряду с этим при хронических энтеритах многие пациенты yказывают на непереносимость ряда пищевых продуктов при отсутствии явной сенсибилизации к ним. Это часто обусловлено наличием различных энтеропатий, ферментопатий, которые по клиническим проявлениям могут напоминать аллергическую энтеропатию.
Только исходя из классификации хронических энтеритов, врач-аллерголог может провести целенаправленную дифференциальную диагностику пищевой аллергии и дигестивных пищевых реакций, связанных с ферментопатией и другими состояниями. Согласно классификации А.Р. Златкиной, А.В. Фролькиса (1985), выделяют хронические энтериты: инфекционный; паразитарный; токсический; медикаментозный, вследствие дисбактериоза; аллергический; радиационный; вследствие врожденной энзимопатии; механический; после операции на тонкой кишке; болезнь тяжелых цепей, абеталипопротеинемию, агаммаглобулинемию; алиментарный.
При подозрении на инфекционный энтерит исключается сальмонеллезная, иерсиниозная, аденовирусная инфекция; паразитарный — глистная инвазия; токсический — употребление алкоголя и других суррогатов; на энзимопатию — непереносимость углеводов (лактазная, мальтазная, галактазная недостаточность, фавизм — недостаточность глюкозо-6-фосфатдегидрогеназы и др.), непереносимость аминокислот (глютеновая энтеропатия — целиакия, гиперфенилаланинемия, нарушение обмена лейцина и изолейцина, гипертирозинемия, нарушение обмена метионина), непереносимость жиров и жирных кислот.
Непереносимость сахарозы — наследственное заболевание, связанное с отсутствием в кишечнике нескольких дисахаридаз, что приводит к накоплению нереаисорбированных дисахаридов, которые под действием бактериальной флоры расщепляются до молочной, ацетоуксусной кислот, вызывающих раздражение слизистой оболочки кишечника — диарею с нарушением всасывания других продуктов питания.
При лактазной недостаточности нарушается обмен углеводов, расщепление лактозы на глюкозу и галактозу, т. е. вместо ферментативного расщепления осуществляется бактериальное, что ведет к диарее, лактоземии, лактозурии, нарушению функции почек.
Целиакия — глютеновая энтеропатия, непереносимость глиадина, клейковины зерновых — сложного комплекса с высоким содержанием глютамина и пролина, обладающих токсическим действием на слизистую оболочку кишечника.
Латентная форма целиакии проявляется легкой диареей при употреблении избыточного количества хлебобулочных и крупяных изделий. Выраженная, типичная форма сопровождается вначале проявлением диареи без нарушения всасывания, а затем с синдромом нарушения всасывания и последующей кахексией. Целиакия у детей может сопровождаться анорексией, депрессией и замедлением развития, афтозным стоматитом, герпетиформным дерматитом и другими полисистемными реакциями.
При целиакии наблюдается непереносимость лактозы до двухлетнего возраста, употребление яиц также ухудшает ее течение (В.Т. Кук, Г.К. Холмс, 1986).
В основе диагностики характера энтеропатии наряду с аллергологическим обследованием для исключения сальмонеллеза, иерсиниоза проводят бактериологическое и специфическое иммунологическое исследование (титры антител), при глистной инвазии — исследование кала на яйца глистов, лабораторные диагностические тесты; проводят общий анализ крови, мочи, функциональные пробы печени; копрологическое исследование кала, копроцитограмму, кал на дисбактериоз, фиброгастродуоденоскопию, УЗИ органов брюшной полости, определение в кишечном соке щелочной фосфатазы, энтерокиназы. Для выявления глютеновой энтеропатии или лактазной недостаточности сопоставляют течение заболевания с аглютеновой или алактозной диетой, осуществляют поиск генетически детерминированных маркеров.
Формулировка диагноза
1. Пищевая аллергия. Хронический аллергический гастрит вне обострения. Энтеропатия реагинового типа вне обострения. Аллергия к куриным яйцам, хеку, треске.
2. Пищевая аллергия. Рецидивирующая крапивница. Хронический гастродуоденит. Дуоденогастральный рефлюкс. Энтеропатия реагинового типа. Аллергия к молоку.
При наличии атопического нейродермита, в этиологии которого наряду с пищевыми аллергенами играют важную роль и другие не менее весомые причины: дисметаболические, нейровегетативные, психоэмоциональные и др., при формулировке диагноза пищевая аллергия не является определяющей. Заключительный диагноз оформляется так: «Атопический нейродермит, хронический гастрит диффузный вне обострения. Непереносимость аспирина, клубники, земляники. Латентная сенсибилизация к бытовым аллергенам».
Лечение
Лечение — см. Реагиновый тип реакции. Исключение пищевого аллергена из рациона питания — обязательный и наиболее эффективный момент в лечении. Нельзя употреблять при сенсибилизации:
1) к молоку — молоко и продукты, содержащие его: сметану, творог, мороженое, пирожные, кондитерские изделия, вафли, шоколад, сосиски, колбасные изделия и др.;
2) к куриному белку — яйца, продукты, содержащие их, куриное мясо, кондитерские изделия, пирожные, мороженое, белые вина, очищенные яичным белком, майонез, докторскую и другие колбасы;
3) к рыбе — треску, хек, продукты, содержащие рыбные изделия, — колбасы, котлеты, рыбные консервы, икру и др.;
4) к белковым компонентам ячменя, ржи, пшеницы — хлебобулочные изделия, манную, перловую, ячменную крупы, пиво, заменители кофе. При аллергии к злаковым гипоаллергенная диета включает соевый хлеб, картофельные изделия, свежеприготовленную говядину, овощи, фрукты и др. Следует исключить продукты, содержащие пищевые красители, тартразин в составе пирожных, тортов, мороженого, пудингов, сыров, покрытых оболочкой. Рекомендуется ограниченный прием быстро всасывающихся из желудочно-кишечного тракта углеводов, экстрактивных веществ, различных пряностей, напитков, содержащих алкоголь, лекарственных веществ (антигистаминных, раздражающих слизистую оболочку желудка).
Больным с пищевой аллергией проводят тщательное лечение основного заболевания желудочно-кишечного тракта, при глистной инвазии — дегельминтизацию. При выраженных аллергических реакциях показаны голод в течение 1–3 дней, прием воды до 1,5 л/сут, очистительные клизмы, энтеросорбенты — активированный уголь (до 6—12 г в сутки), белосорб-п или ваулин (5 г 3 раза в сутки) с последующим переходом на гипоаплергенную диету. При частых рецидивах средством выбора в лечении является гемосорбция.
Высокоэффективен хромотикат натрия (налкром) в капсулах или порошках (100 мг). Назначается по 2 капсулы или 2 порошка 4 раза в день перед едой. По достижении терапевтического эффекта дозировка препарата может быть снижена до минимума.
Неспецифическая гипосенсибилизирующая терапия включает прием кетотифена (задитена) — по 1 мг 2 раза в день в течение 1,5–3 мес. При гиперацидном гастрите, язвенной болезни желудка лечение кетотифеном может сочетаться с приемом фамотидина (40 мг перед сном), ранитидина (150 мг утром или вечером) или кваматела (40 мг на ночь), блокирующими Н2-рецепторы в течение 4–6 нед, могут использоваться несистемные антациды (алмагель, фосфалюгель, магния оксид, соевая мука), или препараты, снижающие продукцию соляной кислоты в желудке, блокаторы Н+/К+-протонового насоса обкладочных клеток (омепразол) (табл. 30), или средства, защищающие слизистую оболочку желудка (викалин, де-нол, сукралфат), средства, активирующие регенерацию слизистой оболочки (облепиховое масло, алоэ, гастрофарм), в случаях гиперацидного гастрита, ассоциированного с Helicobacter pylori, антибактериальные средства (метронидазол, клафоран или цефобид), иммунокорректирующие адаптогенные препараты (сапарал, тималин, нуклеинат натрия, спленин).
При пищевой аллергии с наличием анацидного гастрита, ферментативной недостаточности в составе комплексной терапии показаны ферментативные препараты (панзинорм, фестал, дигестал), при персистирующем гепатите рекомендуются эссенциале, тюбажи с ксилитом, сорбитом.



Дерматит атопический. Нейродермит
Атопический дерматит является составной частью атопической болезни, объединяющей различные формы хронически протекающего заболевания со специфическими аллергическими и ложноаллергическими реакциями.
Это позволило различным авторам называть это заболевание нейродермитом (Л. Брок — французский дерматолог), атопическим нейродермитом (Б.Т. Глухенький, С. А. Грандо, 1990).
Заболеваемость нейродермитом, как и другими аллергическими болезнями, выросла среди населения с 0,1 % (1952, Копенгаген) до 22 % (1994, Бранденбург).
Нейродермит, возникая у детей раннего возраста с «аллергической конституцией», с течением времени трансформируется и может приобретать различные формы. А. П. Торопова, О. А. Синявская (1993), предлагая классификацию данного заболевания под названием «аллергический диатез», детально излагают синдромные проявления, которые могут быть практически использованы при формулировке диагноза.
Классификация
Классификация «аллергического диатеза» (А.П. Топорова, О.А. Синявская, 1993)
I. Преимущественно дерматологические синдромы со следующими клиническими вариантами:
1. Аллергический конституциональный дерматит.
2. Себорейная экзема (ограниченная и диссеминированная).
3. Бляшечная форма экземы.
4. Смешанная форма экземы.
5. Нейродермит, в том числе:
а) нейродермит грудного ребенка;
б) нейродермит с ограниченным поражением кожи (менее 5 %);
в) нейродермит с распространенным поражением кожи (более 5 %);
г) нейродермит с тотальным поражением кожи (диффузный);
д) бляшечная форма нейродермита.
II. ДерматореспираторныЙ синдром.
III. Дерматоинтестинальный синдром.
IV. Дерматомукозный синдром.
Этиология
Рассматривается большой перечень факторов, в различной мере связанных с формированием и прогрессированием нейродермита. Это прежде всего аллергены, ирританты, инфекция, среда, окружающая конкретного больного человека, образ жизни, характер питания, уровень санитарной культуры, наследственная предрасположенность и др.
В последние годы среди разных факторов определяющая и главная причина нейродермита связывается с наличием у больных атопического гена в хромосоме 14 q 11,2 (Ганс-Вернер Тюттенберг, 1998).
Нейродермит — заболевание, в основе которого прослеживаются самые разнообразные реакции, связанные с пищевой (соя, молоко, яйца, орехи, фрукты, сельдерей, морковь, петрушка и др.), алиментарной (пищевые добавки: агар-агар — агент набухания в составе йогурта, хлеб, соус, красители, консерванты — тартразин, салицилаты, глутамат и др.), дигестивной аллергией, пищевыми гистаминолибераторами (сыр, консервы, вино, шампанское, солонина, сардельки, квашеная капуста, рыба — тунец, скумбрия) или содержащими биогенные амины — тирамин (сыр, вино, дрожжи, шоколад, кремы из орехов, цитрусовые), серотонинсодержащие пищевые вещества (бананы, орехи, ананасы, авокадо), салицилатсодержащие продукты (ягоды, сухофрукты, апельсины, ананасы).
Серосодержащие вещества (в составе вина, пива, продуктов брожения, сухофруктов, хрена, карамелей, пищевых добавок— цукатов из лимонных, апельсиновых корок, мякоти плодов, желатины) особенно опасны при сочетании нейродермита и бронхиальной астмы.
Патогенез
У 65 % пациентов нейродермит проявляется к концу первого года жизни детей и характеризуется переключением Тх1 на Тх2 с повышением уровня IgE и снижением — Тс. Провоцирующими факторами служат пищевые и другие аллергены — Dermatophagoides pteronyssinus, Dermatophagoides farinae, эпидермальные аллергены, макроэкологические и микроэкологические факторы, стрессовые ситуации. У больных нейродермитом крайне повышена проницаемость слизистой оболочки кишечника к различным аллергенам, отмечается высокая восприимчивость к герпетической инфекции, к контагиозному заразному моллюску.
Клинические проявления
У пациентов с нейродермитом в анамнезе прослеживаются атопические заболевания, непереносимость многих пищевых продуктов, экссудативный диатез в грудном возрасте, отмечаются различные изменения кожных покровов (сухость и шелушение их, фолликулярный кератоз — «шершавость» кожи в области плеч, бедер, трещины, экзема сосков груди), слизистых оболочек (атопический хейлит, сухие трещины в уголках рта). У детей дошкольного и школьного возраста бывает мучительный зуд с высыпаниями чаще в области разгибательных поверхностей кожных покровов узелкового или пузырькового характера, экзематозные высыпания в области пальцев кистей, стоп.
Лечение
Поскольку на обострение нейродермита влияют разнообразные факторы внешней среды, включая наиболее распространенные — бытовые аллергены, необходимо свести до минимума контакт с домашней пылью, клещами, содержащимися в ней, черными тараканами и другими бытовыми аллергенами.
Мебельные гарнитуры предпочтительнее обтянутые кожей, матрацы из поролона, следует своевременно менять (не менее одного раза в неделю) постельное белье, не рекомендуется держать в доме животных, необходимо бороться с плесенью, избегать не только активного, но и пассивного курения. Важно соблюдение гипоаллергенной диеты с учетом непереносимости пищевых аллергенов.
Белье пациента с нейродермитом должно быть изготовлено из натуральных, неокрашенных волокон, необходимо избегать потливости.
Плавание и купание в хлорированной воде запрещается, вода должна быть адекватной температуры в пределах 25–30 °C, нецелесообразно использовать мыло, богатое щелочами.
Лекарственная терапия нейродермита проводится длительное время и включает препараты, не дающие побочных эффектов.
Стабилизаторы мембран тучных клеток (см. лечение аллергических ринитов).
Кромалин-натрий назначается с учетом клинико-патогенетического течения нейродермита, т. е. при наличии на его фоне ринита — ломузол в виде назального спрея (2 % раствор), конъюнктивита — оптикром в виде глазных капель (2 % раствор) через 4–6 или 8 ч в зависимости от необходимости, при пищевой аллергии — налкром в виде капсул (100 мг)—4–5 раз по 1 или 2 капсулы в сутки за 15 мин до приема пищи. Кромолин-натрий— самый безопасный препарат, используя который в комплексе с максимальным устранением причин, провоцирующих нейродермит, можно стабилизировать заболевание.
При пищевой аллергии с легкими проявлениями нейродермита достаточно эффективен задитен (кетотифен), обладающий инталоподобным противовоспалительным и антигистаминным действием в виде курса до 3–5 нед. Задитен (кетотифен) принимают в дозе — 1 капсула, или 1 таблетка с одной полоской (1 мг), или 2 мл сиропа. Обладает 50 % биодоступностью, максимальная концентрация в плазме в пределах 2–4 ч, связывание с белками составляет 75 %, выделяется из организма за 21–48 ч. Как антигистаминное средство первого поколения опасен при вождении автомобиля и при выполнении другой работы в результате миелорелакснрующего эффекта.
В связи с этим врачи часто отдают предпс чтение антигистаминному средству второго поколения — кларитину — 1 табл. (10 мг) или эбастину (кестину) — 1 табл. (10 мг) один раз в сутки.
Исходя из нашего опыта, можно отметить, что проявления нейродермита часто имеют непредсказуемый характер и, несмотря на наличие достаточно гибкой и эффективной терапии с помощью стабилизаторов мембран тучных клеток, антигистаминных средств, обратное развитие отдельных кожных проявлений может задерживаться при тенденции к трансформации в экзематозные проявления. Наличие даже остаточных явлений нейродермита (в виде гиперемии кожи) часто сопровождается сильным зудом кожных покровов. При механическом почесывании на холинергической основе не только поддерживаются эти изменения, но даже провоцируется появление новых элементов.
Попытка избавиться от зуда с помощью специальных общегигиенических лечебных ванн (углекислых, радоновых, слабощелочных), иглорефлексотерапии — часто только временная мера.
Поэтому заслуживает внимания местное применение антигистаминных средств в виде аэрозолей аллергодила или гистимета.
Следует отметить, что при аллергическом дерматите с локальными реакциями и локальном зуде, развившимся после соприкосновения с гусеницами или после укуса москитов, мошек, комаров, местное нанесение аллергодила или гистимета снимает зуд и способствует обратному развитию местных реакций в течение двух суток.
В качестве вынужденной терапии на альтернативной основе при зудящих высыпаниях рекомендуется периодически использовать местные кортикостероиды в виде мазей, кремов, лосьонов: флуцинар (в 1 г содержится 250 мкг флуоцинолона ацетонида), целестодерм-В (в 1 г 1 мг бетаметазона валерата), ультралан (в 1 г 25 мг флуокортолона моногидрата и 25 мг флуокортолона капроата), лоринден (в 1 мл 200 мкг флуметазона пивалата), гидрокортизон (в 1 г 10 мг гидрокортизона ацетата), элоком (в 1 г 1 мг мометазона фуроата).
Среди глюкокортикоидов мы отдаем предпочтение элокому, который, как и гидрокортизон, не содержит фтора, однако в отличие от гидрокортизона и других подобных препаратов обладает крайне малой биодоступностью — практически не всасывается, не обладает системными эффектами, применяется один раз в сутки. Однако и данный препарат нецелесообразно использовать беременным женщинам.
Показаны физиотерапия: УФО пораженных участков кожи в фазе затухающего обострения, иглорефлексотерапия; лечебная физкультура; санаторно-курортное лечение.
При наличии пищевой аллергии или изменений со стороны желудочно-кишечного тракта — см. лечение пищевой аллергии.
Крапивница острая и хроническая. Отек Квинке
Этиология
Крапивница — это реакция волдырного типа (экссудативная, бесполостная), которая может возникать остро или замедленно. Развитие крапивницы на аллергической основе чаще наблюдается как проявление лекарственной (пенициллин, стрептомицин, амидопирин, анальгин, новокаин, сульфазол, витамин В1), пищевой (употребление куриных яиц, цельного молока, рыбы, алкогольных напитков и др.), инсектной, пыльцовой, гельминтной сенсибилизации.
Патогенез
Крапивница может развиваться на аллергической (немедленный, реагиновый, и замедленный, клеточный, тип), аутоиммунной и ложноаллергической основе.
В зависимости от течения и проявлений крапивница делится на: острую; острую ограниченную гигантскую (отек Квинке); хроническую рецидивирующую; солнечную (ультрафиолетовую); холодовую (криоглобулиновую); контактную (фитодерматит, гусеничный дерматит); пигментную, детскую.
Развитие крапивницы на ложноаллергической основе чаще связано с вегетативной дисфункцией холинергического типа, на фоне которой наряду с избытком ацетилхолина наблюдается повышенная либерация гистамина, провоцируемая рядом неспецифических факторов, раздражителей.
Клинические проявления
Крапивница характеризуется зудом и жжением кожи на фоне появления волдырей. Сыпь может быть размером с копеечную монету или представлять собой сливающиеся отдельные обширные очаги неправильной формы. Если крапивница длится более 3 мес, ее называют хронической.
При гигантской крапивнице — отеке Квинке отек распространяется на глубоко лежащие отделы кожи и подкожной клетчатки. Ангионевротический отек Квинке, как и крапивница, наряду с кожей может локализоваться на слизистых оболочках, нарушая функцию различных органов и систем. При отеке гортани возможно затруднение дыхания вплоть до асфиксии, при локализации на слизистых оболочках других органов — дизурические явления, симптомы острого гастроэнтерита, непроходимости кишечника. Оек Квинке, как и крапивница, держится от нескольких часов до нескольких суток и исчезает бесследно. При пищевой аллергии, глистной инвазии, непереносимости ацетилсалициловой кислоты, бензоата натрия, пищевых добавок, как и при вегетативной дисфункции с холинергическими реакциями, они могут принять рецидивирующее, хроническое течение.
При хронической крапивнице, в отличие от острой, возникают периваскулярные лимфоидные инфильтраты с последующим развитием акантоза (гиперпигментации кожи в коленных, локтевых, пахобедренных и межъягодичных складках), гиперкератоза.
Наряду с этим при крапивнице могут наблюдаться волдыри, оставляющие после себя гиперпигментацию в связи с гиперергической реакцией с образованием пузырей, наполненных геморрагическим содержимым. Это обусловлено острой вазопатией, лимфопатией сосочкового слоя дермы с высокой проницаемостью стенок сосудов.
Контактные крапивницы — появление волдырей после соприкосновения с крапивой, кактусом, плющом, косметическими средствами, дезодорантами, содержимым ворсинок гусениц (особенно из семейства волнянок), солями никеля, синтетическими материалами, латексом и др.
Контактная крапивница характеризуется локализованными высыпаниями в местах контакта с аллергеном или гистаминолибераторами вплоть до развития гигантской крапивницы — отека Квинке. Возможно развитие анафилактоидных реакций.
При распространенной, генерализованной, крапивнице прослеживаются общие реакции, как и при токсидермии, — резкое повышение температуры тела до 38–39 °C, гематологические сдвиги, возможны паренхиматозные изменения.
Атипичная разновидность острой и контактной крапивницы — холинергическая, механическая крапивница, которая возникает при механическом раздражении — в процессе исследования характера дермографизма, при механическом раздражении деталей одежды и проявляется реакциями волдырного типа.
При детской крапивнице мелкие волдыри возникают на фоне экссудативного диатеза, повышенной чувствительности к ряду пищевых продуктов.
Дифференциальный диагноз
У молодых людей (чаще мужчин) необходимо отличать холинергическую крапивницу от вторичной эритромелалгии, вторичного вазомоторного невроза, который развивается на основе ангиопатических расстройств с усиленным сбросом через артериовенозные анастомозы потоков артериальной крови при физических, эмоциональных нагрузках, воздействии низких температур, изменении положения тела (Г.Р. Табеева, 1991). Этому состоянию часто сопутствуют эндартериит, флебитические расстройства, диабет. Мы наблюдали эритромелалгию на фоне эмоциональной лабильности у практически здоровых людей на момент обследования.
Приступам эритромелалгии сопутствует чувство жжения, жгучей боли кожных покровов, выраженной, часто диффузной гиперемии их с цианотичным оттенком симметричного характера на конечностях или туловище с гипергидрозом. Эритромелалгия может развиваться как острый криз и быстро проходить или затягиваться на более продолжительное время.
Дифференцировать аллергическую крапивницу целесообразно с аллергическими поверхностными васкулитами, в частности с простой пурпурой, которая на начальных этапах развития может проявляться ограниченными багрово-красными (эритематозными) пятнами, иногда сливающимися между собой.
На фоне подобных пятен, часто расположенных симметрично на разгибательных поверхностях, могут возникать уртикарные зудящие элементы.
В отличие от крапивницы подобные высыпания при надавливании не исчезают и в динамике претерпевают изменения: вначале синюшно-багровые, затем коричневые, желто-зеленые, исчезая бесследно или оставляя после себя стойкую пигментацию на коже.
Острую крапивницу с проявлениями в местах высыпаний кровоизлияний дифференцируют с пигментной крапивницей, которая является частью (составным целым) мастоцитоза. Мастоцитоз обусловлен пролиферацией мастоцитов в виде ограниченных участков (кожная форма) или в виде системных поражений (кожно-висцеральная форма). Пигментная крапивница может проявляться множеством мелких округлых красноватобурых пятен или возвышающихся папул, имеющих тенденцию к слиянию, слегка зудящих и симметрично разбросанных на кожных покровах. При потирании этих высыпаний пальцем или шпателем они становятся более яркими и отечными вследствие раздражения мастоцитов и выброса ими биологически активных веществ (феномен трения Унны — Дарье).
При дифференциальной диагностике аллергической и ложноаллергической крапивницы следует иметь в виду, что при последней часто выявляются заболевания желудочно-кишечного тракта и гепатобилиарной системы; нет повышения содержания специфических IgE; нет улучшения при голодании или при проведении гипоаллергенной диеты; не оказывают положительного влияния на проявления-регрессию крапивницы антигистаминные препараты. Дифференцировать их позволяет билирубиновый тест, сущность которого заключается в том, что при ложноаллергической крапивнице достоверно возрастают параметры билирубина на 3-и—5-е сут голодания (В.И. Пыцкий, 1999).
Лечение
1. Устранение контакта с аллергеном.
2. Гипоаллергениая диета, включая прием энтеросорбентов (активированный уголь, или белосорб, до 12–18 г в сутки, или пектины).
3. Антигистаминные средства — кларитин или эбастин (10 мг 1 раз в сутки, при необходимости до 2–3 нед) либо задитен — 1 табл. (1 мг) 2 раза в сутки в случаях подозрения на пищевую аллергию с курсом лечения при необходимости до 1–2 мес. Если кетотифен вызывает выраженный седативный эффект, то вместо одной таблетки назначается 1 /2 таблетки 2 раза в сутки. Не следует принимать водителям и другим лицам, в работе которых требуется повышенное внимание и высокая физическая активность, а также беременным женщинам.
4. В случаях отека гортани, абдоминального синдрома подкожно вводят 0,5 мл 0,1 % раствора адреналина и 1 мл 5 % раствора эфедрина. Показан солу-медрол — 30–90 мг или гидрокортизона гемисукцинат — 125 мг внутривенно капельно или внутримышечно.
При отеках Квинке с локализацией в области гортани дополнительно требуется дегидратационная терапия: 2 мл лазикса (при отсутствии аллергии к группе сульфаниламидов) с 20 мл 20 % раствора глюкозы внутривенно. При нарастании асфиксии и отсутствии эффекта от проводимой терапии показана трахеостомия.
5. Для улучшения микроциркуляции и снижения проницаемости сосудистой стенки можно назначать аскорбиновую кислоту и глюконат кальция.
6. При хронической крапивнице следует тщательно обследовать больного для выявления сопутствующих заболеваний со стороны желудочно-кишечного тракта, гепатобилиарной системы (включая энтеропатии) и др. Дополнительно может быть рекомендована гипосенсибилизирующая терапия — внутривенное введение 100 мг 5 % раствора аминокапроновой кислоты в изотоническом растворе хлорида натрия 1 раз в сутки 5 раз (при отсутствии угрозы ДВС-синдрома, повышения других факторов свертывания крови), или тиосульфата натрия — до 20 мл 30 % раствора через день 5 раз, или гистаглобулина подкожно по схеме 0,2–0,4—0,6–0,8— 1,0 мл через день, а затем через А—5 дней до 2 мл 5 раз.
7. Для борьбы с зудом можно рекомендовать местное применение аэрозолей аллергодила или гистимета (особенно при контактной несистемной крапивнице) или протирание 0,5–1 % раствором ментола, 1 % раствором лимонной кислоты или 1 % раствором питьевой соды (бикарбоната натрия). Противозудным действием и выраженным местным противовоспалительным эффектом обладают глюкокортикостероиды в виде мази или крема (элоком — 1 раз в сутки, наносить на наиболее воспаленные участки кожи), радоновые ванны или иглорефлексотерапия.






