Бронхиальная астма
В 1992 г. по инициативе Национального института сердца, легких и крови (США) состоялся Доклад международной группы по риску и безопасности противоастматической терапии, на котором было принято определение этого самостоятельного заболевания.
Бронхиальная астма представляет собой «хроническое заболевание, основой которого является воспалительный процесс в дыхательных путях с участием разнообразных клеточных элементов — тучных клеток, эозинофилов…» Клеточные пролиферативные воспалительные изменения в слизистой оболочке бронхиального дерева определяются также участием Т-лимфоцитов, фибробластов, эпителиальных и эндотелиальных клеток, утолщением ретикулярного слоя базальной мембраны, обнажением, оголением ее в результате слущивания клеток мерцательного эпителия. При БА, таким образом, развивается выраженная перестройка бронхиальной стенки с возникновением крайне высокой пароксизмальной гиперреактивности — повышением возбудимости рецепторов парасимпатических отделов нервной системы бронхиального дерева.
Развитие своеобразной пароксизмальной гиперреактивности бронхиального дерева обусловлено, как показывают многочисленные исследования, гиперпролиферативным клеточным воспалением, крайней активацией эозинофилов, тучных клеток, Т-лимфоцитов с выбросом ряда цитокинов, интерлейкинов и других биологически активных веществ.
Заболеваемость
По данным статистического сборника «Здравоохранение в Республике Беларусь, 1997», всего было зарегистрировано 44 400 больных бронхиальной астмой (БА), или 446,8 на 100 000 населения. Эти данные свидетельствуют о более низкой выявляемости больных БА в Беларуси — 0,4 % (в других регионах мира — более 5 %). Это, возможно, объясняется трудностями дифференциальной диагностики бронхиальной астмы и хронического бронхита, тем более что бронхиальная астма, по данным классификации торакального американского общества, рассматривается в рубрике ХОБЛ, в составе которых фигурируют хронический бронхит, эмфизема легких, облитерирующий бронхиолит — болезнь мелких бронхов, муковисцидоз, бронхоэктатическая болезнь.
Факторы риска
Среди индукторов БА заметное место занимают различные экзо- и эндоаллергены, чаще всего домашняя пыль, клещи, тараканы, пыльца растений, перхоть животных, медикаменты, грибы, профессиональные аллергены (различные высоко- и низкомолекулярные, органические и неорганические вещества).
Установлено, что наряду с аллергенами в развитии пароксизмальной гиперреактивности бронхиального дерева, а также в провокации специфической гиперреактивности важную роль играют некоторые неспецифические макроэкологические факторы — триггеры, такие как поллютанты (пыль, сернистый ангидрид, окислы азота, атомарный кислород и др.), консерванты, медикаменты, респираторные вирусные инфекции. Не менее значимое неспецифическое влияние на указанные механизмы гиперреактивности оказывают и микроэкологические факторы: желудочно-пищеводный рефлюкс в случаях ночных приступов удушья, синуситы, суперинфекция — нарушение гомеостаза микрофлоры кишечника, микробная (Helicobacter pylori), паразитарная инвазия. Провоцирующую роль в запуске удушья на фоне сенсибилизации к экзоаллергенам может играть физическая нагрузка и другие факторы.
В условиях производства многие вредные факторы способны оказывать сочетанное действие — сенсибилизирующее и триггерное в комбинации одновременно с другими триггерами, не являющимися аллергенами, но вызывающими физическое и химически раздражающее действие на слизистую оболочку бронхиального дерева.
В качестве примера приводим перечень различных производственных аллергенов (табл. 18).

Патогенез
В запуске воспалительного процесса при БА важную роль играют аллергены как индукторы и неспецифические факторы — триггеры макро- и микроэкологического характера.
Иммуноморфология воспалительного процесса при БА зависит от типа аллергического ответа, наследственного предрасположения, ассоциированного с HLA В7, DR2.
IgE-зависимый механизм реагинового типа. При иммунологической фазе аллергической реакции аллергенные белки пыльцы растений проникают через эпителий и с помощью специализированных антигенпрезентирующих клеток (макрофагов, В-лимфоцитов) активизируют Т-лимфоциты. Т-лимфоциты класса CD4, относящиеся к нулевым Т-хелперам (Тх0), дифференцируются в Т-хелперы второго типа (Тх2), продуцирующие ИЛ-4 и ИЛ-13. Последние включают в реакцию реагинового типа В-лимфоциты и способствуют экспрессии специфического IgE. В свою очередь ИЛ-4 еще в большей мере усиливают переключение Тх0 на Тх2, активируя лейкоциты и эозинофилы, подталкивают их к внутритканевому накоплению в шоковом органе.
С помощью Fc-фрагмента IgE сенсибилизирует тучные клетки, активируя их при присоединении аллергена через FаЬ-фрагмент. При этом развивается патохимическая ранняя фаза аллергической реакции, основанная на перемещении ионов Са2+ в клетку и выбросе из клетки гистамина. Вслед за ранней формируется поздняя фаза аллергии. Она обусловлена активацией альвеолярных макрофагов, базофилов, эозинофилов, лимфоцитов, тромбоцитов, на мембране которых имеются рецепторы к Fc-фрагменту. Это молекулярная основа их активации, опосредованная IgE при появлении аллергена. В указанных клетках на фоне ряда последовательных биохимических реакций активируются циклоксигеназный и липоксигеназный пути метаболизма арахидоновой кислоты с образованием многочисленных провоспалительных веществ (Ishizaka, 1982), повышается сосудистая проницаемость, выбрасываются лейкотриены С4, D4, выходят из кровотока IgG, лейкоциты. Последние оседают на эпителиальных клетках, эндотелии сосудов за счет взаимодействия с молекулами адгезии. Это в конечном итоге ведет к необратимой перестройке бронхиальной стенки, утолщению и деструкции базальной мембраны бронхиальной стенки, слущиванию, десквамации мерцательного эпителия, что является одним из маркеров БА (A.JI. Черняев с соавт., 1998).
IgG-опосредованные реакции. При тяжелом течении БА с наличием сопутствующего прогрессирующего обструктивного бронхита наряду с реагиновым возможно развитие цитотоксического типа реакции. Антигенами при данном типе реакции являются видоизмененные локусы на мембранах эпителиальных и других клеточных структур, возникающие при участии лекарственных, бактериальных, вирусных компонентов. Поскольку в данном случае антитела класса IgG взаимодействуют с видоизмененными локусами клеток с помощью фрагмента Fab, то остаются свободные фрагменты Fc, которые активируют комплемент, способствуя иммуноцитолизу видоизмененной клетки.
Т-лимфоцитозависимый тип повреждения. Клеточный тип аллергической реакции взаимосвязан с сенсибилизированными Т-лимфоцитами, которые при взаимодействии с антигеном высвобождают воспалительные цитокины (ИЛ-2, ИЛ-5), индуцирующие накопление клеток воспаления — эозинофилов, тучных клеток, нейтрофилов. Последние в шоковом органе накапливаются особенно в большом количестве при обострении БА.
Пароксизмальная неспецифическая гиперреактивность бронхиального дерева. Неспецифическая пароксизмальная гиперреактивность бронхиального дерева является ключевым звеном при БА, напрямую связанным с морфологическими, биохимическими изменениями дыхательных путей. Хроническое персистирующее воспаление служит основой этого явления (Б.И. Шмушкович, 1997).
Изучение причинно-следственных связей, лежащих в основе гиперреактивности бронхиального дерева, позволяет отнести к их числу не только наличие инфильтрации слизистой, подслизистой оболочки бронхиального дерева эозинофилами, Т-хелперами, макрофагами, но и их активацию с выделением различных воспалительных цитокинов. В гиперреактивности бронхиальных структур провоцирующую роль могут играть вирусные инфекции (риновирусы, респираторно-синцитиальные вирусы, вирусы парагриппа), бактериальные и микоплазменные инфекции и развитие сенсибилизации к ним.
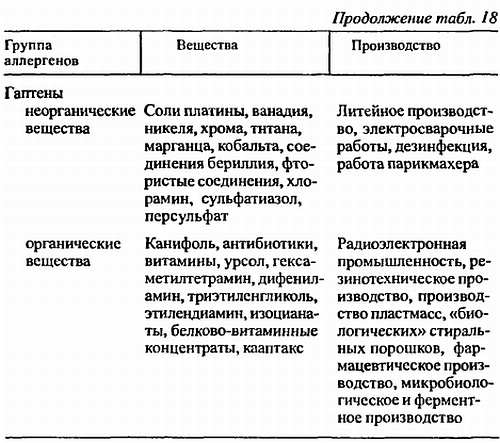
В патогенезе гиперреактивности дыхательных путей имеют значение продукты повреждения эпителия и других клеточных структур с выделением фактора активации тромбоцитов (ФАТ), фактора некроза опухолей, ИЛ-1, ИЛ-6, ИЛ-8 (рис. 3).
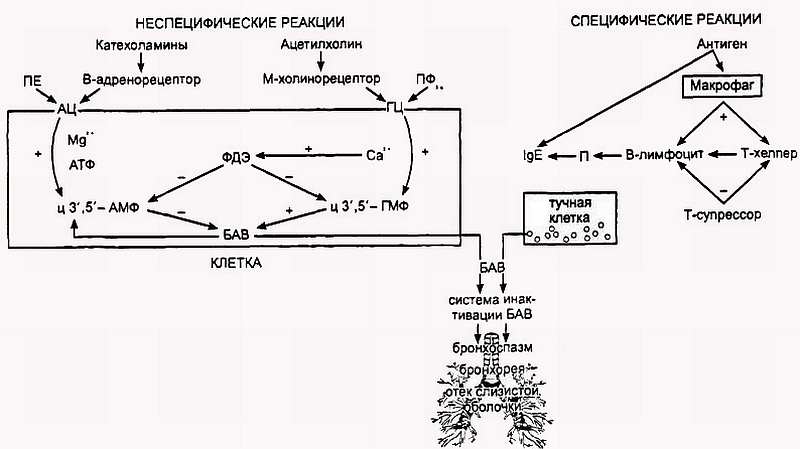
Рис. 3.
ФАТ обладает способностью вызывать многие реакции, свойственные целому ряду медиаторов, включая бронхоюэнстрикцию, является мощным индуктором микрососудистой проницаемости дыхательных путей, селективного хемотаксиса и активации эозинофилов. Столь выраженная значимость ФАТ в персистенции воспаления, его хронизации подтверждается увеличением содержания метаболита ФАТ — лизофосфатидилхолина в плазме крови больных БА.
Нарушение целостности эпителия дыхательных путей вследствие разрушительного воспалительного процесса приводит к обнажению нервных окончаний гладкой мускулатуры, афферентных холинергических нервов, вызывает высвобождение ацетилхолина и развитие рефлекторной холинергической бронхоконстрикции в ответ на воздействие триггеров (Barnes, 1987).
В развитии гиперреактивности дыхательных путей имеет важное значение десенситизация ?2-адренергической рецепции за счет блокады рецепторов дериватами воспалительных продуктов. ?2-адренорецепторы не только обеспечивают бронходилатацию, но и контролируют функциональную активность воспалительных клеток и продукцию провоспалительных медиаторов, особенно метаболитов арахидоновой кислоты. На фоне снижения активности ?2-адренорецепторов может повышаться чувствительность Н1-рецепторов к гистамину, рецепторов к LЕС4 и LTD4 (к лейкотриенам), рецепторов субстанции Р, расположенных на гладкой мускулатуре дыхательных путей, которые представляют собой мощную констрикторную систему.
Псевдоаллергические реакции (ПАР). Аллергические реакции сопровождаются разнообразными патофизиологическими и клиническими проявлениями в ответ на воздействие экзо- и эндоаллергенов. Столь разнообразный характер реакций взаимосвязан с анатомо-физиологическими особенностями шокового органа, что позволяет их классифицировать в виде отдельных номенклатурных заболеваний — аллергического ринита, аллергической бронхиальной астмы, крапивницы и т. д.
Однако идентификация аллергена с помощью современных методов аллергологического тестирования (кожных проб, провокационных, лабораторно-аллергических тестов) свидетельствует, что приступы бронхиальной астмы, крапивница, отек Квинке и др. могут развиваться без сенсибилизации, без иммунологической фазы аллергической реакции, т. е. только при наличии патохимической, патофизиологической фазы — с помощью тех же биологически активных веществ. Наряду с этим Л.B. Лусс (1998) приводит большой перечень медикаментов (препараты пенициллинового ряда, цефалоспорины, анестетики, препараты пиразолонового ряда), способных вызывать псевдоаллергические реакции, так как они обладают гистаминолиберацией (Ф.С. Зарудий, 1995). Это свойственно и ряду пищевых веществ (клубнике, землянике).
В связи с этим Л.В. Лусс выделяет два вида аллергических реакций, различающихся механизмами развития, — истинные, аллергические, реакции и ложные, псевдоаллергические, реакции. На этой основе Д.К. Новиков, В.И. Новикова (1998) предлагают свою классификацию бронхиальной астмы и выделяют в отдельную нозологическую форму неаллергическую, псевдоаллергическую, астму.
В развитии псевдоаллергической реакции активация тучной клетки наблюдается при отсутствии аллергена и IgE. Однако псевдоаллергическая реакция очень похожа на аллергическую, так как наряду с дегрануляцией тучных клеток и выбросом биологически активных веществ прослеживается участие в ней эозинофилов, моноцитов, лимфоцитов, тромбоцитов с включением в патологический процесс эпителиальных и эндотелиальных клеток (рис. 4).
Рис. 4.
В качестве триггеров — «индукторов» дегрануляции тучных клеток могут выступать макроэкологические (пыль, окислы азота, серный и сернистый ангидрид и др.) и микроэкологические факторы (грамположительные и грамотрицательные бактерии, естественные пептиды — субстанция Р, нейропептиды, нейротензин, каллидин, брадикинин), диагностические рентгеноконтрастные вещества (Л.В. Лусс, 1998).
Вероятность возникновения ПАР возрастает при нарушении инактивации гистамина, которому способствует снижение содержания моноаминокеидазы вследствие приема некоторых медикаментов, повышения проницаемости слизистой оболочки кишечника и избыточного всасывания гистамина и тирамина, при заболеваниях желудочно-кишечного тракта.
Л.В. Лycc считает, что при заболеваниях ЖКТ, печени, нейроэндокринной патологии создаются условия для избыточного образования и всасывания гистамина и гистаминоподобных веществ. Существенным условием для развития ПАР является полипрагмазия, одновременное введение несовместимых медикаментов. Один из важных механизмов развития ПАР — неспецифическая активация системы комплемента, в частности, йодосодержащими и рентгеноконтрастными веществами. Многие промежуточные продукты комплемента индуцируют либерацию биологически активных веществ из тучных клеток, базофилов, нейтрофилов, тромбоцитов.
Практически псевдоаллергические реакции могут наслаиваться на аллергические и возникать самостоятельно. Однако из этого, на наш взгляд, не следует, что это самостоятельное заболевание, так как по существу ПАР представляют собой один из вариантов неспецифических проявлений, за которым стоит своя нозологическая форма — БА, крапивница, отек Квинке и др.
Классификация
Классификация БА позволяет врачу правильно сформулировать диагноз. Международная классификация болезней X пересмотра МКБ-10 на современном этапе вполне удовлетворяет практического врача.
Международная классификация болезней X пересмотра (МКБ-10, ВОЗ, Женева, 1992)
45. Астма
45.0. Преимущественно аллергическая астма
— Аллергический бронхит
— Аллергический ринит с астмой
— Атопическая астма
— Экзогенная аллергическая астма
— Сенная лихорадка с астмой
45.1. Неаллергическая астма
— Идиосинкразическая астма
— Эндогенная неаллергическая астма
45.8. Смешанная астма
45.9. Неуточненная астма
— Астматический бронхит
— Поздно возникшая астма
46. Астматический статус
— Острая тяжелая астма
Диагноз преимущественно аллергической БА ставится больным при наличии доказанной сенсибилизации к конкретным аллергенам (с учетом аллергологического анамнеза и аллергологического тестирования).
Источником сенсибилизации при этом могут быть неинфекционные, инфекционные аллергены и аллергены паразитарного происхождения (тараканы и др.). Это упрощает формулировку диагноза и избавляет от необходимости делить астму на неинфекционно-аллергическую и инфекционно-аллергическую (как это предлагали в клинико-патогенетической классификации А.Д. Адо и П.К. Булатов, 1968). Тем более что инфекционно-аллергическая форма БА — понятие противоречивое, особенно при сенсибилизации к бытовым и профессиональным аллергенам.
Неаллергическая эндогенная БА разнообразна по характеру своего развития и сложна по патогенезу, нередко с аутоиммунными механизмами, со сложным анамнезом, связанным с перенесенной вирусно-синцитиальной, риновирусной, аденовирусной инфекцией без четких доказательств сенсибилизации к каким-либо аллергенам.
Неаллергическая идиосинкразическая астма часто развивается на дисметаболической основе, например при «аспириновой триаде» или при непереносимости некоторых пищевых продуктов, содержащих много гистамина, тирамина, гистаминолибераторов, или при выраженных ложноаллергических реакциях.
Смешанная форма БА может быть установлена при наличии как доказанной сенсибилизации к аллергенам, так и проявлений неаллергической БА, которые могут в течении заболевания преобладать, а также сопровождаться ложноаллергическими реакциями.
В основе неуточненной астмы преобладают механизмы вегетативной дисфункции (выраженного дисбаланса между холинергическими и адренергическими, между ?2-адренергическими и ?-адренергическими системами), эндокринных расстройств, псевдоаллергических реакций и др.
Неуточненная астма ассоциируется с поздно возникшей астмой. Подобная ситуация часто прослеживается на фоне длительно существующего (персистирующего) хронического бронхита у пациентов с варьирующим обструктивным синдромом, на фоне которого в конечном итоге развиваются пароксизмальные приступы удушья и появляется необходимость констатировать наряду с бронхитом поздно возникшую бронхиальную астму. Подобное часто возникает на фоне профессионального (пылевого) бронхита, что дало основание А.Е. Вермелю (1966) при появлении у таких больных приступов удушья констатировать «вторичную» астму.
Приведенная международная классификация бронхиальной астмы продолжает обсуждаться и уточняться. В.И. Пыцкий с соавт. (1999) считают необходимым подчеркнуть важную роль в формировании астмы воспалительных реакций, связанных с инфекционными факторами, и выделяют следующие формы бронхиальной астмы.
1. Атопическая бронхиальная астма, вызываемая аллергенами у лиц с атопической конституцией. Она включает:
1.1. Неинфекционно-атопический вариант.
1.2. Инфекционно-атопический вариант.
1.3. Смешанный вариант (1.1+1.2).
2. Псевдоатопические формы бронхиальной астмы у неатопиков, имеющих дефекты в регуляции бронхиального тонуса (псевдоатопическая конституция).
2.1. Формы, вызываемые неинфекционными ирритантами. Наиболее известны:
2.1.1. «Аспириновая астма».
2.1.2. Астма физического усилия.
2.2. Формы, вызываемые возбудителями инфекционных процессов и объединяемые под общим названием «инфекционная астма».
Авторы подчеркивают, что инфекционная астма может сочетаться с любым вариантом из псевдоатопической группы. Она отличается по механизмам развития и клинике от инфекционноатопической бронхиальной астмы и практически соответствует варианту неуточненной астмы, сформировавшейся на фоне длительно протекающего хронического бронхита.
Следует отметить, что международная классификация позволяет правильно сформулировать диагноз бронхиальной астмы, а предлагаемые другие классификации БА в значительной мере помогают наглядно представить сущность патогенетического процесса при БА.
Вместе с тем следует констатировать, что до настоящего времени общепринятой классификации БА не существует из-за разнообразия причин, ее вызывающих.
В связи с этим в Методических указаниях по диагностике, профилактике и лечению бронхиальной астмы (Минск, 1999) правильно утверждается, что из множества предлагаемых терминов следует различать следующие формы бронхиальной астмы: 1) аллергическую; 2) неаллергическую; 3) смешанную.
Различия между аллергической и неаллергической БА представлены в табл. 22, из которой можно сделать вывод, что неаллергическая БА в значительной мере спровоцирована предшествующими инфекционно-воспалительными заболеваниями верхних отделов дыхательных путей или бронхиального дерева, имеет сложный генез и ассоциируется с представлениями об эндогенной неаллергической астме.
Подобный подход упрощает диагностику БА и формулировку диагноза в условиях поликлиники, однако это не снимает многие трудные нерешенные вопросы, касающиеся аспириновой, профессиональной БА, кашлевого варианта астмы.
Каждая из форм БА, предусмотренных в МБК-10, по течению поразделяется на легкую, средней тяжести и тяжелую в зависимости от частоты приступов удушья (или приступообразного кашля) — редких спорадических (эпизодических) или персистирующих, отражающих хронизацию течения с развитием клеточных инфильтралгивных изменений в слизистых, подслизистьтх отделах бронхиального дерева (табл. 19).

Клинические проявления
Бронхиальная астма чаще характеризуется пароксизмальностью кашлевой реакции или удушья в определенное время суток (чаще ночью), наличием экспираторной одышки со свистом на фоне удлиненного выдоха. Внезапность этих проявлений — неприятный сюрприз для больного — требует неотложной помощи. Приступ удушья может так же быстро закончиться с отхождением незначительного количества слизистой по характеру мокроты, при отсутствии каких-либо клинических проявлений в межприступный период.
Однако при сезонной бронхиальной астме, обусловленной пыльцой растений, чаще заболеванию сопутствуют или предшествуют проявления поллиноза (ринита, конъюнктивита, атопического дерматита), в межсезонный период проявления БА отсутствуют. Частота пароксизмальных приступов удушья зависит от степени тяжести БА.
Диагноз
Главные концептуальные направления диагностики БА отражены в ряде национальных программ по борьбе с бронхиальной астмой, которые позволяют выделить из перечня обструктивных болезней органов дыхания БА в самостоятельную нозологическую форму (А.Г. Чучалин, 1998). В настоящее время идет интенсивное изучение основных биологических маркеров БА.
1. БА — персиетирующее воспаление, ведущее к хронизации патологического процесса.
2. При БА среди воспалительных клеток преобладают эозинофилы, которые под воздействием факторов адгезии прилипают к стенке сосудов и пронизывают все стенки бронхов, проникая в просвет последних.
Морфометрические параметры этих клеток в очаге воспаления обращают на себя внимание тем, что они крайне активизированы и, дегранулируя, осуществляют активный синтез ряда пептидов. Это большой основной протеин, эозинофильный катионный протеин, эозинофильная пероксидаза, эозинофильный протеин X, ряд активных медиаторов воспаления — фактор активации тромбоцитов, лейкотриены (LTC4), усиливающих бронхоконстрикцию, проницаемость сосудов и активирующих ряд других клеточных образований (Э.Х. Анаев, А.Г. Чучалин, 1997).
3. Основным маркером бронхиальной астмы является массовая десквамация клеток мерцательного эпителия, оголение и деструкция базальной мембраны бронхиального дерева на фоне активации эозинофилов, макро- и микрофагов с поражением эпителиальных и эндотелиальных клеток и высоким содержанием эндотелина — белка эпителиальных клеток — мощного провокатора бронхоспазма.
4. Пароксизмальная гиперреактивность бронхиального дерева, выявляемая с помощью ингаляционных проб с гистамином, метахолином, ацетилхолином к специфическим и неспецифическим макрои микроэкологическим факторам.
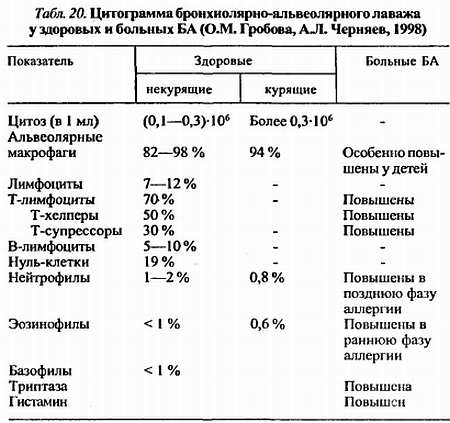
5. В диагностике БА в ряде случаев актуально исследование бронхиолярно-альвеолярного лаважа, который позволяет определить клеточный состав и продукты функциональной активности клеток воспаления (табл. 20).
6. Маркером активности воспаления при БА является повышение концентрации оксида азота (NO) в выдыхаемом воздухе.
7. Высокое наследственное предрасположение при аллергической БА.
8. При оценке иммунологического гомеостаза обращают на себя внимание: а) высокое содержание общего и особенно специфического IgE, б) переключение Тх0 на Тх2 с выбросом ИЛ-4 и ИЛ-5, усиливающих экспрессию В-лимфоцитами IgE.
9. Естественно, что в условиях поликлиники практический врач не сумеет использовать весь этот арсенал биологических маркеров в диагностике БА. Поэтому наряду с вышеприведенными опорными признаками БА принимаются во внимание аллергологический анамнез; клинические особенности заболевания; аллергологическое тестирование.
10. Более сложна диагностика неаллергической БА, так как клинические проявления ее во внеприступный период имеют много общих черт с хроническим бронхитом (см. Хронический бронхит).
11. Исследование функциональных показателей внешнего дыхания с проведением фармакологических проб является одним из важных этапов в диагностике БА, принятии экспертных решений и проведении реабилитации.
Среди предлагаемых функциональных тестов заслуживают особого внимания те из них, которые выполняются в скоростном режиме на выдохе и вдохе, в частности: 1) объем форсированного выдоха за 1 с (ОФВ1); 2) анализ петли «объем-поток» (пневмотахография); 3) пиковая (максимальная) скорость выдоха — ПСВ (пикфлоуметрия) при мониторировании в амбулаторных условиях. Мониторирование ПСВ в течение суток дает возможность установить степень выраженности обструкции, а также вариабельность ее и определить степень тяжести течения БА.
Наряду с этим фармакологические пробы с ?2-агонистами и анализ изменения петли «объем — поток» или ПСВ позволяют также судить о наличии обратимой или необратимой обструкции. Фармакологическая проба с гистамином или метахолином в период ремиссии БА с проведением до и после нее пневмотахографии или исследованием ПСВ дает возможность зарегистрировать степень выраженности гиперреактивности слизистой оболочки бронхиального дерева к воздействию различных триггеров, что имеет определенное значение при проведении экспертизы пациентов в случае длительной ремиссии БА. Аналогичную реакцию можно получить при исследовании функциональных показателей внешнего дыхания до и после ступенчатой физической нагрузки при проведении велоэргометрии.
Объем форсированного выдоха за 1 с — весьма ценный функциональный показатель в динамике и при проведении различных фармакологических проб в сопоставлении с ФЖЕЛ. Уменьшение данного показателя ниже 75 % свидетельствует о выраженности обструктивных изменений, а существенное его увеличение на фоне фармакологической пробы с ?2-агонистами подтверждает обратимый характер их.
Весьма удобным и наглядным функциональным показателем является анализ петли «поток — объем» при пневмотахографии, которая в отличие от ОФВ1 позволяет дифференцировать уровень (крупные, средние, мелкие бронхи) обструктивных изменений дыхательных путей, поэтому, естественно, ценность ее при проведении фармакологических проб резко возрастает (рис. 5).
Особенно демонстративна кривая выдоха, которая при БА имеет вогнутый характер с непропорционально низкими объемными скоростями при анализе потока из мелких бронхов, тогда как петля вдоха не претерпевает существенных изменений. Если изменяются петли потока существенно на выдохе и вдохе, то обструкция часто захватывает и верхние отделы дыхательных путей.

Рис. 5.
1 — петля — поток в норме; 2 — петля — поток (обструктивный тип); 3 — петля — поток (рестриктивный тип); Пм — максимальный поток — выдох; П75 — поток из крупных бронхиальных структур; — лоток из средних бронхиальных структур; П25 — поток из мелких бронхиальных структур
Пикфлоуметрия — метод измерения пиковой (максимальной) скорости выдоха (ПСВ), удобный портативный способ мониторирования в течение суток с приведением показателей на специальном бланке. С помощью этого метода можно определить:
а) провоцирующее влияние профессиональных и непрофессиональных индукторов аллергии;
б) триггерное воздействие различных неспецифических факторов на течение БА;
в) вариабельность изменений ПСВ в течение суток по формуле:
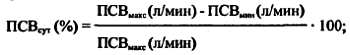
г) объем (глюкокортикоиды в мкг) проводимой лекарственной терапии, т. е. управлять заболеванием, с одной стороны, а с другой — иметь возможность предупредить нарастающую обструкцию на этапах, когда клинически явное ухудшение состояния пациента еще нельзя идентифицировать.
Мониторирование ПСВ позволяет больному вовремя обратиться к врачу за корректировкой лечения или, приобретая соответствующие навыки в астма-школе, самому принять адекватное решение, не ожидая субъективного ухудшения состояния.
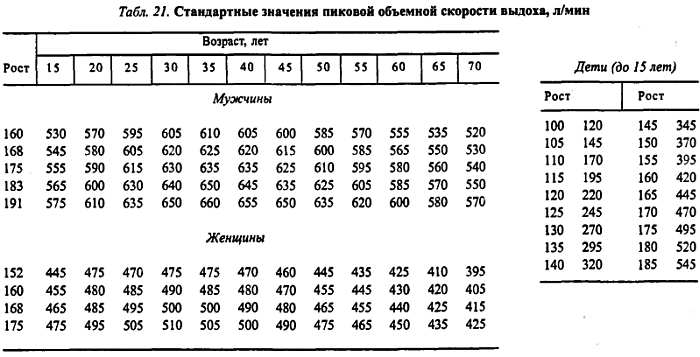
Приводим шкалу стандартных значений пиковой объемной скорости выдоха (табл. 21).
Мониторировать показатели ПСВ больной может после обучения по специальной программе, обеспечивающей адекватное представление больного о характере заболевания, что позволяет ему ориентироваться в изменении своего состояния и принимать правильное решение.
Пациента необходимо обучить принципам самонаблюдения: рекомендовать вести дневник и оценивать свое состояние по специальной шкале, правильно пользоваться методом пикфлоуметрии (рис. 6, 7).

Рис. 6.
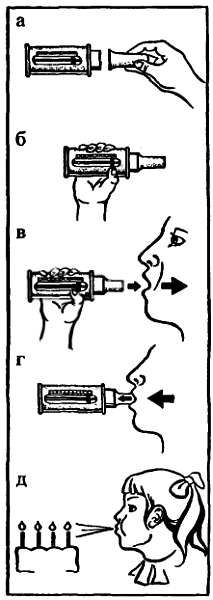
Рис. 7.
а — надеть мундилуковую головку на пикфлоуметр;
б — встать и держать пикфлоуметр горизонтально, убедиться, что бегунок неподвижен и находится в начале шкалы;
в-г глубоко вдохнуть, обхватить губами мундштук и выдохнуть как можно быстрее; отметить результат, дважды повторить стадии б-г, выбрать наивысший результат, сравнить полученные данные с должными;
д — детям объяснить, что выдохнуть нужно так, чтобы можно было погасить свечи на праздничном торте.
Дифференциальный диагноз
Заключение врача о выраженности симптомов астмы, определение степени тяжести не означают окончательного установления тяжести заболевания. БА отличается, например, от хронического бронхита (ХБ) большей вариабельностью течения, даже более полной обратимостью нарушенной бронхиальной проходимости при адекватной терапии. Поэтому прогноз течения БА значительно утяжеляется при наличии на фоне ее ХБ, поскольку обратимость обетруктивного синдрома в таких случаях менее вероятна. При сочетании БА и ХБ межприступный период менее четкий по субъективным и объективным данным вследствие преобладания инфекционно-воспалительного процесса в бронхиальном дереве. Подобное течение БА на фоне ХБ чаще ассоциируется с понятием инфекционной (неатопической) астмы.
Эти различия ярко продемонстрированы В.И. Пыцким с соавт. (1999) в таблице дифференциальной диагностики различных форм бронхиальной астмы.
Мы заимствовали клинико-патогенетические данные указанных авторов и адаптировали их с учетом клинико-патогенетических представлений (табл. 22) об аллергической и неаллергической БА.


При первичной диагностике БА нередко трудно дифференцировать неаллергическую БА и хронический бронхит или кашлевой вариант БА и трахеобронхиальную дискинезию, центральный рак легких, хронический бронхит.
При дифференциальной диагностике БА и ХБ необходимо принимать во внимание наличие характерных для этих двух заболеваний биологических маркеров (см. диагностика и классификация БА и ХБ).
При трахеобронхиальной дискинезии (ТБД) в отличие от БА отсутствует аллергологический анамнез, не наблюдается вариабельность показателей пикфлоуметрии при мониторировании их в течение суток (более 20–30 %).
Исследования В.П. Скибы (1994) показывают, что чаще всего для ТБД характерен приступообразный «лающий» кашель днем (в 90,9 % случаев) или в ночное время (в 18,1 % случаев); у 47,3 % больных кашель заканчивается затрудненным дыханием, переходящим в выраженные приступы удушья (чаще на фоне физической нагрузки вследствие повышения экспираторного внутригрудного давления, усиливающего пролапс в просвет трахеи и крупных бронхов мембранозной стенки).
Весьма показательным исследованием при ТБД является запись форсированного выдоха с наличием отрицательных зубцов в виде провалов на отрезке, характеризующем «поток — объем» крупных бронхиальных структур.
Фибробронхоскопическая картина при ТБД весьма своеобразна. В зависимости от степени выраженности экспираторный пролапс мембранозной стенки дыхательных путей прослеживается на участке от 1/2 до 2/3 просвета трахеи и бронхов. У подобных больных при физической нагрузке наряду с приступообразным кашлем может возникать экспираторная одышка. При ТБД у певцов в процессе исполнения арии при появлении столь выраженного экспираторного пролапса на выдохе может внезапно обрываться мелодия или возникать пароксизмальный кашель вследствие выбухания мембранозной части задней стенки — сильного раздражения рецепторов вагуса (рефлексогенной кашлевой зоны) экспираторным коллапсом задней стенки трахеи и бронхов.
Следует отметить, что наличие спонтанного или приступообразного кашля возможно за счет набухания (отека) слизистой оболочки крупных бронхов, трахеи вследствие воспаления аллергического генеза или медленно нарастающего кашля — вследствие отека инфекционно-воспалительного генеза. Похожая ситуация может возникнуть в процессе дифференциальной диагностики этих состояний, которые на фоне лечения легко устраняются. Однако если кашлевая реакция не исчезает, необходимо углубленное обследование больного с помощью фибробронхоскопии для исключения новообразований с проведением гистоморфологических исследований подозрительных участков слизистых оболочек на выявление метаплазии, анаплазии, гиперплазии.
Бронхиальная астма с ночными приступами удушья. При дифференциальной диагностике не всегда удается принять однозначное решение у пациентов с проявлениями ночных приступов удушья или ночных пароксизмальных кашлевых реакций. Наряду с так называемой «ночной бронхиальной астмой» у подобных больных необходимо исключать гастроэзофагеальный рефлюкс с микроаспирацией желудочного содержимого, а также сердечную астму вследствие подострой (или острой) систолической недостаточности. Казалось бы, эти состояния принципиально отличаются друг от друга. Однако они могут создавать определенные трудности при установлении заключительного диагноза. Тем более, что наличие аллергологического анамнеза, сенсибилизация к экзоаллергенам с повышением содержания общих и специфических IgE, интерлейкинов (ИЛ-4, ИЛ-5, ИЛ-6) играют решающую роль в диагностике атопической БА (реагиновый тип), тогда как при неаллергической (неатопической) БА эти критерии могут отсутствовать. В таких случаях приходится принимать во внимание широкий диапазон других клинико-диагностических маркеров.
Как отмечают С.Т. Холгейт (1997) и др., в случае атопической и неатопической БА при исследовании клеточного состава бронхиолярно-альвеолярного лаважа, биопсии слизистой оболочки бронхиального дерева наряду с лимфоцитами повышено содержание тучных клеток и эозинофилов, продуктов экспрессии их — гистамина, триптазы, эйкозаноидов — простагландина D2, цистенил-лейкотриенов, которые в конечном итоге посредством нейронных эффекторных механизмов провоцируют кашлевую и бронхоспастическую реакцию. Определенную значимость в диагностике БА имеет повышение в выдыхаемом воздухе содержания окиси азота (NO). Это новый интересный диагностический тест. NО продуцируется многими клетками респираторного тракта и существенно возрастает в выдыхаемом воздухе вследствие активации клеток воспаления (С.А. Харитонов с соавт., 1997).
Таким образом, исходя из главного патогенетического аргумента о воспалении при БА, в настоящее время предложен ряд биологических маркеров воспаления, которые позволяют дифференцировать БА с другими состояниями, провоцирующими ночные приступы удушья. Однако этого недостаточно и требуется ряд дополнительных исследований. Приступы ночного кашля и удушья, связанные с рефлюкс-эзофагитом, микроаспираци ей желудочного содержимого, слюны или слизеобразной массы при воспалении носоглотки, могут быть расшифрованы при углубленном обследовании рельефа слизистой оболочки носоглотки, исследовании желудочно-кишечного тракта.
Что касается заболеваний сердечно-сосудистой системы, связанных с первичным исходным наличием систолической недостаточности левого желудочка и наблюдаемыми эпизодами сердечной астмы, то должны исключаться:
— ИБС с атеросклеротическим или постинфарктным склерозом миокарда;
— дилатационная миокардиопатия;
— перегрузка левых отделов сердца давлением (гипертензия, аортальный стеноз);
— диастолическая перегрузка объемом (недостаточность аортальных клапанов) и др.
При этом учитывается: отсутствие аллергического анамнеза, наличие инспираторной одышки при физической нагрузке, наличие тахикардии, концентрической, эксцентрической или асимметричной гипертрофии левых отделов сердца, снижение систолического и пульсового давления, высокая эффективность при ночных приступах удушья не только ?2-агонистов, но нитратов и другой патогенетической терапии, проводимой при сердечнососудистой патологии (применение гипотензивных средств при гипертензии).
Дифференциальная диагностика и диагностика профессиональной бронхиальной астмы. Развитие профессиональной бронхиальной астмы вследствие сенсибилизации рабочих к аллергенам в условиях производства зависит от многих обстоятельств (В.Г. Артамонова, В.Ф. Жданов, E.Л. Лашина, 1997) и может прогнозироваться при:
1) предрасположении вследствие наследственной отягощенности и собственного аллергологического анамнеза;
2) ингаляционном пути поступления аллергена, так как органы дыхания — наиболее чувствительная система в формировании аллергии;
3) наличии сильных аллергенов 1-го класса опасности (урсол, бихромат, соли никеля, кобальта, фенилендиамин, аминазин, кормовые дрожжи и др.);
4) периодическом превышении предельно допустимых концентраций гаптенов в воздушной среде, так как при первичной сенсибилизации имеет значение концентрация аллергена, при развитии же аллергии — приступы бронхиальной астмы провоцируются аллергенами в концентрации, значительно ниже предельно допустимой;
5) сочетанном действии аллергенов с другими вредными факторами (неаллергенами), различными поллютантами (пылью, газообразными и масляными аэрозолями), оказывающими повреждающее действие на физиологические барьеры и способствующими тому, что даже слабые аллергены могут вызывать сенсибилизацию.
Существует три основных варианта формирования профессиональной бронхиальной астмы:
1) аллергическая форма, возникающая первично без предшествующих аллергических поражений верхнего отдела дыхательного тракта, кожных покровов;
2) аллергическая форма в сочетании с развившимися первично в местах наибольшего воздействия производственного аллергена профессиональным аллергическим дерматитом на открытых участках кожных покровов (кисти, кожные покровы шеи, лица), риноконъюнктивитом;
3) аллергическая и неаллергическая — смешанная форма БА, развившаяся на фоне предшествующего хронического профессионального бронхита. В данной ситуации возможен вариант неаллергической БА.
Первые два варианта профессиональной бронхиальной астмы развиваются у работающих в контакте с аллергенами 1-го и 2-го класса опасности. При этом наблюдается повышение аллергоспецифических IgE. Третий вариант профессиональной астмы (смешанная или эндогенная формы) выявляется у работающих в контакте с поллютантами, в составе которых имеются слабые или умеренные аллергены. Порог риска при этом может составлять 10–12 и более лет работы в контакте с аллергенами, концентрация которых превышает предельно допустимую.
Профессиональный аллергический анамнез — появление аллергических реакций на работе и исчезновение их вне ее — важный клинический и диагностический критерий заболевания.
Мониторинг показателей внешнего дыхания, в частности данных портативной пикфлоуметрии — до работы, во время и после нее, является весьма важным и часто решающим объективным тестом для профессионального аллергического анамнеза в диагностике БА.
Наряду с функциональным мониторингом показателей внешнего дыхания осуществляются по общепринятым диагностическим критериям скарификационные кожные тесты и внутрикожные аллергические пробы со стандартизованными профессиональными аллергенами.
Провокационные ингаляционные диагностические пробы с профессиональными агентами проводятся в тех случаях, когда отсутствует корреляция между данными аллергологического анамнеза, экспозиционных тестов и данными накожного тестирования. Провокационный ингаляционный диагностический тест с профессиональными аллергенами осуществляется в предусмотренных и разрешенных концентрациях (не выше ПДК) в межприступном периоде в условиях стационара. При испытании неоактериальных аллергенов животного или растительного происхождения, содержащих 10 000 PNU, готовят двукратные разведения (1:2, 1:4, 1:8 и т. д. до 1:2048), для ингаляционных проб с химическими аллергенами — десятикратные разведения (1:100, 1:1 000 и тд. до 1:100 000) химического соединения, если оно является жидкостью.
До проведения провокационного ингаляционного теста и через 30–90 мин и 24 ч после него регистрируются аускультативные данные и функциональные показатели внешнего дыхания в виде мониторинга, а также проводится тест деструкции тучных клеток (ТДТК). Данные ТДТК через 24 ч после провокационной ингаляционной пробы с профессиональными аллергенами резко повышаются по сравнению с исходными (до пробы) вследствие индукции аллергоспецифических IgE при наличии сенсибилизации к производственному аллергену, с которым проводилась провокационная проба.
В настоящее время в диагностике профессиональной бронхиальной астмы используются реакции клеток крови на гаптен in vitro (реакция специфической агломерации лейкоцитов крови — РСАЛ, реакция специфического повреждения базофилов крови — РСПБ), серологические реакции с химическими аллергенами (реакция связывания комплемента — РСК, реакция пассивной гемагглютинации — РПГА), специфические клеточные реакции гиперчувствительности in vitro (реакция торможения прилипания клеток — РТПК, реакция специфического розеткообразования — РОК, реакция торможения миграции лейкоцитов крови — РТМЛ).
Формулировка диагноза
1. Бронхиальная астма, аллергическая форма, легкое эпизодическое течение, фаза ремиссии, ДН0. Аллергический ринит. Сенсибилизация к бытовым аллергенам.
2. Бронхиальная астма, аллергическая форма, легкое персистирующее течение, обострение, ДН0-I. Поллиноз, риноконъюнктивальный синдром. Сенсибилизация к пыльце полыни.
3. Бронхиальная астма, неаллергическая форма, среднее персистирующее течение средней тяжести, фаза обострения. Хронический бронхит, обострение. ДНI–II.
4. Бронхиальная астма, смешанная форма, среднетяжелое течение, фаза обострения. Эмфизема легких, ДНI. Сенсибилизация к эпидермальным аллергенам (кошки, собаки).
Лечение
1. Главное стратегическое направление в лечении аллергической и профессиональной бронхиальной астмы — определить индуктор сенсибилизации (аллерген) и максимально избавить пациента от дальнейшего контакта с ним — см. Реагиновый тип повреждения и Аллергены. Так, при «аспириновой» астме противопоказаны нестероидные противовоспалительные препараты (содержащие салицилаты или близкие к ним соединения), а также необходима гипоаллергенная диета, исключающая возможные примеси салициловой кислоты в пищевом продукте и пищевые красители (тартразин).
2. Необходимо максимально ограждать больных бронхиальной астмой от контакта с курильщиками, так как пассивное курение способствует усилению симптомов астмы. К обострению астмы предрасполагают повышение концентрации в воздушной среде частиц SO2, NO2, пыли.
3. Обращается внимание на тщательное лечение ринита, синусита, патологии желудочно-кишечного тракта, устранение желудочно-пищеводного рефлюкса и др.
4. При реагиновом типе повреждения у больных с БА решается вопрос о возможном применении специфической иммунотерапии, которая осуществляется аллергологом.
5. Противовоспалительная терапия при бронхиальной астме занимает ключевое место.
При легком и среднем персистирующем течении показаны нестероидные противовоспалительные средства — хромогликат натрия, или тайлед, либо ингибиторы лейкотриеновых рецепторов, при среднем и тяжелом персистирующем течении — ингаляционные глюкокортикоиды. Противовоспалительным действием при мягком течении БА обладают кетотифен, метилксантины, природные факторы — например спелеотерапия.
6. Симптоматическая терапия, направленная на устранение приступов, крайне актуальна и включает симпатомиметики быстрого и пролонгированного действия.
Лекарственная терапия БА проводится во всех случаях, когда есть клинические признаки БА или регистрируется супрессия показателей внешнего дыхания, в частности ФОВ1 < 80 %, ПОСвыд < 80 % или индекс вариабельности ПОСвыд >15 %.
В соответствии с отчетом экспертов разных стран EPR-2 (1997) создано руководство по диагностике и лечению астмы, которое позволяет врачам лучше управлять этим заболеванием. В нем уточнен характер течения бронхиальной астмы — вместо легкой, умеренно тяжелой и тяжелой предлагается различать легкую интермиттирующую, легкую персистирующую, персистирующую умеренной тяжести и персистирующую тяжелую БА.
Подчеркнуто, что у пациентов с любой тяжестью течения астмы могут наступать обострения легкой, средней и тяжелой степени.
В системе управления астмой ставятся задачи поддержания лёгочной функции, близкой к нормальной, нормального уровня активности, профилактики обострений и снижения до минимума числа госпитализаций, проведения фармакотерапии с минимальными нежелательными эффектами.
Это достигается в процессе обучения пациентов по специальной программе методам самоконтроля за состоянием обструкции, правильному использованию пикфлоуметра, спейсера, небулайзера, элементарному дозированию и правильному приему в аэрозолях лекарственных препаратов. Решение поставленных задач осуществляется частично на основе мониторирования данных пикфлоуметрии — ПОСвыд ранним утром при легком течении БА и утром, в обед и вечером при персистирующем умеренной тяжести и тяжелом течении, с занесением данных в протокол-график (рис. 8).

Рис. 8.
Мониторирование ПОСвыд позволяет прогнозировать обострение заболевания, так как накануне его супрессия показателей развивается до появления субъективных признаков обструкции.
Полученные данные опытной ПОСвыд сопоставляются с должными ПОСвыд из табл. 13, и вычисляется процент отклонения от должного.

Наряду с этим вычисляется индекс суточной вариабельности (ИСВ).
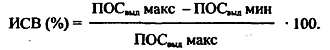
При мониторировании ПОСвыд ухудшение своего состояния пациент может прогнозировать на основании вариабельных отклонений показателей пикфлоуметрии в течение суток и при нарастающей их супрессии, т. е. без расчета показателей в процентах.
Чтобы пациент мог правильно оценить состояние по регистрируемой кривой пикфлоуметрии, разработана система зон, которая для облегчения ориентировки адаптирована к цветам светофора — зеленая, желтая, красная.
Зеленая зона констатирует относительное благополучие в состоянии больного — она соответствует ПОСвыд > 80 %, суточной вариабельности < 15 %. В данной ситуации симптомы астмы могут отсутствовать или быть минимальными.
Желтая зона: ПОСвыд в пределах 50–80 %, суточная вариабельность — 20–30 %. Если эта ситуация возникает постепенно или быстро, то она обязывает увеличить объем лекарственной помощи, и обученный пациент может сам принять это решение.
Красная зона — сигнал тревоги: при падении ПОСвыд < 50 % и увеличении суточной вариабельности > 30 % пациент обязан обратиться к врачу, с тем чтобы совместно с ним определить адекватную терапию БА. Переход показателей ПОСвыд с красной зоны в желтую и снижение объема проводимой терапии осуществляются под наблюдением врача.
На основании опыта мониторирования ПОСвыд в сопоставлении с течением БА была сформулирована концепция ступенчатого подхода к лечению при базовом постоянном лечении противовоспалительными препаратами и препаратами для быстрого купирования БА.
При ухудшении состояния пациента количество лекарственных средств и частота их приема увеличиваются, при улучшении — уменьшаются. При такой тактике удается контролировать астму и использовать наименьшее количество медикаментов.
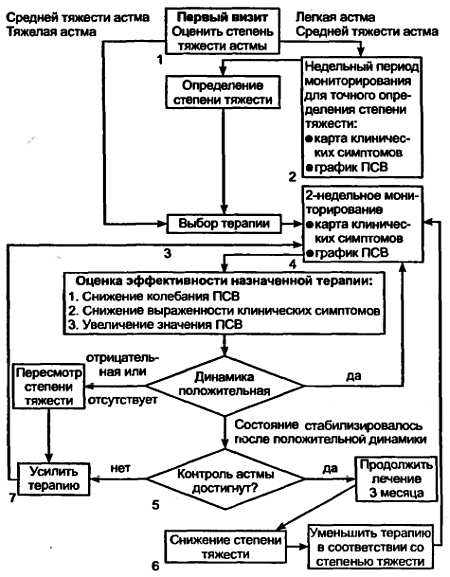
Наряду с этим приводим блок-схему (см. с. 133) метода оптимизации противоастматической терапии (А.Г. Чучалин с соавт., 1997), которая отражает необходимую последовательность действий врача при первом визите к нему пациента и при осуществлении ступенчатого лечения больных БА.
Легкая интермиттирующая астма
Противовоспалительная терапия не проводится.
Для оказания экстренной помощи рекомендуются бронхоцилататоры короткого действия — ингаляционные ?2-агонисты.
Вентолин (сальбутамол) — дозированный аэрозоль (1 вдох = 100 мкг) или вентодиск (сальбутамол) в дозе 200–400 мкг используются для контроля симптомов, но не более 1 раза в неделю. Прием сальбутамола возможен и с профилактической целью перед предполагаемым контактом с аллергеном.
Следует отметить, что вентодиск в отличие от вентолина содержит сальбутамол в виде дозированного сухого мелкодисперсного порошка, который вдыхается с помощью специального устройства — дискхалера. При обострении астмы с высокой гиперреактивностью слизистой оболочки бронхиального дерева на триггерной неспецифической основе возможна кашлевая реакция на форму препарата — микрокристаллы. Поэтому предлагаются новые технологические формы — сальтос с содержанием в одной таблетке 0,00723 мг гемисукцината сальбутамола, который на осмотической основе постепенно выделяется из таблеток после их приема (А.С. Соколов, 1998).
Наряду с применением сальбутамола возможно назначение других селективных ?2-агонистов: фенотерола (беротека) — 200 мкг на 1 вдох или тербуталина (бриканила) — 250 мкг на 1 вдох.
Однако сальбутамол в отличие от фенотерола обладает минимальной активностью на ?1—рецепторы и является одним из лучших селективных препаратов. Обеспечивает снижение высвобождения гистамина, медленнореагирующей субстанции и других медиаторов тучной клетки с помощью экспрессии на ее поверхности ?-адренорецепторов — в результате снижается проницаемость капилляров, продукция слизи, улучшается мукоцилиарный клиренс.
Легкая персистирующая астма
Наряду с ?2-адреномиметиками быстрого действия, необходимость приема которых не превышает 2–3 раз в неделю, требуются противовоспалительные препараты (тайлед или блокаторы лейкотриеновых рецепторов, ингаляционные глюкокортикоиды).
В качестве альтернативы ингаляционным глюкокортикоидам назначают аэрозоли кромолин-натрия (интала) от 2 мг 3 раза в день до 4–8 мг 4 раза в день. Действие препарата оценивается через 3–4 нед. Если при этом показатели пикфлоуметрии (ПОСвыд от должного) восстановились и индекс вариабельности стал менее 15 %, то ?-адреномиметики при отсутствии необходимости не принимаются, продолжается лечение инталом до 2–3 мес в профилактической дозе (2 мг 3 раза в день). При продолжающемся благополучии интал принимают эпизодически — перед ожидаемой физической нагрузкой, при триггерном воздействии факторов окружающей среды.
Если же приступы удушья периодически появляются или данные пикфлоуметрии нестабильны, то в качестве альтернативы назначают недокромил-натрий (тайлед) — натриевую соль пиранохинолиндикарбоновой кислоты, который хорошо сочетается с другими препаратами, подавляет как раннюю, так и позднюю фазу аллергии, оказывает преимущественно местный противовоспалительный эффект. Тайлед подавляет активность тучных клеток, эозинофилов, макрофагов, тромбоцитов, эпителиальных клеток, блокирует активность хлоридных каналов, обеспечивающих гиперполяризацию мембран, необходимую для притока в клетки кальция. В результате блокирования активности хлоридных каналов и снижения притока кальция в клетку предотвращается секреция провоспалительных медиаторов (ИЛ-1, ИЛ-8, ФНОа, гранулоцитарно-моноцитарного колониестимулирующего фактора — ГМ-КСФ), ингибируется миграция эозинофилов из кровеносных сосудов в ткани, их адгезия и хемотаксис, предотвращается повреждение эпителия бронхов. Это резко снижает пароксизмальную гиперреактивность бронхиального дерева, способствует сокращению приема ?2-адреномиметиков. Курс лечения — по 2 вдоха (4 мг) 4 раза (16 мг) до стабилизации состояния — появления устойчивых показателей пикфлоуметрии, через 3–4 нед 2 вдоха 2 раза в сутки. Наши наблюдения в течение 5–8 мес лечения позволяют утверждать, что тайлед обеспечивает управление течением легкой персистирующей астмы и у отдельных пациентов персистирующей астмы средней тяжести (у подростков и пациентов до 35 лет).
К другой группе мощных противовоспалительных средств при лечении больных БА можно отнести ингибиторы лейкотриеновых рецепторов аколат (зафирлукаст) или сингуляр (монгелукаст).
Аколат — таблетированный препарат, средняя уточная доза — 20 (40) мг, принимают 2 раза в сутки, подавляет как ранние, так и поздние реакции аллергии (Т. А. Червинская, Т.Г. Вылегжанина, 1988; Л.А. Горячкина с соавт., 1998).
По данным А.Г. Чучалина, ГЛ. Осиповой (1998), аколат (антагонист ЛTD4) через месяц от начала лечения в дозе 40 мг в сутки у больных БА средней тяжести облегчал симптомы астмы, обеспечивал снижение потребности в ?2-агонистах в 2 раза и практически при 14-месячном применении не вызывал каких-либо побочных реакций.
Сингуляр (таблетки по 10 мг в сутки) показал высокую эффективность при БА с персистирующим легким течением, при астме, провоцируемой физической нагрузкой (в этом случае глюкокортикоиды противопоказаны), при высокой чувствительности к аспирину. Лечение сингуляром при аспириновой астме обеспечивает не только стойкий противовоспалительный эффект, но и регрессирование полипов в полости носа.
Персистирующая астма средней тяжести
Бронходилататоры короткого действия (сальбутамол — 200 мкг) назначают для экстренной помощи (при появлении удушья) не более 3–4 раз в день.
При отсутствии удушья и супрессии данных пикфлоуметрии рекомендуется таблетированный пролонгированного действия ?2-агонист волмакс (сальбутамол) — 8 мг 2 раза в день или ингаляционный пролонгированный ?2-агонист серевент (сальметерол) — 50 мкг 2 раза в сутки (или в виде сухой пудры с дискхалером — 100–200 мкг в день). Пролонгированные ?2-адреномиметики крайне актуальны для предупреждения ночных приступов удушья. Они обладают наиболее высокой селективностью к ?2-адренорецепторам, способны поддерживать длительную персистирующую стимуляцию ?2-адренорецепторов, не вызывают их резистенции, ингибируют антиген-индуцируемое высвобождение простагландинов, лейкотриенов, гистамина, способствуя снижению в лаваже эозинофильного катионного белка.
Для достижения устойчивых результатов лечения необходимы более мощные противовоспалительные препараты — ингаляционные глюкокортикоиды.
В настоящее время есть много различных топических стероидов, которые позволяют при длительном приеме избегать риска возникновения системного эффекта. Для этого наряду с выбором препаратов необходимо соблюдать определенные правила приема аэрозолей — использовать спейсер, способный сепарировать крупные частицы, каждый раз после приема аэрозолей полоскать рот, максимально по возможности задерживать вдох после впрыскивания глюкокортикоида.
Противовоспалительный эффект ингаляционных глюкокортикоидов обусловлен низкой растворимостью в воде, высоким сродством к жирам, высокой липофильностью молекул, что позволяет создавать микродепо на слизистой оболочке бронхиального дерева. Это обеспечивает длительный контакт с клеточными структурами, проникновение в клетку через богатую липидами мембрану, связывание с рецептором в цитолизе клетки, ингибицию ряда продуктов воспаления — фактора агрегации тромбоцитов, лейкотриенов, простагландинов.
Таким образом, высокая липофильность ингаляционных глюкокортикоидов обеспечивает им выраженную противовоспалительную активность, низкую биодоступность — минимальный системный эффект вследствие ограниченной способности к всасыванию и попаданию в общий кровоток.
Общая биодоступность составляет у флунизогида (ингакорта) 21 %, триамцинолона ацетонида — 22,5 %, беклометазона дипропионата (альдецина) — 20 %, будезонида (пульмикорта) — 11 %, флутиказона пропионата (фликсотида) — менее 1 %. Местная противовоспалительная активность глюкокортикоидов (в условных единицах) у флутиказона дипропионата составляет 945, беклометазона дипропионата — 450, бетаметазона валерата — 370, флунизолида — более 100, триамцинолона ацетонида —110.
Например, при лечении аэрозолями флунизолида в связи с высокой его биодоступностью (всасыванием) и более низкой противовоспалительной активностью, чем у флутиказона, для достижения терапевтического эффекта требуется применение более высоких доз препарата, а это значит, системные эффекты будут выше (А.Г. Чучалин с соавт., 1998). В то же время использование аэрозолей флутиказона пропионата (фликсотида) при длительном лечении больных БА дает много преимуществ, так как в случаях обострения астмы доза его может быть увеличена до 2000 мкг в сутки и при купировании приступов не нужно будет назначать на короткий период пероральные глюкокортикоиды. Следует отметить, что максимальная терапевтическая доза будезонида не превышает 1200 мкг, ингакорта — 1500 мкг.
Фликсотид можно применять как в виде дозированного аэрозольного ингалятора, так и в виде сухой пудры с дискхалером. Это позволяет обойтись без фреонов, используемых для генерации аэрозолей, не безразличных при длительном лечении аэрозолями для пациентов и для окружающей среды.
Заслуживает внимания применение в аэрозолях при долговременной терапии больных БА негалогенизированного гтококортикоида будезонида (пульмикорта) — ацетилового производного окспреднизолона с сильным локальным противовоспалительным действием и низкой биодоступностью. При этом значительная часть препарата при всасывании со слизистой оболочки органов дыхания, поступая в кровоток, метаболизируется в печени, превращаясь в неактивные метаболиты, не способные вызывать супрессию надпочечников.
Будезонид мите выпускается в виде дозированных аэрозолей (50 мкг), позволяет в ряде случаев при легком персистирующем течении астмы стабилизировать ситуацию — контролировать заболевание при дозе 200 мкг в сутки (2 вдоха 2 раза в сутки по 50 мкг).
Будезонид форте чаще используется при персистирующей астме средней тяжести и тяжелом течении в виде дозированного аэрозоля (200 мкг).
Аэрозоли будезонида при длительной управляемой местной терапии больных БА (около года) в сочетании с теопэком (пролонгированной формой теофиллина) позволили добиться стойкого противовоспалительного эффекта (по данным морфометрии), восстановления целостности цилиарных эпителиальных клеток над обнаженной базальной мембраной бронхиального дерева (А.Г. Чучалин, 1998). Кстати, вместо теопэка можно использовать неотеопэк с более длительным высвобождением кристаллов теофиллина, вмонтированного по особой технологии в виде мелкодисперсного порошка КЛН-1, через мембрану таблетки (А.С. Соколов, 1998).
У нас накоплен определенный материал, свидетельствующий, что наряду с рано начатой лекарственной терапией заслуживает внимания сочетанное применение противовоспалительной лекарственной и «экологической» (управляемой) терапии.
«Экологическая» терапия в противовес триггерному провокационному воздействию, поддерживающему воспалительный процесс, позволяет на время исключать не только специфическое (аллергенное), но и неспецифическое (триггерное) влияние на пациентов.
«Экологическая» терапия представляет собой лечение в специфической спелеосреде — экосистеме, способной привести к ремиссии заболевания, снижению гиперреактивности бронхиального дерева, сокращению объема лекарственной терапии. Эффективность подобной терапии также тем выше, чем раньше начато лечение, перспективность ее крайне высока при мягком течении бронхиальной астмы у подростков.
Бронхиальная астма — заболевание воспалительной природы, на фоне которого весьма ярко прослеживаются хаотические отклонения со стороны функциональных показателей внешнего дыхания, вариабельность их — хаотический эффект. Столь выраженная неопределенность, неравновесность этих показателей обусловлена провоцирующими специфическими и неспецифическими факторами. Поэтому спелеотерапия представляет своеобразную экологическую систему, обеспечивающую стабилизацию хаотических эффектов у пациентов, по данным пикфлоуметрии, и других клинических проявлений.
Спелеокомплекс на базе Республиканской больницы спелеолечения — это абактериальная среда с наличием постоянного микроклимата (температура окружающего воздуха, атмосферное давление, экранирование электромагнитного поля) в сочетании с активным образом жизни, аэроионотерапией, оксигенотерапией, ингаляцией в виде микропримесей хлористого натрия (в боксах с залеганием минерала галлита), хлористого калия и магния (в боксах с залеганием минерала сильвинита).
Мы проанализировали клинико-функциональные, биохимические, иммунологические данные у 146 больных с атопической бронхиальной астмой до и после спелеолечения (наблюдение до 1 года).
Полученные результаты были оценены как отличные у 78 больных (53,7 %) с ремиссией заболевания более 5 мес, хорошие у 48 (33,1 %) с ремиссий от 2,5 до 5 мес. При этом принимались во внимание стабилизация хаотических ОФВ1 (до лечения более 30 %), после лечения в пределах 10 % в течение суток, сокращение приема лекарственных препаратов — ?2-агонистов в 2–3 раза, аэрозолей тайледа — в 2 раза, ингаляционных глюкокортикоидов — в 2 раза, снижение бронхиальной гиперреактивности на ингаляционную пробу с 0,1 % раствором ацетилхолина или метахолина (рис. 9).

Рис. 9.
1 —мощность выдоха; 2—лейкоциты периферической крови; 3, 4 — эозинофилы; 5 — тромбоциты; 6 — гистамин; 7 —ацетилхолин; 8 — кашлевая реакция; 1, 2, 3, 6, 7 — через 90 мин после пробы; 4, 5 — через 24 ч после пробы
Удовлетворительные результаты лечения отмечались у 12 пациентов (8,3 %) с неполной ремиссией до 1–2,5 мес и незначительные — у 7 человек (4,8 %) при отсутствии ремиссии. У этих пациентов оставалась высокой бронхиальная реактивность на неспецифические раздражители вследствие сопутствующего бронхита, с наличием необратимой обструкции.
В период ремиссии у больных с отличными и хорошими результатами лечения существенно повышалось качество жизни, наблюдалась высокая толерантность к физической нагрузке со стабилизацией ОФВ1, биохимических показателей крови (газовый состав, диеновые конъюгаты, малоновый ангидрид и др.).
Исследование иммунологического гомеостаза больных накануне спелеолечения свидетельствовало о преобладании гиперпролиферативных отклонений со стороны специфических показателей иммунитет, повышение IgE, активности комплемента). После спелеотерапии отмечалось снижение этих показателей, включая и клеточные формы иммунитета.
Таким образом, результаты лечения больных с атопической БА позволяют сделать заключение, что спелеотерапия на базе Республиканской больницы спелеолечения представляет собой экосистему с комплексом лечебных факторов, оказывающих благоприятное действие на адаптационно-приспособительные реакции, бронхиальную реактивность, и способствует стабилизации хаотических отклонений у больных со стороны функциональных и биохимических показателей.
Персистирующее тяжелое течение БА. При переходе на 4-ю ступень вследствие ухудшения состояния пациента может повышаться доза ингаляционных кортикостероидов (см. табл. 23), однако если этого недостаточно, то для выведения пациента из тяжелого состояния глюкокортикоиды коротким курсом (2–3 дня) могут назначаться перорально — например, медрол в таблетках.
Приводим обобщенные данные лечения больных БА (табл. 23).












