Иммунологический гомеостаз и типы аллергических реакций
В настоящее время наблюдается не только увеличение частоты аллергических болезней (32,1 случая на 1000 человек), но и распространение более тяжелых аллергических реакций с вовлечением органов дыхания (астматический статус, аллергические альвеолиты), поражением кожных покровов (синдром Лайелла, токсидермия), слизистых оболочек (синдром Стивенса — Джонсона), внутренних органов, суставов, лимфатических узлов (сывороточноподобные реакции, аутоиммунные заболевания). Весьма опасный патологический процесс — анафилактический шок.
Исследование иммунологического гомеостаза у больных расширяет диагностические возможности врача и позволяет дифференцировать атопические, неатопические и аутоиммунные заболевания. Отдельные элементы иммунограммы дают возможность более предметно судить о складывающейся клинической ситуации. При атопических заболеваниях выявляется гиперпролиферативный синдром — повышение отдельных звеньев иммунограммы (IgE, В-лимфоцитов и др.). Избыточное реагирование иммунной системы у таких больных часто сочетается со снижением количества Т-супрессоров. При формировании повышенной чувствительности к неинфекционным аллергенам у больных с немедленным типом реакции Тх1 — лимфоциты переключаются на Тх2 с выделением интерлейкинов 4,5 (ИЛ-4, ИЛ-5), при формировании замедленного типа реакции активируются Тх1.
Расшифровка отдельных показателей иммунограммы осуществляется в сопоставлении с иммунограммой здоровых лиц.
Характеристика отдельных показателей гуморального звена иммунитета
Антитела представляют собой молекулы белка, присутствующие в сыворотке и в других субстратах (слюне, молоке, в тканях вокруг сосудов), они в большинстве своем высокоспецифичны по отношению к различным антигенам. Это иммуноглобулины G, А, М, D, Е, экспрессируемые плазматическими клетками — генерацией В-лимфоцитов. Период полужизни IgG — 23 дня, IgA — 6 дней, IgM—5 дней, IgE—2,5 дня.
Определение уровня иммуноглобулинов крайне важно в диагностике гуморальных иммунодефицитов, моноклональных гаммапатий, иммунных пролиферативных реакций, включая аллергические реакции реагинового типа, при оценке аутоиммунных заболеваний, других патологических состояний.
IgM (в норме 0,6–1,8 г/л) образуются на ранних этапах иммунного ответа, при первом контакте с антигеном. На смену их повышению нарастает содержание IgG более высокой авидности (специфичности) по отношению к антигену. При повторном контакте с антигеном IgG синтезируются быстрее и в большем количестве по сравнению с IgM. Однако при вирусных инфекциях (гепатите С), аутоиммунной патологии содержание IgM может оставаться повышенным в течение длительного периода.
IgG (в норме 7,2—16,3 г/л) проникают через плаценту и защищают ребенка от инфекции после рождения (количество их постепенно нарастает и достигает нормы к 7 годам жизни), активны по отношению к грамотрицательным бактериям, токсинам, вирусам. С помощью IgG-антител микробы и чужеродные клетки агглютинируются и лизируются. IgG состоят из четырех подклассов: IgG1, IgG2, IgG3, IgG4, из них наиболее значительна концентрация IgG1 и наименее — IgG4. IgG1 и IgG3 обладают способностью связывать и активировать комплемент, они взаимодействуют с Fc-рецептором моноцитов. IgG4 практически не связывают комплемент, уровень их существенно повышается в ходе проведения специфической иммунотерапии при реагиновом типе реакции, при этом они представляют собой блокирующий тип антител. Избирательная недостаточность субклассов IgG3 или IgG2, ассоциированный дефицит IgG2—IgG4 являются значимыми лабораторными признаками.
IgA (в норме 1,9–5,3 г/л) нейтрализует бактериальные токсины, вирусы, может активизировать систему комплемента. Секреторный IgA (slgA) обнаруживается в слюне, молозиве, грудном молоке, в содержимом трахеобронхиального дерева, пищеварительного, урогенитального тракта, желчевыделительной системы. slgA препятствует проникновению бактериальной флоры с поверхности слизистых оболочек. slgA резистентен к протеолизу, участвует в фагоцитозе микробов альвеолярными макрофагами. Содержание IgA может быть повышено на фоне увеличения количества IgE при атопии, персистирующем гепатите, хроническом гастрите, мезенхимальном гломерулонефрите. Снижение slgA в содержимом бронхиального секрета свидетельствует о транзиторном иммунодефиците, особенно у часто болеющих простудными заболеваниями, у страдающих хроническим бронхитом. Целесообразно определять соотношение между иммуноглобулинами М, G и А (в норме 1:10:2), которое позволяет при их отклонениях определить соответствующую направленность со стороны гуморального иммунитета.
IgE в сыворотке содержится в крайне малой концентрации по сравнению с другими иммуноглобулинами (0,002—0,004 г/л). В свободном состоянии находится около 51 % от общего количества, остальная часть IgE прочно связана с определенными рецепторами тучных клеток. Менее прочная связь IgE с рецепторами макрофагов, эозинофилов, тромбоцитов, лимфоцитов. Период полураспада IgE — 2,5 дня, в связи с чем при реагиновом типе реакции наблюдается постоянный активный синтез IgE соответствующими плазматическими клетками, наиболее активные регионы которого находятся в аденоидах, полипах носа, небных миндалинах, в подслизистом слое бронхиального дерева, возле желез дыхательных путей, в лимфатических структурах тонкого кишечника. IgE не обладают цитотоксическим действием, не связывают комплемент. Резко повышаются при гельминтозах, атопии, в ответ на сенсибилизацию к веществам белковой природы (полноценным аллергенам). При реагиновом типе реакции резко увеличивается уровень специфических IgE, тогда как содержание общих IgE может быть повышено незначительно.
Иммунные комплексы (в норме до 38 %) включают антитела типа IgM, IgG в сочетании с антигенами — видоизмененными локусами (под влиянием вирусов, бактерий, гаптенов) в составе циркулирующих белков крови. Повышение количества иммунных комплексов свидетельствует о наличии риска развития иммунокомплексного типа патологии, понижение при патологических состояниях с проявлением капилляротоксикоза — о накоплении их в сосудистых структурах тканей.
Характеристика отдельных показателей клеточного звена иммунитета
Изучение моноклональных антител (МАТ) к различным поверхностным антигенам лейкоцитов (с помощью проточного флюороцитометра) позволило более надежно определять различные иммунные клетки по кластеру дифференцировки (CD) с соответствующим номером (CD1, CD2, …, CD57). Т-лимфоциты гетерогенны по составу (в периферической крови 2000–3000 лимфоцитов в 1 мкл). Т-лимфоциты, идентифицируемые по CD2, CD3, CD7, составляют 70–80 % от общего числа, Т-хелперы (CD4) — 50–60 %, Т-супрессоры (CD8) — 20–30 %, NK-клетки (CD16) в норме до 15 %.
Т-хелперы (Тх) с наличием CD2, CD3, CD4 — важный клеточный элемент в запуске специфического иммунитета, с помощью выброса более 20 лимфокинов обеспечивает включение В-лимфоцитов, Т-киллеров, макрофагов и других клеток в ответ на появление антигенов. Тх1 играют важную роль в запуске реакций замедленного типа, Тх2 — немедленного, реагинового типа. Это явление многие исследователи (А. Д. Адо, И.С. Гущин и др.) объясняют снижением инфекционной заболеваемости в детском возрасте и переключением избирательной дифференциации противоинфекционного иммунитета с типа Тх1 на тип Тх2 — состояние, ведущее к гиперреактивности при воздействии аллергенов.
Abeshira et al. (1992), раскрывая механизм подобного переключения, считают, что ИЛ-4 в значительной мере обеспечивает повышение Тх2 из ТхО, тем более что ТхО способны выбрасывать ИЛ-4 и ИЛ-2. По мнению Н.Д. Беклемишева, на ранней стадии аллергической реакции из-за незначительного числа Тх2 такой механизм целесообразен, но при дальнейшем нарастании Тх2 и выброса ими ряда интерлейкинов, включая и ИЛ-4, должна включаться супрессия.
Иммунологический ответ в зависимости от целесообразности может осуществляться Тх1 при индукции бактериальных или протозойных антигенов или переключаться на Тх2 при наличии протозойных — неинфекционных аллергенов (Scott et al., 1991). Тем более, что, как указывают Н.Д. Беклемишев, И.Г. Цой (1992), «одна из общих закономерностей функционирования иммунной системы состоит в том, что различные механизмы иммунитета взаимно антагонистичны». Это прослеживается при рассмотрении антагонизма Тх1 и Тх2.
Тх1 экспрессируют ИЛ-2, у — интерферон, ИЛ-3, лейкотриены, фактор стимуляции колоний макрофагов и гранулоцитов (GMCSF), тогда как Тх2 — ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-10 и ИЛ-6.
Сейчас однозначно утверждается, что Тх1, выделяя ИЛ-2, стимулируют продукцию В-лимфоцитами IgA, IgM, IgG и, активируя Т-киллерный механизм иммунитета, выброс интерферона, обеспечивают противовирусную защиту. Что касается Тх2, то с помощью ИЛ-4 они обеспечивают активацию и дифференцировку В-лимфоцитов, экспрессию IgE плазмоцитами, посредством ИЛ-5 осуществляют (особенно на фоне лейкотриенов ЛТС4) пролиферацию, активацию, дегрануляцию эозинофилов, при участии ИЛ-10 тормозят активно сть Тх 1, т. е. запускают механизм атопической болезни.
Т-супрессоры (Тс) с наличием CD2, CD3, CD8 выполняют важную регуляторную функцию в иммунных реакциях, оказывая влияние на Т- и В-лимфоииты. Снижение их уровня при реагиновом типе сопровождается увеличением содержания IgE. Повышение количества Тс может сопутствовать формированию иммунодефицитного состояния.
Соотношение Тх: Тс = 2:1 у здоровых лиц при аутоиммунных заболеваниях изменяется в сторону увеличения Тх (> 2:1), при иммунодефицитах — в сторону снижения Тх (< 2:1).
TNK-клетки (естественные киллеры) обладают спонтанной цитотоксичностью к видоизмененным клеткам (опухолевидные клетки, клетки, инфицированные вирусами) и ведут к лизису их в естественных условиях. У оольных с системной красной волчанкой могут появляться антитела против TNK-клеток.
Наряду с естественными киллерами (Тцк) существуют цитотоксические Т-клетки — сенсибилизированные Т-лимфоциты, возникающие после предварительного контакта с антигеном, способные разрушать клетки, на которых присутствует антиген. Подобные Т-киллеры по кластерам дифференцировки похожи на Т-супрессоры — CD2, CD3, CD8 (В.Н. Федосеева с соавт., 1993).
В-лимфоциты — CDI9, CD20, CD22 — (10–20 %), являясь важным звеном иммунитета, обеспечивают продукцию иммуноглобулинов после дифференцировки их в плазмоциты. При их избыточной активности возникают иммунные гиперпролиферативные состояния, аутоиммунная патология, при снижении — развиваются иммунодефицитные заболевания. Вследствие инфицирования В-лимфоцитов вирусом Эпстайна — Барра формируется инфекционный мононуклеоз. При моноклональных гаммапатиях с гиперпродукцией IgM вследствие метаплазии и гиперплазии плазмоцитов, трансформирующихся из В-лимфоцитов, могут возникать болезни холодовых агглютининов (доброкачественный вариант) или множественная миелома (злокачественный вариант).
Цитокины
Взаимодействие между иммунокомпетентными клетками в «шоковом органе» осуществляется сложной системой иммунорегуляторных цитокинов: интерлейкинами (ИЛ), колониестимулирующими факторами (КСФ), трансформирующими факторами роста (ТФР), интерферонами (ИФН), туморнекротизирующими факторами (ТНФ), которые в клинической практике позволяют дифференцировать различные патологические состояния, включая аллергические, аутоиммунные, воспалительные реакции, и управлять ими.
Цитокины активно участвуют в регуляции миеломоноцитопоэза и лимфопоэза (ИЛ-3, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-9). Процесс воспаления контролируется провоспалительными (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ТНФ, ИФН) и противовоспалительными цитокинами (ИЛ-4, ИЛ-10, ТФР). В регуляции иммунного специфического ответа принимают участие ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-10, ИЛ-9, ИЛ-12, ИЛ-13, ИЛ-15, ИФН, т. е. каскад с разнонаправленным действием цитокинов (И.С. Фрейдлин, А.А. Тотолян, 1998).
Началом этой каскадности является активация макрофагов вследствие встречи с объектом фагоцитоза. При этом осуществляется индукция провоспалительных цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ТНФ, ИФН), обладающих местными (расширение сосудов, повышение проницаемости их, развитие отека, гиперемии и др.) и общими системными реакциями (ИЛ-1, ИЛ-8) с индукцией белков острой фазы, лейкоцитоза, активацией Т-лимфоцитов, экспрессией на эндотелиальных клетках адгезивных молекул. В связи с активацией Т-лимфоцитов продуцируются провоспалительные (ИФН) и противовоспалительные цитокины (И.С. Фрейдлин, А.А. Тотолян, 1998), на фоне которых формируется иммунный специфический ответ.
Не затрагивая дальнейшего каскада экспрессии цитокинов и активации клеточных элементов иммунной системы, приводим краткую характеристику отдельных цитокинов (табл. 1).


Характеристика типов аллергических реакций
Клинические особенности, дифференциальная диагностика и лечение аллергических болезней в значительной мере обусловлены механизмом их развития, характером и количеством аллергенного воздействия, типом специфического ответа.
По классификации Сооке (1930), аллергические реакции делятся на реакции немедленного и замедленного типа.
А.Д. Адо (1978), исходя из иммунологической патогенетической концепции аллергии, предложил реакции немедленного, антителозависимого, типа обозначать как В-зависимые — химергические, связанные с выбросом соответствующих биологически активных веществ, а реакции замедленного, антителонезависимого, типа как Т-зависимые (китергические — реакции клеточного типа). Каждая из этих групп в соответствии с иммунокомпетентным механизмом развития была подразделена на подгруппы.
1. В-зависимые аллергические реакции, обусловленные лимфоцитами типа В:
а) А-глобулиновые, вызываемые сскрсторным глобулином А (аллергический ринит, бронхит);
б) G-глобулиновые (феномен Артюса, сывороточная болезнь, анафилактический шок у кролика, цитотоксические реакции);
в) Е-глобулиновые (анафилаксия у человека, морской свинки, мышей, поллиноз);
г) М-глобулиновые.
2. Т-зависимые аллергические реакции:
а) туберкулинового типа;
б) типа контактного дерматита;
в) реакции отторжения трансплантата.
Данная классификация имеет клинико-экспериментальное прикладное значение и углубляет наши представления при сопоставлении с известной клинико-патогенетической классификацией Gell и Coombs (1968), в которой представлены четыре основных типа реакции:
1) реагиновый тип повреждения тканей (I);
2) цитотоксический тип повреждения тканей (II);
3) иммунокомплексный тип реакции (III);
4) клеточный, замедленный тип реакции (IV).
В зависимости от фазы развития А. Д. Адо (1978), В.И. Пыцкий с соавт. (1984) каждый из названных типов подразделяют на стадии: 1) иммунологическую; 2) патохимическую и 3) патофизиологическую, что позволяет наглядно продемонстрировать этапы формирования аллергических и аутоиммунных реакций при различных патологических состояниях (рис. 1).
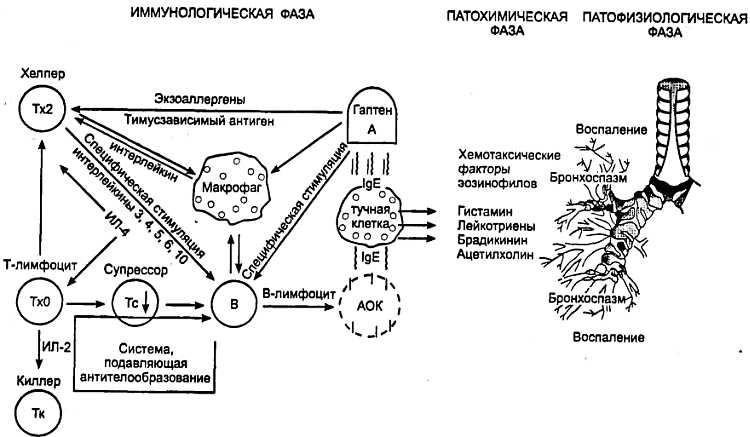
Рис. 1.
Реагиновый (IgE-зависимый, немедленный) тип повреждения тканей
Чаще развивается при сенсибилизации к неинфекционным аллергенам (пыльце растений, бытовым, эпидермальным, пищевым аллергенам, гаптенам).
Иммунологическая фаза реакции включает неспецифическую (взаимодействие аллергена с макрофагом) и специфическую (выработку антител к аллергену) форму реагирования через систему кооперации Тх2 и В-лимфоцитов. Последние трансформируются в плазмоциты и вырабатывают специфические антитела (реагины — IgE). Опосредованная связь между неспецифическим (макрофагом) и специфическим (Тх2) звеньями иммунитета осуществляется с помощью иммуноцитокинов (ИЛ-1). Индукция синтеза IgE В-лимфоцитами опосредована через лимфокины (ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10), секретируемые Тх2. В продукции IgE В-лимфоцитами важную роль играет также блокада их кластеров дифференцировки (CD40), которая реализуется с помощью лиганд CD40L — поступление второго сигнала со стороны Тх2. В запуске продукции IgE участвуют и другие иммуноцитокины, в частности ИЛ-13, который имеет некоторое сходство с ИЛ-4 (И.С. Гущин, 1998). Допускается, что активизированные тучные клетки, базофилы также могут выполнять функцию Тх2, поскольку они способны синтезировать ИЛ-4 или ИЛ-13 и могут экспрессировать CD40L. Однако наиболее вероятно, что эти клетки не участвуют в первичной индукции IgE, а лишь усиливают его выработку. Они, по-видимому, способны расширить сенсибилизирующий спектр аллергенов на фоне аллергии к одному аллергену, что часто наблюдается на практике. Следует заметить, что активизированные макрофаги, высвобождая ИЛ-12, способны тормозить синтез IgE за счет угнетения продукции ИЛ-4. Таким образом, зная систему управления синтезом IgE, можно оказывать иммунокорректирующий эффект, влиять на выброс реагинов.
Циркулируя в кровотоке, IgE оседают на тучных клетках, железистых образованиях, гладкомышечных элементах с помощью Fc-фрагмента, к которому в названных структурах имеются рецепторы. Степень сенсибилизации, уровень продукции IgE в значительной мере зависят от функции и количества Т-супрессоров — регуляторов темпа и выраженности аллергической реакции.
Патохимическая фаза реакции. Развитие аллергической реакции нельзя буквально понимать как переключение с иммунологической на патохимическую фазу, так как они тесно связаны друг с другом. В течении иммунологической фазы прослеживается участие различных каскадов иммуноцитокинов (биологически активных веществ) — выброс макрофагами ИЛ-1 и Тх2—ИЛ-4, ИЛ-5, ИЛ-6 (индукторов секреции IgE).
При развитии патохимической фазы реакции реагинового типа видное место принадлежит тучной клетке — тканевой форме базофила, которая содержит обширный набор медиаторов, сосредоточенных в гранулах. На одну клетку приходится 100–300 гранул. Тучные клетки сосредоточены в соединительной ткани вокруг сосудов, в ворсинках кишечника, в волосяных фолликулах. В активации-дегрануляции тучных клеток участвуют ионы Са, которые стимулируют эндомембранную проэстеразу, трансформируемую в эстеразу. Эстераза посредством фосфолипазы D способствует гидролизу мембранных фосфолипидов, обеспечивающих истончение и разрыхление мембраны, что облегчает экзоцитоз гранул. Данный процесс сопровождается увеличением содержания внутриклеточного Са2+ и повышением цГМФ.
Следует отметить, что подобный процесс дегрануляции тучных клеток может наблюдаться как при аллергических реакциях (индуктор аллерген +IgE), так и при холинергических, провоцируемых холодом/теплом, декстраном, рентгеноконтрастными веществами, химотрипсином, соматостатином, АТФ, т. е. ложноаллергическим механизмом (неспецифическим индуктором).
Среди биологически активных веществ, экспрессируемых из гранул тучных клеток, различают медиаторы первого порядка, которые опосредуют быстрые реакции (через 20–30 мин после воздействия аллергена), и медиаторы второго порядка, вызывающие позднюю фазу аллергической реакции (через 2–6 ч).
К медиаторам первого порядка относятся гистамин, гепарин, триптаза, ФХЭ (фактор хемотаксиса эозинофилов), ФХН (фактор хемотаксиса нейтрофилов), ФАТ (фактор активации тромбоцитов и высвобождения их медиаторов).
К медиаторам второго порядка — запуска производных арахидоновой кислоты относятся лейкотриены, тромбоксаны, простагпандины и др.
Патохимическая фаза, таким образом, ассоциируется как с иммунологической, так и с патофизиологической фазой.
Патофизиологическая фаза реакции (капилляропатия, отечный синдром, формирование клеточных инфильтратов в шоковом органе) может проявляться риноконъюнктивальным синдромом, ларинготрахеитом, атопическим дерматитом, бронхиальной астмой, анафилактическим шоком, пищевой аллергией, крапивницей, отеком Квинке.
Диагностика. См. Диагностические аллергены. В перспективе в диагностике реагинового типа реакции важное место может занять способ установления переключения дифференцировки Т-лимфоцитов при аллергическом ответе в сторону Тх2. Биологическим маркером такого переключения могло бы быть определение содержания Тх2, ИЛ-4, ИЛ-5, клетки CD30. Последняя экспрессируется на В-лимфоцитах (СО19+-клетках).
Таким образом, определение кластеров дифференцировки клеток (CD) позволяет не только точно установить природу клеток (исходя из номерного знака кластера), но и своевременно определить направленность иммунологического переключения в сторону аллергической гиперреактивности (И.С. Гущин, 1998).
Цитотоксический тип повреждения тканей
Этот тип реакции обусловлен появлением видоизмененных локусов, отдельных фрагментов клетки (ее оболочки или внутриклеточных органелл). Под влиянием чаще лекарственных веществ — гаптенов, возможно вирусов, бактерий, дисметаболических расстройств и других факторов подобные видоизмененные локусы клетки становятся чужеродными, приобретая свойства аутоантигенов.
Иммунологическая фаза. Макрофаги, соприкасаясь с аутоантигенами и выделяя интерлейкины, способствуют запуску механизмов специфического иммунитета. Т-лимфоциты через систему лимфокинов обеспечивают с помощью В-лимфоцитов, плазмоцитов выработку специфических иммуноглобулинов класса IgG (IgGl, IgG3) или IgM, которые посредством Fab-фрагмента соединяются с аутоантигеном, измененным локусом пострадавшей клетки. Иммуноцитотоксический эффект такого комплекса нарастает при присоединении через фрагмент Fc аутоантител (IgG, IgG 1, IgM) нейтрофилов, макрофагов, эозинофилов, К-клеток, имеющих Fc-рецептор.
Патохимическая фаза. Активным медиатором реакции является комплемент, представляющий собой неспецифическую, но биологически весьма значимую часть иммунитета.
Комплемент — система сывороточных факторов — белков, которые в виде каскадов обеспечивают быстрый, многократно усиливающийся ответ при развитии иммунной как специфической, так и неспецифической реакции. Активация комплемента способствует иммунному прилипанию, иммуноцитолизу, повышению проницаемости капилляров, накоплению лейкоцитов в тканях и их активации, фагоцитозу, связыванию анафилатоксинов, иммунных комплексов и др.
В сыворотке крови в наибольшей концентрации обнаруживается компонент G3. В синтезе компонентов комплемента участвуют макрофаги, лимфатические узлы, слизистая оболочка тонкого кишечника, купферовская система печени, клетки печени и др.
Активация комплемента может идти по классическому пути (специфическая), т. е. осуществляться в результате образования комплекса «антиген — антитело» (К.П. Кашкин, В.Г. Кубась, 1981), при этом часто гибнут чужеродные для организма клеточные структуры (иммуноцитолиз). Альтернативная (неиммунная) активация комплемента протекает при участии пропердина, бактериальных эндотоксинов, яда кобры и др. Известна неспецифичсская активация при воздействии на комплемент некоторых протеаз, рентгеноконтрастных веществ.
При патохимической фазе на этом фоне с участием супероксидного анион-радикала (О2), генерируемого нейтрофилами, моноцитами, эозинофилами, инициируется свободнорадикальное окисление липидов мембран, наблюдается обильное образование лизосомальных ферментов, что в конечном итоге ведет к гибели клеток с последующим удалением их дериватов с помощью фагоцитоза.
Патофизиологическая фаза. Ряд заболеваний, на фоне которых развивается данный тип реакции, протекает крайне остро и угрожает жизни (синдромы Лайелла, Стивенса — Джонсона, буллезные варианты дерматита). Заболевания с подострим, хроническим прогрессирующим течением — рецидивирующий дерматит, легочные обструктивные заболевания, подострый прогрессирующий гпомерулонефрит, дилатационный тип кардиомиопатий, хронический агрессивный гепатит, гемолитическая анемия, аутоиммунные тромбоцитопении, лейкопении.
Диагностика данного типа основывается на анамнезе, клиническом характере заболевания, наличии лекарственной аллергии и идентификации ее (см. Аллергия лекарственная), определении иммунологического гомеостаза, включая исследование компонентов комплемента.
Иммунокомплексный тип реакции
Одна из распространенных разновидностей аутоиммунной патологии. Различные экзогенные и эндогенные аллергены, в частности лекарственные препараты, пищевые вещества, сыворотки, бактериальные и вирусные антигены, продукты дисметаболизма, вызывают изменения в виде отдельных локусов (чужеродных субстанций) в системе циркулирующих или тканевых белков, по отношению к которым возникает иммунный ответ с образованием циркулирующих иммунных комплексов (ЦИК).
Иммунологическая фаза. Образование иммунных комплексов представляет собой естественный процесс инактивации различных антигенов. Подобные иммунные комплексы в конечном итоге подвергаются фагоцитозу и разрушаются.
Трудновыводимые иммунные комплексы откладываются в местах с повышенным гидростатическим давлением с помощью фильтрации, турбулентности (в лимфатических узлах, синовиальных оболочках, коже, почках).
Наряду с этим иммунные комплексы через Fc-рецептор активируют тромбоциты, тучные клетки, систему комплемента, и изосомальные ферменты лейкоцитов, приводят к высвобождению анафилотоксинов.
Под влиянием анафилотоксинов, медиаторов тучных клеток повышается сосудистая проницаемость, и иммунные комплексы, проникая в субэндотелиальное пространство, вызывают васкулит (реакцию Артюса). При поступлении антигенов аэрогенным путем на иммунокомплексной основе возникает альвеолит.
Патохимическая фаза. За счет активации С3-компонента комплемента усиливается прилипание иммунных комплексов к фагоцитам, эндотелиальным клеткам сосудов с повышением проницаемости их, макрофагам внутренних органов; за счет С3а освобождается гистамин из тучных клеток; за счет С5а нарастает экзоцитоз лизосомальных энзимов макро- и микрофагов; активизируется калликреин-кининовая система, те. нарастает повреждающее действие в местах накопления ЦИК, особенно на базальных мембранах наружной оболочки сосудов. При этом нарастает клеточная инфильтрация, накопление биологически активных веществ, что в конечном итоге ведет к изменению микроциркуляции вследствие повышения проницаемости и нарушения целости наиболее мелких сосудов.
Патофизиологическая фаза. Клинические проявления в виде капилляротоксикоза, капилляропатий в большей мере выражены в органах, богатых сосудистыми образованиями, — альвеолярно-капиллярных структурах, боуменовой капсуле, подсосочковом слое кожи и др.
Заболевания, на фоне которых наблюдается подобная разновидность аллергических и аутоиммунных реакций, весьма разнообразны. Это сывороточная болезнь и сывороточноподобные реакции, реакции на месте введения лекарственных веществ типа феномена Артюса, синдром Гудпасчера, капилляротоксикозы различной этиологии, атеросклероз, гломерулонефриты, некоторые хронические заболевания, на фоне которых развиваются нарушения микроциркуляции.
Диагностика реакций этого типа основана на наличии аллергологического анамнеза к лекарственным или пищевым аллергенам, клинических проявлений заболевания, исследовании иммунных комплексов, компонентов комплемента, иммунологического гомеостаза.
Клеточный, замедленный тип реакции
Описанные выше три типа аллергических реакций относятся к антителозависимым, тогда как четвертый — замедленный — тип развивается на основе гиперчувствительности сенсибилизированных лимфоцитов, которые выполняют роль «антител», способных реагировать с соответствующим антигеном. При данном типе воспаления отсутствует ранняя, связанная с выбросом гистамина и гистаминоподобных продуктов, и наблюдается поздняя (пролиферативная) фаза реакции, обусловленная лимфоцитами, макрофагами с формированием в ряде случаев гранулематозного процесса.
Иммунологическая фаза. Подобный иммунный ответ в значительной мере взаимосвязан с природой антигенной субстанции — сенсибилизацией к антигенам микробного происхождения, протеинам многих грибов, некоторых растений (пыльца плюща) и отдельным гаптенам.
Чужеродные антигены представляются Т-хелперам с помощью системы макрофагов, выбрасываемых ИЛ-1, и других факторов. Т-хелперы, выделяя ростковый фактор (ИЛ-2), активируют и поддерживают пролиферацию антигенстимулированных Т-клеток, способных реагировать с соответствующим антигеном. Число сенсибилизированных лимфоцитов в очаге воспаления невелико, их около 1–2 %, остальные, несенсибилизированные, клетки накапливаются при активном влиянии таких провоспалительных факторов, как лимфокины (В.И. Пыцкий, Н.В. Адрианова, А.В. Артомасова, 1999).
Патохимическая фаза. В значительной мере взаимосвязана с выбросом ряда лимфокинов, которые по своему характеру классифицируются в зависимости от точки приложения: 1) интерлейкины (ИЛ-1, ИЛ-2, ИЛ-3); 2) хемотаксические факторы, стимулирующие хемотаксис макрофагов, эозинофильных, базофильных, нейтрофильных гранулоцитов; 3) фактор, угнетающий миграцию макрофагов (МИФ), обеспечивающий накопление и активацию макрофагов в очаге аллергической альтерации; 4) лимфотоксины, обеспечивающие цитотоксическое действие Т-лимфоцитов путем повреждения мембран клеток-мишеней; 5) участие в процессе разрушения клеток других активированных, их собственных компонентов — лизосомальных ферментов, калликреин-кининовой системы и др.
Выделяемые при этом биологически активные вещества (типа лимфокинов) способствуют формированию местной сосудистой и тканевой реакции, которая в отличие от реакций реагинового типа возникает через 24–28 ч.
Патофизиологическая фаза реакции. Практически повреждающее действие при замедленном типе реакции развивается в результате: 1) прямого цитотоксического действия сенсибилизированных лимфоцитов на клетки-мишени; 2) неспецифического действия лимфотоксинов, обеспечивающих повреждение не только клеток-мишеней, но и интактных клеток; 3) повреждающего действия активированных лизосомальных ферментов, выбрасываемых в первую очередь макрофагами, накапливаемыми в очаге аллергического и неаллергического воспаления.
Данный тип воспаления, реакция замедленного типа, лежит в основе многих заболеваний — хронического инфекционного ринита, неатопической и атопической инфекционно-зависимой астмы, эозинофильных инфильтратов разной локализации, заболеваний инфекционно-аллергического, аутоиммунного генеза (ревматизм, миокардиты, демиелинизирующие заболевания нервной системы), отторжения трансплантата.
Диагностика базируется на аллергологическом анамнезе, клинических проявлениях заболевания, лабораторных данных аллергологического тестирования. При диагностике следует учитывать тот факт, что замедленный тип реакции может сочетаться с другими — реагиновым, цитотоксическим, иммунокомплексным.






