На новом этапе
Тотальные гастрэктомии в течение полувека казались логическим пределом того, что можно предпринимать по поводу обширных раков желудка или карцином кардиальной локализации. Однако технические возможности операции и прогноз в обеих группах показаний были совсем различны.
В самом деле, как бы обширен ни был скирр желудка или как бы высоко ни распространялась карцинома малой кривизны в сторону кардии, если подобные больные еще операбильны, т. е. у них нет явных метастазов в печень или слишком крупных пакетов регионарных узлов с прорастанием в совершенно здоровом участке; последующее соустье с кишкой будет накладываться с пищеводной стенкой далеко от границы раковой опухоли. В таких случаях можно обходиться и без сагиттальной диафрагмотомии, ибо абдоминальный отрезок пищевода не инфильтрирован. А если мы все-таки предпочитаем рассечь диафрагму, то не для того чтобы повыше перерезать пищевод, а чтобы поудобнее завести под него приводящее колено кишки для анастомоза.
Совсем другое дело при раке кардии. Тут опухоль не только циркулярно окружает весь вход в желудок и представляется плотной, ригидной розеткой большей или меньшей ширины, но самое главное то, что основание опухоли перешло на стенку пищевода и граница инфильтрации теряется где-то в толще мышечной и подслизистой оболочки. Границу опухоли на пищеводе можно прощупать, но определить с уверенностью, где кончается раковая зона, почти невозможно. Таким образом, всегда остается риск, что пересечение пищевода произойдет в подозрительной зоне и в краях стенки могут остаться раковые элементы, сводящие на нет всю трудную операцию.
Увы, это не только верно, но много раз приходилось убеждаться в этом воочию: пересекши пищевод и приступая к швам соустья, надо было дополнительно остригать ножницами край опухоли или явно подозрительную инфильтрацию, оставшиеся на пищеводной стенке. Отсекать пищевод еще выше внутри средостения представляется делом безусловно неосуществимым снизу, т. е. сквозь сделанную диафрагмотомию. Естественно, что каждый раз при этом возникала мысль о трансплевральной операции, когда пищевод можно было бы перерезать гораздо выше, ближе к дуге аорты, и там накладывать соустье с кишкой без всякого натяжения, гораздо легче и удобнее, а следовательно, и надежнее. Но от этого удерживало несколько соображений.
Во-первых, поддиафрагмальный путь через брюшную стенку являлся не только привычным и хорошо освоенным, но он обеспечивал наилучший осмотр печени, поджелудочной железы и лимфатических желез в районе вогнутой поверхности двенадцатиперстной кишки и ниже брыжейки поперечноободочной кишки; сделать такую ревизию сквозь диафрагму при трансторакальных операциях вряд ли можно с полной отчетливостью. Итак, вопрос об операбильности решается не только легче, но и вернее при лапаротомии.
Во-вторых, трансплевральный путь пугал из-за распространенности мнения об опасностях широкого пневмоторакса, плевропульмонального рефлекса и возможных смещений средостения с перегибом сосудов сердца. И если опыт двух мировых войн настоятельно подсказывал более либеральное отношение к этим вопросам, то систематические неудачи операций Терека не только отнимали надежду на успех операций рака среднего отдела пищевода, но неизбежно портили впечатление о трансторакальных операциях как таковых.
Наконец, в-третьих, еще больше пугала мысль о комбинированных вмешательствах, т. е. операциях, начатых через живот и заканчиваемых трансплеврально, будь то из особого межреберного разреза, или даже при комбинации обоих разрезов и полной поперечной диафрагмотомии. Величина разреза, обширность травмы и вскрытие сразу двух больших полостей — все вместе представлялось непереносимым.
Тем не менее пришлось прибегнуть именно к этому методу, потому что он действительно решает и техническую, и онкологическую часть проблемы, а высказанные опасения в значительной мере рассеялись благодаря ряду предосторожностей и мероприятий во время операции и после нее. С другой стороны, все возраставший опыт показал, что сам метод резекций кардии или тотальных гастрэктомий только снизу, т. е. делая анастомоз внутри средостения сквозь диафрагмотомию, является порочным для очень многих случаев. Именно несовершенство доступов снизу приводило к гибели больных либо от несостоятельности швов соустья, накладываемого в глубине средостения на девитализированный пищевод, либо от местных рецидивов в пищеводе, который поневоле отрезали не слишком высоко, т. е. в зоне раковой инфильтрации.
В тех стадиях болезни, в которых фактически производится операция, трудно бывает решить вопрос об исходном пункте злокачественной опухоли, т. е. о переходе опухоли кардии на нижний конец пищевода или наоборот. Даже гистологическое исследование препарата не всегда дает вполне уверенный ответ. Хотя чаще всего в этой зоне встречаются лишь два типа опухолей — веретенообразноклеточные и аденокарциномы, а последние теоретически могут иметь исходным пунктом только кардию, т. е. элементы слизистой желудочного строения, тем не менее и в нижнем конце пищевода изредка встречаются аденокарциномы. Суит (Sweet) и другие авторы полагают, что источником их являются заносные островки гетеротипной желудочной слизистой среди слизистой пищевода вблизи кардии.
Гистологическое различие обоих типов опухолей весьма важно в практическом отношении. В то время как кардиальные аденокарциномы довольно часто дают метастазы в печень и диссеминацию по брюшине, спиноцеллюлярные новообразования пищевода очень долго никуда не метастазируют, зато диффузно прорастают мышечную и подслизистую оболочку стенок пищевода по длине органа, порой на весьма значительном протяжении.
Вопрос этот кардинальной важности. Многочисленные гистологические исследования давно уже показали такую склонность опухолей пищевода распространяться внутристеночно, что происходит не столько рег continuitatem, сколько по интрамуральным лимфатическим сосудам. Весьма часто такое распространение можно увидеть на гистологических препаратах на расстоянии нескольких сантиметров от макроскопически определяемой границы новообразования. Свойство это характеризует опухоли не только нижнего, но и среднего отдела пищевода. И хотя опухоли среднего отдела пищевода при разборе кардиальных новообразований нас не интересуют, тем не менее следует сказать несколько слов об очень важной особенности их распространения по лимфатическим путям. Ныне можно считать твердо установленным, что, не давая долго метастазов в отдаленные органы, карциномы пищевода рано и очень часто поражают группы регионарных лимфатических узлов. Направление диссеминации тоже выявлено достаточно; оно нисходящее. Это значит, что при раке среднего отдела пищевода поражается не столько группа трахеобронхиальных желез, сколько нисходящие узлы — околопищеводные и две группы поддиафрагмальных, а именно кардиальные и пакет желез вдоль левой желудочной артерии.
Итак, по многим изложенным выше мотивам зону кардии и нижнего конца пищевода необходимо рассматривать как единое целое с обеих точек зрения, т. е. хирургической и онкологической. Пищевод надо пересекать повыше, чтобы отступить возможно дальше от опухоли с инфильтрирующим ростом вдоль стенки. Удалять надо не только всю нижнюю треть пищевода, но и по меньшей мере всю верхнюю половину желудка вместе с ее постоянными и почти всегда пораженными группами регионарных лимфатических узлов. Все это требует, во-первых, эксплораторной лапаротомии, а во-вторых, обязательной торакотомии для высокой резекции пищевода и трансторакального наложения анастомоза; как один нижний доступ безусловно недостаточен, так и чисто трансторакальный путь нам кажется менее совершенным, чем комбинированный. Последний создает такой замечательный простор для осмотра и производства всех необходимых манипуляций, что операция благодаря этому может быть закончена не только надежнее с онкологической точки зрения, но отчетливее, чище и быстрее, т. е. безопаснее. Наконец, комбинированная тораколапаротомия с полным пересечением диафрагмы позволяет иногда успешно и благополучно иссечь кардиальные опухоли, частично проросшие в одну из ножек диафрагмы или интимно спаявшиеся с левой долей печени или хвостом поджелудочной железы. Не всегда такие случаи являются безнадежными, но технически подобные операции могут представить непреодолимые трудности как при трансторакальном, так и при абдоминальном подходе. Только с помощью комбинированного метода можно решить такую задачу.
* * *
Новый этап в желудочной хирургии начался с 1945 г., когда в хирургическую практику широко вошло применение новых мощных антибиотиков, а вслед за тем и внутритрахеальные наркозы с помощью хороших, усовершенствованных аппаратов. То и другое коренным образом изменило ситуацию при трудных внутригрудных операциях. Разумеется, обильные переливания крови во время и после операции существенно улучшали исходы.
Каковы узловые вопросы хирургии рака желудка и кардии независимо от главнейшего из всех — ранней диагностики и своевременной операции? С последним пока делать нечего и приходится считаться с тем, что до сих пор, несмотря на все успехи диспансеризации и санпросветительной работы в нашей стране, к нам больные с опухолями желудка поступают в весьма запоздалые сроки.
По нашему мнению, имеется два наиболее существенных технических вопроса: выбор доступов к кардии и пищеводу и выбор обезболивания.
Мы уже указывали, что среди крупнейших хирургов нашей страны имеется весьма различное отношение и к тому, и к другому. Проф. А. Г. Савиных оперирует всех больных раком пищевода и кардии только под спинномозговой анестезией и неизменно снизу, чрезбрюшинно и чрездиафрагмально. Даже опухоли среднего отдела пищевода он удаляет путем сагиттальной диафрагмотомии, пользуясь специально им построенными длинными инструментами — зеркалами, подъемниками, пинцетами, ножницами и иглодержателями длиной до 40 см. Можно поистине поражаться мастерству и виртуозной технике Андрея Григорьевича и его школы, но вряд ли метод внеплевральных экстирпаций пищевода при раках срединного отдела и в районе бифуркации трахеи можно считать нормальным способом, доступным в любых больницах и клиниках. Мы еще вернемся к этому вопросу.
В противоположность исключительно лапаротомному доступу можно указать на цитированный материал проф. Б. В. Петровского, оперирующего чресплевральным методом не только опухоли грудного отдела пищевода, но и кардиальные. Что можно сказать по этому поводу? Если при внеплевральных медиастинотомиях по Савиных имеется две угрозы: трудности чрездиафрагмального пути при анастомозировании пищевода с кишкой на очень большой глубине и вынужденная близость пересечения пищевода от края опухоли, то оба эти упрека полностью отпадают при чресплевральных операциях.
Действительно, выделив пищевод на значительном протяжении, можно пересекать его на глаз, значительно отступя от края опухоли, и анастомоз накладывать совершенно уверенно, не будучи стесненным ни глубиной операционной раны, ни трудностью доступов. Таким образом, чресплевральный метод имеет, казалось, все преимущества перед внеплевральным как с онкологической, так и с хирургической точки зрения. Зато ему можно сделать весьма существенный упрек, так как при раках кардии никогда нет уверенности в операбильности случая, т. е. в отсутствии метастазов в печени и диссеминации по брюшине, то приходится идти на риск и делать не только торакотомию, но и широкую диафрагмотомию часто только в качестве обзорной операции.
Итоги нашей работы приводятся за время с 1947 по 1953 г. включительно (табл. 45).
Всего за этот период было госпитализировано 2400 больных, страдавших раком желудка, кардии, тела желудка и нижнего отдела пищевода. Но хотя почти все они довольно тщательно отбирались в поликлинике и приемном отделении до помещения в стационар, тем не менее при подробном исследовании и повторном просвечивании уже после поступления в клиники 602 человека были признаны иноперабильными, а на общее число 1798 оперированных только у 979 удалось более или менее радикально удалить раковую опухоль. По локализации эти раковые опухоли распределялись следующим образом: больных с раком кардии госпитализировано 795 человек, из них оперировано 557, причем 298 больным были сделаны лишь пробные или паллиативные операции и только 259 раз удалось произвести резекции, что составляет 32,6 %. Что касается исходов, то при общей смертности 24,7 % для всей группы смертность среди оперированных была 32,5 %, а подвергшиеся радикальным резекциям дали 47 % операционной смертности.
Таблица 45 Хирургическое лечение рака желудка за период 1947–1953 гг. (по данным Института имени Склифосовского)
| Рак тела желудка | Рак кардии и нижнего отдела пищевода | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| число больных | % к общему числу больных | из них умерло | % летальности | число больных | % к общему числу больных | из них умерло | % летальности | ||
| Всего больных | 1605 | 100 | 351 | 21,8 | Всего больных | 795 | 100 | 196 | 24,7 |
| Из них неоперированных | 364 | 22,7 | 74 | 20,4 | Из них неоперированных | 238 | 30 | 15 | 6,4 |
| оперированных: | 1241 | 77,3 | 277 | 22,4 | оперированных: | 557 | 70 | 181 | 32,5 |
| а) перенесших пробную и паллиативную операцию | 521 | 32,5 | 134 | 25,8 | а) перенесших пробную и паллиативную операцию | 298 | 37,4 | 59 | 19,8 |
| б) перенесших радикальную операцию | 720 | 44,8 | 143 | 19,8 | б) перенесших радикальную операцию | 259 | 32,6 | 122 | 47,0 |
| Из них перенесших резекцию: | Из них перенесших резекцию: | ||||||||
| частичную | 595 | 82,6 | 104 | 17,5 | абдоминальным путем | 29 | 11,2 | 9 | 31,0 |
| расширенную | 68 | 9,5 | 16 | 23,6 | чрездиафрагмальным путем | 97 | 37,4 | 42 | 43,3 |
| тотальную | 57 | 7,9 | 23 | 40,4 | комбинированных | 111 | 42,9 | 60 | 54,0 |
| чресплевральных | 22 | 8,5 | 11 | 50,0 | |||||
Для сравнения с этими грустными результатами приведем наши данные чревосечений по поводу раков тела желудка, включая сюда и раки кардии; операцию мы делали снизу, иногда с диафрагмотомией по Савиных, но без торакотомий. Таких больных за тот же период было госпитализировано 1605, из них умер 351 (21,8 %). Эксплораций и паллиативных операций было сделано 521 со смертностью 25,8 %, а на 720 резекций, в том числе тотальных, умерло 143 больных, т. е. 19,8 %.
Мы считаем наши исходы мало утешительными. Высокую смертность мы объясняем тем, что, надеясь на довольно сносные отдаленные результаты, мы нелегко отказываемся от попыток расширенных резекций в более запущенных случаях, что неизбежно сказывается на непосредственных исходах операций.
Обращаясь к сравнению нашего отчетного материала со сводками других хирургов, приходится признать, что они далеко уступают цифрам А. Г. Савиных и проф. А. А. Вишневского, по данным которого, смертность при раке кардии всего лишь 17 %. Из оперированных нами больных раком кардии только у половины опухоль оказывается доступной резекции (259 из числа 557); таким образом, в половине случаев вместо простой и щадящей лапаротомии больные подвергнуться гораздо более трудной и травматичной торакодиафрагмотомии с одной диагностической целью. В этом мы усматриваем главный недостаток чресплевральных доступов как метода выбора для всех случаев операций рака кардии.
Нетрудно понять, что сами мы занимаем среднюю позицию, а именно, охотно оперируя чресплеврально во всех случаях рака среднего отдела пищевода, мы принципиально начинаем все операции рака кардии с чревосечения, дабы установить операбильность, т. е. отсутствие метастазов и слишком обширных и глубоких прорастаний в соседние органы. При этом во всех более легких случаях, когда опухоль не распространилась вверх по пищеводу выше диафрагмы, мы заканчиваем операцию снизу резекцией кардии и проксимальной половины желудка или, чаще, тотальной гастрэктомией с эзофагоеюностомией. Эти операции мы делаем всегда под спинномозговой анестезией, но вводя больным заранее трахеальную канюлю на случай необходимости расширить операционный разрез на диафрагму и заканчивать резекцию комбинированным абдомино-торакальным путем.
На протяжении ряда лет эти сочетанные абдомино-торакальные операции нам представлялись наиболее совершенными со многих точек зрения. Во-первых, они позволяли под идеальной спинномозговой анестезией легко произвести пробное чревосечение, каковым все и заканчивалось почти в половине случаев рака кардии. Эти обзорные лапаротомии при полной релаксации брюшной стенки и абсолютной анестезии позволяют быстро и исчерпывающим образом осмотреть и ощупать все, что требуется для установления операбильности. Если имеются метастазы или опухоль неудалима вследствие глубоких прорастаний в окружающие органы, то мы сразу вливаем в живот 50 мл 2% раствора пентотала натрия или эвипана, и, пока зашивают брюшную стенку, больные засыпают, и наркоз длится еще 3–4 часа.
В операбильных случаях мы или стремимся все вмешательства закончить снизу путем тотальной гастрэктомии, будь то по Савиных, т. е. с рассечением диафрагмы сагиттально, или даже без такой мобилизации пищевода, что позволяет лучше обеспечить кровоснабжение пересекаемого пищевода. Заботы о сохранности кровоснабжения при отсечении пищевода от желудка одно время заставили нас все чаще воздерживаться от широкой мобилизации пищевода через сагиттальную диафрагмотомию. Высокая операционная смертность вследствие недостаточности внутримедиастинального анастомоза побуждала склониться к столь категоричным выводам, к которым пришли Лефевр из Бордо и особенно Ричард Суит из Бостона. Оба они решительно утверждали, что основная причина гибели больных кроется в недостаточности кровоснабжения отсеченного конца пищевода, обусловливающей расхождение швов и смертельный медиастинит и перитонит. Так как смертность была действительно высокой и чаще всего именно от недостаточности швов, эти утверждения казались правдоподобными. А раз так, то нельзя было не только высоко освобождать и тем девитализировать пищевод при доступах снизу по Савиных и тем самым нарушать основные требования онкологии, но даже, расширив операционное поле вверх путем торакодиафрагмотомии в плевральную полость следует по Суиту пересекать пищевод очень высоко, в пределах участка, обеспеченного кровоснабжением из a. thyroidei inferioris. Таковы были требования, продиктованные особенностями кровоснабжения пищевода после отсечения от него желудка.
Мы поручили произвести специальные исследования О. И. Виноградовой, которая выполнила на 100 трупах полную мобилизацию желудка в кардиальном отделе и выделение пищевода через сагиттальную диафрагмотомию по Савиных. После этого она производила наливку сосудов контрастной массой через аорту и, выделив весь препарат, делала рентгеновские снимки. Наполненные суриком сосуды великолепно воспроизводились на рентгеновских пленках, позволяя видеть наливку даже самых тончайших веточек. Эти работы О. И. Виноградовой полностью опровергли опасения и утверждения указанных выше зарубежных авторов и позволяют ныне утверждать, что даже после самой широкой мобилизации пищевода в средостении васкуляризация его из аортальных и интеркостальных веток всегда остается вполне достаточной.
Теперь мы уже более не боимся за судьбу анастомозов вследствие якобы недостаточного кровоснабжения. Напротив, мы теперь стремимся получше обеспечивать гемостаз из обрываемых при мобилизации пищевода многих аортальных веточек, ибо в них мы усматриваем источник неприятных, но почти неизбежных послеоперационных кровотечений, что доказывается тем, что по чресплевральному дренажу в первые сутки обычно выделяется от 350 до 500 мл сильно кровянистой жидкости, почти чистой крови. Столь значительная кровопотеря все же нежелательна, так же как и столь обильные скопления крови в плевре.
Возвращаясь к технике и оценке комбинированных абдомино-торакальных операций, скажем, что с точки зрения широты доступов эти вмешательства не имеют себе равных, а это наилучшим образом решает обе важнейшие задачи: онкологическую, т. е. широту удаления опухоли вместе с регионарными лимфатическими узлами и пересечением пищевода высоко, в пределах совершенно здорового участка, и хирургическую, т. е. быстроту и удобство операции, а следовательно, ее безопасность.
Так ли все это оказалось в действительности? Что касается онкологических соображений, то тут возражать нечего: ни один способ не дает такого простора действий, а следовательно, и наилучшей гарантии. Что же касается хирургической стороны, то она выявила два очень существенных возражения. Первое из них выплыло довольно неожиданно и заключается в следующем. После замечательно удобной мобилизации опухоли и гарантированной сохранности селезенки при трудных лигатурах vasorum gastrices breves в углу около левой ножки диафрагмы и особенно позади желудка, у самого хвоста поджелудочной железы, после идеального освобождения всего желудка и высокой мобилизации пищевода через широкое рассечение медиастинальной плевры слева, оставалось совсем легко и надежно выполнить анастомоз пищевода то ли с подведенной сюда тощей кишкой, то ли с желудочной культей после резекции проксимальной половины. И вот тут-то и возникает большое неудобство: больной лежит на спине и даже при сильном боковом наклоне операционного стола вправо пищевод остается в значительной мере прикрытым сердцем, которое закрывает собой доступы для выполнения соустья пищевода с желудком или кишкой. Оно все время нависает на зону анастомоза и так мешает работать, что момент этот оказывается труднейшим. При попытках отвести сердце рукой или экартером сразу падает кровяное давление и приходится немедленно возвращать сердце на свое место. А тогда опять нельзя работать.
Изложенные неудобства при оперировании больного, помещенного на спине, таковы, что они дискредитируют столь соблазнительный во всех остальных отношениях метод. Испытав его не один десяток раз и считая его наилучшим в отношении онкологическом, мы ныне должны открыто признать, что названный выше крупнейший недостаток, т. е. нависание сердца вследствие отсутствия полного бокового положения на правом боку, делает комбинированный абдомино-торакальный метод недостаточно совершенным. Или операцию удается закончить целиком снизу, т. е. без широкого рассечения диафрагмы и торакотомии, тогда положение на спине не мешает. Если же по ходу операции приходится проникать вверх, в плевральную полость, то, вопреки всем удобствам широкого доступа при мобилизации опухоли и желудка, будет очень трудно накладывать анастомоз под нависающим сердцем. Тут нужен полный поворот больного на бок, вследствие чего сердце само отклоняется на правую сторону и перестает мешать делать соустье.
Но, помимо описанной чисто технической трудности, наложения анастомоза под нависающим сердцем, широкие абдомино-торакальные операции выявили и другой важный недостаток — особую тяжесть для больных, выявляющуюся как во время операции, так и в послеоперационном периоде, Мы долгое время считали, что частое и значительное падение кровяного давления обусловливается применяемой нами спинномозговой анестезией. Это несомненно так, и в этом нет ничего неожиданного. Расчеты, однако, строились на том, что это закономерное падение кровяного давления, безусловно, будет ликвидировано в первые полчаса после начала операции, т. е. за время чревосечения и всех манипуляций по мобилизации желудка, рассечению связок и сальников и даже пересечению самого желудка и ушивания культи. А ко времени рассечения диафрагмы и открытия плевральной полости кровяное давление окажется полностью сбалансировано всеми принимавшимися мерами, особенно трансфузиями крови. Таким образом, расчет делался на то, что к моменту торакотомии при полностью законченной мобилизации желудка все последствия спинномозговой анестезии будут ликвидированы полностью.
Так оно и бывало в большинстве случаев. Тем не менее случалось не так редко, что вскоре после рассечения диафрагмы и вскрытия плевры кровяное давление снова падало довольно значительно, причем вторично восстановить систолическое давление оказывалось не так легко. Трудно сказать, что больше являлось виной — спинномозговая анестезия или неизбежное отодвигание сердца и частичное скручивание больших сосудов? Вероятно, то и другое вместе. Но нельзя отрицать и того, что даже после окончания операции и переноски в палату эти больные еще много часов оставались в довольно тяжелом состоянии.
Только более значительный опыт показал, что действительно эти комбинированные торако-абдоминальные операции как-то особенно тяжело переносятся больными. Мы пробовали отказаться от спинномозговой анестезии, чтобы избежать классического коллапса на 15—20-й минуте. Оперируя под общим внутритрахеальным эфирно-кислородным наркозом, мы поддерживали кровяное давление непрерывными вливаниями солевого раствора и крови. Однако кровяное давление резко падало не только в момент отведения сердца рукой или экартером. К сожалению, и в послеоперационном периоде общее состояние больных долго оставалось довольно тяжелым и наблюдались резкие колебания кровяного давления.
У нас все яснее складывалось впечатление, что эти комбинированные абдомино-торакальные операции, безусловно, тяжелее переносятся больными, чем оба других метода, т. е. брюшной с диафрагмотомией по Савиных, производимый под спинномозговой анестезией, или чисто торакальный, производимый под внутритрахеальным наркозом с добавлением местной анестезии средостения. Только более значительный опыт мог показать это на сравнительных сериях всех трех категорий. И на сегодняшний день эти впечатления у нас сложились довольно твердо. Надо всемерно стремиться уточнить вопрос об операбильности каждого отдельного больного, дабы твердо выбрать либо доступ снизу, для окончания всей операции типичной тотальной гастрэктомией по Савиных под спинномозговой анестезией, либо сразу чресплеврально под внутритрахеальным наркозом, в положении больного полностью на правом боку. Это позволит отлично накладывать соустье пищевода с кишкой или желудочной культей при сердце, совершенно отвалившемся вправо и нисколько не мешающем работать. Заметим, что опыт работы через широкую диафрагмотомию сверху приобретается довольно скоро, а простор бывает вполне достаточным для большинства случаев.
Все изложенное касается случаев рака кардии с переходом на абдоминальный конец пищевода.
Но, отмечая замечательные успехи операции Савиных — экстраплеврального доступа в заднее средостение, нельзя умолчать об одном обстоятельстве, а именно риске повреждения плевральных синусов и сопутствующих пневмотораксах. Мы долгие годы широко пользовались сагиттальной диафрагмотомией и в подавляющем большинстве случаев смогли избежать широкого повреждения плевральных синусов. Тем не менее довольно часто можно было наблюдать, как при отсутствии сколько-нибудь заметного надрыва плевральный листок в виде тончайшей перепонки, раскачиваясь в обе стороны при дыхательных экскурсиях, начинает постепенно пропускать воздух внутрь плевральной полости, очевидно, через точечные надрывы отслоенной плевры в местах оборванных капиллярных сосудов или соединительнотканных тяжей медиастинальной клетчатки.
Что это так, удалось показать ассистенту хирургических клиник Института имени Склифосовского В. С. Романенко. В своей диссертации он показал, что даже при всех предосторожностях, принимаемых для сохранения второй плевры при чресплевральных вмешательствах, это удается редко. Например, по данным Института имени Склифосовского, до 1951 г. (Хирургия, 1951, № 3) при чресплевральных операциях широкие разрывы плевры отмечены 29 раз, а точечные повреждения и скрытые проколы — 9 раз.
При задних трансмедиастинальных доступах, равно как при прохождении инструментом и расширителем через переднее средостение для устройства загрудинных искусственных пищеводов, двусторонние пневмотораксы через точечные повреждения оказались угрожающе частыми. Это было установлено с помощью специального двухампульного аппарата, изготовленного В. С. Романенко; аппарат этот позволяет уверенно диагностировать проникший воздух или скопившуюся кровь.
Каждый хирург, оперировавший чресплеврально и при этом более или менее широко обнажавший вторую плевру после вылущения пищевода из клетчатки средостения, знает, как легко наступает просачивание воздуха во вторую плевру. Это тем легче может случиться, если вылущивать пищевод на большую высоту тупым путем через сагиттальную диафрагмотомию. Мы не хотим сказать, что такое подсачивание воздуха является особо страшным осложнением. Страшным оно становится, если останется незамеченным, а скопление воздуха во второй плевре окажется значительным.
Мы потеряли одного больного при довольно досадных обстоятельствах. Я оперировал больного раком пищевода через левостороннюю торакотомию. Все шло хорошо, но к концу операции вдруг наступило катастрофическое падение сердечной деятельности и дыхания. Дыхание можно было поддерживать через трахеальную канюлю, а деятельность сердца не восстанавливалась. Через широко обнаженную сердечную сорочку нетрудно было впрыснуть два раза адреналин в сердце. Эти инъекции оказали чудодейственный эффект и при отличном пульсе и кровяном давлении операция была закончена. При зашивании легкое было раздуто полностью и больного перенесли в кровать совершенно розового. К сожалению, через несколько часов пульс и кровяное давление снова начали падать, и больной умер ночью, через 8 часов после окончания операции. На секции: обширный пневмоторакс на здоровой стороне. Там, где мы оперировали, т. е. с левой стороны, легкое было раздуто через внутритрахеальную канюлю, а на другой стороне, там, где пневмоторакс накопился через точечный прорыв плевры и был просмотрен во время и после операции, легкое не смогло расправиться. Нам кажется, что случай этот весьма поучителен.
Техники самой операции мы коснемся лишь в общих чертах. Если рак ограничивался зоной кардии и нижнего конца пищевода, то можно сохранить дистальную часть желудка и анастомозировать обрезанный пищевод с оставленной антральной культей. Так как эту желудочную культю не придется подтягивать слишком высоко, как то бывает при резекции среднего отдела пищевода, то можно не только не сохранить вилки gastricae sinistrae, но, наоборот, резецировать вместе с фундальным отделом и всю верхнюю половину малой кривизны, стараясь не оставлять постоянной группы лимфатических желез ни при культе центрального конца артерий на truncus coeliacus, ни на сохраняемой части желудка.
Если при локальном раке кардии и нижнего конца пищевода можно ограничиться все же экономной резекцией фундального отдела, то при более обширном раке или опухолях, захвативших немалую часть верхней трети малой кривизны, иногда возникает вопрос о целесообразности оставления антральной культи взамен тотальной гастрэктомии с трансторакальным соустьем пищевода и тощей кишки. Мотивы для этого могут быть двоякие. Первый и, конечно, главный — это радикальность самой резекции. Вопрос ставится так: да стоит ли сохранять антральный отдел желудка, рискуя, что в нем останутся пока еще невидимые раковые очаги; не вернее ли убрать весь желудок целиком и анастомозировать с тощей кишкой? Не создает ли тотальная гастрэктомия все же большую гарантию от рецидива?
Я несколько раз видел отчетливую диссеминацию раковых узелков по передней и задней стенке желудка в радиальных направлениях, исходящую от строго локальной карциномы кардии. Это понуждало резецировать желудок в дистальном направлении весьма широко, оставляя лишь совсем маленькую антральную культю, которую удавалось все же подвести вверх в средостение и там легко анастомозировать с пищеводом тотчас ниже дуги аорты. На прилагаемых рентгенограммах (рис. 95—102) можно видеть, что небольшая культя желудка хорошо подтягивается кверху и прекрасно располагается в заднем средостении на месте иссеченного пищевода. Но каждый раз остается и тревожная мысль, как бы не получилось рецидива именно в этой сохраненной части желудка, поскольку рак проявил склонность к узелковому распространению по самой желудочной стенке.
Второе соображение, которое выдвигает мысли о тотальной гастрэктомии, это опасение, что содержимое оставляемой дистальной половины желудка после пересечения обоих блуждающих нервов будет плохо эвакуироваться и тем доставит серьезные неприятности в ближайшем послеоперационном периоде. На моем личном опыте я пока еще не имел такого осложнения, но в нашей клинике однажды наблюдался больной, у которого эвакуация содержимого из оставленной антральной культи была чрезвычайно плохой в течение многих дней после операции. При этом создавалось впечатление, что полная атония оставленной части тела желудка сочетается с выраженным спазмом привратника, который не пропускал принятого бария в двенадцатиперстную кишку. Хотя, в конце концов, все наладилось и больной выписался в хорошем состоянии, однако тревог с ним было очень много.
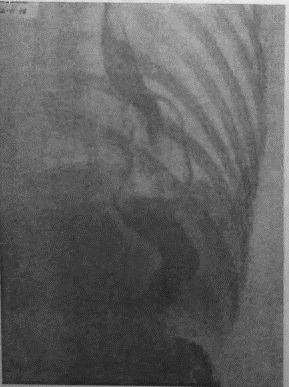
Рис. 95.
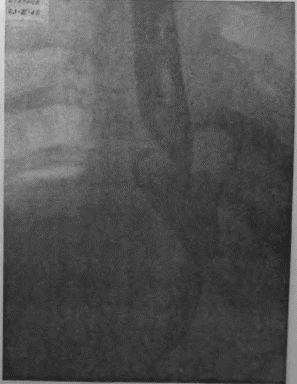
Рис. 96.
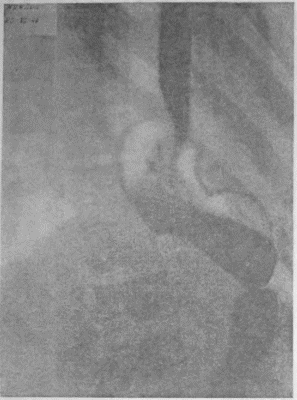
Рис. 97.
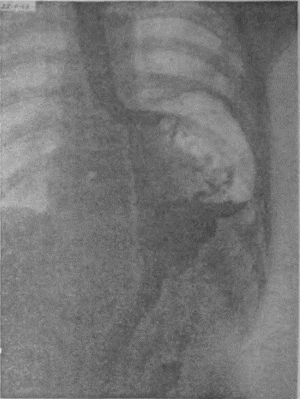
Рис. 98.
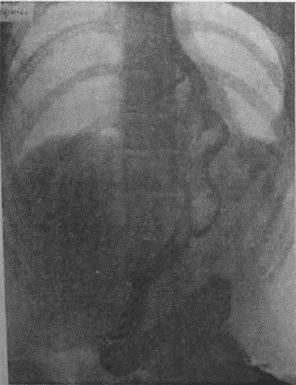
Рис. 99.
Рис. 100.
Рис. 101.
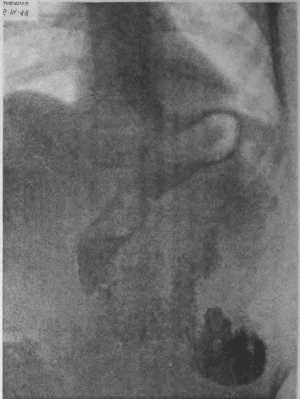
Рис. 102.
За сохранение антральной половины желудка и использование ее для прямого анастомоза с пищеводом говорит соблазнительно хорошая васкуляризация этой дистальной половины из сохраненных магистралей: аа. gastro-epiploica dextra et gastrica dextra. Насколько внимательно надо оценивать пригодность фундального отдела после лигирования обеих левых желудочных магистралей и всех vasa gastricae breves при самых высоких, надаортальных соустьях после экстирпаций среднего пищевода, настолько же после резекций проксимальной трети или половины желудка остающаяся дистальная часть превосходно васкуляризируется правыми артериальными магистралями. А это обстоятельство надежнее всего обеспечивает быстрое и прочное сращение по линии желудочно-пищеводного соустья, т. е. наиболее решающий этап всей операции.
Мне могут возразить, что, анастомозируя пищевод с тощей кишкой, мы пользуемся органом, не менее богатым по кровоснабжению. Это верно, но поперечник тощей кишки не дает столько простора и пластического материала, сколько его имеется даже на короткой, но широкой антральной культе. Благодаря ширине культи имеется возможность после окончания двухрядного поперечного соустья укрыть дополнительно всю переднюю полуокружность анастомоза, сдвигая и сшивая над ним складки большой и малой кривизны. Прием этот чрезвычайно повышает прочность и герметизм соустья. А риск недостаточности последнего является главной опасностью всех подобных операций. При анастомозах с дистальной половиной желудка мы до сих пор осложнений еще не имели; зато три раза на десяток высоких резекций пищевода и анастомозов с фундальным отделом мы столкнулись с частичной недостаточностью соустья. В двух из этих случаев дело закончилось благополучно, и после вскрытия и дренажа ограниченных эмпием и срочного наложения подвесных энтеростомий для кормления пищевые свищи закрылись самостоятельно и довольно быстро. Но третий больной, врач 52 лет, хорошо перенеся надаортальную резекцию пищевода, постепенно угас, истощаясь из-за чресплеврального свища, получившегося вследствие недостаточности пищеводно-желудочного соустья. Повторяю, не только васкуляризация, но и форма оставляемой желудочной культи предопределяют качество и надежность анастомоза. Поэтому и при наложении раздавливающих гразеровских зажимов на желудок мы стремимся получить не длинную, узкую культю, а широкую, хотя бы за счет ее укорочения. Поднять высоко в средостение короткую культю можно без натяжения; зато ширина ее позволит сделать двойную боковую запашку поверх передней части законченного соустья с пищеводом.
Чтобы еще уменьшить натяжение на линии анастомоза, после окончания последнего желудочную культю тщательно укладывают в заднее средостение и пришивают в нескольких местах к краям левой медиастинальной плевры. Наконец, совершенно обязательно пришить желудок к отверстию, оставляемому для него в ушиваемом разрезе диафрагмы. Напомню, что в самом начале операции, как только была вскрыта плевральная полость, n. phrenicus, всегда отчетливо видимый при переходе с перикарда на верхний купол диафрагмы, анестезируется инъекцией новокаина и раздавливается торзионным зажимом. Это создает неподвижность левой половины диафрагмы не только на время вмешательства, но и в течение нескольких месяцев после операции; таким образом, желудочная культя, вшитая в отверстие неподвижной диафрагмы, получает надежную опору и тем дополнительно исключается возможность натяжения в швах анастомоза.
В заключение несколько слов о закрытии плевральной полости. Я всегда предпочитаю сделать прокол десятого межреберного промежутка сзади, почти у самого конца XI ребра, и через него вывести длинный конец резинового дренажа. Внутренний конец этого дренажа со многими отверстиями ляжет вдоль всего заднего реберно-диафрагмального синуса, а концом своим подойдет к отверстию в заднем средостении и даже может войти в него. В момент заключительного раздувания легкого через интрахеальную канюлю, т. е. в момент завязывания последних швов на межреберных мышцах, через этот дренаж хорошо одновременно произвести отсасывание воздуха и остатков крови. После этого наружный конец резинового дренажа перегибают и герметически завязывают. Через этот дренаж мы производим дважды в сутки отсасывание кровянистого экссудата с помощью шприца Жане, а после этого вводим раствор пенициллина: по 100 000 единиц в первые двое суток и по 50 000 два последующих дня. Внутримышечно пенициллин вводят каждые 3 часа из расчета по 500 000 единиц первые два дня и по 250 000 единиц на третий и четвертый день.
К этому времени дренаж можно уже удалить за ненадобностью. Если же экссудация продолжается, то можно не только держать дренаж в плевре 7—10 дней, но установить постоянную аспирацию при помощи трех бутылей с разным уровнем жидкости.






