Коморбидность при ХОБЛ
Результаты скрининга 120 пациентов, обратившихся в поликлинику к терапевту, свидетельствуют, что у каждого пятого была ХОБЛ.
Данные амбулаторных карт этих пациентов говорят, что тяжесть течения определена только у 21 (77,8 %), информация о регулярной терапии представлена у 6 (22,2 %). При этом половина пациентов лечится эуфиллином, а не показанными ингаляционными глюкокортикостероидами и бета-агонистами. При этом указано, что частота обострений достигает 3–6 раз в год, пикфлуометрия не используется, небулайзер имеют 4 человека, курят – большая половина, немедикаментозные методы лечения никто не использует. Представленные факты выявляют определенные недостатки амбулаторного этапа в ведении пациентов с ХОБЛ.
Данные аутопсий 6425 пациентов, умерших в многопрофильном стационаре, свидетельствуют о распространенности ХОБЛ у 14 % пациентов. Помимо высокой распространенности ХОБЛ, нельзя забывать, что коморбидный фон этих пациентов отягощён ничуть не меньше соматического статуса сосудистых больных, при этом очевидно, что ХОБЛ по ряду клинических и лабораторных показателей усугубляет клиническое течение большинства известных сегодня заболеваний.
Результаты наших исследований, основанных на ретроспективном анализе патологоанатомических вскрытий больных ХОБЛ (n = 3239, средний возраст 72,2 ± 5,7 лет), демонстрируют данные, согласно которым у больных ХОБЛ:
• в 85 % имеет место АГ с поражением органов-мишеней;
• в 64 % выражен коронарный атеросклероз;
• в 19 % признаки перенесенного ишемического инсульта;
• в 21 % подтверждается диагноз ТЭЛА;
• в 39 % имеется ожирение;
• в 27 % диагностируются злокачественные новообразования разных локализаций;
• в 34 % присутствует ДГПЖ;
• в 67 % имеется снижение минеральной плотности костной ткани и т. д.
Часто основной причиной смерти у больных с документированной ХОБЛ являются не респираторные заболевания, а коморбидные состояния. В том числе кардиоваскулярные причины (25 %), опухоли различных локализаций, преимущественно рак легких (20–33 %) и только в 4-35 % от всех смертельных случаев отмечена легочная недостаточность на фоне обострения ХОБЛ. ССЗ, остеопороз и другие коморбидные состояния при ХОБЛ связаны с наличием хронического системного воспаления [38–40].
Хроническое системное воспаление – это типовой патологический процесс, развивающийся при системном повреждении и характеризующийся тотальной воспалительной реактивностью эндотелиоцитов, плазменных и клеточных факторов крови, соединительной ткани, а на заключительных этапах – и микроциркуляторными расстройствами в жизненно важных органах и тканях [41].
Реакция микрососудов носит тотальный характер и вмешивается в интересы абсолютно всех органов, в связи с чем можно заключить, что микроциркуляторные расстройства являются его ключевыми составляющими. Кроме того, ХСВ проявляется окислительным стрессом, повышением концентраций циркулирующих цитокинов и активацией клеток воспаления, синтезирующих собственные медиаторы [42]. Системная воспалительная реакция невозможна без вовлечения внутрисосудистых нейтрофилов, системы гемостаза и комплемента, а также стромальных клеток периваскулярной соединительной ткани, которые приводят к отсроченному разви тию во внутренних органах склеротических изменений, метаболических нарушений и снижению их функциональных резер вов, вплоть до появления полиорганной недостаточности. Таким образом, ХОБЛ является базовой моделью воспаления с развитием коморбидной патологии (рис. 26).
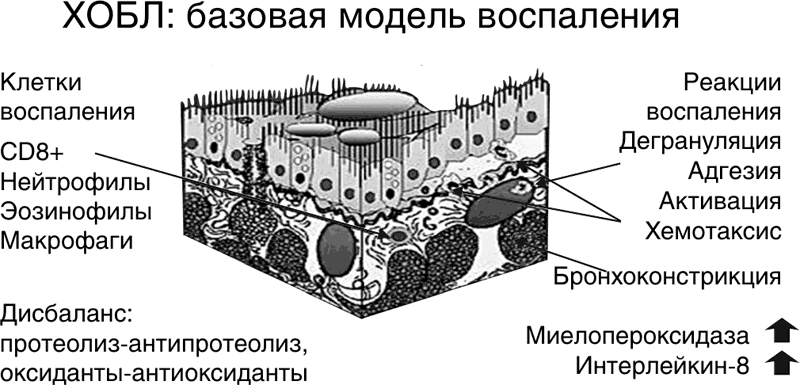
Рисунок 26.
Самым частым фоном у больных ХОБЛ является АГ, что доказывает общность патогенеза развития сосудистой коморбидности и коморбидности при ХОБЛ. Аргументами в пользу этого являются следующие факты: повышение АД возникает через 4–7 лет после манифестации ХОБЛ; повышение АД сопровождает обострение ХОБЛ; АД снижается по мере регресса симптомов обострения ХОБЛ; разрешения бронхообструкции и пр. [43].
Среди патогенетических механизмов АГ у больных ХОБЛ ведущая роль принадлежит первичной активизации симпато-адреналовой системы. Основным механизмом системной и лёгочной АГ на фоне ХОБЛ является хроническая артериальная гипоксемия и гиперкапния [44]. Снижение напряжения кислорода в крови и тканях стимулирует хеморецепторы артериальных и венозных сосудов, вызывая усиление афферентных возбуждающих влияний на центральные вегетативные нейроны, и далее усиливает эфферентную симпатическую вазоконстрикторную активность на периферии. По мере усугубления бронхиальной обструкции и прогрессирования АГ повышается центральная ?-адренергическая и дофаминергическая активность, которую повышают даже относительно короткие периоды гипоксии [45].
Повышение активности симпато-адреналовой системы посредством увеличения выработки катехоламинов способствует нарушению функционального состояния центрального адренергического аппарата гипоталамо-гипофизарной системы и усилению модулирующего влияния адренокортикотропного гормона на минералокортикоидную функцию надпочечников, что приводит к увеличению секреции альдостерона.
Таким образом, к патогенезу АГ при ХОБЛ подключается почечное звено, заключающееся в гиперреактивности ренин-ангиотензин-альдостероновой системы, повышении активности юкстагломерулярного аппарата, гиперпродукции ренина и ангиотензина II, при этом почечный механизм формирования АГ при ХОБЛ быстро становится доминирующим. При бронхиальной обструкции в сочетании с АГ наблюдается высокая активность ренин-ангиотензин-альдостероновой системы уже в начальной стадии ХОБЛ.
Помимо гипоксии, причиной повышения АД у больных ХОБЛ могут служить резкие колебания интраторакального давления, возникающие во время эпизодов удушья, которые также приводят к значительной активации симпато-адреналовой системы и развитию системной вазоконстрикции. Колебания интраторакального давления влияют не только на симпатическую нервную систему, но и на синтез гормонов, ответственных за регуляцию объёма циркулирующей крови (простагландины, предсердный натрий-уретический пептид) [46].
Как упоминалось ранее, гипоксия, развивающаяся при хронической бронхообструкции в условиях недостаточной оксигенации, способствует ещё большему повышению потребности миокарда в кислороде и дальнейшему ухудшению микроциркуляции. Кроме того, прогрессирование гипоксии способствует повышению порога болевой чувствительности и формированию безболевой ишемии миокарда, аналогичной таковой у пациентов, страдающих СД.
Однако в поиске общих механизмов патогенеза ХОБЛ и ИБС не следует забывать о системном воспалении. Как известно, высокая концентрация различных системных маркеров воспаления, среди которых С-РБ, ИЛ?6, ИЛ?18 и ФНО-? ассоциирована с усугублением атеросклероза и развитием его осложнений [47].
Наиболее изученным фактором риска является С-РБ, который, будучи центральным белком острой фазы воспаления, может увеличивать воспалительный каскад, усиливая продукцию провоспалительных цитокинов ИЛ?1?, ИЛ?1?, ИЛ?6 и ФНО-?, стимулируя захват липопротеидов низкой плотности макрофагами, а также усиливая адгезию лейкоцитов сосудистым эндотелием [48].
Взаимодействуя с другими провоспалительными медиаторами, С-РБ участвует в привлечении моноцитов в зону атеросклеротической бляшки и образовании «пенистых» клеток [49]. Вместе эти изменения ведут к развитию острого воспаления, протекающему в основании атеромы, её дестабилизации, вазоконстрикции, тромбообразованию и окклюзии ветвей коронарных артерий, лежащих в основе ОКС.
С другой стороны, известно, что при стабильном течении ХОБЛ уровни данных маркеров воспаления также повышены, что отражается в наличии прямой корреляции между тяжестью ХОБЛ и концентрациями С-РБ, ФНО-?, ИЛ?6 и ряда других провоспалительных цитокинов [50–52]. При обострении ХОБЛ их уровни увеличиваются в 2,5–3 раза [53], а, следовательно, каждое обострение ассоциировано с повышенным риском развития новых кардиоваскулярных событий. Поскольку обострение ХОБЛ заведомо сопровождается нарастанием системно-воспалительных сдвигов, то можно предположить более выраженную структурно-геометрическую перестройку сердца в случае развития инфаркта миокарда в фазу обострения бронхолёгочной патологии. Так, у больных ХОБЛ, имеющих 5 и более обострений в течение года риск ОИМ увеличивается примерно в 5 раз [54].
Таким образом, фаза обострения ХОБЛ является фактором, провоцирующим развитие ОИМ и триггером ОКС у пациентов с хронической бронхообструкцией.
Кроме того, сегодня известно о влиянии обострения ХОБЛ на последующие процессы постинфарктного ремоделирования миокарда за счет усугубления систолической дисфункции ЛЖ, которая развивается в результате значительного увеличения концентрации С-РБ, ФНО-? и гаптоглобина, последующему избыточному синтезу коллагена, нарастанию размеров полостей сердца, утолщению его стенок и усугублению ишемии миокарда с развитием очагов некроза и повторного воспаления в сердечной мышце [55].
Таким образом, ХОБЛ – это базисная модель коморбидной патологии, в основе которой лежит системное воспаление, обусловливающее развитие полиорганных внелегочных изменений.