ОСАДА ТКАНЕВОГО БАРЬЕРА
В начале своего развития восстановительная хирургия шла по пути использования собственных тканей организма (аутотрансплантация), так как было замечено, что пересадка тканей от одного организма другому (гомотрансплантация) не дает успеха. Но все же попытки пересадить ткань или орган от одного человека другому или от животного — человеку (гетеротрансплантация), возможно, предпринимались еще в глубокой древности, и об этом мы узнаем в отраженном виде — из дошедших до нас сказаний и легенд.
Вспомните, какие причудливые образы содержат древние мифы о химерах, кентаврах, русалках, тела которых будто бы состояли из разных частей животных и человека. Известно и сказание о Дедале. Он прикрепил себе крылья, улетел с отдаленного острова и благополучно достиг родной земли.
В Индии пересаживать кожу пытались еще несколько тысячелетий назад. Индийские врачи уже тогда знали, что собственная (ауто) кожа человека приживляется хорошо. Сохранившиеся источники свидетельствуют, что делались и довольно трудные операции. Прежде чем произвести пересадку, кожный лоскут донора «отбивали» до тех пор, пока он равномерно вздувался. Затем для лучшего «прилипания» использовали особый состав, рецепт которого держался в строгом секрете и, к сожалению, до нас не дошел.
Способность приживления собственной кожи охотно использовали для рекламы знахари. По сообщению итальянского физиолога Г. Баранио, в 1804 году некая дама, расхваливая свои мази, отрезала на глазах у изумленных людей лоскут своей кожи и тут же прикрепляла его с помощью снадобий на прежнее место. На следующий день она демонстрировала публике, как хорошо прижился вчерашний лоскут.
Однако еще в древности люди столкнулись с конфликтом между реципиентом — организмом нового хозяина и трансплантатом, то есть пересаженной ему тканью или органом. Причем конфликт этот почти всегда заканчивается гибелью трансплантата.
Известный итальянский хирург и анатом XVI века Г. Таглиакоцци писал: «Характер индивидуума полностью разубеждает нас в том, что возможно проведение пересадок между людьми, потому что власть и сила индивидуальности безграничны. Если кто–то полагает, что он способен увеличить красоту свою за счет другого и, более того, способен успешно пользоваться пересаженным органом, то нужно считать такого человека плохо разбирающимся в естествознании». Видимо, сам Таглиакоцци предпринимал попытки осуществлять пересадку, но безуспешно.
В начале нашего века были сделаны первые шаги и в области еще одного вида пересадок — переливания крови. При этом было выявлено содержание в эритроцитах крови антигенов, а в сыворотке крови — противоэритроцитарных антител. Чтобы успешно переливать кровь, необходимо подобрать подходящую группу крови для совместимости и совпадения антигенов донора и реципиента.
Конфликт, разыгрывающийся при гомотрансплантации других тканей, так же, как и при переливании крови, обусловлен различием их антигенного строения.
В настоящее время известно более семидесяти антигенов эритроцитов человека, которые составляют четыр–наддать систем изоантигенов. Причем комбинации этих антигенов у разных людей совершенно не одинаковы. Почему? Генетика установила, что антигены эритроцитов человека формируются еще в эмбриональный период развития и не меняются на протяжении всей жизни. Структура же их наследуется от родителей. Однако комбинация антигенов у каждого организма своя, специфическая. Если у родителей имеется антиген А и антиген В, то у детей этих родителей будет различная комбинация антигенов. Так, один ребенок может унаследовать только А, другой — только В, а третий — А и В антигены. Мы упомянули только эритроцитарные антигены, а их общее число в каждом организме очень велико. Поэтому нетрудно себе представить, какое количество комбинаций может быть в различных антигенных группах у различных людей.
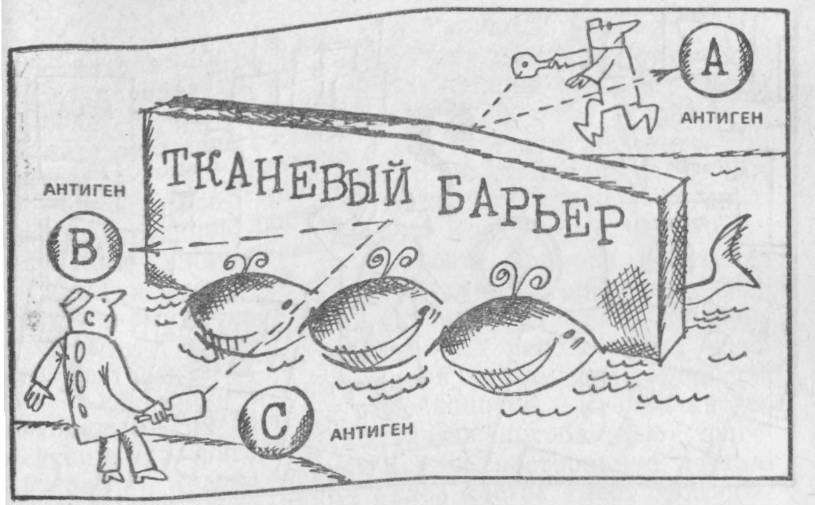
В чем суть такой вариабильности комбинаций антигенов? Оказывается, благодаря этому возникает сугубо индивидуальный набор антигенов, с которыми «мирятся» оборонительные, защитные силы каждого индивидуума. Это представляет одну из форм проявления так называемого тканевого барьера.
Возникает вопрос: возможно ли обойти его и заставить организм принять чужеродный орган или ткань? Ответить на него можно только после досконального исследования трех важных проблем: химической структуры трансплантационных антигенов и их локализации в клетке, изменения этих антигенов и подбора совместимых по известным изоантигенам донора и реципиента; усиления защитной реакции организма против трансплантационных антигенов, введенных с пересаженным органом.
Вот три «кита», обеспечивающие непробиваемость тканевого барьера, который, по остроумному выражению видного французского иммуногематолога Ж. Доссэ, «создан для того, чтобы противостоять мирному союзу предприимчивых хирургов, задавшихся целью изменить организм хозяина».
Что же известно в настоящее время об этих трех «китах»?
Установлено, что кроме эритроцитарных антигенов есть и специфические антигены лейкоцитов, при совместимости которых трансплантат живет гораздо дольше. Можно предположить, что эти антигены играют большую роль в формировании иммунологического ответа реципиента.
Ученым предстоит выявить остальные группы антигенов совместимость по которым будет способствовать успеху пересадки тканей и органов. Пока мы еще не знаем химической структуры трансплантационных антигенов, не можем четко сказать, с какой частью клетки они связаны, где находятся в наибольшем количестве. Существующие ныне способы разделения клеточных структур несовершенны и не дают возможности получить их в чистом виде. Однако экспериментальные данные подтверждают, что большинство антигенных структур сосредоточено на клеточной оболочке.
Во многих странах, в том числе и Советском Союзе, установлено, что до семидесяти процентов антигенов тканевой совместимости (так называют трансплантационные антигены) локализованы на поверхностной плазматической мембране форменных элементов крови— лимфоцитов, лейкоцитов и тромбоцитов, что эти белковые растворимые препараты обладают активностью более слабой, чем антигены, находящиеся на неповрежденной живой клетке. Пока еще трудно решить вопрос о чистоте выделенных антигенов тканевой совместимости у человека и их свойствах, хотя за последние пять–семь лет произошел большой качественный скачок в этих исследованиях. Описана целая система лейкоцитарных антигенов человека, состоящая из нескольких групп, объединяющих свыше тридцати антигенов.
Осада тканевого барьера.
Бесконечное множество комбинаций антигенов.
В настоящее время во всех крупных клинических центрах трансплантации проводится обязательный подбор совместимых пар доноров и реципиентов по известным антигенам тканевой совместимости.
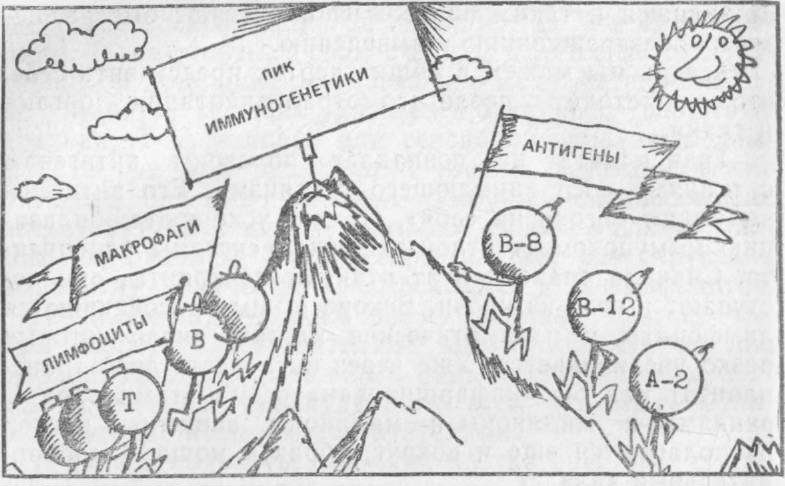
Решение вопроса о лейкоцитарных антигенах, в частности, исследования в одной узкой области иммунобиологии— трансплантационном иммунитете, посвященные выявлению и типированию антигенов, привели к формированию самостоятельного направления в иммунологии и генетике, касающегося изучения механизмов наследования антигенов и связи их с предрасположенностью к ряду заболеваний. Так возникла иммуногенетика. Исследования в этой области показали, что носители антигенов, обозначаемых B8 и В15, часто предрасположены к заболеванию системной красной волчанкой. Люди, имеющие антигены А2 и В12, подвержены заболеванию лейкемией, при наличии антигена B12 часто развиваются некоторые кожные болезни и т. д. «Наступление» на всех «фронтах» иммуногенетики продолжается, и, вероятно, в ближайшие годы мы будем свидетелями новых важных открытий.
Все, что зашифровано в генетическом аппарате, при повреждении способно быстро восстанавливаться. Вот почему изменить любой врожденный признак организма практически невозможно. Кроме того, на защиту и поддержание этой устойчивости природа поставила целую «армию» — лимфоидную систему организма. Она, так сказать, «заведует» защитными реакциями организма. Состоит «войско» обороны из неподвижных «дзотов» — селезенки и лимфоидной системы: лимфоцитов, плазматических клеток, лейкоцитов. Разновидность лейкоцитов — фагоциты обладают способностью фагоцитировать (заглатывать) всякие посторонние частички. Каждый из указанных видов клеток имеет свои обязанности.
В последние годы довольно четко показаны обязанности различных лимфоцитов. Во–первых, установлено, что в любой стадии защитных реакций организма происходит взаимодействие, или кооперация, клеток — макрофага (фагоцита) с лимфоцитами. Малые лимфоциты по своей функции различаются на Т и В лимфоциты. Т-лимфоциты, в свою очередь, делятся на три подгруппы: Т-помощники, помогающие макрофагу и В-клетке узнавать «чужой» антиген и запускать защитные реакции; Т-эффекторы, или сенсибилизированные лимфоциты, их еще называют Т-убийцы («узнав» чужие антигены, они несут на своих мембранах специфические антиструктуры к ним и вызывают гибель «чужих» клеток), и, наконец, Т-супрессоры клетки, регулирующие выработку количества Т-эффекторов и В-лимфоцитов.
Посторонним антигенам вход воспрещен.
В-лимфоциты — также очень важные клетки, так как являются прародителями плазматических клеток, вырабатывающих различные виды специфических белков различного молекулярного веса — гамма–глобулинов, которые называются антителами.
Удалось выяснить, как одна клетка общается с другой и принимает от нее информацию. Оказывается, лимфоидные клетки так же, как и клетки нервной системы, выделяют особые растворимые вещества, специфичные для каждой реакции организма: усиления продукции В-клеток или Т-эффекторов или, наоборот, увеличения числа Т-супрессоров. Эти вещества называются лимфокинами, или медиаторами иммунного ответа.
Таким образом, мы сейчас располагаем новым представлением о взаимодействии различных клеток при защитных реакциях организма, и все же до сих пор остается ряд «белых пятен» в учении об иммуногенезе.
Одна из загадок: как лимфоидные образования распознают чужеродные вещества? Предполагается, что в этом значительную роль играют фагоциты — они первыми вступают в контакт с чужеродным антигеном, захватывают и «переваривают» его. Затем, как утверждают некоторые исследователи, происходит контакт фагоцитов с лимфоцитами, количество которых начинает значительно увеличиваться. Они также устремляются к месту, где «окопался» чужой антиген. На помощь приведенному в действие защитному «гарнизону» организма приходят плазматические клетки. Они поставляют «боеприпасы» — специфические, пристрастные к чуждому антигену белки — антитела. Кроме того, некоторые другие системы организма вырабатывают особые вещества, которые благоприятствуют лучшему взаимодействию собственных лимфоцитов и антител с чуждыми антигенами и таким образом способствуют быстрейшему их обезвреживанию и выведению.
Теперь мы можем в общих чертах представить себе, что происходит после гомотрансплантации органа и ткани.
Трансплантат не совпадает по своим антигенам с тканями воспринимающего организма. Его антигены вызывают «огонь на себя», то есть ускоряют мобилизацию иммунокомпетентной защитной системы реципиента. Сначала трансплантат атакуют лейкоциты, они поступают в него из крови. Вскоре к ним присоединяются лимфоциты и плазматические клетки, число которых резко увеличивается. Уже через пять–шесть дней трансплантат как бы «нафарширован» всеми этими образованиями, а миллионы и миллионы защитных клеток располагаются еще и вокруг, образуя мощный «оборонительный вал».
Некоторые исследователи утверждают, что во взаимодействии лимфоцитов с чужеродными клетками участвуют и антитела, вырабатываемые плазматическими клетками. Но участие антител еще недостаточно изучено. Ведь иногда они, к нашему удивлению, оказывают противоположное действие, усиливая рост и жизнедеятельность пересаженного трансплантата.
Итак, «нафаршированный» защитными клетками трансплантат гибнет. Но куда же девается его масса? Ее убирают «мусорщики» — фагоциты. Мы видим сложную и слаженную систему взаимодействия разных сил: одни вызывают гибель трансплантата, другие убирают его погибшие части, третьи участвуют в замещении возникшего дефекта соединительной тканью.
Эта ответная иммунологическая реакция сама по себе очень ценна, так как защищает организм от проникновения извне любых чуждых для него инородных тел белкового происхождения, в том числе болезнетворных микроорганизмов, возбудителей всякого рода инфекций. Но, к сожалению, организм в одинаковой мере мобилизует свои силы как против микробов, вызывающих болезнь, так и против пересаженных тканей или органов.
Однако из этого общего правила бывают исключения. Встречаются люди, антигенное (белковое) строение и состав тканей которых совершенно одинаковы. Это близнецы, развившиеся из однояйцевой клетки.
Штурм «Пика иммуногенетики».
Между их тканями нет антагонизма, и поэтому близнецы— идеальный объект для пересадок. В разных странах произведено свыше четырехсот пересадок почек между однояйцевыми близнецами. Некоторые из них живут с единственной новой почкой уже более десяти лет. Конечно, нуждаются в пересадке органов и тканей, увы, не одни только однояйцевые близнецы. Но эти операции помогают ученым прокладывать трудные пути для преодоления несовместимости тканей.
Каковы же пути и тропинки, которые ученые прокладывают в обход тканевого барьера?
Первыми хитроумно «обманули» иммунокомпетентную систему организма чехословацкий ученый М. Гашек и английский иммунолог П. Медавар. Они вводили эмбриону животного клетки костного мозга, селезенки и форменных элементов крови, взятых от другого животного— донора, а затем пересаживали от него же выросшему животному участок кожи. Оказалось, что способность организма реагировать на чужие антигены формируется, главным образом, к концу эмбрионального периода развития. В это время и в первые дни после рождения (постэмбриональный период) организм еще способен воспринять чужеродный белок тканей и закрепить его в своей «памяти». В последующем, во «взрослом» состоянии, такой организм уже без конфликта воспримет ткани донора, от которого ему были ранее введены антигены. Подобное состояние «терпимости» к чужому белку получило название толерантности. Оно было открыто М. Гашеком и П. Медаваром.
Ученик М. Гашека — С. Пуза, сотрудничавший с нашей лабораторией, предложил создать такую же «терпимость» к донорским клеткам путем полной замены крови у новорожденного щенка.
На разработку этого метода его натолкнули исследования советских ученых. Еще 30?е годы два врача, работавшие в Средней Азии, — О. С. Глозман и А. П. Касаткина задумались над тем, как спасти людей, получивших большие дозы ядовитых веществ, например, при укусе змеи. Различные виды медикаментозного лечения помогали мало, так как отравляющие вещества, находясь в крови, вместе с ней разносятся по всему организму. Следовательно, удалить их можно только с кровью. В связи с этим «был предложен метод тотального (полного) замещения крови, который заключался в том, что кровь больного медленно выпускали через артерию и одновременно в вену нагнеталась в том же количестве кровь донора.
В результате замещения крови собственная кровь больного полностью удалялась из организма. Таким образом удавалось спасти практически обреченного человека. В настоящее время этот метод стал широко использоваться в акушерско–гинекологической практике. Детям, родившимся с признаками, скажем, такого грозного заболевания, как гемолитическая желтуха, срочно производят обменное переливание крови, исходя из тех же соображений, которые высказывали О. С. Глозман и А. П. Касаткина по поводу отравления змеиным ядом.
Казалось бы, данный пример прямого отношения к трансплантации органов не имеет, но так ли это? Ведь если можно полностью заменить кровь реципиента, то можно ожидать, что и орган, взятый от того же донора, что и кровь, будет длительное время функционировать в организме нового хозяина, имеющего тот же состав крови. Однако поставленные в Лаборатории по пересадке органов и тканей эксперименты разочаровали исследователей: после тотального замещения крови в организме все же вырабатывались антитела в ответ на введение чужеродного органа, и трансплантат довольно быстро погибал.
Вновь начались эксперименты в нашей лаборатории, душой и инициатором которых стал чехословацкий ученый С. Пуза. Исследователи исходили из того, что в самом раннем периоде жизни организм еще не представляет собой хорошо налаженного «механизма», способного отвечать на внедрение чужеродных белков защитной реакцией, характерной для взрослого. Вводимая кровь, считали они, может усваиваться как своя собственная, со всеми ее антигенными свойствами. Однако оказалось, что период, в течение которого организм способен адаптироваться к чужеродным белкам, длится очень короткое время — всего четыре–пять дней!
Был поставлен эксперимент на собаках. Производилась почти ювелирная операция на сосудах щенят двух-четырех дней от рождения. Бедренные сосуды — артерия и вена — у новорожденных щенят очень тонкие (примерно диаметр волоса). В них вставляли иголочки. Через артерию кровь выпускали в градуированный сосуд, одновременно с этим через вену нагнетали кровь будущего донора. Приходилось внимательно следить за соответствием объемов вводимой и удаляемой крови — они должны быть на протяжении всего эксперимента одинаковыми. Чтобы быть полностью уверенным в том, что вся кровь щенка заменена новой, обменное переливание осуществляли три раза. После этого терпеливо ждали несколько месяцез, пока щенки подрастут. Орган для пересадки брался от животного, кровь которого раньше переливали щенку.
Аналогичные эксперименты в это же время проводились и в лаборатории А. Г. Лапчинского. Опыты показали, что методом тотальной замены крови в раннем периоде можно влиять на защитные силы и добиваться удлинения срока жизни пересаженных тканей от другого организма.
В экспериментах, проведенных в Лаборатории по пересадке органов и тканей, гомологичный кожный лоскут, пересаженный собакам, подвергшимся тотальному замещению крови, сохранял жизнеспособность до 80 дней. А. Г. Лапчинскому удалось добиться у таких животных стойкого приживления пересаженной задней лапы (правда, за исключением кожного покрова).
С. Пуза у себя на родине, в Чехословакии, пересадил собакам, подвергшимся тотальной замене крови, почку, которая функционировала несколько лет.
Но, к сожалению, тотальную замену крови невозможно широко использовать при пересадке органов. Она нередко вызывает крайне тяжелую реакцию. А ведь эту процедуру необходимо производить новорожденным. Есть и другая трудность: толерантность, как я уже говорил, создается только к одному–единственному донору. Но как может человек быть всю жизнь связан со своим заранее нареченным спасителем? И как знать, кому из них раньше придется встретиться с грозной опасностью?
Поэтому практически более перспективным оказался метод воздействия на взрослый организм, нуждающийся в пересадке органа, различными иммунодепрессивными агентами. При иммунодепрессивной терапии, направленной прежде всего на подавление активности лимфоидной ткани, используются химические, физические и биологические средства. Это определенные химические соединения, гормональные препараты, антибиотики типа антиномицинов С и Д.
Но, к сожалению, большинство из них токсично и отрицательно влияет на жизнедеятельность других органов и тканей, а также значительно снижает сопротивляемость организма всяким болезнетворным микробам и вирусам. Больных, которым вводят эти средства, приходится содержать в стерильных (безмикробных) условиях. В настоящее время широко ведутся поиски новых химических соединений, которые были бы менее токсичны и более действенны против иммунной защиты.
Снижению реактивности иммунокомпетентной системы служит и воздействие рентгеновскими и гамма-лучами.
Как известно, ионизирующее облучение губительно действует на живые клетки, причем степень этого воздействия зависит от их вида и дозы облучения. Это используется для разрушения злокачественных опухолевых клеток.
Облучение всего организма вызывает подавление иммунитета, то есть невосприимчивости к различного рода агентам, и прежде всего к возбудителям инфекционных заболеваний. На этот факт было обращено внимание еще в 50?е годы нашего века при первых попытках пересадки почки. Общее облучение в этих случаях было направлено на подавление реакции организма на чужеродную ткань. Проведенные на различных животных опыты показали, что действительно при облучении всего организма удлиняется срок жизнеспособности трансплантата, пересаженного от другого животного того же вида.
Гамма–облучение.
Это явилось основанием для испытания данного метода на практике, чему способствовал трагический случай, произошедший с группой югославских ученых-физиков. В результате аварии на атомном реакторе ученые получили смертельную дозу радиации. Для их спасения были мобилизованы все силы. Приняли решение сделать им пересадку костного мозга, чтобы предотвратить развитие лучевой болезни. Операцию произвел французский ученый Ж. Матэ, который взял костный мозг от здоровых людей. Клетки костного мозга прижились. Именно тогда и возникла мысль об искусственном облучении человека (конечно, не опасными для жизни дозами), чтобы добиться приживления пересаженного органа.
Оказалось, что применение общего облучения действительно удлиняет срок функции трансплантата. Но даже при дозе облучения, не превышающей 600 рентген, у больных возникали тяжелые осложнения, приводившие иногда к гибели от лучевой болезни.
Тем не менее сама идея использования ионизирующего облучения при пересадке органов не забыта, и в последнее время этот метод нашел свое применение в виде локального (местного) облучения пересаженного органа и расположенных вблизи него лимфатических узлов.
Изучение нового метода началось одновременно в нескольких странах. За рубежом интенсивные исследования проводились в США — в клинике профессора Д. Хюма в Ричмонде (1964 г.) и в урологической клинике профессора В. Гудвина в Лос—Анджелесе (1963 г.), а в Советском Союзе — в нашей Лаборатории по пересадке органов и тканей и на кафедре оперативной хирургии Университета дружбы народов имени П. Лумумбы.
Ассистент университета Э. Д. Лебедева использовала метод локального рентгеновского облучения области пересаженного органа с двоякой целью: для предупреждения отторжения пересаженного органа и для борьбы с уже начавшимся отторжением. Исследования на крысах и собаках показали, что данный метод приводит к удлинению сроков жизни пересаженных чужеродных кожных лоскутов. Были изучены разные режимы облучения. Оказалось, что важное значение имеют разовая доза облучения, начало его и интервалы между отдельными сеансами. Лучшие результаты были достигнуты в случаях, когда облучение начинали в день пересадки. Разработана специальная схема облучения. Строго придерживаясь ее, удалось добиться удлинения срока жизнеспособности кожных лоскутов в среднем в три с половиной раза по сравнению с теми случаями, когда рентгеновское облучение не применялось.
Важным преимуществом локального рентгеновского облучения является его относительная безопасность. Он не вызывает резкого нарушения общего состояния животных, как при общем облучении организма.
Идея использования ионизирующего облучения для предотвращения отторжения пересаженного органа была использована также в другой методике. Японский исследователь И. Шиката для подавления реакции отторжения предложил вводить в лимфатические пути больного радиоактивное золото, которое проникало в лимфатические узлы и облучало их. Результаты оказались в шести случаях весьма благоприятными.
В последние годы разработаны также методы радиоактивного облучения лимфоидных клеток, выведенных с помощью трубочек, которые вставлены в кровеносные или лимфатические сосуды, за пределы организма. Такое «экстракорпоральное» облучение наиболее функционально активных лимфоцитов, циркулирующих в крови и лимфе, позволяет удалять их, не оказывая при этом токсического действия на организм.
В настоящее время известны и биологические способы борьбы с тканевой несовместимостью, такие, как феномен усиления. Он впервые был применен в начале XX века в опытах на опухолевых трансплантатах крысиных сарком и в последующем многократно воспроизводился на опухолях различных млекопитающих. Суть его заключается в том, что опухоль приживается и начинает усиленно расти, если реципиенту предварительно вводят гипериммунную сыворотку, содержащую антитела против трансплантата. В ряде работ четко показано, что усиление роста трансплантата связано с гуморальными антителами. Этот феномен был также воспроизведен с положительным эффектом при пересадке нормальных гомологичных кожных лоскутог». Можно допустить, что переизбыток антител действует, вероятно, так же, как и избыток антигенов, которые блокируют специфические центры размножения клеток, вызывая их отмирание, и сводят на нет индуктивную и продуктивную фазы иммуногенеза, создавая толерантность.
Активно внедряется в клиническую практику иммунодепресснвный препарат биологического характера — антилимфоцитарная сыворотка. Получают ее от животного (лошади, кролика), которому предварительно многократно вводят лимфоциты человека. В такой сыворотке содержатся готовые антитела против воинственных лимфоцитов, стоящих на страже неприкосновенности организма.
В нашей Лаборатории по пересадке органов и тканей В. И. Говалло применял антилимфоцитарную сыворотку при пересадках кожи кроликам и мышам. Данные оказались очень интересными. У одного подопытного кролика кожный трансплантат продержался свыше десяти месяцев (обычно он погибает через семь–пятнадцать дней). Ценность препарата заключается в том, что он обладает более направленным антилимфоцитарным действием, чем химиопрепараты, и в то же время менее токсичен.
Воздействие аитилимфоцитарной сыворотки на животных при пересадке органов.
Механизм действия аитилимфоцитарной сыворотки еще не ясен. Ученые выявляют специфические свойства препарата, чтобы шире использовать его в клинике. Пытаются воздействовать на ответную реакцию и удалением органов лимфоидной системы, селезенки, вилочковой железы, лимфатических узлов.
Предложений много, но пока еще нет общепризнанного надежного метода подавления врожденного иммунитета.
Кроме того, о чем уже говорилось, продолжается поиск и в совершенно новом направлении, предпосылкой которого послужил анализ накопленных данных в области трансплантационного иммунитета и общей иммунологии. Остановимся на некоторых из них.
После «знакомства» с «чужим» антигеном клеток иммунокомпетентной системы, которое происходит в первые четыре–восемь часов, ни один из известных в настоящее время препаратов не снимает защитные реакции организма: их можно ослабить, на время затормозить, но полностью ликвидировать нельзя. Это напоминает сказку братьев Гримм о горшочке каши с той разницей, что горшочку можно приказать перестать варить кашу, а лимфоциты, получив первый приказ о начале работы, ни на что затем не реагируют. Во всяком случае, мы еще не знаем того «заветного средства», которое бы могло отменить работу лимфоцита, «заведенного» чужим антигеном.
Естественно, возник вопрос: как достигнуть такого положения, когда не будет происходить запуск этой реакции, то есть как предотвратить «пусковое» знакомство макрофагов и лимфоцитов с чужими антигенами? Конечно, это достижимо только в том случае, если знаешь точно, как развивается начало этого «знакомства» и что ему способствует. Оказалось, что громадная иммунологическая литература не дает ответа на этот вопрос, потому что в первые минуты и часы после попадания чужого антигена невозможно классическими приемами определить реакцию организма. У иммунитологов сложилось представление о том, что этот процесс «знакомства» протекает скрыто, невидимо для глаз исследователей.
И вот мы поставили перед собой цель созсем необычными средствами и путями поднять эту «целину» иммунологии. Решили посмотреть, меняется ли обмен веществ в лимфоцитах крови, то есть тех клетках, которые впервые «знакомятся» с чужими антигенами органа при прохождении через него крови, и как меняется кровоснабжение органа, его обмен, функция и морфология. Кроме того, нужно было исследовать состояние центральной нервной системы, регулирующей процессы в организме.
Два–три года шли тяжелые поиски лучшей экспериментальной модели, отрабатывались различные этапы исследования, перепроверялись данные и анализировались. В результате мы выяснили, что в первые пятнадцать–тридцать минут после подключения трансплантата в кровоток реципиента появляются изменения практически во всех исследованных органах и системах его, то есть происходит генерализованный ответ организма.
Получив такую реакцию организма и трансплантата, мы решили несколько изменить модель, то есть посмотреть, как сам орган реагирует на чужую для него кровь. Взяли сегмент тонкого кишечника, обеспечили его искусственное кровоснабжение с помощью аппарата искусственного кровообращения АИК?2 и установили два интересных факта: во–первых, уровень обмена в лимфоцитах, входящих в кишку и выходящих из нее с перфузируемой кровью, различен. Во–вторых, если перфузию осуществлять «чужой» кровью по отношению к сегменту кишки, то в ее поверхностных слоях открываются «шлюзы» — шунты (дополнительные анастомозы между артериями и венами на уровне капилляров), что и предотвращает попадание «чужой» крови в более глубокие ее слои. Все эти изменения мы объединили под общим названием — синдром ранних проявлений тканевой несовместимости.
Первые данные наших экспериментов были доложены на Всесоюзном симпозиуме по тканевой несовместимости, участники которого при обсуждении представленных нами материалов предложили Лаборатории по пересадке органов и тканей Академии медицинских наук СССР разработать комплексную научную программу — «Ранние проявления тканевой несовместимости». В настоящее время решением основных задач этой программы занимаются научные сотрудники четырнадцати центров Советского Союза и зарубежных стран. Цель программы — установить пусковые механизмы процесса распознавания «чужого» антигена на примере антигенов гомологичного органа–трансплантата.
Почему в первый момент включается весь организм, а затем уже активно и «не скрыто» работает высокоспециализированная и квалифицированная «бригада» — лимфоидная система? Как это осуществляется? Ответы на эти вопросы помогут перейти к специфической терапии, направленной не на уничтожение клеток иммунной системы, а на предотвращение реакции распознавания «чужого». Думается, что в этом отношении должны очень помочь те «слова» — сигналы клеток (медиаторы), умелое использование которых даст возможность управлять реакциями организма.