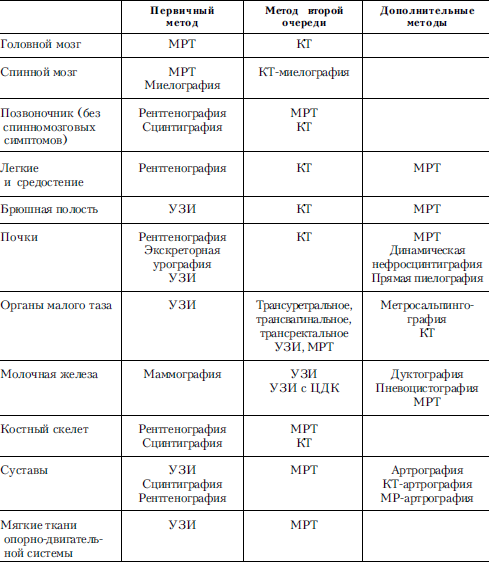
Глава 9. ДИАГНОСТИЧЕСКИЕ ИЗОБРАЖЕНИЯ В СОВРЕМЕННОЙ МЕДИЦИНЕ
Медицинская визуализация – совокупность методов, позволяющих сделать видимыми анатомические структуры в глубине тела и происходящие в них патологические изменения, – основана на применении различных видов волновой энергии, взаимодействие которой с тканями тела порождает диагностическую информацию, преобразуемую в видимые (диагностические) изображения. Хотя медицинская визуализация ведет свое начало с открытия рентгеновского излучения, сам термин вошел в медицину в 1980-е гг., когда появились новые способы получения диагностических изображений. В современной диагностике широко используются рентгенологические исследования (РИ), ультразвуковые исследования (УЗИ; синонимы – эхография, ультрасонография), рентгеновская компьютерная томография (КТ), магнитно-резонансная томография (МРТ), радионуклидная визуализация.
Успехи медицинской визуализации стали возможными на базе технического прогресса. Одно из знамений времени – внедрение в визуализацию цифровых технологий, без которых немыслимы новые высокоинформативные методы, – КТ и МРТ. На цифровую основу переходят и более старые методы визуализации: рентгенодиагностика, УЗИ и сцинтиграфия. Все шире применяются и стремительно совершенствуются за счет отображения более мелких морфологических деталей и быстродействия послойные изображения (УЗИ, КТ, МРТ). Новые возможности открывают трехмерные изображения. На цифровой основе развиваются беспленочные технологии получения изображений. Успехи искусственного контрастировавания – создание гораздо более безопасных неионных йодсодержащих контрастных средств для рентгенодиагностики, появление контрастных средств для МРТ и УЗИ способствуют выявлению и истолкованию патологических изменений.
Современные диагностические изображения все более информативны. Стала возможной визуализация всех анатомических структур и практически всех патоморфологических изменений. Все это резко повысило роль визуализации в современной медицине. Одновременно все больше заявляют о себе факторы, ограничивающие применение диагностических изображений. Первый фактор – экономический: современная визуализация обходится очень дорого в связи с высокой стоимостью аппаратуры, контрастных средств и т. д. Второй фактор – потенциальный риск инвазивных исследований (с внедрением в ткани путем нарушения внешних покровов или глубоким проникновением в него по естественным путям с опасностью кровотечения, инфекции и повреждения глубоких структур тела) и исследований с использованием ионизирующего (рентгеновского и гамма-) излучения, которое вследствие возрастающего применения все больше превращается в серьезную экологическую опасность. Так, за несколько лет тотальная доза рентгеновского излучения в Европе выросла в 1,5 раза, преимущественно за счет применения КТ. Поэтому при проведении того или иного диагностического исследования следует исходить из соотношения польза/риск.
С учетом этих фактов наметилась тенденция к пересмотру концепции применения диагностических изображений. Первостепенное значение приобретает выбор наиболее адекватного метода (или последовательности методов) визуализации в конкретной клинической ситуации, а такой выбор требует специальных знаний. Не следует сбрасывать со счета более дешевые, но тем не менее достаточно информативные рентгенодиагностику и УЗИ. Опыт показывает, что значительная часть их ограничений обусловлена не пределами этих методов, а недостаточно квалифицированным использованием. Они продолжают оставаться первичными и чаще всего единственно необходимыми методами визуализации во многих областях медицины. Дорогостоящие высокоинформативные методы визуализации и исследования с применением ионизирующего излучения должны использоваться по строго обоснованным показаниям с учетом их возможностей и пределов, а также исходя из того, насколько их результаты способны изменить тактику лечения пациента. Только улучшение исходов заболеваний, снижение смертности, восстановление трудоспособности, увеличение продолжительности и качества жизни пациентов могут оправдать те огромные затраты, которые несет общество, приобретая и эксплуатируя современную аппаратуру для получения диагностических изображений.
Нужно также иметь в виду недостаточную специфичность диагностических изображений в установлении нозологического (патогистологического) диагноза. Никакая визуализация не в состоянии заменить, например, бактериологического, биохимических или радионуклидных in vitro исследований. Например, диагноз гормонально-активной опухоли устанавливается на основании клинической картины и определения уровня гормонов, а диагностические изображения используют для морфологического подтверждения и уточнения ее локализации. Для постановки окончательного диагноза часто требуется патоморфологическая верификация. Главными задачами визуализации остаются выявление патологических изменений, уточнение их локализации и распространенности, ограничение круга дифференциальной диагностики, оценка динамики прогрессирования или регрессии, нацеливание биопсии, облегчающее ее выполнение и повышающее точность результатов. В то же время специфичность визуализации значительно повышают изображения, основанные на картировании метаболизма: радионуклидные, особенно позитронно-эмиссионная томография, в меньшей степени однофотонная эмиссионная компьютерная томография, а также магнитно-резонансная спектроскопия. Эти изображения называют метаболическими, противопоставляя их остальным (морфологическим) изображениям.
ХАРАКТЕРИСТИКА ДИАГНОСТИЧЕСКИХ ИЗОБРАЖЕНИЙ
Рентгенодиагностика остается наиболее распространенным методом визуализации. Преимущества рентгенологического исследования (РН): широкий обзор исследуемой области, высокое пространственное разрешение – возможность воспроизведения более мелких деталей, чем при других видах диагностических изображений (рентгенография); возможность исследований в режиме реального времени (рентгенотелевизионное просвечивание), обеспечивающем выбор оптимальных проекций и исследования двигательной функции; относительно низкая стоимость.
Недостатки рентгенодиагностики: суммационный характер изображения с перекрытием структур, расположенных на различной глубине; использование ионизирующего излучения, что следует учитывать прежде всего при широких и многократных рентгенологических исследованиях, особенно с применением рентгеноскопии; зависимость контраста (дифференцированного изображения различных тканей) только от плотности и в соответствии с этим возможность различать всего лишь несколько градаций тканей: обызвествления и костную ткань, мягкие ткани и жидкости, жировую ткань и воздух. Вместе с тем в силу этой зависимости РИ наиболее информативно и является первичным и часто единственным необходимым методом визуализации в ряде областей: при болезнях легких (контраст между воздушной легочной тканью и ее патологическими уплотнениями позволяет выявить и охарактеризовать большинство поражений); при болезнях костей, поскольку нормальная костная ткань отличается по содержанию кальция и потому по плотности от замещающих ее патологических тканей и склерозированной костной ткани; при воспалительных заболеваниях околоносовых пазух и среднего уха благодаря контрасту между костными стенками, содержащимся в полостях воздухом и патологически измененными мягкими тканями; при острых заболеваниях органов брюшной полости за счет выявления свободного газа в ней при перфорациях полых органов, горизонтальных уровней жидкости при кишечной непроходимости и учета распределения газа в кишечнике; при выявлении металлических инородных тел и обызвествленных образований, например мочевых камней.
Флюорография (фотография рентгеновского изображения со светящегося экрана) переживает определенный подъем благодаря внедрению цифровых технологий, позволивших существенно снизить лучевую нагрузку на пациента. Вывод на экран монитора изображений органов грудной клетки с возможностью их компьютерной обработки и изучения деталей как в светлых, так и в темных участках, беспленочная технология – все это дает новую жизнь флюорографии.
При РИ изображение мягких тканей характеризуется только очень слабыми контрастами, обусловленными жировой тканью. Для визуализации мягких тканей используют специальную технику рентгенографии рентгеновским излучением с низкой энергией, особенно в диагностике болезней молочных желез (маммография). Однако главный путь преодоления этого недостатка рентгенодиагностики – искусственное контрастирование. Используемые для этого контрастные средства (КС) ослабляют рентгеновское излучение в большей степени, чем мягкие ткани (например, йодсодержащие КС), или в меньшей степени (например, воздух). Из числа контрастных РИ в полной мере сохранили свое значение РИ желудочно-кишечного тракта с взвесью сульфата бария и экскреторная урография. Большинство инвазивных контрастных рентгенологических методов вытеснено послойными изображениями; некоторые, например ангиография, продолжают применяться, хотя и в ограниченных масштабах.
Ультразвуковое исследование – второй по распространенности метод визуализации. Изображения создаются благодаря отражению ультразвуковых волн от поверхностей раздела между тканями с разными акустическими свойствами (плотность и эластичность). При исследовании мягких тканей получают их богато дифференцированное изображение, в котором жидкостные образования отличимы от солидных, тогда как обызвествленные структуры и воздух не проводят ультразвук. Таким образом, УЗИ хорошо дополняет рентгенодиагностику. Важное преимущество – проведение исследования в режиме реального времени. УЗИ может быть выполнено у постели больного.
Недостатки УЗИ: ограничения, связанные с очень большим объемом тканей (массивные пациенты) или очень глубоким расположением интересующих структур; ограничения акустического доступа из-за наличия костных структур или газа на пути ультразвукового пучка (например, при острых заболеваниях брюшной полости, сопровождающихся вздутием кишечника); наличие повреждений кожи и повязок, препятствующих контакту между ультразвуковым датчиком и кожей; недостаточное воспроизведение мелких деталей в зависимости от используемой частоты ультразвуковых волн; повышенная зависимость результатов исследования от квалификации врача.
Часть ограничений преодолена с появлением новых техник УЗИ: УЗИ по второй гармонике дополнительно улучшает контраст, УЗИ в режиме повышенной частоты (7-10 МГц и выше) позволяет представить более мелкие детали при изображении поверхностно расположенных структур. Посредством специальных датчиков с повышенной частотой, которые могут быть введены в те или иные полые органы или полости тела, осуществляется внутриполостное и внутрипросветное УЗИ (например, трансуретральное, трансвагинальное, трансректальное, трансэзофагеальное). Такими датчиками оснащают и эндоскопы, что позволяет сочетать непосредственный осмотр глазом внутренней поверхности органа с ультразвуковой визуализацией стенок органов и прилежащих тканей (эндоскопическое УЗИ пищевода и желудка, лапароскопическое УЗИ).
Важным развитием и дополнением УЗИ является допплерография, которая позволяет провести анализ скоростного спектра кровотока и определить его направление, а также визуализировать кровоток в цвете в зависимости от направления и скорости (цветовое допплеровское картирование – ЦДК). Особенно чувствительно к кровотоку энергетическое допплеровское картирование (ЭДК). Возможности допплеровского метода определяются особенностями аппаратуры. Дуплексное УЗИ позволяет представить помимо изображения в серой шкале (В-режим) допплеровский спектр или ЦДК, триплексное УЗИ обеспечивает все три режима. ЦДК не только играет важную роль в диагностике заболеваний сердца и сосудов, но и вносит все больший вклад в оценку опухолей и острых воспалительных процессов: аппендицита, холецистита, воспалительных заболеваний малого таза, артритов, теносиновитов и др., демонстрируя воспалительную гиперваскуляризацию.
Эхоконтрастные средства (эхо-КС) с преимущественно интраваскулярным распределением позволяют визуализировать мелкие сосуды и благодаря этому отображать особенности кровотока в злокачественных опухолях, способствуя диагностике некоторых локализаций рака. Большой интерес вызывает трехмерное УЗИ, особенно его кардиологические применения, хотя этот метод еще несовершенен.
Вследствие отсутствия ионизирующего излучения УЗИ практически безвредно. Нагревание тканей под действием ультразвуковых волн представляет опасность главным образом для быстро размножающихся клеток и поэтому ограничения касаются допплерографии плода в I и III триместрах беременности.
Стандартное УЗИ в В-режиме относительно недорогое. Стоимость возрастает за счет внутриполостных датчиков. Значительно дороже современные ультразвуковые сканеры высокого класса с триплексным УЗИ. Дороги и контрастные средства для УЗИ.
Рентгеновская аксиальная компьютерная томография позволила получать изображения поперечных слоев тела с применением рентгеновского излучения. Это достигается благодаря сканированию, в процессе которого рентгеновская трубка обходит по кругу тело пациента. Специальные детекторы регистрируют при этом интенсивность излучения, прошедшего сквозь тело пациента, преобразуя его в электрический сигнал. На основе таких первичных данных, полученных в сотнях проекций, компьютер воссоздает изолированное изображение слоя тканей. Возможности КТ в значительной мере определяются классом аппаратуры; современные томографы обеспечивают возможность спирального сканирования, т. е. непрерывного сканирования не одиночного слоя, а большего или меньшего объема тканей. Однако в лечебной сети еще преобладают более старые модели для последовательного сканирования одиночных слоев.
Преимущества КТ: устранение суммационного эффекта и связанных с ним ограничений; значительно более высокий тканевой контраст по плотности, чем в обычном рентгеновском изображении, включая разграничение солидных образований от жидкостных и очень высокую чувствительность к очагам обызвествления и скоплениям газа.
Внутривенное контрастирование йодсодержащими контрастными средствами улучшает выявление ряда патологических изменений, способствует их распознаванию в кровеносных сосудах (например аневризм), позволяет отличать сосуды от лимфатических узлов и т. д. Чтобы создать градиент концентраций между сосудистым руслом и тканями или между патологическими очагами и нормальными тканями (за счет отличий их васкуляризации или динамики кровотока в них), необходимо очень быстрое введение контрастного средства с помощью автоматического шприца (болюсное контрастирование).
Динамическая КТ с контрастированием, т. е. повторные сканирования одного и того же слоя с короткими интервалами времени после болюсного введения КС, позволяет получить изображения в различные фазы контрастирования (артериальную, венозную, паренхиматозную); визуализировать патологические очаги в период максимального контраста с окружающими тканями, изучать быстротекущие процессы и оценить перфузию.
Недостатки КТ:
1) ориентация выделяемых слоев за некоторыми исключениями ограничена аксиальной плоскостью, что не обеспечивает оптимального представления многих образований. Частично это восполняется благодаря компьютерному преобразованию в изображения в других плоскостях, хотя качество преобразованных изображений хуже, чем исходных;
2) по пространственному разрешению КТ существенно уступает рентгенографии, даже при использовании режима повышенного разрешения;
3) продолжительность сканирования слоя варьирует от нескольких секунд на более старых моделях до субсекундного времени на современных мощных томографах, что требует соответствующей задержки дыхания;
4) распознаванию деталей мешают артефакты от костей, газа, металлических включений, а также от движений, в том числе пульсации, перистальтики и т. д.
Спиральное сканирование дает возможность резко сократить продолжительность исследования и увеличить пропускную способность, а при исследовании грудной и брюшной полости в полной мере использовать преимущества тонких слоев, улучшить качество реформаций изображения в других плоскостях благодаря сканированию объема тканей за одну дыхательную паузу, осуществлять трехмерную реконструкцию изображений (при последовательном сканировании одиночных слоев возможна только для неподвижных объектов); распространить преимущества динамической КТ с контрастированием на большой объем тканей. Благодаря этим преимуществам спиральная КТ стала предпочтительной при заболеваниях грудной и брюшной полости, в то время как КТ с одиночными слоями сохранила свое значение при визуализации головного мозга, позвоночника и костей. В целом же КТ предоставляет возможность изображения различных областей тела от головного мозга до мягких тканей опорно-двигательной системы.
Спиральная КТ послужила основой для ряда приложений. КТангиография (КТА) представляет собой трехмерную визуализацию контрастированных сосудов на большом протяжении независимо от их направления. Виртуальная эндоскопия позволяет как бы осмотреть изнутри околоносовые пазухи, трахеобронхиальное дерево, толстую кишку, сосуды, создавая иллюзию продвижения по ним, как при эндоскопии, и с большой наглядностью выявить патологические образования в полостях и просветах органов и их сужения. Не заменяя обычную эндоскопию, такая имитация может быть полезной в случаях, когда обычная эндоскопия неосуществима. Одно из реализуемых применений – скрининг опухолей прямой и сигмовидной кишки.
Замена вращения рентгеновской трубки вращением пучка электронов (электронно-лучевая КТ) сократило время сканирования до 50-100 мс (против 0,5 с на самых скоростных спиральных томографах), обеспечив тем самым важные преимущества главным образом в кардиологической диагностике. Такие томографы очень дороги и в обозримом будущем останутся привилегией отдельных медицинских учреждений. Более дешевый путь увеличения скорости КТ – многослойное сканирование, или одновременное изображение 2–4 слоев тела на специальных томографах.
Учитывая экономические соображения (КТ – дорогое исследование), недостаточную обеспеченность аппаратурой и значительную лучевую нагрузку, КТ должна проводиться строго по показаниям и по возможно более точному «адресу», т. е. уровню для КТ-сканирования.
Магнитно-резонансная томография – высокоинформативный метод визуализации на основе ядерно-магнитного резонанса (физический феномен, возникающий при воздействии двух магнитных полей – сильного статического и слабого радиочастотного с частотой, специфической для каждого вида атомных ядер). Возбужденные радиочастотным воздействием ядра после его прекращения выделяют поглощенную энергию в виде радиоволн с той же частотой. Этот радиоволновой сигнал (MP-сигнал), который получают от атомных ядер водорода, входящих в состав тканей тела, воздействуя на них радиочастотным импульсом, регистрируется с помощью специальных (приемных) катушек и преобразуется в изображение. Таким образом, физические основы магнитно-резонансного (MP) изображения в корне отличаются от рентгеновского и КТ-изображений.
В отличие от них MP-изображение различных тканей определяется не разной плотностью, а целым комплексом физических и химических характеристик тканей, включая размеры молекул, агрегатное состояние вещества и др. Поэтому МРТ позволяет выявить изменения, которые не визуализируются при УЗИ и КТ. Контрастом при МРТ можно управлять, ставя его в зависимость то от одного, то от другого параметра. Фактически MP-изображение – это несколько видов изображений с отличающимся контрастом, полученных в разных режимах: если в одном из них ткань выглядит темной, то в другом может дать яркий сигнал. Сравнение изображений с различным типом контраста позволяет уточнить наличие и характер патологических изменений. По яркостному выражению контраста MP-изображение существенно отличается от рентгеновского и КТизображений: обызвествленные образования выглядят не светлыми, а так же, как воздух, темными, а жировая ткань в одном из режимов МРТ выглядит яркой. МРТ специфичнее КТ в опознавании кровотока, излившейся крови, начиная с 3-4-го дня; фиброзной ткани, меланом и др., но уступает ей в выявлении обызвествлений и костной ткани.
Важное преимущество МРТ – свободный выбор ориентации слоев (мультипланарность), что облегчает анатомическую ориентировку, обеспечивает отображение патологических изменений в оптимальной плоскости и точное определение границ анатомических и патологических образований при любой их пространственной ориентации. Эти возможности еще возрастают при использовании трехмерных реконструкций МР-изображений. Отсутствие артефактов от костей, нередко перекрывающих мягкотанные контрасты при КТ, позволяет без помех визуализировать поражения спинного и базальных отделов головного мозга. Диагностические возможности МРТ расширяются благодаря внутривенному контрастированию с помощью специальных (очень дорогих) КС, содержащих парамагнитные атомы гадолиния, которые усиливают MP-сигнал многих патологических тканей.
Важным достоинством МРТ является возможность визуализировать без искусственного контрастирования субарахноидальное пространство головного мозга (МР-цистернография), спинного мозга (МР-миелография), мочевыводящих путей (МР-урография), системы желчных и панкреатического протоков (МР-холангиопанкреатография) и заменить соответствующие контрастные и в том числе инвазивные исследования.
Особенности MP-сигнала движущихся частиц крови по сравнению с неподвижными окружающими тканями позволяют отличить кровоток в сосудах от таких тканей без искусственного контрастирования. На этой основе специальные ангиопрограммы обеспечивают отображение кровотока с отличным контрастом, сходным с рентгеновской АГ (магнитно-резонансная ангиография – МРА). Более информативна и шире используется МРА с внутривенным контрастированием (КМРА).
При МРТ нет ионизирующего излучения и радиационной вредности. Для подавляющего большинства пациентов метод не представляет опасности. Однако МРТ противопоказана: пациентам с установленным водителем ритма или с внутриглазничными, внутричерепными и внутрипозвоночными ферромагнитными инородными телами и с сосудистыми клипсами из ферромагнитных материалов (абсолютное противопоказание); реанимационным больным из-за воздействия магнитных полей MP-томографов на системы жизнеобеспечения (оно минимально в случае низкопольных MP-томографов); пациентам с клаустрофобией (составляют примерно 1 %), хотя она нередко уступает седативным средствам (реланиум); женщинам в I триместре беременности.
МРТ остается наименее доступным методом визуализации из-за очень высокой стоимости аппаратуры. С повышением интенсивности используемого магнитного поля увеличиваются возможности томографов и улучшается качество изображений, но одновременно растут закупочная цена и с переходом к магнитному полю средней и высокой интенсивности – также эксплуатационные расходы.
Главные применения МРТ: диагностика болезней головного и спинного мозга (для последнего МРТ – единственный неинвазивный метод визуализации), органов малого таза, костномозговых поражений, суставов и мягких тканей опорно-двигательной системы. В этих областях в 80–90 % случаев эффективны MP-томографы с низкой интенсивностью магнитного поля, которые в 2 раза дешевле и экономичнее в эксплуатации. Однако на большинстве томографов исследования невозможны при задержке дыхания. Это порождает артефакты от дыхательных и других движений и ограничивает применение МРТ в распознавании болезней органов брюшной полости, средостения и особенно сердца, а также МРА и функциональных МРисследований, требующих быстродействия. MP-томографы высокого класса необходимы также для визуализации мелких деталей, например при исследованиях гипофиза. МРТ в реальном времени, используемая для контроля за интервенционными процедурами и некоторых функциональных исследований, пока еще достигается ценой сниженного пространственного разрешения.
Магнитно-резонансная спектроскопия (МРС) определение in vivo химического состава того или иного объема тканей и концентрации в нем различных метаболитов по радиочастотному спектру, полученному с помощью ядерно-магнитного резонанса. Осуществима только на очень дорогих МРтомографах с силой магнитного поля от 1,5 Т. Информация представлена в виде частотных спектров, которые могут быть преобразованы в карты метаболизма, отображающие концентрации некоторых метаболитов в анатомическом срезе органа. Имеются данные о возможности использовать метод в дифференциальной диагностике патологических образований головного мозга и других органов.
Радионуклидная визуализация основана на использовании ионизирующего излучения, испускаемого нестабильными атомными ядрами – радионуклидами. Введенные в организм радионуклиды подвергаются радиоактивному распаду с излучением гамма-квантов, обладающих различной энерией. Применение короткоживущих радионуклидов – технеция 99mТс (период полураспада – 6 ч) или индия (113mIn) делает процедуру практически радиационно безопасной, позволяя в десятки раз снизить лучевую нагрузку на пациента. В клинической практике часто используют также галлий – 67Ga, таллий – 201Тl, ксенон – 133Хе, йод – 123I и др. Для радионуклидной визуализации применяют радиофармакологические препараты (РФП) – меченные этими радионуклидами метаболически активные соединения (молекулы-носители). Благодаря свойствам радионуклидов или молекулносителей РФП включаются в специфические для каждого из них метаболические процессы, что определяет их объемное распределение в организме с концентрацией в определенных органах и образованием очагов гиперфиксации. Это распределение РФП в тканях тела отображается посредством регистрации их гамма-излучения.
Измерения радиоактивности с построением графиков ее в зависимости от времени (радиография) используют, например, для оценки сократительной функции левого желудочка сердца (радиовентрикулография), функции почек (радиоренография) и т. д.
Наиболее распространенный метод радионуклидной визуализации – сцинтиграфия с помощью сцинтилляционных гамма-камер, которые регистрируют гамма-излучение введенных в организм пациента РФП и отображают на экране монитора их объемное распределение в теле. Используют однократное изображение (статический режим) или серию последовательных изображений в различные моменты времени (динамический режим).
Сцинтиграфия – наиболее дешевый метод исследований перфузии, которые проводятся в ранние сроки после введения РФП, пока он не покинул микроциркуляторное русло. Они используются в диагностике эмболий легочной артерии (с внутривенным введением меченых макроагрегатов альбумина сыворотки человека), показывая в 1/3 случаев локальный дефект перфузии легких при нормальной вентиляции, ишемии миокарда.
Оценку перераспределения РФП между нормальными и патологически измененными тканями выполняют при визуализации костей через 3–4 ч, а для РФП, содержащих 67Ga или 123I, – через 24 или 48 ч. Отображение патологических изменений основано на разнице концентраций РФП между нормальными тканями и тканями с патологически измененными функциями. Если РФП накапливается в какой-либо ткани, то патологические очаги, не содержащие этой ткани, выглядят как дефекты накопления («холодные» очаги). Например, для визуализации печени используют захват коллоидной серы купферовскими клетками, тогда как метастатические очаги, не содержащие этих клеток, выглядят как «холодные». Наоборот, препараты, меченные 99mТс, фиксируются в патологических очагах в печени (очаги гиперфиксации, или «горячие»), Сцинтиграфия значительно уступает другим методам визуализации в изображении морфологических деталей, а послойным – также в выявлении очаговых изменений в паренхиматозных органах. Однако ни один из них не способен конкурировать с ней в отображении специфических метаболических изменений.
Иммуносцинтиграфия – визуализация с помощью меченных радионуклидами антител, которые, соединяясь с соответствующим антигеном, накапливают в местах его локализации. Так, скрытые очаги воспаления обнаруживаются с помощью меченных антител к антигену, имеющемуся в нейтрофилах, или меченых иммуноглобулинов. Меченные 99mТс и 111In моноклональные антитела к антигенам раковых опухолей (например, мелкоклеточного рака легкого) используют для их выявления, дифференцирования от доброкачественных процессов, определения стадии, прослеживания эффекта терапии, распознавания рецидивов и метастазов. Широкая визуализация в пределах всего тела с 67Ga или лейкоцитами, меченными 111In, создает удобства выявления множественных очагов поражения в процессе одного исследования. При сцинтиграфии с 67Ga визуализируются как опухоли, так и воспалительные фокусы. Этот РФП непригоден в неотложной диагностике: сканирование осуществляется через 48 ч после введения.
Однофотонная эмиссионная компьютерная томография (ОФЭКТ) – послойное изображение распределения радионуклидов в теле – позволяет детализировать картину, точнее локализовать очаги гиперфиксации и провести количественные определения, например с высокой точностью определить количество функционирующих гепатоцитов в слое и тем самым объем функционирующей печеночной ткани в целом.
Позитронная эмиссионная томография (ПЭТ) дает возможность благодаря метке метаболически активных веществ радионуклидами с позитронной эмиссией (выделение позитронов при распаде ядер) определять концентрации этих веществ в тканях и благодаря этому получать карты метаболических нарушений при различных заболеваниях. В качестве РФП чаще всего используют деоксиглюкозу, меченную позитрон-эмитирующим фтором – 18F (FDG), которая накапливается в ткани раковой опухоли в гораздо больших концентрациях, чем в нормальных тканях. Метод позволяет картировать и другие специфические особенности метаболизма злокачественных опухолей. ПЭТ чувствительнее и специфичнее КТ и МРТ в распознавании злокачественных опухолей и метастазов в лимфатические узлы размером даже меньше 1 см и вносит важный вклад в их дифференциальную диагностику. Чаще всего ПЭТ применяют для характеристики солитарных узлов в легких, определения стадии рака легкого, оценки рака прямой и толстой кишки у пациентов с повышенным уровнем эмбрионального антигена, для диагностики лимфом и меланом. Используется визуализация метаболизма головного мозга, сердца и т. д.
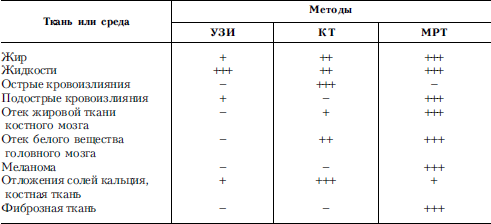
Радионуклидные исследования производятся только в специальных радиологических центрах, что ограничивает их доступность. Они значительно дороже рентгенологических исследований и УЗИ прежде всего за счет закупочной стоимости аппаратуры и некоторых РФП и в то же время, включая ОФЭКТ, дешевле КТ. ПЭТ – самый дорогой и у нас пока практически недоступный метод визуализации. В табл. 8 суммированы возможности методов визуализации в распознавании различных тканей и сред тела пациента.
Таблица 8. Возможности распознавания тканей и сред различными послойными методами
ВИЗУАЛИЗАЦИЯ ПО ОРГАНАМ, АНАТОМИЧЕСКИМ ОБЛАСТЯМ И ФУНКЦИОНАЛЬНЫМ СИСТЕМАМ
Болезни легких. КТ является методом второй очереди после рентгенографии, отображая внутрилегочные уплотнения, не выявляющиеся рентгенологически, в том числе скрытые плевральным экссудатом, и позволяя отличать их от скоплений жидкости в плевральной полости, а также улучшая выявление и характеристику полостных изменений в легких, в том числе туберкулезных каверн. Благодаря этому точнее оценивается распространенность поражений легких. КТ также лучше отображает структуру уплотнений (просветы бронхов в них, полости деструкции, обызвествления) и предоставляет возможность более детального рентгеноморфологического анализа патологических изменений в легких, что позволяет в ряде случаев установить диагноз или хотя бы сузить круг дифференциальной диагностики.
КТ показана для выяснения природы неразрешившейся пневмонии и для динамического наблюдения при туберкулезе легких, уточняя стабильность изменений и дополняя исследование мокроты на микобактерии туберкулеза при оценке эффективности терапии. С помощью КТ можно оценить состояние крупных бронхов вплоть до сегментарных и распознать 85–90 % бронхостенозов, дополняя бронхоскопию визуализацией перибронхиальных изменений. При шаровидных образованиях легких обосновывается диагноз кист, нередко – туберкул ем, гамартом и артериовенозных мальформаций, а также осуществляется отбор образований для пункционной биопсии, с тем чтобы подвергнуть остальные динамическому наблюдению. Этим методом оценивают распространенность рака легкого и, несмотря на некоторые ограничения КТ, ее широко используют при выборе тактики его лечения.
КТ в режиме повышенного разрешения используют для диагностики бронхоэктазов (бронхографию применяют для оценки их распространенности в случае предстоящего хирургического лечения). При диффузных (диссеминированных) заболеваниях легких эта техника позволяет отличить очаговые уплотнения альвеолярной паренхимы от поражений легочной стромы, оценить распределение изменений по субплевральной и центральной зонам легких, выяснить их отношение к анатомическим элементам легочной структуры. С помощью КТ в этом режиме на вдохе и выдохе раньше, чем при РИ и даже чем при функциональных пробах, устанавливается диагноз эмфиземы легких и точнее распознаются эмфизематозные буллы.
Посредством УЗИ может быть выявлена жидкость в плевральных полостях в гораздо меньшем количестве, чем рентгенологически. Его используют и в распознавании пневмоторакса.
КТ – обязательный метод визуализации при клиническом подозрении на поражение средостения или при выявленных на рентгенограммах изменениях в нем. Без КТ нельзя отвергнуть патологические изменения в средостении. КТ помогает уточнить, из каких органов они исходят, их распространение и взаимоотношения с анатомическими структурами, и судить об их доброкачественности или злокачественности. КТ с болюсным контрастированием исключает или подтверждает сосудистую природу патологических образований средостения (аневризмы, аномалии развития крупных сосудов, которые при РИ можно принять за опухоли). КТ гораздо чувствительнее, чем РИ, в определении медиастинальных лимфоаденопатий и близка по чувствительности к медиастиноскопии, позволяя визуализировать также недоступные для нее лимфатические узлы, например переднего средостения, выбрать оптимальный метод биопсии и нацелить медиастиноскопию.
Главные показания к МРТ грудной полости – определение стадии рака легких (точнее, чем при КТ, распознаются прорастание в средостение, грудную стенку и шею, вовлечение в процесс подключичной артерии и плечевого сплетения, инвазия сердца и крупных сосудов). МРТ может внести решающий вклад в диагностику заболеваний средостения за счет визуализации сосудистых образований без введения контрастных средств, лучшей пространственной оценки патологических образований и их взаимоотношений с анатомическими структурами средостения или специфических изменений MP-сигнала (при гематомах).
Болезни сердца. РИ ценно как метод визуализации сердца при клапанных пороках, главным образом приобретенных, оценки малого круга кровобращения и распознавания внутрисердечных обызвествлений.
Эхокардиография (эхо-КГ) – УЗИ сердца – высокоинформативный неинвазивный радиационно безопасный и относительно недорогой метод визуализации; может выполняться у постели больного. Обеспечивая морфологическую и гемодинамическую информацию, применяется как первичный при широком круге болезней сердца. В отличие от рентгенографии позволяет раздельно визуализировать камеры сердца, дифференцированно отображает кровоток в полостях сердца и их стенки, морфологию сердечных клапанов и подклапанных структур и др. Это дает возможность оценить размеры полостей, толщину и массу миокарда и распознать его гипертрофию или истончение стенок, судить о соотношении давления в предсердиях по положению межпредсердной перегородки. Выявляются утолщение перикарда при констриктивном перикардите, жидкость в полости перикарда и ее гемодинамические эффекты, тромбы в полостях сердца и опухоли сердца и т. д. Эхо-КГ принадлежит главная роль в распознавании непенетрирующих ранений сердца, а при пенетрирующих ранениях с ее помощью распознаются инородные тела в полости сердца. В М-режиме с высоким временным разрешением регистрируются быстрые движения створок клапанов, их нарушенные смыкание и раскрытие.
Допплероэхо-КГ позволяет оценить скорость и направление внутрисердечного кровотока посредством спектрального анализа, выявить стенотический тип кровотока и клапанную регургитацию, а ЦДК прямо визуализирует кровоток и наглядно демонстрирует эти и другие функциональные феномены. Важное достоинство – определение максимального систолического давления в легочной артерии (на основе измерения максимальной скорости потока трикуспидальной регургитации) и оценка степени легочной гипертензии.
Эхо-КГ позволяет рассчитать показатели как систолической (ударный и минутный объемы, фракцию выброса и др.), так и – с помощью спектрального анализа трансмитрального кровотока – диастолической функции (кровенаполнение в диастолу) миокарда левого желудочка и различить типы нарушения последней. Эхокардиографическая оценка правого желудочка, особенно количественная, труднее, чем левого.
Чреспищеводная эхо-КГ предпочтительна там, где важны улучшенная видимость и тонкие детали, например при распознавании тромбов в левом предсердии или вегетаций на клапанах при бактериальном эндокардите, и обеспечивает более точные расчеты объемов левого желудочка и фракции выброса. Визуализация сердца – одна из наиболее перспективных областей применения трехмерной эхо-КГ, которая должна облегчить понимание динамической морфологии сердца и уточнить объемные измерения.
Выявляемые при эхо-КГ морфологические изменения клапанов и нарушения кровотока удостоверяют диагноз клапанного порока, дают возможность определить на основании вторичных (косвенных) симптомов его гемодинамическое значение и оценить количественно тяжесть стеноза (расчет площади отверстий) и регургитации. Большие дефекты межпредсердной и межжелудочковой перегородки прямо визуализируются при эхо-КГ, с уменьшением объема шунтирования возрастает роль допплерографии. Для визуализации низкоскоростных потоков через шунты используют внутривенное контрастирование эховистом или перекисью водорода: выявляется сброс справа налево (иногда и слева направо). Благодаря перечисленным возможностям эхо-КГ вместе с допплерографией и РИ нередко позволяет обойтись без ангиокардиографии. Она играет главную роль в отборе больных для кардиохирургических вмешательств по поводу клапанных пороков и врожденных заболеваний сердца и в визуализации протезов клапанов.
Этим методом также определяют снижение сократимости миокарда в участках преходящей ишемии, инфаркта миокарда, постинфарктных рубцов и аневризм или гибернирующего миокарда и подтверждают диагноз стенокардии (во время приступа) или инфаркта миокарда. В период между приступами с этой целью прибегают к стресс-эхо-КГ с провокацией повышенной нагрузкой (например посредством велоэргометрии или добутаминовой пробы), которая дешевле и безопаснее, чем перфузионная сцинтиграфия с нагрузкой. Однако обратимые нарушения сократимости миокарда определяются только у 2/3 пациентов с обратимыми дефектами перфузии. Новые эхо-контрастные средства, по-видимому, предоставят возможность эхокардиографических исследований перфузии миокарда. С помощью эхо-КГ распознаются также осложнения инфаркта миокарда, а после лечебных вмешательств оценивается эффективность реперфузии.
Эффективный метод выявления нарушений перфузии миокарда в зонах, кровоснабжаемых стенозированными коронарными артериями, определения лечебной тактики и прогноза – сцинтиграфия с 201ТI. Нарушения перфузии отображаются в виде «холодных» очагов на фоне накопления РФП миокардом уже через 5-10 мин. Подтверждая ишемическую природу болей в грудной клетке и других симптомов, метод так же, как эхо-КГ, неинформативен в диагностике ИБС вне ишемических приступов. В качестве скринингового метода используют сцинтиграфию с провокацией ишемии повышенной функциональной нагрузкой на миокард. Посредством фармакопробы с дипиридамолом определяют отставание обусловленного нагрузкой роста перфузии миокарда в зонах коронаростеноза по сравнению с нормально кровоснабжаемым миокардом.
Уже с первых часов можно подтвердить или исключить диагноз инфаркта миокарда, локализовать его и определить размеры «горячего» очага с помощью сцинтиграфии с меченными 99mТс пирофосфатом и сестамиби; однако между введением РФП и получением изображений проходит не менее 12 ч. Поэтому в повседневной практике используется эхо-КГ, которая доступнее и может быть выполнена у постели больного.
Ангиокардиография – визуализация камер сердца посредством серийной рентгеновской съемки или рентгенокинематографии после заполнения их КС – неразрывно связана с его катетеризацией и применяется в специализированных хирургических учреждениях. Ангиокардиография остается золотым стандартом визуализации сердца, детально отображая морфологию сердечных камер и клапанов и движения последних, позволяя измерить функциональные параметры сердечной деятельности, визуализируя функциональные нарушения. Коронарная ангиография – окончательный метод выявления коронаростеноза, определения его локализации и степени тяжести у больных стенокардией или инфарктом миокарда.
Главные показания к ангиокардиографии: расхождения между результатами эхо-КГ и клиникой; некоторые пороки, например трехстворчатого клапана (рентгенодиагностика и эхокардиографическая оценка труднее, чем митрального, тогда как ангиокардиография информативна даже при ее выполнении на обычных рентгенодиагностических аппаратах и с внутривенным контрастированием); выяснение состояния коронарных артерий; распознавание сочетанных и многоклапанных, а также врожденных пороков сердца, при которых важен комплексный анализ клинических симптомов, результатов всех методов визуализации и измерения давления в полостях сердца.
Роль нативной КТ в диагностике болезней сердца ограничена главным образом уточнением обызвествлений в сердце и распознаванием болезней перикарда. При КТ с болюсным контрастированием дифференцированно отображаются полости сердца, сердечная мышца и клапаны. Применяется главным образом для распознавания морфологических изменений: аневризм сердца, тромбов в его полостях, пара– и интракардиальных опухолей размером не меньше 1 см, аномалий развития крупных сосудов и аневризм аорты. КТ и МРТ приобретают дополнительные возможности при использовании новых томографов с высоким быстродействием, которое важно при визуализации сердца, как ни в какой другой области. Важное применение скоростной КТ при скрининге ИБС – выявление обызвествлений коронарных артерий как признака их атеросклероза. Для подсчета индекса коронарной кальцификации, позволяющего с большой вероятностью отвергнуть тяжелый коронаростеноз и, по-видимому, выделить группы высокого риска, наиболее пригодны многослойная и электронно-лучевая КТ. Скоростная КТ в режиме кино также может предоставить информацию о быстротекущих гемодинамических процессах, включая оценку систолической функции и перфузии миокарда.
Из всех альтернатив эхо-КГ только МРТ лишена радиационной вредности и не требует введения в организм йодсодержащих КС или РФП, отображая кровоток в полостях сердца без искусственного контрастирования и в любой плоскости. Поэтому МРТ претендует на роль метода визуализации сердца второй очереди. Обычная МРТ, помимо показаний общих с КТ, полезна в диагностике врожденных пороков сердца, позволяет лучше, чем эхо-КГ, оценить морфологию и функцию правого желудочка и используется в ограниченном объеме при инфарктах миокарда для определения размеров зоны инфаркта и в диагностике его осложнений (отличительное распознавание истинных аневризм от ложных, тромбов в полостях сердца от опухолей и острого тромбоза от хронического).
При МРТ возможно получение изображения всего сердца, слой за слоем, в одной и той же фазе сердечного цикла; либо одного и того же слоя в последовательные фазы сердечного цикла с выведением на экран в режиме кино, что дает возможность рассчитать параметры систолической функции более точно, чем при эхо-КГ.
Появление новых томографов высокого класса, обеспечивающих изображение за дыхательную паузу, повысило точность всех измерений при МРТ и открыло новые возможности, обеспечив всестороннюю оценку морфологии и функции сердца за одно исследование. Однако применение высокоскоростных КТ и МРТ в практике ограничено из-за их высокой стоимости. Они неприменимы, в отличие от эхо-КГ, у постели больного и в кабинетах кардиологов, а МРТ непригодна для исследования тяжело больных из-за того, что в магнитном поле нарушается функционирование систем жизнеобеспечения. Эти ограничения часто определяют выбор метода изображения в кардиологии в пользу эхо-КГ.
Для морфологической оценки проксимальных отделов коронарных артерий используются малоинвазивные КТА и КМРА. Хотя они пока не заменяют коронарографию, чувствительность многослойной КТА в определении гемодинамически значимого коронаростеноза достигает 89 %, специфичность – 91 %. Оба метода перспективны как скрининговые у пациентов с болями в грудной клетке, для мониторинга прогрессирования ИБС при установленном диагнозе и для выбора метода лечения. Посредством МРА можно измерять коронарный кровоток и его резерв.
Последние достижения МРТ, реализованные в новых томографах, обеспечивают широкий диапазон возможностей при ИБС и инфаркте миокарда: исследования сократительной функции миокарда, после внутривенного контрастирования – его перфузии, функциональную оценку коронарного кровотока с дипиридамоловой пробой, определение жизнеспособности миокарда.
Болезни желудочно-кишечного тракта и брюшной полости. Контрастное РИ с взвесью сульфата бария незаменимо как метод визуализации, отображая деформацию органов, патологические образования, выступающие в их просвет, и изъязвления вплоть до тонких деталей его внутренней поверхности; ригидность их стенок за счет опухолевой инфильтрации. В диагностике морфологических изменений желудка и толстой кишки наиболее информативно РИ с двойным контрастированием (барием и воздухом). В ряде отношений (непосредственный осмотр глазом внутренней поверхности органов желудочно-кишечного тракта с распознаванием мелких и поверхностных изменений слизистой оболочки: мелких полипов, поверхностных изъязвлений, ограниченных плоских инфильтраций, а также возможность взять биопсию) эндоскопия превосходит РИ. Эндоскопия в целом эффективнее в диагностике воспалительных изменений слизистой оболочки, язвенной болезни желудка и двенадцатиперстной кишки и ранних форм рака. Зато она уступает РИ в распознавании подслизистых инфильтраций стенок (отличить их от рубцовых и спастических изменений при РИ помогают фармакологические пробы, стимулирующие перистальтику, например с морфином), и функциональных изменений, особенно нарушений моторики пищевода и причин дисфагии (с этой целью применяют РИ только с сульфатом бария) и в некоторых других случаях. Для анализа быстротекущей ротоглоточной фазы глотания оптимальны, но малодоступны видеозапись на магнитную пленку или рентгенокинематография акта глотания. Сцинтиграфия после введения внутрь меченой коллоидной серы более чувствительна, чем РИ, при распознавании гастроэзофагеального рефлюкса.
УЗИ и КТ прямо отображают опухолевое или воспалительное утолщение стенки желудка (кишки), а эндоскопическое УЗИ – даже дифференцировку ее на анатомические слои. Этими методами визуализируются также экстрагастральный (экстраинтестинальный) компонент рака, неэпителиальных опухолей и лимфом, инфильтраты и свищи, например при болезни Крона, перидивертикулярные абсцессы при дивертикулите толстой кишки, вовлечение в процесс лимфатических узлов при злокачественных опухолях и ряде воспалительных заболеваний кишки. В то же время послойные методы не решают главной задачи – распознавания ранних форм рака. Выбор эндоскопии или контрастного РИ, а при необходимости их сочетание с УЗИ и КТ в соответствии с указанными возможностями этих методов – залог эффективной и рентабельной диагностики болезней желудочно-кишечного тракта.
Контрастное РИ – ведущий метод диагностики болезней тонкой кишки. Обычное прослеживание пассажа взвести сульфата бария по тонкой кишке недостаточно информативно. В последние годы разработаны новые методики. При специальном РИ тонкой кишки после приема внутрь разведенного бария поддерживается его непрерывная эвакуация из желудка с помощью фармакологических средств, ускоряющих пассаж по кишечнику. Наиболее информативна энтероклизма – введение контрастного вещества непосредственно в тонкую кишку через кишечный зонд в целях максимального растяжения кишки, что создает оптимальные условия изучения слизистой оболочки (инвазивный метод).
Основной метод визуализации толстой кишки – контрастная клизма, которая вследствие высокой лучевой нагрузки должна проводиться по обоснованным показаниям, особенно у лиц детородного возраста, так как в сферу прямого действия рентгеновского излучения попадают половые органы. Контрастную клизму с двойным контрастированием (условие эффективности последнего – хорошо очищенная кишка) используют наряду с эндоскопией как метод скрининга и диагностики опухолей. Для скрининга перспективна также виртуальная колоноскопия.
При хронических запорах с помощью контрастной клизмы исключают стенозирующие поражения и мегаколон, а РИ с приемом бария внутрь позволяет оценить пассаж бария по кишечнику. Для аноректальной визуализации используется эвакуационная проктография – контрастное РИ анального канала в положении сидя с функциональными пробами (чиханье, натуживание без дефекации и в процессе дефекации), требующее специального оборудования. Посредством радионуклидного теста с мечеными микросферами можно измерить сегментарный пассаж по кишечнику, а с помощью радионуклидной проктографии провести количественные измерения эффективности эвакуации из прямой кишки.
УЗИ превосходит РИ в распознавании жидкости в брюшной полости. Его предпочтительно использовать как первичный метод при подозрении на ряд острых заболеваний: аппендицит, холецистит, панкреатит, внутрибрюшные абсцессы; оно может дополнять РИ в диагностике тонкокишечной непроходимости. Однако возможности УЗИ часто ограничивает газ, скапливающийся в кишечнике вследствие его пареза.
КТ может дополнять рентгенографию в распознавании язвенных перфораций даже в отсутствие свободного газа и в 3/4 случаев позволяет установить причину неязвенных перфораций. С помощью КТ распознаются свежие внутрибрюшные кровоизлияния, ее рекомендуют как первичный метод визуализации при травме брюшной полости. Она чувствительнее для выявления мочевых камней, превосходит УЗИ в диагностике острого аппендицита, панкреатита, показана при осложнениях острого холецистита (перфорация стенки пузыря, пенетрация камня в соседние полые органы или вклинение в шейке пузыря), если УЗИ недостаточно информативно. Чувствительность КТ при внутрибрюшных абсцессах близка к 100 % (на 10 % выше, чем УЗИ). КТ позволяет лучше других методов установить их множественность, локализовать их и наметить наиболее безопасный путь иглы для чрескожного дренирования, а также нередко определить причину абсцесса (аппендицит, дивертикулит и др). КТ помогает распознать рентгенонегативную кишечную непроходимость, показана для быстрой уточненной диагностики при нарастающей клинике тонкокишечной непроходимости и является лучшим методом определения ее причины.
При кровотечениях из верхнего отдела желудочно-кишечного тракта ведущая роль принадлежит эндоскопии. Ангиографию применяют гораздо реже, главным образом в случаях кровотечений из варикозно расширенных вен пищевода и желудка. При локализации источника кровотечения ниже трейтцевой связки ангиография является ведущим методом диагностики и остановки кровотечения (при негативных данных контрастной клизмы). У больных с необильными и рецивирующими кровотечениями в качестве предварительного метода подтверждения текущего кровотечения и локализации его источника полезна сцинтиграфия с коллоидной серой или более чувствительная и позволяющая выявлять также перемежающиеся кровотечения – с мечеными эритроцитами.
При клиническом подозрении на инородные тела брюшной полости и отрицательных (сомнительных) результатах рентгенографии показаны УЗИ и КТ. Методы распознавания наружных свищей: фистулография (КТ-фистулография), внутренних – УЗИ, РКИ полых органов, КТ с контрастированием просвета полых органов водорастворимыми КС, МРТ, кисто– или абсцессография (РИ с инъекцией КС в патологическую полость после ее дренирования).
УЗИ является первичным и чаще всего единственным методом визуализации при болезнях желчного пузыря, особенно камнях (точность их распознавания 95–98 %), и первичным – при механической желтухе. Холесцинтиграфия с холетропными РФП (броммезида или ХИДА), позволяющая изучать динамику оттока желчи (замедление при обструкции желчных путей, незаполнение желчного пузыря вследствие обструкции пузырного протока, утечку желчи), высоко чувствительна при остром холецистите (90 %), но недостаточно специфична. Возможности УЗИ при хроническом холецистите ограничены, наиболее показательна картина сморщенного пузыря с заполнением его камнями. КТ используют при осложнениях острого холецистита и в диагностике рака желчного пузыря (точность достигает 90 %), хотя картина более ранних форм рака неспецифична.
КТ чувствительнее, чем УЗИ, при обструкции желчных путей и точнее в определении ее уровня. Однако причина обструкции распознается не всегда. Детали морфологии нередко лучше отображается благодаря инвазивным эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) и чрескожной чреспеченочной холангиографии. Перспективна магнитнорезонансная холангиопанкреатография (МРХПГ), отображающая желчное дерево и панкреатический проток без контрастирования (чувствительность и специфичность при холелитиазе превышает 90 %). Эти методы также помогают выбрать способ дренирования (чреспеченочный или через общий желчный проток) и предоставляет информацию о состоянии панкреатических протоков.
Эхографией чаще всего ограничивается визуализация при диффузных поражениях паренхиматозных органов брюшной полости. Ее используют как начальный метод при очаговых поражениях, позволяющий выявить более 2/3 патологических очагов в печени и отличить солидные очаги от кист и фокального жирового гепатоза. При хроническом панкреатите этот метод превосходит КТ в определении калибра панкреатического протока и отображает псевдокисты. Визуализируется большинство опухолей головки поджелудочной железы. Распознаются неорганные опухоли брюшной полости, в том числе диссеминации опухолей по брюшине, особенно у худых больных и при осложнении асцитом (в остальных случаях предпочтительнее КТ).
КТ с контрастированием вручную нередко недостаточно чувствительна для обнаружения очаговых поражений паренхиматозных органов. Она превосходит УЗИ при опухолях тела и хвоста поджелудочной железы и специфичнее, чем УЗИ, при гемангиомах печени. При КТ не обнаруживаются очаговые поражения печени размером меньше 1 см и большинство их размером 1–2 см, тогда как при УЗИ визуализируются некоторые очаги размерами 2–3 мм. При спиральной КТ в венозной фазе болюсного контрастирования распознается 90 % очагов размером более 1 см и 50 % очагов меньше 1 см, а в артериальной фазе дополнительно выявляются гиперваскулярные метастазы ряда опухолей в печень и опухоли поджелудочной железы размером 1–2 см. С этим методом сравнима по чувствительности МРТ с внутривенным контрастированием на томографах высокого класса. Общая чувствительность этих двух методов в распознавании метастазов рака в печень 80–85 %. Специфические для печени МР-контрастные средства на основе ферритов обещают еще улучшить выявление очаговых изменений в печени. Динамическая КТ с контрастированием и МРТ демонстрируют ряд характерных особенностей, отличающих гепатому от гиперваскулярных доброкачественных образований печени. Диагноз крупных гепатом устанавливается с большой вероятностью при УЗИ и КТ, а при размерах меньше 2 см и в целях дифференцирования от узлов регенераторной гиперплазии и предраковых аденоматозных узелков в цирротической печени используется МРТ с контрастированием.
МРТ является альтернативой КТ в распознавании острого панкреатита, а динамическая МРТ с контрастированием конкурирует с КТ в диагностике опухолей поджелудочной железы, включая их дифференциальную диагностику с опухолевидным панкреатитом. При использовании КТ и МРТ с контрастированием, дополненных КТА, МРА, ЭРХПГ и МРХПГ, точность распознавания рака поджелудочной железы, определения его стадии и резектабельности приблизилась к 100 %.
УЗИ и стандартная КТ позволяют визуализировать эндокринные опухоли поджелудочной железы размером больше 2 см. Наилучшие результаты при распознавании инсулом (обычно меньше 2 см) среди неинвазивных методов обеспечивают спиральная КТ и особенно скоростная динамическая МРТ с контрастированием (обе с болюсным контрастированием в артериальной фазе).
Болезни мочевой системы, органов забрюшинного пространства, малого таза и яичек. Обзорная рентгенография используется главным образом для выявления камней в мочевых путях. УЗИ демонстрирует большинство камней в чашечно-лоханочной системе (ЧЛС) и мочевом пузыре (в мочеточниках – только в случае их расширения) и дополняет РИ, визуализируя рентгенонегативные (уратные и др.) камни ЧЛС размером от 4 мм. Этим методом выявляется расширение ЧЛС, можно оценить его степень, однако заподозренная при УЗИ обструктивная уропатия требует подтверждения, а причина обструкции обнаруживается только в 50 % случаев. В случае немой почки УЗИ используют для подтверждения обструкции верхних мочевых путей.
Экскреторная урография обладает рядом преимуществ перед другими методами визуализации мочевой системы: обзор всего мочевого тракта, включая мочеточники и мочевой пузырь; возможность оценить выделительную функцию почек; распознавание мочевых камней, не выявляющихся при УЗИ, особенно в мочеточниках; подтверждение или исключение обструкции, в том числе в случае обнаруженного при УЗИ расширения ЧЛС; определение уровня обструкции; уточненная характеристика ЧЛС, особенно при папиллярном некрозе, туберкулезе, небольших папиллярных опухолях лоханки.
При сниженной выделительной функции почек используют фармакоурографию с лазиксом, фармко-УЗИ, инфузионную экскреторную урографию (ЭУ). В будущем место ЭУ, очевидно, займет полностью безопасная (без контрастирования и использования ионизирующего излучения) магнитнорезонансная урография. Допплерография помогает распознать обструкцию мочевых путей независимо от функции почек и отличить обструктивную дилатацию ЧЛС от функциональной.
Главные показания к прямой пиелографии – детальная характеристика ЧЛС и выяснение состояния мочеточника ниже окклюзии при немой почке, если этот отдел плохо контрастируется при ЭУ (важно при заболеваниях с тенденцией к множественным поражениям мочевой системы). Ретроградную пиелографию в большинстве случаев заменила КТ, тогда как антеградную, с введением контрастного вещества непосредственно в лоханку, используют шире, когда по тем или иным показаниям производится пункция ЧЛС или наложена нефростома. Визуализация помогает выбрать вид лечения уролитиаза в зависимости от вида камней, оценить его эффект и осложнения.
Динамическая нефросцинтиграфия (ДНС) более чувствительна, чем ЭУ, к снижению функции почек и обепечивает ее количественную оценку. Объединяет в себе исследование перфузии в ранние сроки после введения РФП, позже – клубочковой фильтрации и, наконец, оттока мочи из ЧЛС. ДНС позволяет распознать обструктивный тип поражения в случае выявленной при ЭУ «немой» почки и с РФП, меченным 99mТс (пентатек), изучать функцию почек у больных в тех случаях, когда высок риск осложнений при введении йодсодержащих КС и РФП. Посредством ДНС оценивается степень утраты функции почки при различных патологических изменениях, что помогает определить объем и характер операции.
КТ наиболее чувствительна при выявлении мочевых камней, даже если они не содержат солей кальция. Она помогает установить уровень обструкции мочевых путей при неинформативности других методов, в том числе при немой почке, и в 2/3 случаев – ее причину даже без внутривенного контрастирования (ценно у больных с повышенным риском введения йодсодержащих КС). Дополненная контрастированием КТ облегчает оценку ЧЛС, показывая ее слабое контрастирование в случае «немой» почки.
УЗИ является первичным методом визуализации объемных образований почек и единственно необходимым при типичной ультразвуковой картине кисты почки. Оно позволяет выявить солидные образования размером от 1 см. Определению злокачественности может способствовать ЦДК (ЭДК), особенно с эхо-КС, демонстрируя неопластическую васкуляризацию с патологическим кровотоком. Однако всеми методами визуализации трудно дифференцировать доброкачественные и злокачественные опухоли размером до 3 см, за исключением ангиомиолипом, которые дают специфичную картину при КТ и МРТ. КТ с контрастированием чувствительнее, чем УЗИ, в диагностике абсцессов почек, специфичнее в их отличительном распознавании от опухолей и лучше показывает экстраренальное распространение процесса. Она позволяет выяснить природу большинства атипичных кистозных образований и точнее в распознавании рака почки, чем УЗИ. Возможности УЗИ и КТ без контрастирования сближаются.
Современную МРТ считают самым точным и чувствительным методом диагностики рака почки. При МРТ с контрастированием визуализируются маленькие опухоли, не выявляющиеся при КТ, и уточняется природа большинства атипичных кистозных образований, оставшаяся неопределенной после УЗИ и КТ. Визуализация опухолевых тромбов в почечной и нижней полой венах при КТ требует болюсного контрастирования. Нативная МРТ не менее точна в их распознавании, чем АГ, и уточняет уровень их распространения по венам.
Диффузные заболевания почек, первично поражающие паренхиму почек и мезангиум, сходны в диагностических изображениях. Главная задача визуализации – исключить обструкцию мочевых путей. Ориентироваться в характере почечной патологии можно по результатам ДНС с РФП, меченными 99mТс. Отдельные формы проявляются более или менее характерной картиной при УЗИ (острый тубулярный некроз), на рентгенограммах и при КТ (медуллярная губчатая почка, нефрокальциноз) или при ЭУ (папиллярный некроз). При инфаркте почки ДНС и допплерография подтверждают отсутствие (снижение) кровотока в почке, ЦДК показывает место артериальной окклюзии. При сегментарных инфарктах используют КТ в сочетании с ЦДК. При остром тромбозе почечных вен с помощью дуплекс– или триплекс-УЗИ выявляют отсутствие венозного кровотока в вене и в паренхиме почки. Для скрининга реноваскулярной гипертензии используют нефросцинтиграфию с катоприловой (эналаприловой) пробой, УЗИ с ЦДК, КТА, МРА, а как окончательный метод – АГ.
При опухолях и воспалительных заболеваниях забрюшинного пространства часто информативно УЗИ, которое могут дополнять КТ и МРТ.
КТ гораздо точнее УЗИ при опухолях надпочечников, позволяя подтвердить или отвергнуть диагноз, но неспецифична для отдельных форм гормонально-активных аденом. Для поисков экстраадреналовых или множественных и метастазирующих гормонально-активных опухолей применяют сцинтиграфию с меченными радионуклидами йода метилгуанидином (при феохромоцитомах) или холестеролом (при альдостеромах). При КТ визуализируются также гормонально-неактивные аденомы – так называемые инсиденталомы. В их дифференциальной диагностике от метастазов рака в надпочечники более специфична МРТ. Визуализация малоинформативна в распознавании гиперплазии надпочечников.
Как скрининговый метод при заболеваниях органов малого таза применяют трансабдоминальное УЗИ, обеспечивающее полный обзор таза. Определяются камни и опухоли мочевого пузыря, остаточная моча и др., визуализируются мочеиспускательный канал, предстательная железа и др. Более чувствительный метод при раке мочевого пузыря – трансуретральное УЗИ. При гинекологических заболеваниях оптимально сочетание трансабдоминального и трансвагинального УЗИ, обеспечивающего их более детальную характеристику. ЦДК помогает распознать перекрут яичника, отличить кисты от кистозных опухолей и оценить вероятность их злокачественности, показывает гиперемию при воспалительных заболеваниях женских гениталий. Для уточнения причин бесплодия и при некоторых аномалиях развития матки применяют метросальпингографию. Ультразвуковая метросальпингография с введением в полость матки 10 %-ного раствора глюкозы или эховиста не менее точна, чем рентгеновская, в распознавании изменений эндометрия и маточных труб, минимально инвазивна и безопасна. В перспективе преимущества трехмерного УЗИ – изображения в плоскостях, недоступных при обычном УЗИ, точность измерений и экономическая выгода по сравнению с МРТ – могут сделать его золотым стандартом визуализации женских половых органов.
Главная задача послойных методов визуализации при опухолях прямой кишки, мочевого пузыря, шейки матки, доступных прямому осмотру, – определение стадии рака для выбора метода лечения, хирургической тактики и зоны облучения. Установить глубину прорастания стенки и начального распространения на прилежащие ткани рака мочевого пузыря и прямой кишки позволяют трансуретральное и трансректальное УЗИ; последнее дает возможность также выбрать мишени для биопсии при подозрении на рак предстательной железы; при отрицательных результатах у больных с высоким риском рака его дополняют трансректальным УЗИ с ЦДК. УЗИ, предпочтительно в режиме повышенной частоты, – первичный и в большинстве случаев единственно необходимый метод визуализации яичек.
Методом второго выбора после УЗИ при болезнях органов малого таза является МРТ. Лучше, чем при КТ, отображаются стенки мочевого пузыря и прямой кишки, дифференцируются слои тела матки, легче отличать увеличенные лимфатические узлы таза от поперечных сечений сосудов. МРТ специфичнее других методов при миомах матки и эквивалентна трансвагинальному УЗИ в определении распространенности рака эндометрия в пределах органа. МРТ с высоким разрешением и эндоректальную МРТ используют как дополнение внутриполостного УЗИ при опухолях полых органов и у пациентов с высоким риском рака предстательной железы. МРТ – оптимальный метод оценки распространенности инвазивных опухолей органов малого таза. При ее недоступности с этой целью прибегают к КТ, предпочтительно спиральной с болюсным контрастированием.
МРТ также наиболее информативна в распознавании патологических изменений придатков, особенно эндометриом. В диагностике дермоидных кист яичников более специфична КТ. КТ и МРТ (обе с контрастированием) точнее УЗИ в дифференциальной диагностике и определении стадии опухолей яичника. МРТ дополняет УЗИ в визуализации яичек, особенно при опухолях.
В комплексной диагностике заболеваний молочной железы ведущим методом является маммография, выполняемая на специальных аппаратах и обладающая широким спектром возможностей, в том числе визуализацией непальпируемых образований. На основе маммографии осуществляются неинвазивные и инвазивные методики: пневмокистография, дуктография, контролируемая диагностическая пункция солидных образований и кист, предоперационная внутритканевая маркировка непальпируемых образований. Однако метод связан с лучевой нагрузкой, что особенно следует учитывать при многократных исследованиях, а также при обследовании молодых женщин.
Радиационно безопасное УЗИ показано как дополнительный метод визуализации молочной железы у беременных и лактируютцих женщин, с профилактической целью – у женщин в возрасте до 30 лет; для дифференциальной диагностики между солидными и полостными образованиями, прослеживания воспалительных процессов в динамике и оценки подмышечных лимфатических узлов, для контролируемой пункции визуализируемых образований. В то же время УЗИ малоинформативно при жировой инволюции железы и не всегда позволяет визуализировать непальпируемый рак, что ограничивает его возможности как метода скрининга и диагностики заболеваний молочной железы. При сомнительных результатах рентгенографии, УЗИ в В-режиме и пункции и при расхождениях между этими методами используют УЗИ с ЦДК. Возможности УЗИ возрастают при использовании повышенного разрешения и ЦДК с эхо-КС.
МРТ позволяет выявлять различные заболевания, в том числе и непальпируемые образования в железе. МРТ с контрастированием чувствительнее маммографии при мультицентрическом раке, демонстрируя до 80 % неопластических фокусов. Динамическую МРТ с контрастированием используют как дополнительный метод для дифференциальной диагностики между доброкачественными и злокачественными опухолями в случаях, остающихся сомнительными после применения других методов. Однако место МРТ в комплексе методов исследования молочной железы окончательно еще не определено. МРТ, как и УЗИ, не отменяет необходимости маммографии.
С пневмокистографией как диагностическим и лечебным методом конкурирует УЗИ. Дуктография – искусственное контрастирование млечных протоков – показана при выделениях из соска, особенно кровянистого и серозного характера, и является основным методом диагностики внутрипротоковых изменений (точность определения причин патологической секреции 96 %). Однако она противопоказана при острых воспалительных процессах и в случае несомненного рака в силу опасности миграции опухолевых клеток по системе протоков.
Головной мозг. Рентгенография черепа малоинформативна, позволяя лишь иногда выявлять косвенные симптомы болезней головного мозга. При транскраниальном УЗИ с наиболее распространенным трансорбитальным доступом (через верхнюю глазничную щель) определяется только смещение срединных структур. Посредством транскраниального дуплекс-УЗИ распознаются поверхностно расположенные очаговые интракраниальные поражения, в режиме ЦДК визуализируются патологические изменения крупных базальных сосудов. Этот метод используется как ориентирующий при недоступности КТ и МРТ или дополняет их в оценке интракраниального кровотока. Особенно перспективно применение при этом эхо-КС. Сосудистую природу церебральной симптоматики можно подтвердить посредством допплерографии сонных и позвоночных артерий.
Как методы первичной и чаще всего окончательной визуализации используют КТ и МРТ. КТ предпочтительнее МРТ при острой черепномозговой травме и при внутричерепных кровоизлияниях различной природы вследствие более специфичного отображения острых кровоизлияний. В остальных случаях информативнее МРТ, особенно при очаговых поражениях задней черепной ямы, срединных структур, включая область турецкого седла, а также субкортикальных очагах. Наиболее чувствительна при опухолях головного мозга, особенно метастатических, МРТ с контрастированием. Однако при КТ с контрастированием также распознается до 95 % опухолей мозга, а в некоторых случаях, например при менингиомах, она специфичнее МРТ за счет выявления обызвествлений и реактивных костных изменений. Макроаденомы гипофиза хорошо выявляются как при КТ, так и при МРТ. Диагностика микроаденом гораздо труднее и часто требует динамической КТ и МРТ с контрастированием.
КТ является методом выбора при острых нарушениях мозгового кровообращения, демонстрируя внутричерепные гематомы при геморрагических инсультах, субарахноидальные кровоизлияния в 1–3 сутки, например при разрывах артериальных аневризм, и позволяя заподозрить ишемический инфаркт мозга в 50 % случаев с первых часов. Однако при ишемических инфарктах предпочтительнее МРТ. Еще недоступные у нас специальные техники МРТ (с диффузионным взвешиванием, перфузионная) отображают ишемические повреждения мозга в обратимой стадии, позволяют отличить их от необратимых и проследить их обратное развитие. МРА может демонстрировать эмбол, но в случае планируемой эмболэктомии и тромболиза показана ангиография. Важную роль КТ и МРТ играют в дифференциальной диагностике между острыми нарушениями мозгового кровообращения, опухолями мозга и хроническими субдуральными гематомами. КТ предваряет ангиографию при подозрении на разрыв артериальной аневризмы, отображая субарахноидальные и паренхиматозные кровоизлияния. Только более крупные аневризмы визуализируются посредством КТ и МРТ. Для диагностики аневризм размером 3–5 мм могут использоваться КТА и МРА. КТ и МРТ позволяют распознать артериовенозные мальформации, в случае хирургического лечения необходима ангиография. МРТ является наиболее надежным методом диагностики кавернозных ангиом.
МРТ более информативна, чем КТ, в диагностике энцефалитов, рассеянного склероза и других демиелинизирующих процессов. Для распознавания абсцессов мозга КТ дополняют внутривенным контрастированием. МРТ несколько более специфична, однако для диагноза асбцесса важны клинические данные и результаты исследования цереброспинальной жидкости. При ликворее используют КТ-цистернографию или неинвазивную МР-цистернографию.
КТ и МРТ объективизируют диагноз гидроцефалии и способствуют разграничению ее различных форм, позволяют распознать окклюзионную гидроцефалию, определить уровень окклюзии и стеноза в желудочковой системе и их причину. Локальные поражения головного мозга как причина эпилепсии обнаруживаются при КТ в 15–20 % случаев. Главное ее преимущество – выявление обызвествлений. МРТ чувствительнее КТ в распознавании склероза аммонова рога (эпилепсия височной доли) и является единственным методом визуализации корковых дисплазий. В 5-15 % случаев причина эпилепсии остается невыясненной и после МРТ. При планируемой операции по поводу височной эпилепсии с помощью МРТ определяют сторону поражения у 80 % больных.
Гораздо меньше роль диагностических изображений при дегенеративных и метаболических заболеваниях головного мозга. КТ и МРТ показывают в основном атрофию ткани мозга. Главная задача – исключить курабельные заболевания: опухоль мозга, хроническую гематому, окклюзионную гидроцефалию и др. МРТ и здесь более информативна, чем КТ. МРТ и исследования перфузии послужили опорой в диагностике болезни Альцгеймера. МРТ помогает отличить от нее деменции сосудистой природы. Изменения MP-сигнала базальных ганглиев, выявляемые при ряде первичных дистрофических заболеваний глубокого серого вещества, недостаточно специфичны. Изображения используют, чтобы подтвердить клинический диагноз, исключить симптоматические формы (например, симптоматический синдром Паркинсона при ишемии, опухолях), сопутствующие и неподозреваемые нарушения. С помощью КТ исключают обызвествления базальных ганглиев.
Все шире применяются в диагностике этой группы заболеваний головного мозга метаболические изображения. Например, ПЭТ обещает возможность диагностики болезни Альцгеймера в доклинической стадии. При паркинсонизме высоко чувствительна радионуклидная визуализация с меченным 123I допосканом, который связывается с допаминергическими нервными окончаниями. Функциональную МРТ головного мозга, позволяющую точно локализовать в нем центры различных видов активности, применяют для определения объема резекции мозговой ткани.
Голова и шея. Роль визуализации заключается главным образом в оценке глубоких тканей и полостей, недоступных непосредственному осмотру, эндоскопии и пальпации, а также «слепых пятен» на поверхности слизистой оболочки (носоглотка, грушевидные синусы, корень языка). Рентгенография и обычная томография отображают более грубые костные изменения, обызвествления, замещение воздуха в полостях экссудатом и патологическими тканями, деформацию полостей мягкотканным патологическим образованием. Для выбора хирургического или лучевого лечения, планирования их объема, определения резектабельности опухоли, выбора хирургического доступа к ней, оценки ее кровоснабжения и т. д. необходима детальная визуализация с помощью КТ и МРТ.
КТ – метод второй очереди при неопухолевых заболеваниях околоносовых пазух, воспалениях, травме и пороках развития пирамид височной кости, абсцессах шеи и первичный метод при травме и опухолях гортани. Показана в диагностике агрессивных острых синуситов, распространяющихся за пределы пазух, для уточненной характеристики путей аэрации и дренажа при хронических синуситах перед реконструктивными операциями. Поражения костного лабиринта, холестеатомы и их осложнения, отосклероз хорошо отображаются посредством КТ, тогда как для визуализации мембранозного лабиринта применяют МРТ, а внутриканальных неврином VIII нерва, невритов лицевого нерва и гломусных ангиом – МРТ с контрастированием.
При опухолях головы и шеи КТ отображает в большинстве случаев глубокую опухолевую инвазию, вовлечение в процесс костей основания черепа и интракраниальное распространение опухоли. МРТ, особенно с контрастированием, лучше отображает мягкотканные опухоли, особенно маленькие, прилежащие к основанию черепа, превосходит КТ в отображении глубокой инвазии; точнее показывает замещение костного мозга опухолью, прорастание соседних анатомических полостей и пространств, выясняет отношение опухоли к крупным сосудам и нервам. Посредством МРТ точнее визуализируется краниальное и каудальное распространение опухоли. Она предпочтительнее для выявления распространения опухолей и агрессивных воспалительных процессов на основание и в полость черепа и их интракраниальных осложнений. КТ и МРТ помогают установить, из каких анатомических структур исходит опухоль, ограничивая тем самым круг дифференциальной диагностики.
Ангиография показана главным образом в целях диагностики гломусных ангиом и предваряет предоперационную эмболизацию, уменьшающую кровотечения при операциях по поводу этих опухолей и особенно юношеских ангиофибром носоглотки. Выяснить отношение опухоли к сосудам помогают КТА или МРА.
С помощью УЗИ отображаются передние отделы полости глазницы и глазное яблоко и распознаются их поражения. При неинформативной офтальмоскопии УЗИ с ЦДК помогает дифференцировать отслойку сетчатки и субретинальные кровоизлияния от опухолей. КТ и МРТ дают возможность изучить все анатомические компоненты глазницы и существенно превосходят УЗИ в распознавании ретробульбарных поражений. УЗИ обычно достаточно для визуализации экстраокулярных мышц. КТ дополняет его в диагностике псевдоопухолей глазниц, является методом выбора при травме глазницы, предпочтительнее других методов в диагностике воспалительных процессов в ней и деструкции костных стенок. Посредством КТ распознается 95 % внутриглазничных опухолей. МРТ используют как первичный метод или в дополнение к КТ при визуализации опухолей глазного яблока, особенно небольших размеров, и меланом, при сосудистых поражениях глазниц, поражениях зрительного нерва, в том числе невритах. За МРТ остаются преимущества в диагностике внутричерепного распространения патологических процессов. Однако применять МРТ можно только после исключения металлических инородных тел глаза.
УЗИ – ведущий метод визуализации щитовидной железы, позволяющий быстрее и дешевле, чем сцинтиграфия, и без ионизирующего излучения определить наличие или отсутствие тиреоидной ткани и точно локализовать ее, подтвердить, что пальпируемое образование относится к щитовидной железе, точнее и объективнее, чем пальпация, определить размеры железы, выявить или исключить узлы в увеличенной железе, определить их количество, размеры и локализацию. УЗИ помогает отобрать подозрительные на озлокачествление узлы или участки узла для прицельной биопсии. При тиреоидитах УЗИ подтверждает увеличение размеров щитовидной железы и демонстрирует изменения структуры, характерные для обострений процесса. УЗИ принадлежит ведущая роль и в распознавании опухолей околощитовидных желез.
Сцинтиграфию с радионуклидами йода и 99mТс дополняют при выявлении нефункционирующих «холодных» узлов в железе исследованием с 201Тl для дифференциальной диагностики злокачественных узлов от доброкачественных и для поиска метастазов и рецидивов рака щитовидной железы В– и С-клеточного генеза, а также недифференцированного рака А-клеточного генеза.
Поверхностное расположение тканей шеи благоприятствует применению УЗИ в режиме повышенной частоты, которое в большинстве случаев является единственным методом визуализации этой области. УЗИ в этом режиме отображает шейные лимфатические узлы диаметром всего несколько миллиметров и помогает выбрать узлы для биопсии. Методом выбора при оценке шейных лимфатических узлов становится УЗИ с ЦДК, повышающей точность распознавания их метастатических поражений благодаря выявляемым признакам неопластического ангиогенеза. Ангиоархитектоника лимфатических узлов лучше отображается благодаря эхо-КС, особенно в сочетании с трехмерным сбором данных.
Костный скелет и спинной мозг. Принципы визуализации позвоночника не отличаются от остального костного скелета. КТ используется для оценки позвонков и каудальных поясничных межпозвоночных дисков на небольших отрезках позвоночника (3–4 вертебральных сегмента). МРТ свободна от таких ограничений и позволяет визуализировать любой отдел позвоночничка со всеми анатомическими элементами (позвоночный канал, дуральный мешок, субарахноидальное пространство, спинномозговые корешки и спинной мозг). Следует иметь в виду, что при МРТ часто выявляются маленькие гемангиомы позвонков, которые не имеют существенного клинического значения. Поскольку МРТ представляет собой единственный неинвазивный метод визуализации спинного мозга, при наличии соответствующей симптоматики ее следует применять первично. К миелографии прибегают главным образом при недоступности МРТ и иногда в дополнение к ней. Она обладает некоторыми преимуществами перед МРТ (отображение дуральных сращений, демонстрация сообщения полостей с субарах ноидальным пространством, визуализация корешковых субарахноидальных воронок и др.). Информативность миелографии повышается при сочетании ее с КТ (КТ-миелография), однако структуру спинного мозга отображает только МРТ.
Первичные методы визуализации костного скелета – рентгенография и остеосцинтиграфия с меченным 133Тс бифосфонатом. Последняя более чувствительна при многих патологических изменениях, особенно начинающихся с костного мозга, например остеомиелите в первые 2–3 нед, асептическом некрозе костей, позволяя обнаружить их раньше, чем рентгенография. Кроме того, предоставляя широкий обзор скелета, она предпочтительнее при его системных (например, метаболических) и множественных поражениях. В то же время позитивные результаты остеосцинтиграфии не всегда клинически значимы и часто требуют уточнения другими методами визуализации. Рентгенография при меньшей чувствительности более специфична, так как отображает, хотя и приближенно, макроморфологию патологических процессов в костях. Посредством этих двух методов можно обнаружить и оценить большинство заболеваний костного скелета.
КТ используют главным образом для уточнения природы уже обнаруженных или заподозренных патологических изменений, особенно при трудностях интерпретации рентгенологической картины. Она полезна для исключения или подтверждения злокачественных опухолей, а также при исследовании грудины, крестца, костей таза. Однако, демонстрируя скрытые на рентгенограммах патологические изменения, обусловленные убылью или приростом минерализованной костной ткани, КТ неэффективна в ранних стадиях ряда заболеваний, когда макроскопические изменения еще отсутствуют.
Отображая костную ткань хуже, чем КТ, МРТ высоко чувствительна к патологическим изменениям костного мозга. Поэтому посредством МРТ лучше, чем другими методами, распознаются метастатические поражения костей, асептические некрозы, остеомиелит начиная с первых дней заболевания, повреждения костей от статико-динамической перегрузки в рентгенонегативной стадии и др. Обнаруживается локальный отек костного мозга, например при ушибах. КТ и МРТ мало улучшают нозологическую диагностику опухолей костей. В то же время МРТ наиболее точна в определении распространенности злокачественных опухолей (как интра-, так и экстраоссально).
Для оценки степени потери костной ткани, особенно губчатой, и ее динамики используют измерения костной минеральной плотности – денситометрию, которая позволяет выделить группу лиц, особенно женщин, с низкой костной массой и риском переломов позвонков и шейки бедренной кости в инволютивном периоде (остеопороз). Чаще всего примененяют рентгеновскую денситометрию, хотя дешевле ультразвуковая. Для определения минеральной костной плотности тел позвонков используют также количественную компьютерную томографию. Однако надо иметь в виду, что результаты денситометрии неспецифичны и не позволяют отличить остеопороз от других метаболических заболеваний скелета или его поражений при генерализованной миеломе и диффузных метастазах.
Патология суставов. Комплекс первичных методов визуализации включает УЗИ, сцинтиграфию и рентгенографию. Сцинтиграфия значительно чувствительнее рентгенографии в распознавании острых и подострых артритов и полиартритов. С помощью УЗИ визуализируются утолщенная синовиальная оболочка и скопления жидкости внутри суставов и в синовиальных сумках, отображается большинство разрывов вращательной сухожильной манжетки плеча, выявляются суставные мыши в заворотах суставов и их сметцаемость в суставной полости. УЗИ – идеальный метод контроля при аспирации небольших суставных выпотов.
В ранней диагностике ревматоидного артрита УЗИ в режиме повышенной частоты превосходит рентгенографию, раньше визуализируя мягкотканные изменения и даже костные эрозии в мелких суставах. УЗИ с ЦДК (ЭДК) вносит вклад в оценку активности процесса. В развитой стадии болезни при УЗИ визуализируются паннус, выпот в суставах, тендовагинит и ревматоидные узелки. Важную роль УЗИ может играть в распознавании периферических тендинопатий при серонегативных спондилоартритах. Одно из преимуществ УЗИ перед рентгенографией при полиартритах – отсутствие накладываемых радиационной вредностью ограничений продолжительности исследований, частоты их повторений и количества визуализируемых суставов. Тем самым УЗИ становится скрининговым методом в ревматологической клинике. В то же время сакроилеиты и спондилоартриты распознаются в ранней стадии посредством сцинтиграфии или МРТ, позже – при рентгенографии.
Роль рентгенографии ограничивается главным образом визуализацией изменений суставных поверхностей костей. МРТ – единственный метод, отображающий все анатомические структуры суставов, часто незаменимый и существенно дополняющий артроскопию; особенно ценен при внутренних повреждениях коленного сустава и при некоторых поражениях плечевого сустава.
Инвазивный метод визуализации – артрография с введением в сустав йодсодержащего КС или воздуха позволяет оценить величину полости сустава, толщину суставных хрящей, распознать суставные мыши, синовиальный хондроматоз, разрывы сухожилий вращательной манжетки плеча и некоторых связок. Используется при неинформативности УЗИ, недоступности или неинформативности МРТ. Сочетание с КТ (КТ-артрография) обеспечивает более детальное изображение контрастируемых структур и в ряде случаев, например при передней нестабильности плечевого сустава, превосходит МРТ. Особенно показательна МРТ с парамагнитным контрастированием полости сустава (МР-артрография).
Патология мягких тканей опорно-двигательной системы. Информативность УЗИ, особенно с повышенной частотой, и экономичность в большинстве случаев оправдывают его применение как первичного метода визуализации, часто достаточного для получения необходимой диагностической информации. Прямо визуализируются повреждения мышц, сухожилий и части связок, можно дифференцировать частичные разрывы от полных. Выявляются прямые симптомы тендинопатий, например подошвенного апоневроза, косвенным признаком которой являются «пяточные шпоры». УЗИ с компрессией датчиком позволяет проводить дифференциальный диагноз тендинозом, пролиферативным и экссудативным тендовагинитом. Чувствительность функционального УЗИ при распознавании повреждений связок, например при нестабильности кистевого сустава, выше, чем функциональной рентгенографии. Распознается подколенная киста Бейкера, редко подозреваемая клинически, определяются симптомы ее разрыва.
УЗИ позволяет дифференцировать глубокие подкожные абсцессы от простого целлюлита и обеспечивает точное пред– и внутриоперационное распознавание рентгенонеконтрастных инородных тел в подкожной клетчатке конечностей. УЗИ является первичным методом визуализации пальпируемых опухолей мягких тканей и позволяет выявить также непальпируемые опухоли подкожной клетчатки, например метастазы. В связи с возможностями УЗИ сократилось применение мягкотканной рентгенографии, которая дополняет его при липомах и гемангиомах мягких тканей. Нередко полезна комбинация УЗИ, визуализирующего изменения мягких тканей, с рентгенографией, отображающей обызвествления в них, костные изменения и рентгеноконтрастные инородные тела. УЗИ используют в случае недоступности КТ и МРТ для визуализации вторичных изменений пароссальных мягких тканей при болезнях костей.
Возможности КТ ограничены главным образом распознаванием жидкостных образований, опухолей, особенно липом и липосарком, и уточнением вторичных костных изменений или обызвествлений. МРТ используется при недостаточной информативности УЗИ как метод второй очереди и показана во всех случаях опухолей мягких тканей кроме липом, так как она точнее УЗИ и КТ в определении их тканевого состава и распространенности. Дифференциальной диагностике доброкачественных и злокачественных опухолей способствуют динамическая МРТ с контрастированием и УЗИ с ЦДК.
Визуализация кровеносных сосудов. Ангиография (АГ) остается золотым стандартом ангиовизуализации. Водорастворимое КС вводят в артериальное русло путем прямой пункции артерий (сонной, бедренной) или чаще – через катетер, продвинутый после пункции артерии, обычно бедренной, в нужное место артериального русла под контролем рентгенотелевизионного просвечивания. Изображение регистрируют посредством серийной съемки, осуществляемой на ангиографических установках, или – при дигитальной субтракционной ангиографии (ДСА) – на экране монитора и в памяти компьютера.
АГ отображает артериальное русло вплоть до мелких сосудов, позволяет визуализировать быстротекущие процессы и выполнить вторым этапом лечебные вмешательства: ангиопластику, эмболизацию артерий и др. Ее применение ограничивают инвазивность и риск осложнений, высокая стоимость, значительная лучевая нагрузка и необходимость введения йодсодержащих КС, нередко в большом количестве, с опасностью токсических и аллергических реакций. ДСА, несколько уступая обычной АГ в отображении деталей, может выполняться с в/в введением КС, требует меньшего их количества и обеспечивает компьютерную обработку изображений, включая субтракцию – вычитание фона из картины контрастирования сосудов с устранением проекционного наложения плотных костных структур, например основания черепа.
Рентгенологическое исследование вен выполняют в венозной фазе АГ или – для некоторых областей венозной системы – путем введения контрастных средств в вены (вено– или флебография). Наиболее часто применяют восходящую флебографию нижних конечностей от уровня стоп до нижней полой вены, флебографию верхних конечностей для диагностики тромбоза и сдавления подмышечной и подключичной вен (обе можно выполнять на обычных рентгенодиагностических аппаратах с введением КС вручную), кавографию – контрастирование нижней полой вены через катетер с серийной съемкой.
С АГ конкурируют неинвазивные (малоинвазивные), лишенные ее недостатков методы: УЗИ с ЦДК и ЭДК; КТ с болюсным контрастированием, МРТ, КТА, МРА. Из них УЗИ с ЦДК и МРТ (МРА) обеспечивают изображение кровотока без искусственного контрастирования, позволяя легко распознать кровеносные сосуды и отличить их от несосудистых образований.
УЗИ дает возможность оценить морфологию сосудов брюшной полости, таза, конечностей и шеи, допплерографический спектральный анализ – определить гемодинамические показатели, ЦДК – легче и быстрее выявить участки патологического кровотока. Одно из преимуществ УЗИ – отображение сосудов не только в продольных проекциях, но и в поперечных срезах на нужном уровне. Ограничения – общие для УЗИ, особенно зависимость результатов от квалификации исследующего врача и класса аппаратуры. Эхо-КС, усиливающие допплеровские эхо-сигналы, обещают еще расширить применение УЗИ в диагностике заболеваний сосудов.
УЗИ используется как метод скрининга при атеросклеротических стенозах и окклюзиях артерий и как окончательный метод – при стенозах сонных артерий, превосходя в этом случае АГ. Расчет степени стеноза позволяет определить его гемодинамическую значимость. При ЦДК благодаря прокрашиванию цветом легче и быстрее выявляются участки патологического кровотока и деформация просвета. Однако для количественной оценки гемодинамических сдвигов необходимы спектральные допплеровские измерения. ЦДК – единственный метод выявления «мягких» атеросклеротических бляшек. Оно обеспечивает более точные прямые измерения стеноза высокой степени; дифференцировать его от окклюзии помогают ЭДК и эхоКС. Хотя определить морфологию бляшек не всегда возможно, морфологические признаки дополняют оценку сужения просвета артерий. Так, выявление явно изъязвленной бляшки делает клинически значимым даже поражение с небольшой степенью стеноза.
Посредством УЗИ с повышенной частотой оценивают морфологию периферических артерий нижних конечностей, а морфологическая и гемодинамическая информация, обеспечиваемая триплексным УЗИ, значительно сократила применение АГ в этой области. Ее еще используют первично для определения протяженности стеноза, оценки выраженности коллатералей и периферического кровотока, особенно если планируется операция или интраваскулярная интервенционная терапия. УЗИ как единственный метод визуализации применяют главным образом для прослеживания больных с клинически подозреваемой прогрессирующей окклюзией артерий в целях исключения сосудистого генеза острых эпизодов локальной боли или припухлости (псевдоаневризмы, гематомы, артериовенозные фистулы, эмболии), для выявления осложнений протезирования сосудов, оценки эффективности интраваскулярных вмешательств, например ангиопластики, и т. п. Послойные методы позволяют распознать компрессию сосудов опухолью или гематомой.
Интраваскулярное УЗИ, главным образом коронарных и периферических артерий нижних конечностей, лучше других методов отображает артериальную стенку, чувствительнее в распознавании атеросклероза, позволяет дифференцировать мягкие бляшки от фиброзных, обнаружить обызвествления, изъязвления. Показания: интраоперационное применение при эндоваскулярных вмешательствах, выбор диаметра стента (баллона) для ангиопластики, оценка прилегания стентов к стенке сосуда.
КТ с болюсным контрастированием используют в диагностике аневризм, тромбоза, сдавления извне крупных сосудов грудной и брюшной полости. МРТ незаменима при сомнительных данных КТ и АГ или непереносимости йодсодержащих КС.
РИ ненадежно в дифференцировании аневризм грудной аорты от опухолей средостения. Эхо-КГ применяют для скрининга аневризм восходящей аорты и расслаивающих аневризм. Нативная КТ позволяет определить степень и протяженность расширения аорты, форму аневризмы, воздействие на прилежащие структуры и заподозрить разрыв. Соотношения перфузируемой и тромбированной части просвета, состояние стенки, отношение к ветвям аорты уточняют посредством КТ с болюсным контрастированием или МРТ. Оба этих метода используют для определения прогноза, необходимости и срочности операции и для динамического наблюдения. Они и особенно КТА обеспечивают достаточную информацию при расслаивании аорты дистальнее левой подключичной артерии.
При УЗИ, особенно с ЦДК, различимы перфузируемый просвет и тромбированная часть аневризм брюшной аорты и обнаруживаются косвенные симптомы их разрыва. КТ точнее в распознавании и определении локализации разрыва. Однако при угрожающем разрыве аневризм, травматических псевдоаневризмах и расслаивающих аневризмах восходящей аорты краниальнее правой коронарной артерии методом выбора остается аортография. Главная ее задача: получить информацию, необходимую для планирования операции визуализировать шейку аневризмы, отношение аневризмы к начальным отделам шейных, почечных и висцеральных артерий. КТА и МРА уже конкурируют с аортографией в окончательной диагностике стенозов и аневризм грудной и брюшной аорты.
УЗИ с ЦДК также используют для выявления и характеристики аневризм и расслаивающих аневризм периферических артерий и как первичный метод визуализации сосудистых мальформаций. КТ с контрастированием и еще лучше МРТ позволяют отличить мальформации с высоким и низким кровотоком, установить их протяженность, количество, вовлечение в процесс костей и мышц. АГ обеспечивает распознавание капиллярных и венозных мальформаций и решающую информацию для планирования операции: выраженность артериовенозного сброса крови, локализацию «нидуса» и дренирующих вен.
УЗИ с ЦДК – метод скрининга и в большинстве случаев окончательный метод визуализации при тромбозе глубоких вен нижних конечностей. В объем УЗИ включают вены от подвздошных до подколенных, а в случае двустороннего поражения – также нижнюю полую вену для исключения ее тромбоза, сдавления извне и оценки проходимости. Визуализация вен голени существенно увеличивает продолжительность УЗИ при меньшей точности, чем для более проксимальных вен, и относительно небольшом клиническом значении. Для поверхностных вен применяют УЗИ в режиме повышенной частоты. Показания: боль и отек ног, эмболия легочной артерии с неизвестным источником, заболевания и состояния с повышенным риском тромбоза. По точности распознавании тромбоза глубоких вен выше коленного сустава УЗИ эквивалентно флебографии при меньшем риске и расходах, отсутствии радиационной нагрузки, возможности динамического наблюдения.
К свежим тромбам особенно чувствителен радионуклидный тест с меченым фибриногеном. Учитывая трудности дифференциальной диагностики от хронического тромбоза и возможность рецидивов, важно проследить с помощью УЗИ динамику до завершения терапии. Изменения просвета вен, ретроградный и коллатеральный кровоток при посттромботическом синдроме предпочтительнее визуализировать флебографией или флебосцинтиграфией. Визуализация венозных клапанов и перфорирующих вен при УЗИ с ЦДК ненадежна. Этим методом распознают венозный рефлюкс, локализуют несостоятельные клапаны, оценивают степень несостоятельности и отличают первичную несостоятельность от присоединяющейся к тромбозу глубоких вен. При исследовании вен используют функциональные тесты, например спектральную допплерографию и ЦДК в условиях пробы Вальсальвы, дистального сжатия и др.
Одно из преимуществ КТА перед АГ – визуализация не только перфузируемого просвета сосудов, но и его тромбированной части и окружающих тканей. Применение полностью неинвазивной МРА ограничено главным образом визуализацией церебральных сосудов. МРА с контрастированием (КМРА) позволила устранить или уменьшить недостатки бесконтрастной МРА. КМРА с трехмерным сбором данных хотя и уступает АГ, тем не менее используется для изображения всех областей сосудистого дерева. Клинические результаты КТА и КМРА в большинстве применений почти идентичны. С их помощью распознаются аневризмы и окклюзии церебральных артерий. Они находят применение в оценке и других сосудистых поражений головного мозга, для скрининга стенозов почечных, висцеральных, подвздошных артерий, используются в качестве первичного и в большинстве случаев окончательного метода диагностики эмболий легочной артерии, а при специальном техническом оснащении – взамен и в дополнение к АГ артерий нижних конечностей. КМРА предпочтительнее у пациентов молодого возраста (при КТА значительная лучевая нагрузка) и с почечной недостаточностью. При острых состояниях (разрыв аневризмы, расслаивание и др.) более пригодна КТА. Важное достоинство КТА – возможность дифференцировать «твердые» бляшки от «мягких» и благодаря этому отобрать пациентов для ангиопластики. КМРА дороже, чем КТА, за счет более высокой цены КС.
НЕКОТОРЫЕ УЗЛОВЫЕ ВОПРОСЫ ВИЗУАЛИЗАЦИИ
Опухоли обычно распознаются в диагностических изображениях по их отличиям в плотности, эхогенности, интенсивности MP-сигнала и степени контрастирования от окружающих тканей, а также по оказываемому ими объемному воздействию – смещению и сдавлению анатомических структур. Морфологические изображения далеко не всегда позволяют отличить опухоли от неопухолевых поражений, например от воспалительных фокусов, и злокачественные опухоли от доброкачественных. Для злокачественных опухолей значительных размеров характерны негомогенная структура и неравномерное контрастирование за счет некроза, хотя сходную картину могут давать абсцессы. Однако нет ни одного абсолютно достоверного признака злокачественности, особенно если опухоль ограничена пределами первично пораженного органа.
Этой дифференциальной диагностике могут способствовать выявление признаков опухолевого ангиогенеза при ЦДК, особенно с эхо-КС, особенности динамики контрастного усиления при КТ и МРТ, а в поздних стадиях злокачественных опухолей – инвазия окружающей жировой ткани, прорастание соседних анатомических структур и метастазы в локальные или регионарные лимфатические узлы. Ценность послойных методов в диагностике опухолей дополняет более высокая достоверность биопсий, проводимых под их контролем.
Особенно важную роль играют метаболические изображения: сцинтиграфия с РФП, избирательно фиксирующимися в воспалительных очагах, магнитно-резонансная спектроскопия, ПЭТ и в меньшей степени ОФЭКТ, отображающие специфические метаболические нарушения. Например, при раке легкого чувствительность ПЭТ достигает 95 %, а специфичность – 8085 % (за счет ложноположительных результатов при некоторых гранулемах). Поэтому негативные данные ПЭТ считают достаточным основанием для отказа от активных вмешательств и других исследований в пользу выжидания и наблюдения.
Послойные изображения отображают распространенность опухоли и используются для определения ее стадии, резектабельности, объема и вида хирургического вмешательства или лучевого лечения. Наилучший результат дает МРТ. Для поисков отдаленных метастазов предпочтительны методы тотальной визуализации – главным образом радионуклидные. По мере роста возможностей диагностических изображений нарастает тенденция к более строгому отбору больных для хирургических операций на этой основе, с тем чтобы повысить их эффективность и избежать тяжелых последствий неоправданных операций. Однако существует немало ограничений, которые ведут как к ложноположительным, так и к ложноотрицательным результатам оценки глубины инвазии первично пораженного органа, прорастания опухоли за его пределы, инвазии соседних органов и метастазов в лимфатические узлы. Поэтому точность морфологической визуализации в этом отношении часто недостаточна (ниже 70–80 %), чтобы полностью полагаться на нее в терапевтических решениях.
Визуализация дает хирургу только предварительную ориентировку относительно резектабельности опухоли. Операбельность нередко окончательно устанавливает хирург во время операции. И все же применение послойных методов с этой целью может иметь важное практическое значение, заставляя прибегать к более адекватным методам лечения, если обнаруживается явно неоперабельная опухоль. Роль визуализации возрастет, когда станут доступнее уточненные методы такой оценки – ПЭТ с ее высокой чувствительностью к метастатическим поражениям, по крайней мере, при ряде локализаций рака, лапароскопическое УЗИ.
Лимфоаденопатии. Визуализацию используют в целях обнаружения патологических изменений лимфатических узлов, недоступных физикальному исследованию, определения их распространенности и локализации, контроля за игловой биопсией. Основной критерий поражения лимфатических узлов в послойных изображениях – их увеличение (пороговый размер их чаще всего принимают равным 10 мм) – недостаточно чувствителен, так как патологическую ткань могут содержать и неувеличенные узлы. Визуализируемые множественные лимфатические узлы, даже не достигшие критического размера, особенно в полости таза, также расценивают как признак лимфоаденопатии.
Внутренняя структура лимфатических узлов обычно не определяется. По чувствительности послойные изображения уступают лимфографии, которая может показывать изменения структуры неувеличенных узлов, хотя отображает только узлы по ходу магистральных сосудов таза и брюшной полости. Этот инвазивный и небезопасный метод практически вытеснен послойными изображениями. Однако они не избавляют от необходимости пред– или интраоперационной патогистологической верификации лимфоаденопатий.
С другой стороны, послойные изображения неспецифичны в оценке природы увеличения лимфатических узлов. Узлы, увеличенные за счет реактивной гиперплазии, гранулематозных воспалений, лимфом, метастазов рака и т. д., выглядят одинаково. Как правило, с нарастанием их размеров у больных раком увеличивается вероятность метастатического поражения. Выявляемые при КТ обызвествления в лимфатических узлах наиболее характерны для гранулематозов (чаще всего туберкулеза), но наблюдаются и при метастазах преимущественно аденокарциномы. Низкая плотность обусловлена жиром, например при болезни Уиппла, или центральным некрозом (туберкулез, метастазы опухолей), более отчетливо выявляющимся в центре узлов после внутривенного контрастирования.
УЗИ информативно при выявлении лимфоаденопатий на шее, в брюшной полости, в конечностях, уступая КТ в отображении глубоко расположенных лимфатических узлов забрюшинного пространства и таза. При УЗИ с ЦДК (ЭДК), особенно дополненном контрастированием и трехмерным сбором данных, визуализируется ангиоархитектоника капсулы и ворот в лимфатических узлах. Это лучший метод определения злокачественных лимфоаденопатий на шее. При КТ отображаются некоторые нормальные и большинство увеличенных лимфатических узлов во всех областях тела. Однако визуализацию лимфатических узлов затрудняет слабое развитие окружающего жира, а для уверенного дифференцирования их от сосудов часто, особенно в области шеи, таза и в корнях легких, необходимо болюсное контрастирование. При МРТ дифференцировать лимфатические узлы от сосудов часто удается и без контрастирования, фиброзные лимфатические узлы можно отличать от воспалительных и неопластических, но не всегда выявляются обызвествления в них. МРТ предпочтительнее КТ в случае повышенного риска применения йодсодержащих КС и трудностей дифференцирования от сосудов при недоступности болюсного контрастирования. Перспективна магнитно-резонансная лимфография, основанная на захвате мельчайших частиц окиси железа клетками системы мононуклеарных фагоцитов лимфатических узлов.
Лимфомы. После установленного по результатам биопсии лимфатического узла диагноза лимфомы к визуализации прибегают с целью выявить поражения в местах, трудно доступных физикальному исследованию, и отличить локальные поражения от распространенных. Методами визуализации невозможно отличить лимфомы от метастазов рака в лимфатические узлы и определить патогистологические типы лимфом и степень злокачественности.
КТ – главный метод определения стадии лимфомы. КТ грудной полости становится обязательной при обследовании больных лимфогранулематозом (ходжкинской лимфомой; в 60 % случаев к моменту установления диагноза имеется медиастинальная лимфоаденопатия), помогая установить стадию болезни, планировать лучевую терапию и выбрать место биопсии, а также проследить регресс лимфоаденопатии в ходе лечения и обнаружить рецидивы. Поскольку поражение часто локализовано и распространяется на соседние лимфатические узлы, редко перепрыгивая их, исследование обычно завершается на том уровне, где их увеличение больше не выявляется. Для определения стадии неходжкинских лимфом из-за преимущественного вовлечения периферических лимфатических узлов и частых мультифокальных или диффузных поражений, которые могут «перепрыгивать» на отдаленные лимфатические узлы, необходима визуализация как грудной, так и брюшной полости. Большинство пораженных лимфомами, особенно неходжкинской, узлов увеличено и обнаруживается при КТ (точность определения стадии 80–90 %) или УЗИ. УЗИ лучше, чем КТ, показывает гепатоспленомегалию и очаговые изменения в печени и селезенке размером от 4–6 мм. Диффузные поражения этих органов и микроскопические изменения в лимфатических узлах не распознаются ни одним методом. У больных лимфомами нормальная картина селезенки при УЗИ и КТ не исключает ее специфического поражения, а спленомегалия не обязательно свидетельствует о нем. Крупные фокусы поражения этих органов при доказанной лимфоме почти всегда представляют собой ее проявления, но в увеличенной селезенке они могут отображать осложняющие спленомегалию инфаркты. Как КТ, так и МРТ, даже с органоспецифическими КС, редко дополняют УЗИ в распознавании лимфоматозных поражений селезенки. Но МРТ в отличие от КТ чувствительна к поражениям костного мозга.
Послойные методы помогают оценить эффективность терапии и рецидивы опухоли. Для распознавания рецидивов рекомендуется получить базисные изображения через 8-12 нед после хирургического или лучевого лечения, когда обычно завершаются связанные с ним процессы. Без этого при КТ трудно отличить рецидив опухоли от послеоперационных Рубцовых изменений и пострадиационного фиброза. Более информативна при этом МРТ благодаря характерному MP-сигналу фиброзной ткани. Однако в части случаев вопрос о рецидиве окончательно решается только в динамике. ПЭТ гораздо чувствительнее и точнее в диагностике рецидивов на фоне рубцов и фиброза. При неоперабельном раке с помощью ПЭТ можно определить ответ на лечение по снижению накопления FD-глюкозы в опухоли. Для оценки эффекта противоопухолевой терапии, по-видимому, найдет применение ЦДК с эхо-КС, которая позволяет раньше оценить ответ на лечение по снижению васкуляризации опухоли, которое предшествует уменьшению ее размеров.
Главный критерий эффективности лечения лимфом в диагностических изображениях – уменьшение размеров лимфатических узлов. В случае частичной регрессии изменений лимфатических узлов приходится дифференцировать неполностью излеченную лимфому от неактивных остаточных изменений. Так как современное лечение значительно увеличило продолжительность жизни, у многих больных требуется динамическое наблюдение на протяжении ряда лет, для чего целесообразно использовать УЗИ. Однако при сомнениях или расхождениях данных УЗИ с клиникой его дополняют КТ и МРТ. Поскольку при УЗИ и КТ невозможно отличить фиброзные лимфатические узлы от узлов, содержащих активную опухоль, остаточные изменения условно расцениваются как фиброзные и подвергаются динамическому наблюдению. В случае увеличения или изменения морфологии лимфатических узлов показаны биопсия или дальнейшая визуализация. Высокая интенсивность MP-сигнала через 6 мес от начала лечения расценивается как показатель остаточной активной болезни, а появление новых фокусов яркого сигнала в фиброзных лимфатических узлах – как надежный признак рецидива. Если МРТ указывает на возможное сохранение опухоли в лимфатических узлах, рекомендуются тщательное наблюдение и биопсия. В силу отсутствия лучевой вредности МРТ особенно привлекательна для длительной многократной визуализации у больных с лимфомами. С той же целью применяют сцинтиграфию с И при МРТ и при сцинтиграфии возможны ложноположительные результаты в первые полгода терапии из-за некроза и воспалительной реакции.
В табл. 9 суммированы данные о методах визуализации различных органов и систем.
Таблица 9. Методы визуализации, применяемые при заболеваниях различных органов и систем