Глава 10. БОЛЕЗНИ ОРГАНОВ КРОВООБРАЩЕНИЯ
АНЕВРИЗМА АОРТЫ – ограниченное расширение просвета аорты вследствие растяжения и выпячивания ее стенки. По форме различают аневризмы мешковидные (локальное выпячивание стенки аорты) и веретенообразные (аорта расширена по всей окружности), по локализации – аневризму восходящего отдела, дуги и нисходящего отдела грудной аорты и аневризму брюшной аорты. Ложная аневризма аорты представляет собой периаортальную гематому травматического генеза.
Этиология. Аневризма аорты наблюдается чаще всего при атеросклерозе, более редкие причины – сифилис, неспецифический аортоартериит, травмы, врожденные заболевания соединительной ткани (например, синдром Марфана).
Симптомы, течение зависят от локализации и темпов увеличения аневризмы. Аневризма грудной аорты нередко протекает бессимптомно, достигая значительных размеров. Ее признаком может быть аорталгия, возникающая при раздражении парааортальных нервных сплетений. Ноющая, давящая, иногда распирающая боль за грудиной или в парастернальной области появляется в покое либо при незначительной физической нагрузке и длится часами. Она может усиливаться при подъеме рук кверху, не купируется нитратами и не сопровождается динамикой ЭКГ. Характерно повышение АД в момент болевого приступа, применение гипотензивных средств (в частности, антагонистов кальция) улучшает состояние и самочувствие больных. При значительных размерах аневризмы грудной аорты возникают признаки компрессии: головная боль, отечность головы и шеи, набухание шейных вен (синдром верхней полой вены), односторонний отек, цианоз и набухание поверхностных вен руки (при сдавлении правой или левой брахиоцефальной артерии), кашель, инспираторная одышка, стридорозное дыхание (при сдавлении трахеи, бронхов), нарушения глотания (при сдавлении пищевода), охриплость голоса, афония (при сдавлении левого возвратного нерва с парезом голосовой складки), односторонний птоз, сужение зрачка и глазной щели, западение глазного яблока (синдром Горнера при сдавлении грудной части симпатического ствола). Кровохарканье и скудная рвота кровью могут свидетельствовать об угрозе прорыва аневризмы в трахею или пищевод. При осмотре определяют локальную патологиче-скую пульсацию грудной клетки, расширение границ сосудистого пучка, систолический шум во II межреберье справа от грудины, пальпаторно ощутимое и синхронное пульсу подергивание щитовидных хрящей вниз. При аневризме проксимального отдела восходящей аорты нередко выявляют признаки аортальной недостаточности – диастолический шум во II межреберье справа от грудины, снижение диастолического АД, синхронное пульсу покачивание головы (симптом Мюссе) и др.
Аневризма брюшной аорты в подавляющем большинстве случаев располагается ниже места отхождения почечных артерий. Она может протекать бессимптомно или проявляется болью в левой половине живота, мезогастрии с иррадиацией в подложечную, пояснично-крестцовую области (следствие сдавления аневризмой окружающих тканей и органов), ощущением усиленной пульсации в животе. При нарушении кровоснабжения кишечника возникают признаки диспепсии – тошнота, рвота, вздутие живота. При осмотре в верхней половине живота чаще слева от средней линии выявляется плотное пульсирующее опухолевидное образование, не смещаемое при пальпации, над которым выслушивается систолический шум. Болезненность при пальпации или надавливании фонендоскопом может указывать на высокую вероятность разрыва аневризмы. При эмболиях артерий ног появляются характерные признаки ишемии нижних конечностей – мраморность кожи, цианоз одного или нескольких пальцев.
Наиболее тяжелое осложнение – разрыв аневризмы. Прорыв аневризмы грудной аорты в бронх проявляется легочным кровотечением, в левую плевральную полость – гемотораксом, в пищевод – рвотой алой кровью. Массивное кровотечение при разрыве аневризмы брюшной аорты быстро приводит к летальному исходу вследствие гиповолемического шока.
Диагноз подтверждается при рентгенологическом, ультразвуковом исследованиях, компьютерной и магнитно-резонансной томографии, аортографии.
Лечение оперативное – протезирование аорты и ее ветвей. Больные с разрывом хронической грудной или брюшной аорты подлежат экстренной госпитализации в ангиохирургический стационар, в остальных случаях целесообразность оперативного лечения определяется в плановом порядке. Консервативное лечение сводится к адекватной гипотензивной терапии.
АНЕВРИЗМА АОРТЫ РАССЛАИВАЮЩАЯ – надрыв внутренней оболочки аорты, сопровождающийся расслоением сосудистой стенки кровью.
Этиология. Расслаивающая аневризма аорты чаще возникает у мужчин пожилого возраста с атеросклерозом и артериальной гипертензией в анамнезе, реже при сифилитическом аортите. Синдром Марфана, врожденные пороки аортального клапана также относятся к факторам риска расслаивания аорты.
Патогенез. В начальном периоде расслаивания аневризмы аорты происходит надрыв внутренней, а иногда и средней ее оболочки при сохранении целостности наружной оболочки аорты. В дальнейшем проникающая под большим давлением кровь расслаивает всю стенку аорты и прорывает наружную оболочку, что ведет к мгновенной смерти больного от массивнейшего внутреннего кровотечения. В других случаях расслаивание распространяется чаще в дистальном, реже – в проксимальном направлении, что приводит к гемоперикарду, отрыву аортального клапана, тяжелой аорта-льной недостаточности, окклюзии коронарных артерий. Расслаивание может завершаться повторным прорывом внутренней оболочки аорты ниже места начального расслаивания, однако такие благополучные случаи самоизлечения чрезвычайно редки.
Симптомы, течение. Заболевание начинается остро, темп развития бурный. Основной симптом – жесточайшая боль в груди, чаще раздирающего или режущего характера. Боль может локализоваться в левой половине грудной клетки или в межлопаточном пространстве, иррадиирует в спину и нередко распространяется в подложечную область. Больной возбужден, мечется, не находит себе места от боли.
После первого приступа может наступить кратковременное облегчение, сменяющееся затем новым приступом прежних болей. Чередование болевых приступов и светлых промежутков связано с тем, что расслоение стенки аорты происходит иногда в несколько этапов. Кроме того, вовлечение новых участков стенки аорты в процесс расслоения может менять место наибольшей выраженности боли, миграция боли от места первоначального надрыва аорты по ходу расслаивания – характерный признак этой патологии. После начального приступа боли в груди в дальнейшем она может локализоваться преимущественно в животе, пояснице, что следует учитывать при диагностике.
Нередко сразу вслед за болью развивается картина тяжелого коллапса с падением АД, нитевидным пульсом, периферическими проявлениями сосудистой недостаточности; вывести больного из коллапса почти никогда не удается. В других случаях первый болевой приступ сопровождается резким повышением АД.
Вследствие нарушения кровотока в отходящих от аорты артериях возможно появление значительной асимметрии давления на правой и левой руках (ишемия конечностей иногда делает невозможным определение АД на одной или обеих руках), симптомов нарушения мозгового кровообращения (парапарезы, параплегии), инфаркта миокарда, нередки эпизоды потери сознания. Вовлечение в процесс брюшной аорты обычно сопровождается нарушением кровообращения в бассейне основных брыжеечных сосудов с присоединением картины тяжелой кишечной непроходимости. При проксимальном расслаивании более чем в половине случаев выявляется аортальная недостаточность. При прорыве расслаивающей аневризмы в полость перикарда возможна тампонада сердца, возможен также прорыв аорты в левую плевральную полость.
От момента начального надрыва внутренней оболочки до окончательного прорыва наружной оболочки и смерти больного проходит от нескольких минут до нескольких суток, в течение которых иногда наступают непродолжительные периоды относительного благополучия. В зависимости от давности развития заболевания различают острое (до 2 нед) и хроническое (более 2 нед) расслаивание аорты.
Диагноз устанавливают на основании клинической картины, при этом учитываются несоответствие выраженности болевого синдрома и отсутствия характерных для инфаркта миокарда изменений на ЭКГ, миграция локализации боли по мере распространения расслаивания аорты (в частности, распространение боли в нижние отделы живота и ноги), нарушения пульсации артерий, признаки нарастающей анемии. Иногда постановке правильного диагноза помогают рентгенологические признаки расслаивания аневризмы аорты: в половине случаев выявляется расширение средостения – вправо при расслаивании восходящей дуги аорты и влево – при поражении нисходящей части дуги аорты. Могут определяться видимое расширение тени аорты над отложениями солей кальция в стенке аорты; ограниченное выпячивание дуги аорты; выпот в плевральной полости (чаще слева). Диагноз может быть подтвержден при УЗИ и верифицирован с помощью аортографии в условиях специализированного учреждения (обязательна перед хирургическим лечением).
Дифференциальный диагноз обычно проводят с инфарктом миокарда, что представляет значительные трудности из-за сходства болевых проявлений и симптоматики обоих заболеваний в целом, особенно в начальном периоде болезни. По данным многих исследований, правильный диагноз удается установить только в половине случаев. В отличие от острейшей стадии инфаркта миокарда, антикоагулянты и тромболитики противопоказаны.
Лечение. Больной с подозрением на расслаивающую аневризму аорты подлежит срочной госпитализации при условии соблюдения абсолютного покоя при транспортировке. Неотложная помощь заключается в создании абсолютного покоя, снятии болевого синдрома введением 1–2 мл 1 %-ного раствора морфина п/к или в/в. Для быстрой коррекции повышенного АД при подозрении на расслаивание аорты (когда оптимальный уровень систолического АД – 100–120 мм рт. ст.) используют в/в введение нитратов (нитроглицерина, изосорбида динитрата) или нифедипин (10–20 мг сублингвально каждые 2–4 ч) в сочетании с в/в введением бета-адреноблокаторов (пропранолол – по 1 мг каждые 3–5 мин до достижения частоты сердечных сокращений 50–60 в 1 мин или до достижения общей дозы 0,15 мг/кг). При непереносимости бета-адреноблокаторов используют верапамил в/в в дозе 0,05 мг/кг.
При расслаивающей аневризме аорты с успехом выполняют экстренное протезирование аорты, что делает особенно важной раннюю диагностику этого грозного заболевания. В условиях реанимационного отделения при сохранении артриальной гипертензии проводят экстренную ее коррекцию, выполняют обследование для верификации диагноза (рентгенография грудной клетки, УЗИ). После этого показана консультация сосудистого хирурга для решения вопроса о необходимости и объеме оперативного пособия. В качестве поддерживающей гипотензивной терапии используют антагонисты кальция и бета-адреноблокаторы. В случае хронической аневризмы аорты в целях поддержания систолического АД на уровне не более 130–140 мм рт. ст. также используют бета-блокаторы, антагонисты кальция, при задержке жидкости к терапии добавляют диуретики.
АНЕВРИЗМА СЕРДЦА – выбухание ограниченного участка истонченной стенки левого желудочка. В большинстве случаев аневризма локализуется на передней его стенке у верхушки сердца; аневризма межжелудочковой перегородки выбухает в полость правого желудочка (где давление меньше, чем в левом). От истинных аневризм сердца отличают ложные – особую форму разрыва миокарда; стенкой ложной аневризмы служит перикард.
Этиология, патогенез. Аневризма обычно формируется в течение 3 мес после переднего трансмурального инфаркта миокарда. Острая аневризма развивается в острой стадии инфаркта миокарда, когда некротизированный участок размягчается и под влиянием повышенного во время систолы давления выбухает кнаружи или, при поражении межжелудочковой перегородки, в полость правого желудочка. По мере рубцевания инфаркта миокарда острая аневризма исчезает или превращается в хроническую, определенную роль при этом играют сохраняющаяся окклюзия коронарной артерии и недостаточный коллатеральный кровоток. Аневризма приводит к уменьшению сердечного выброса – часть ударного объема попадает в ее полость. В полости аневризмы часто образуются тромбы, которые могут стать источником тромбоэмболий артерий большого круга кровообращения.
Симптомы, течение. Аневризма сердца может протекать бессимптомно, однако нередко она служит причиной нарушений сердечного ритма, сердечной недостаточности, источником тромбоэмболий. При осмотре может выявляться прекордиальная пульсация, расширение границ сердца, систо-лический шум. Рентгенологически нередко удается выявить локальное выпячивание контура сердца. Характерные изменения ЭКГ – патологический зубец Q и сохраняющийся подъем сегмента ST в грудных отведениях (застывшая монофазная кривая). Диагноз подтверждают с помощью эхо-кардиографии, выявляющей участок дискинезии левого желудочка, истончение его стенки, а также в ряде случаев пристеночный тромбоз.
Лечение. При нарастающей левожелудочковой недостаточности, опасных для жизни нарушениях сердечного ритма (эпизодах желудочковой тахикардии), рецидивирующих тромбоэмболиях проводят хирургическое иссечение аневризмы (аневризмэктомию). В случае ложной аневризмы в связи с высокой вероятностью ее разрыва также показано оперативное лечение.
АРИТМИИ СЕРДЦА – нарушения частоты, ритмичности и последовательности сокращений отделов сердца. Аритмии могут возникать при структурных изменениях в проводящей системе при заболеваниях сердца и (или) под влиянием вегетативных, эндокринных, электролитных и других метаболических нарушений, при интоксикациях и некоторых лекарственных воздействиях. Нередко даже при выраженных структурных изменениях в миокарде аритмия обусловливается отчасти или в основном метаболическими нарушениями. Перечисленные выше факторы влияют на основные функции (автоматизм, проводимость) всей проводящей системы сердца или ее отделов, обусловливают электрическую неоднородность миокарда, что и приводит к аритмии. В отдельных случаях аритмии вызваны индивидуальными врожденными аномалиями проводящей системы. Выраженность аритмического синдрома может не соответствовать тяжести основного заболевания сердца. Аритмии диагностируются главным образом по ЭКГ. Большинство аритмий может быть диагностировано и дифференцировано по клиническим и электрокардиографическим признакам (при необходимости проводится суточное мониторирование ЭКГ). Изредка необходимо специальное электрофизиологическое исследование (внутрисердечная или внутрипищеводная электрокардиография со стимуляцией отделов проводящей системы). Лечение аритмий всегда включает лечение основного заболевания и собственно противоаритмические мероприятия. Антиаритмическая терапия показана при плохой субъективной переносимости нарушений ритма, при гемодинамически и прогностически значимых аритмиях.
Нормальный ритм обеспечивается автоматизмом синусового узла и называется синусовым. Частота синусового ритма у большинства здоровых взрослых в покое составляет 60–75 уд/мин.
Синусовая аритмия – синусовый ритм, при котором разница между интервалами R-R на ЭКГ превышает 0,1 с. Дыхательная синусовая аритмия – физиологичное явление, она более заметна (по пульсу или ЭКГ) у молодых лиц и при медленном, но глубоком дыхании. Факторы, учащающие синусовый ритм (физические и эмоциональные нагрузки, симпатомиметики), уменьшают или устраняют дыхательную синусовую аритмию. Синусовая аритмия, не связанная с дыханием, встречается редко. Синусовая аритмия сама по себе лечения не требует.
Синусовая тахикардия – синусовый ритм с частотой более 90-100 в 1 мин. У здоровых людей она возникает при физической нагрузке и при эмоциональном возбуждении. Выраженная склонность к синусовой тахикардии – одно из проявлений вегетативной дистонии, в этом случае тахикардия заметно уменьшается при задержке дыхания. Преходящая синусовая тахикардия возникает под влиянием атропина, симпатомиметиков, при быстром снижении АД любой природы, после приема алкоголя. Более стойкой синусовая тахикардия бывает при лихорадке, тиреотоксикозе, миокардите, сердечной недостаточности, анемии, тромбоэмболии легочных артерий. Синусовая тахикардия может сопровождаться ощущением сердцебиения.
Лечение должно быть направлено на основное заболевание, поскольку синусовая тахикардия в большинстве случаев представляет собой физиологическую реакцию, направленную на поддержание сердечного выброса. При тахикардии, обусловленной тиреотоксикозом, вспомогательное значение имеет применение бета-адреноблокаторов. При синусовой тахикардии, связанной с вегетативной дистонией, могут быть полезны седативные средства, бета-адреноблокаторы в малых дозах, верапамил; при тахикардии, обусловленной сердечной недостаточностью можно использовать сердечные гликозиды или бета-адреноблокаторы в малых дозах.
Синусовая брадикардия – синусовый ритм с частотой менее 55 в 1 мин – нередко наблюдается у здоровых, особенно у физически тренированных лиц в покое, во сне. Она часто сочетается с заметной дыхательной аритмией, иногда с экстрасистолией. Синусовая брадикардия может быть одним из проявлений вегетативной дистонии. Иногда она возникает при заднем инфаркте миокарда, при различных патологических процессах (ишемических, склеротических, воспалительных, дегенеративных) в области синусового узла (синдром слабости синусового узла – см. ниже), при повышении внутричерепного давления, снижении функции щитовидной железы, при некоторых вирусных инфекциях, под влиянием некоторых лекарств (сердечные гликозиды, бета-адреноблокаторы, верапамил, амиодарон и др.). Иногда брадикардия проявляется в виде неприятного ощущения в области сердца; при выраженной брадикардии (менее 40 в 1 мин) возможны артериальная гипотония, сердечная недостаточность, стенокардия, спутанность сознания.
Лечение направлено на основное заболевание. При выраженной синусовой брадикардии, обусловленной вегетативной дистонией и некоторыми другими причинами, иногда эффективны холиноблокаторы (атропин, беллоид), которые могут оказать временный симптоматический эффект. В редких случаях (при выраженных клинических проявлениях) показана временная или постоянная электрокардиостимуляция.
Эктопические ритмы. При ослаблении или прекращении деятельности синусового узла могут возникать (временами или постоянно) замещающие эктопические ритмы, т. е. сокращения сердца, обусловленные проявлением автоматизма других отделов проводящей системы или миокарда. Частота их обычно меньше частоты синусового ритма. Как правило, чем дистальнее источник эктопического ритма, тем реже частота его импульсов. Эктопические ритмы могут возникать при воспалительных, ишемических, склеротических изменениях в области синусового узла и в других отделах проводящей системы, они могут быть одним из проявлений синдрома слабости синусового узла (см. ниже). Наджелудочковый эктопический ритм может быть связан с вегетативной дистонией, передозировкой сердечных гликозидов.
Изредка эктопический ритм обусловлен повышением автоматизма эктопического центра; при этом частота сердечных сокращений выше, чем при замещающем эктопическом ритме (ускоренный эктопический ритм). Наличие эктопического ритма и его источник определяются только по ЭКГ.
Предсердный ритм характеризуется изменениями конфигурации зубца Р. Диагностические признаки его нечетки, обычно ритм правильный, зубец Р отрицательный в отведениях II, III, aVF. Иногда форма зубца Р и продолжительность интервала P-Q меняется от цикла к циклу, что связывают с миграцией водителя ритма по предсердиям (наблюдается у здоровых лиц, спортсменов, при органических заболеваниях сердца). Ритм из атриовентрикулярного соединения характеризуется инверсией зубца Р, который может регистрироваться вблизи желудочкового комплекса или накладываться на него. Для замещающего узлового ритма характерна частота 40–50 в 1 мин, для ускоренного – 60-100 в 1 мин. Если эктопический центр несколько более активен, чем синусовый узел, а обратное проведение импульса блокировано, то возникают условия для неполной атриовентрикулярной диссоциации; при этом периоды синусового ритма чередуются с периодами замещающего узлового (редко желудочкового) ритма, особенностью которого является более редкий ритм предсердий (Р) и независимый, но более частый ритм желудочков (QRST). Эктопический желудочковый ритм (регулярный зубец Р отсутствует, желудочковые комплексы деформированы, частота 20–50 в 1 мин) обычно указывает на значительные изменения миокарда, при очень низкой частоте желудочковых сокращений может способствовать возникновению ишемии жизненно важных органов.
Лечение. При указанных эктопических ритмах следует лечить основное заболевание. Ритм из атриовентрикулярного соединения и неполная атриовентрикулярная диссоциация, связанные с вегетативной дистонией, могут быть временно устранены атропином или атропиноподобным препаратом. При редком желудочковом ритме может стать необходимой временная или постоянная электрокардиостимуляция.
Экстрасистолы – преждевременные сокращения сердца, обусловленные возникновением импульса вне синусового узла. Экстрасистолия может сопровождать любое заболевание сердца. Не менее чем в половине случаев экстрасистолия не связана с заболеванием сердца, а обусловлена вегетативными и психоэмоциональными нарушениями, влиянием лекарственных средств (особенно сердечных гликозидов), нарушениями электролитного баланса различной природы, употреблением алкоголя и возбуждающих средств, курением, рефлекторным влиянием со стороны внутренних органов. Изредка экстрасистолия выявляется у видимо здоровых лиц с высокими функциональными возможностями, например у спортсменов. Физическая нагрузка в общем провоцирует экстрасистолию, связанную с заболеваниями сердца и метаболическими нарушениями, и подавляет экстрасистолию, обусловленную вегетативной дистонией.
Экстрасистолы могут возникать подряд, по две и более – парные и групповые экстрасистолы. Ритм, при котором за каждой нормальной систолой следует экстрасистола, называется бигеминией. Особенно неблагоприятны гемодинамически неэффективные ранние экстрасистолы, возникающие одновременно с зубцом Т предыдущего цикла или не позднее чем через 0,05 с после его окончания. Если эктопические импульсы формируются в разных очагах или на разных уровнях, то возникают политопные экстрасистолы, которые различаются между собой по форме экстрасистолического комплекса на ЭКГ (в пределах одного отведения) и по величине предэкстрасистолического интервала. Такие экстрасистолы чаще обусловлены значительными изменениями миокарда. Иногда возможно длительное ритмичное функционирование эктопического фокуса наряду с функционированием синусового водителя ритма – парасистолия. Парасистолические импульсы следуют в правильном (обычно более редком) ритме, независимом от синусового ритма, но часть их совпадает с рефрактерным периодом окружающей ткани и не реализуется.
На ЭКГ предсердные экстрасистолы характеризуются изменением формы и направления зубца Р и нормальным желудочковым комплексом. Постэкстрасистолический интервал может быть не увеличен. При ранних предсердных экстрасистолах нередко отмечается нарушение атриовентрикулярной и внутрижелудочковой проводимости (чаще по типу блокады правой ножки) в экстрасистолическом цикле. Экстрасистолы из области атриовентрикулярного соединения характеризуются тем, что инвертированный зубец Р расположен вблизи неизмененного желудочкового комплекса или накладывается на него. Возможно нарушение внутрижелудочковой проводимости в экстрасистолическом цикле. Постэкстрасистолическая пауза обычно увеличена. Желудочковые экстрасистолы отличаются более или менее выраженной деформацией комплекса QRS, которому не предшествует зубец Р (за исключением очень поздних желудочковых экстрасистол, при которых записывается обычный зубец Р, но интервал P-Q укорочен). Сумма пред– и постэкстрасистолического интервалов равна или несколько превышает продолжительность двух интервалов между синусовыми сокращениями. При ранних экстрасистолах на фоне брадикардии постэкстрасистолической паузы может не быть (вставочные экстрасистолы). При левожелудочковых экстрасистолах в комплексе QRS в отведении V1 наибольшим является зубец R, направленный вверх, при правожелудочковых – зубец S, направленный вниз.
Симптомы. Больные либо не ощущают экстрасистол, либо ощущают их как усиленный толчок в области сердца или замирание сердца. При исследовании пульса экстрасистоле соответствует преждевременная ослабленная пульсовая волна или выпадение очередной пульсовой волны, а при аускультации – преждевременные сердечные тоны.
Клиническое значение экстрасистол может быть различным. Редкие экстрасистолы при отсутствии заболевания сердца обычно не имеют существенного клинического значения. Учащение экстрасистол иногда указывает на обострение имеющегося заболевания (ишемической болезни сердца, миокардита и др.) или интоксикацию гликозидами. Частые предсердные экстрасистолы могут предшествовать мерцанию предсердий, но не являются ее предвестниками. Особенно неблагоприятны частые ранние, а также политопные и групповые желудочковые экстрасистолы в остром периоде инфаркта миокарда и при интоксикации сердечными гликозидами, когда они могут быть предвестниками мерцания желудочков. Частые экстрасистолы (6 и более в 1 мин) могут сами по себе способствовать усугублению коро-нарной недостаточности.
Лечение. Следует выявить и по возможности устранить факторы, приведшие к экстрасистолии. Если она связана с каким-то определенным заболеванием (миокардит, тиреотоксикоз, алкоголизм или др.), то лечение этого заболевания имеет определяющее значение для устранения аритмии. Если экстрасистолы сочетаются с выраженными психоэмоциональними нарушениями (независимо от наличия или отсутствия заболевания сердца), важно седативное лечение. Экстрасистолы на фоне синусовой брадикардии, как правило, не требуют противоаритмического лечения, иногда их удается устранить беллоидом (по 1 таблетке 1–3 раза в сутки). Редкие экстрасистолы при отсутствии заболевания сердца также обычно не требуют лечения.
Если лечение признано показанным, то подбирают противоаритмическое средство с учетом противопоказаний, начиная с меньших доз. При клинически проявляющейся наджелудочковой экстрасистолии используют пропранолол (анаприлин) в дозе 10–40 мг 3–4 раза в сутки и другие бета-адреноблокаторы, верапамил (по 40–80 мг 3–4 раза в сутки).
Желудочковая экстрасистолия нуждается в лечении, если она возникает в острой стадии инфаркта миокарда, или если она субъективно плохо переносится, или в случае ее гемодинамической либо прогностической значимости. При остром инфаркте миокарда препаратом выбора для купирования желудочковых нарушений ритма является лидокаин (в/в по 100 мг); в случае его неэффективности может использоваться новокаинамид. В остальных случаях чаще всего используют бета-адреноблокаторы, при упорной экстрасистолии – амиодарон (кордарон) в дозе 200 мг 3 раза в сутки в течение 1–2 нед, затем по 200–400 мг в сутки в 1–2 приема. Если экстрасистолы возникают или учащаются на фоне лечения сердечными гликозидами, их следует временно отменить; при гипокалиемии используют препараты калия.
Пароксизмальная тахикардия – приступы эктопической тахикардии, характеризующиеся правильным ритмом с частотой около 140–240 в 1 мин с внезапным началом и внезапным окончанием. Этиология пароксизмальной тахикардии сходна с таковой при экстрасистолии, возможные ее механизмы – повторный вход волны возбуждения, реже – повышение автоматизма клеток проводящей системы сердца.
По ЭКГ в большинстве случаев удается выделить наджелудочковые и желудочковую тахикардии. Наджелудочковая тахикардия характеризуется строгой ритмичностью, наличием на ЭКГ неизмененных желудочковых комплексов, перед которыми может быть заметен слегка деформированный зубец Р. Нередко наджелудочковая тахикардия сопровождается нарушением атриовентрикулярной и (или) внутрижелудочковой проводимости, чаще по правой ножке пучка Гиса. Желудочковая тахикардия характеризуется значительной деформацией комплекса QRST. Предсердия могут возбуждаться независимо от желудочков в правильном ритме, но зубец Р трудно различим. Форма и амплитуда комплекса QRST и контур изоэлектрической линии слегка меняются от цикла к циклу, ритм обычно не является строго правильным. Эти особенности отличают желудочковую тахикардию от наджелудочковой с блокадой ножки пучка Гиса. Иногда в течение нескольких дней после пароксизма тахикардии на ЭКГ регистрируются отрицательные зубцы Т, реже – со смещением сегмента ST – изменения, обозначаемые как посттахикардиальный синдром. Такие больные нуждаются в наблюдении и исключении у них мелкоочагового инфаркта миокарда.
Симптомы. Пароксизм тахикардии обычно ощущается как приступ сердцебиения с отчетливым началом и окончанием, продолжительностью от нескольких секунд до нескольких дней. Наджелудочковые тахикардии нередко сопровождаются другими проявлениями вегетативной дистонии – потливостью, обильным мочеиспусканием в конце приступа, усилением перистальтики кишечника, небольшим повышением температуры тела. Затянувшиеся приступы могут сопровождаться слабостью, обмороками, неприятными ощущениями в области сердца, а при наличии заболевания сердца – стенокардией, появлением или нарастанием сердечной недостаточности. Общим для разных видов наджелудочковой тахикардии является возможность хотя бы временной нормализации ритма при массаже области каротидного синуса. Желудочковая тахикардия наблюдается реже и почти всегда связана с заболеванием сердца. Она не отвечает на массаж каротидного синуса и чаще приводит к нарушению кровоснабжения органов и сердечной недостаточности. Желудочковая тахикардия, особенно в остром периоде инфаркта миокарда, может быть предвестником мерцания желудочков.
Лечение. Во время приступа необходимо прекратить нагрузки, важно успокоить больного, использовать, если надо, седативные средства. Всегда необходимо исключить сравнительно редкие особые ситуации, когда пароксизм тахикардии связан с интоксикацией сердечными гликозидами или со слабостью синусового узла (см. ниже); таких больных надо сразу госпитализировать в кардиологическое отделение.
В остальных случаях врачебная тактика при приступе наджелудочковой пароксизмальной тахикардии определяется стабильностью гемодинамики пациента. Падение АД с развитием обморока, приступ сердечной астмы или отек легких, развитие тяжелого ангинозного приступа на фоне тахикардии – показания для немедленной электроимпульсной терапии.
Если гемодинамика стабильна, сознание больного ясное, то купирование пароксизма начинают с приемов, направленных на раздражение блуждающего нерва и замедление проведения через атриовентрикулярный узел. Иногда удается прервать приступ задержкой дыхания, кашлем, резким натуживанием после глубокого вдоха (проба Вальсальвы), искусственной рвотой, проглатыванием корки хлеба, погружением лица в ледяную воду. Указанные приемы помогают только при наджелудочковой тахикардии, при мерцании и трепетании предсердий они вызывают преходящее снижение частоты сердечных сокращений, а при желудочковой пароксизмальной тахикардии вообще неэффективны.
Отсутствие эффекта от рефлекторных приемов требует применения противоаритмических средств. Терапию пароксизмальной наджелудочковой тахикардии в условиях специализированного кардиореанимобиля и в стационаре начинают с в/в введения аденозина (АТФ), прерывающего круг повторного входа возбуждения в атриовентрикулярном узле: 10 мг (1 мл 1%-ного раствора) АТФ вводят в/в струйно болюсом в течение 5-10 с, при отсутствии эффекта через 2–3 мин повторно вводят еще 20 мг (2 мл 1%-ного раствора). Эффективность препарата при этом виде нарушений ритма составляет 90-100 %. Как правило, удается купировать пароксизмальную наджелудочковую тахикардию в течение 20–40 с после введения АТФ. Внутривенное введение аденозина позволяет также дифференцировать наджелудочковую тахикардию и трепетание предсердий с проведением 1:1, угнетение атриовентрикулярного проведения позволяет выявить на ЭКГ характерные волны трепетания, однако ритм при этом не восстанавливается.
При отсутствии эффекта от аденозина показано применение антагониста кальция верапамила (изоптина), также ухудшающего предсердно-желудочковую проводимость, но действующего более продолжительно (до 30 мин). Препарат вводят в/в болюсно в дозе 2,5–5 мг в течение 2–4 мин (во избежание развития коллапса или выраженной брадикардии). При сохранении тахикардии и отсутствии гипотонии возможно повторное введение 5-10 мг препарата через 15–30 мин. Верапамил следует применять только при нарушениях ритма с «узким» комплексом QRS. При «широком» комплексе QRS и подозрении на синдром Вольфа – Паркинсона – Уайта верапамил противопоказан, так как он укорачивает рефрактерный период дополнительных путей проведения и может вызвать увеличение частоты сердечных сокращений, падение АД и фибрилляцию желудочков. Кроме того, верапамил противопоказан пациентам, которым в течение последних 2 ч вводился какой-либо бета-адреноблокатор.
Альтернативой верапамилу может служить прокаинамид (новокаинамид), препарат можно также использовать при неэффективности верапамила, но не ранее чем через 15 мин после введения последнего и при условии сохранения стабильной гемодинамики. Новокаинамид эффективен при реципрокных тахикардиях у пациентов с синдромом Вольфа – Паркинсона – Уайта (когда верапамил противопоказан). При отсутствии АТФ и верапамила возможно также использование бета-адреноблокаторов (пропранолола) и сердечных гликозидов (дигоксина), однако их эффективность при пароксизмальной суправентрикулярной тахикардии составляет только 40–55 %. Если больному уже введен верапамил, то не ранее чем через 30 мин после его введения пропранолол (анаприлин) может быть использован сублингвально в дозе 10–20 мг. Препарат противопоказан при артериальной гипотонии и синдроме бронхиальной обструкции. Внутривенное введение пропранолола в дозе 0,15 мг/кг со скоростью 1 мг/мин желательно осуществлять под контролем ЭКГ-монитора в условиях кардиоблока. Пропранолол высоко эффективен при пароксизмальной тахикардии, обусловленной кругом повторного входа в синусовом или предсердножелудочковом узле, а при других вариантах тахикардии его применение позволяет снизить частоту сердечных сокращений.
Если приступ не купируется, а состояние больного ухудшается (что бывает редко при наджелудочковой тахикардии), то больного направляют в кардиологический стационар для купирования приступа путем частой внутрипредсердной или чреспищеводной стимуляции предсердий или при помощи электроимпульсной терапии.
Профилактика пароксизмов наджелудочковой тахикардии показана пациентам, у которых пароксизмы возникают часто либо сопровождаются тягостными субъективными ощущениями, стенокардией, гипотонией, декомпенсацией кровообращения. С этой целью чаще всего используют бетаадреноблокаторы, верапамил.
Желудочковая тахикардия, как и наджелудочковая, при нестабильной гемодинамике требует немедленной электроимпульсной терапии, после чего проводится поддерживающая терапия капельным введением лидокаина. В условиях стабильной гемодинамики средством выбора для купирования пароксизма желудочковой тахикардии является лидокаин. Препарат вводят в/в болюсно в дозе 1–2 мг/кг (80-100 мг) в течение 3–5 мин; возможна последующая поддерживающая капельная инфузия длительностью до 2436 ч со скоростью 20–55 мкг/кг/мин (максимально 2 мг/мин). При необходимости на фоне капельной инфузии допустимо дополнительное струйное введение лидокаина в дозе 40 мг через 10–30 мин после первого болюса. При удлинении интервала QT показано в/в капельное введение сульфата магния (кормагнезина) со скоростью 3-20 мг/мин. В дальнейшем возможен переход на профилактическое в/м введение лидокаина в дозе 2–4 мг/кг (160–200 мг; максимально 600 мг, а при инфаркте миокарда не более 300 мг) каждые 4–6 ч.
При неэффективности лидокаина применение других антиаритмиков показано при отсутствии побочных эффектов и сохранении стабильной гемодинамики (опасность коллапса и потенцирования аритмогенного действия антиаритмических препаратов) либо при невозможности проведения электроимпульсной терапии. В этих случаях вторым по значимости препаратом является прокаинамид (новокаинамид), вводимый в/в дробными дозами по 100 мг каждые 5 мин до восстановления синусового ритма или достижения насыщающей дозы (500-1000 мг). Эффективность прокаинамида при всех пароксизмальных тахикардиях делает его препаратом выбора для лечения тахикардии неустановленной природы с широким комплексом QRS (желудочковой либо наджелудочковой с аберрантным проведением или на фоне блокады ножек пучка Гиса).
После пароксизма тахикардии показан прием противоаритмического средства в малых дозах для профилактики рецидива. Для профилактики пароксизмов желудочковой тахикардии эффективны кордарон (высокая эффективность, токсическое действие при длительном приеме), мексилетин, пропафенон; бета-блокаторы менее эффективны (предупреждают желудочковую тахикардию, вызываемую катехоламинами или ишемией миокарда).
Мерцание и трепетание предсердий (мерцательная аритмия). Мерцание предсердий – хаотичное сокращение отдельных групп мышечных волокон предсердий, при этом предсердия в целом не сокращаются, а в связи с изменчивостью атриовентрикулярного проведения желудочки сокращаются аритмично, обычно с частотой около 100–150 в 1 мин. Трепетание предсердий – регулярное сокращение предсердий с частотой около 250–300 в 1 мин; частота желудочковых сокращений определяется предсердно-желудочковой проводимостью, желудочковый ритм может быть при этом регулярным или нерегулярным. Мерцание предсердий может быть стойким или пароксизмальным. Пароксизмы его нередко предшествуют стойкой форме. Трепетание встречается в 10–20 раз реже, чем мерцание, и обычно в виде пароксизмов. Иногда трепетание и мерцание предсердий чередуются. Мерцательная аритмия может наблюдаться при митральных пороках сердца, ишемической болезни сердца, тиреотоксикозе, алкоголизме. Преходящая мерцательная аритмия иногда наблюдается при инфаркте миокарда, интоксикации алкоголем.
На ЭКГ при мерцании предсердий зубцы Р отсутствуют, вместо них регистрируются беспорядочные волны, которые лучше видны в отведении V1; желудочковые комплексы следуют в неправильном ритме. При частом желудочковом ритме возможно возникновение блокады ножки, обычно правой, пучка Гиса. При наличии наряду с мерцанием предсердий нарушений атриовентрикулярной проводимости или под влиянием лечения частота желудочкового ритма может быть меньшей (менее 60 в 1 мин – брадисистолическое мерцание предсердий). Изредка мерцание предсердий сочетается с полной атриовентрикулярной блокадой (синдром Фредерика). При трепетании предсердий вместо зубцов Р регистрируются регулярные предсердные волны, без пауз, имеющие характерный пилообразный вид; желудочковые комплексы следуют ритмично после каждой 2-й, 3-й и т. д. предсердной волны или аритмично, если часто изменяется проводимость.
Симптомы. Мерцательная аритмия может не ощущаться больным или ощущается как сердцебиение. При мерцании предсердий и трепетании с нерегулярным желудочковым ритмом пульс аритмичен, звучность сердечных тонов изменчива. Наполнение пульса также изменчиво и часть сокращений сердца вообще не дает пульсовой волны (дефицит пульса). Трепетание предсердий с регулярным желудочковым ритмом может быть диагностировано только по ЭКГ. Мерцательная аритмия с частым желудочковым ритмом способствует появлению или нарастанию сердечной недостаточности. Как стойкая, так и особенно пароксизмальная мерцательная аритмия обусловливает склонность к тромбоэмболическим осложнениям.
Лечение. Постоянная нормосистолическая форма мерцательной аритмии без признаков сердечной недостаточности не нуждается в антиаритмической терапии. При пароксизме мерцания предсердий, длящемся более 2 дней, или невозможности установления давности мерцательной аритмии (нельзя исключить приступ тахисистолии на фоне постоянного мерцания), при доказанной дилатации левого предсердия (передне-задний размер более 4,5 см по данным эхо-КГ), у пожилых пациентов цель терапии заключается не в восстановлении синусового ритма, а в урежении желудочкового ритма (до 70–80 в 1 мин). Средством выбора для этого являются сердечные гликозиды; при необходимости добавляют малые дозы бетаадреноблокаторов (пропранолола). Систематический прием дигоксина способствует переводу пароксизмальной мерцательной аритмии в постоянную форму, которая после достижения рациональной частоты желудочкового ритма обычно лучше переносится больными чем частые пароксизмы; иногда на фоне этой терапии восстанавливается синусовый ритм.
Пароксизмы мерцательной аритмии нередко прекращаются спонтанно, в таких случаях больные часто не обращаются за медицинской помощью. Врачебная тактика при пароксизме мерцательной аритмии определяется стабильностью гемодинамики пациента. Пароксизм мерцания предсердий с высокой частотой желудочковых сокращений и развитием осложнений (гипотонии, отека легких, ангинозного приступа, обморока и др.) служит показанием для немедленной электроимпульсной терапии.
При неосложненном пароксизме мерцательной аритмии препаратом выбора является прокаинамид (новокаинамид), вводимый в/в медленно в дозе 1000 мг в течение 8 мин (10 мл 10 %-ного раствора, доведенные до 20 мл изотоническим раствором хлорида натрия) с постоянным контролем АД, частоты сердечных сокращений и ЭКГ. В момент восстановления синусового ритма введение препарата прекращается. В связи с возможностью снижения АД новокаинамид вводят в горизонтальном положении больного при заготовленном шприце с 0,1 мг мезатона. При исходно пониженном АД в один шприц с прокаинамидом набирают 20–30 мкг фенилэфрина (мезатона). Мезатон не только препятствует дальнейшему снижению АД, но и, вызывая вагусный рефлекс с барорецепторов, усиливает антиаритмический эффект новокаинамида. В поврежденном миокарде новокаинамид может вызывать потенциально опасные нарушения внутрижелудочковой проводимости, проявляющиеся на ЭКГ уширением желудочковых комплексов и блокадами ножек пучка Гиса.
В ряде случаев альтернативой прокаинамиду может служить верапамил. Этот препарат не всегда восстанавливает синусовый ритм, но эффективно снижает частоту сердечных сокращений за счет блокирующего влияния на атриовентрикулярный узел. Нельзя, однако, забывать о том, что при мерцательной аритмии у пациентов с синдромом Вольфа – Паркинсона – Уайта использование верапамила не показано (препарат улучшает проведение по дополнительным путям).
При магнийзависимом мерцании предсердий (в случае доказанной гипомагниемии или при наличии удлинения интервала QT) препаратом выбора служит сульфат магния (кормагнезин), являющийся в остальных случаях дополнительным средством для урежения ритма.
Тактика при пароксизме трепетания предсердий незначительно отличается от тактики при лечении пароксизма мерцательной аритмии. При осложненном пароксизме трепетания предсердий и высокой частоте сердечных сокращений (атриовентрикулярное проведение 1:1) показана экстренная электроимпульсная терапия. Неосложненное трепетание предсердий с высокой частотой сокращения желудочков требует, в первую очередь, урежения сердечного ритма, для чего используются дигоксин или верапамил.
При отсутствии эффекта от применения одного препарата на догоспитальном этапе медикаментозная терапия прекращается. Показана госпитализация, а при появлении осложнений проводится электроимпульсная терапия. Экстренная госпитализация показана также при впервые возникшем пароксизме и при нарушениях гемодинамики на фоне мерцательной аритмии. В условиях стационара пароксизм, длящийся менее 2 сут, купируют сразу. С этой целью нередко применяют хинидин по схеме (200 мг внутрь каждые 2 ч до восстановления ритма, обычно до суммарной дозы 1,6 г) или пролонгированный препарат – хинидин-дурулес (содержит 0,2 г активного вещества в таблетке и назначается в 2 приема, по 2–5 таблеток утром и вечером). В случае более длительных пароксизмов в связи с опасностью тромбоэмболии восстановление ритма (медикаментозное или плановой кардиоверсией) проводят в плановом порядке после предварительной подготовки антикоагулянтами. Результаты лечения тем лучше, чем короче продолжительность аритмии, меньше величина предсердий и выраженность сердечной недостаточности. Дефибрилляция противопоказана при значительном увеличении предсердий, тромбоэмболических осложнениях в ближайшем анамнезе, миокардите, редком желудочковом ритме (не связанном с лечением), выраженных нарушениях проводимости, интоксикации сердечными гликозидами, различных состояниях, препятствующих лечению антикоагулянтами. Частые пароксизмы мерцательной аритмии в прошлом также указывают на малую перспективность восстановления синусового ритма. В то же время в некоторых случаях излечение основного заболевания или его обострения (оперативное устранение порока, компенсация тиреотоксикоза, успешное лечение миокардита, прекращение приема алкоголя) может привести к восстановлению синусового ритма.
Профилактику пароксизмов мерцательной аритмии после восстановления синусового ритма проводят пациентам, у которых пароксизмы возникают часто либо сопровождаются тягостными субъективными ощущениями, развитием сердечной недостаточности, гипотонией, стенокардией. Учитывая тот факт, что пароксизму мерцательной аритмии нередко предшествует увеличение частоты сердечных сокращений вследствие активации симпато-адреналовой системы (например, при физической или эмоциональной нагрузке), с этой целью нередко используют бета-адреноблокаторы. Применение одного из наиболее эффективных средств для профилактики пароксизмов мерцательной аритмии – амиодарона (кордарона) – ограничено его высокой токсичностью при длительном приеме.
При частых, плохо переносимых пароксизмах, не предотвращаемых лекарственным лечением, может быть эффективным частичное или полное рассечение области перехода атриовентрикулярного узла в пучок Гиса (с помощью криовоздействия, чрезвенозной катетерной электроаблации), при необходимости – с последующей постоянной электрокардиостимуляцией. Это вмешательство выполняется в специализированных учреждениях.
Мерцание и трепетание желудочков, желудочковая асистолия могут возникнуть при любом тяжелом заболевании сердца (чаще в острой фазе инфаркта миокарда), при тромбоэмболии легочных артерий, передозировке сердечных гликозидов, противоаритмических средств, при электротравме, наркозе, при внутрисердечных манипуляциях, тяжелых общих метаболических нарушениях.
Симптомы – внезапное прекращение кровообращения, картина клинической смерти: отсутствие пульса, сердечных тонов, сознания, хриплое агональное дыхание, иногда судороги, расширение зрачков (начинается через 45 с после прекращения кровообращения). Дифференцировать мерцание и трепетание желудочков и асистолию возможно по ЭКГ. При мерцании желудочков ЭКГ имеет вид беспорядочных волн различной формы и величины. Крупноволновое мерцание (2–3 мВ) несколько легче обратимо при адекватном лечении, мелковолновое указывает на глубокую гипоксию миокарда. При трепетании желудочков ЭКГ сходна с ЭКГ при желудочковой тахикардии, но ритм чаще. Трепетание желудочков гемодинамически неэффективно. Асистолии (т. е. отсутствию электрической активности сердца) соответствует на ЭКГ прямая линия. Некоторое вспомогательное диагностическое значение имеет предшествующая аритмия: ранние политопные желудочковые экстрасистолы и желудочковая тахикардия чаще предшествуют мерцанию и трепетанию желудочков, нарастающая блокада – асистолии.
Лечение включает немедленный наружный массаж сердца, искусственное дыхание, которые следует продолжать до достижения эффекта (спонтанные тоны сердца и пульс) или в течение времени, необходимого для подготовки к электроимпульсной терапии (при мерцании и трепетании желудочков) или временной электрокардиостимуляции (при асистолии).
При трепетании или крупноволновой фибрилляции желудочков неэффективность прекордиального удара (резкого удара по передней грудной стенке) служит показанием к немедленному проведению электродефибрилляции возрастающими разрядами (200–360 Дж) до восстановления синусового ритма. В случае ее неэффективности, а также при мелковолновой фиб-рилляции или асистолии, на фоне ИВЛ и массажа сердца, в крупную вену (если система введения была налажена до реанимации), в периферическую вену (через длинный катетер, достигающий крупной вены и промываемый после каждого введения 50 мл изотонического раствора хлорида натрия) или, при полной невозможности быстрого налаживания внутрисосудистого введения, в трахею (максимальные рекомендуемые дозы на 10 мл изотонического раствора хлорида натрия вводятся в интубационную трубку с последующими несколькими интенсивными раздуваниями легких для их распыления по бронхам) вводится 0,5–1 мл адреналина на 10 мл изотонического раствора хлорида натрия с последующей электродефибрилляцией. Внутрисердечный путь введения лекарственных средств допустим лишь при невозможности интубации трахеи и отсутствии венозного доступа. При лечении асистолии может быть эффективным аналогичное двукратное введение 1 мг атропина сульфата. При неэффективности электродефибрилляции разрядом максимальной мощности струйно вводится лидокаин из расчета 1 мг/кг с последующим повторным разрядом. Препараты кальция не улучшают прогноз и обладают повреждающим действием на миокард, поэтому применение хлорида кальция (2–4 мг/кг струйно) целесообразно только при точно установленных гиперкалиемии, гипокальциемии или при интоксикации антагонистами кальция. Для профилактики повторных трепетания и мерцания желудочков после восстановления синусового ритма показано капельное профилактическое введение лидокаина, при удлинении интервала QT необходимо применение сульфата магния.
Блокады сердца – нарушения сердечной деятельности, связанные с замедлением или прекращением проведения импульса по проводящей системе. По локализации различают блокады синоатриальные (на уровне миокарда предсердий), атриовентрикулярные (на уровне атриовентрикулярного узла) и внутрижелудочковые (на уровне пучка Гиса и его разветвлений). По выраженности различают замедление проводимости (каждый импульс замедленно проводится в нижележащие отделы проводящей системы; блокада I степени), неполные блокады (проводится лишь часть импульсов; блокада II степени) и полные блокады (импульсы не проводятся, сердечная деятельность поддерживается эктопическим центром ведения ритма; блокада III степени).
Нарушения синоатриальной и атриовентрикулярной проводимости могут возникать при миокардитах, кардиосклерозе, очаговых и дистрофических поражениях миокарда, особенно в области заднедиафрагмальной стенки, интоксикациях, например, сердечными гликозидами, при повышении тонуса блуждающего нерва, под действием бета-адреноблокаторов, верапамила. Нарушения внутрижелудочковой проводимости чаще обусловлены некротическим, склеротическим или воспалительным процессами. Нетяжелые нарушения проводимости (синоатриальная и атриовентрикулярные блокады I и II степени, блокада правой ножки пучка Гиса или одной из ветвей левой ножки) изредка наблюдаются у практически здоровых лиц. Врожденная полная поперечная блокада встречается очень редко. В целом, чем дистальнее и выраженнее блокада, тем серьезнее ее клиническое значение. Все блокады могут быть стойкими или преходящими, преходящие блокады иногда свидетельствуют об обострении болезни сердца. Локализация и выраженность блокады определяются по ЭКГ, более надежно при внутрисердечной регистрации потенциалов проводящей системы.
Синоатриальная блокада (диагностируется лишь неполная блокада) на фоне синусового ритма или синусовой аритмии отмечается выпадение отдельных комплексов PQRST с соответствующим (вдвое, реже втрое и более) удлинением диастолической паузы.
Атриовентрикулярная блокада I степени: интервал P-Q удлинен до 0,21 с и более, но все предсердные импульсы достигают желудочков. Атриовентрикулярная блокада II степени: отдельные предсердные импульсы не проводятся в желудочки, соответствующий желудочковый комплекс выпадает (на ЭКГ изолированный зубец Р). При атриовентрикулярной блокаде типа Мобитц I (развивается на уровне атриовентрикулярного узла) такому выпадению предшествует прогрессирующее удлинение интервала P-Q в ряду 2–8 циклов, и эти периоды повторяются, иногда регулярно (периодика Венкебаха). При блокаде типа Мобитц II (на уровне пучка Гиса и дистальнее) выпадению отдельных циклов не предшествует постепенное удлинение интервала P-Q. Блокада дистального типа бывает при более тяжелом поражении миокарда, она чаще переходит в полную поперечную блокаду. Атриовентрикулярная блокада III степени – предсердия и желудочки возбуждаются в правильном, но независимом друг от друга ритме. При этом также может быть выделена блокада проксимального типа (узкий QRS, частота желудочкового ритма около 40–50 в 1 мин; ей предшествует неполная блокада проксимального типа) и дистального типа (широкий QRS, частота желудочкового ритма около 20–40 в 1 мин; предшествует ей, иногда очень кратковременно, неполная блокада дистального типа). Наиболее точное определение уровня блокады возможно при внутрисердечной регистрации потенциалов проводящей системы.
Внутрижелудочковые блокады касаются одной, двух или всех трех ветвей внутрижелудочковой проводящей системы (соответственно моно-, би– и трифасцикулярные блокады). Блокада передней или задней ветви левой ножки пучка Гиса характеризуется значительным отклонением электрической оси сердца соответственно влево или вправо (последний признак менее специфичен – должны быть исключены другие, более обычные причины правого типа ЭКГ). При блокаде правой ножки пучка Гиса начальная часть комплекса QRS сохранена, конечная расширена и зазубрена, продолжительность QRS обычно увеличена; в отведении V1 обычно увеличен и зазубрен зубец R, сегмент ST опущен, зубец Т отрицательный; электрическая ось на фронтальную плоскость проецируется плохо (S-тип ЭКГ в стандартных отведениях). Сочетание блокады правой ножки с блокадой одной из ветвей левой ножки (бифасцикулярная блокада) характеризуется по ЭКГ наличием признаков блокады правой ножки и значительным отклонением электрической оси. Блокада обеих ветвей левой ножки, блокада левой ножки: комплекс QRS расширен до 0,12 и более, зазубрен; в левых грудных отведениях преобладает зубец R, сегмент ST часто опущен, зубец Т отрицательный. Трифасцикулярная блокада соответствует атриовентрикулярной блокаде III степени дистального типа (см. выше).
Симптомы. При неполных поперечных блокадах отмечается выпадение пульса и сердечных тонов. Внутрижелудочковые блокады иногда сопровождаются расщеплением тонов, чаще – блокада правой ножки пучка Гиса. Полная поперечная блокада характеризуется стабильной брадикардией, изменчивой звучностью тонов сердца, обмороками, судорогами (приступы Морганьи – Адамса – Стокса). Стенокардия, сердечная недостаточность, внезапная смерть могут возникать при полной поперечной блокаде, особенно дистального типа.
Лечение. Лечат основное заболевание, устраняют факторы, приведшие к блокаде. При нарушениях внутрижелудочковой проводимости антиаритмическая терапия не показана. При клинически проявляющейся атриовентрикулярной блокаде бывает достаточно увеличить частоту сердечных сокращений внутривенным введением 0,1 %-ного раствора атропина сульфата в дозе 0,3–1,0 мл с повторением начальной дозы при ее эффективности через 4–5 ч. Отсутствие эффекта служит показанием к временной электрокардиостимуляции, а при невозможности ее проведения по жизненным показаниям может быть использован орципреналин (в дозе 10–30 мкг/мин под контролем частоты сердечных сокращений внутривенно капельно до появления терапевтического эффекта). Стойкие блокады, приведшие к недостаточности сердца и (или) периферического кровообращения, а также неполные и полные блокады дистального типа являются показанием к постоянной желудочковой электростимуляции.
Синдром слабости синусового узла (СССУ) связан с ослаблением или прекращением автоматизма синусового узла. СССУ может быть обусловлен ишемией области узла (нередко при инфаркте миокарда, особенно заднем, как преходящее или стойкое осложнение), кардиосклерозом (атеросклеротическим, постмиокардитическим, особенно после дифтерии), миокардитом, кардиомиопатией, а также инфильтративными поражениями миокарда. СССУ может быть также проявлением врожденной особенности проводящей системы. Процесс, обусловивший возникновение СССУ, иногда распространяется и на другие отрезки проводящей системы.
Симптомы. Наиболее характерно сочетание синусовой брадикардии или брадиаритмии с пароксизмами тахисистолических и эктопических аритмий. Другие проявления синдрома: периоды замещающего эктопического ритма и иногда полной асистолии, миграция водителя ритма, мерцание предсердий (более характерно с редким желудочковым ритмом, что указывает на вовлечение атриовентрикулярного узла), синоатриальная блокада, экстрасистолия и тахикардия, чаще над желудочковые. Характерно, что непосредственно после тахикардии пауза особенно велика, необычное увеличение паузы может быть заметно и после экстрасистолы. У многих больных СССУ не сопровождается никакими неприятными ощущениями. В части случаев могут быть признаки недостаточного кровоснабжения мозга, сердца, возможна сердечная недостаточность. Больные плохо переносят ваготропные воздействия.
Лечение. Многие больные не нуждаются в лечении. При частой смене ритма, при признаках нарушения кровоснабжения жизненно важных органов показана постоянная электрокардиостимуляция. До установки кардио-стимулятора симпатомиметики и противоаритмические средства в общем противопоказаны, поскольку они могут опасно усилить соответственно тахи– или брадикардический компонент синдрома. Прогноз в большой степени зависит от заболевания, приведшего к развитию синдрома.
Синдром преждевременного возбуждения желудочков (Вольфа– Паркинсона-Уайта) – электрокардиографический синдром с укорочением интервала P-Q и расширением комплекса QRS за счет начальной так называемой дельта-волны. Синдром может быть стойким или преходящим. В его основе лежит врожденная особенность проводящей системы (наличие дополнительных проводящих путей). Синдром может обнаружиться уже при рождении или проявляется позже, диагноз ставят только по ЭКГ. В некоторых отведениях возможна регистрация зубца Q, изменений сегмента S-T, что иногда ведет к ошибочной диагностике ишемической болезни сердца, инфаркта миокарда, гипертрофии желудочков. Приблизительно у половины больных наблюдаются различной частоты и продолжительности пароксизмы наджелудочковой тахикардии, реже – мерцательной аритмии (изредка с очень частым желудочковым ритмом – около 200 в 1 мин). Синдром может случайно сочетаться с любым заболеванием сердца.
Лечение в отсутствие пароксизмальных аритмий не требуется, следует избегать воздействий, которые могут их спровоцировать (например, приема алкоголя). Лекарственное лечение и профилактику пароксизмов тахикардии проводят в основном так же, как при пароксизмальной наджелудочковой тахикардии другой природы; дигоксин и верапамил противопоказаны. Если лекарственное лечение пароксизма неэффективно, а состояние больного ухудшается, прибегают к электроимпульсному лечению. Если приступы часты или связаны с тяжелой симптоматикой, то вне приступов проводят профилактическое лечение, подбирая эффективное противоаритмическое средство. При частых и плохо переносящихся приступах и неэффективности лекарственной профилактики хирургически разрушают дополнительный проводящий путь с последующей постоянной электрокардиостимуляцией в необходимых случаях.
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ (АГ) – стойкое повышение АД выше границ физиологической нормы (140/90 мм рт. ст.) у лиц, не получающих гипотензивную терапию. Под изолированной систолической АГ понимают стойкое повышение систолического АД выше 140 мм рт. ст. при нормальном диастолическом АД.
При отсутствии осложнений АГ протекает почти бессимптомно и выявляется лишь при случайном осмотре пациента, основной метод диагностики – обнаружение повышенного АД при помощи сфигноманометра. АД измеряют через 1–2 ч после приема пищи, после 5-минутного отдыха, в положении сидя; у пожилых пациентов и больных сахарным диабетом рекомендуется также измерение АД в положении лежа и стоя. Плечо, на которое накладывают манжету, должно находиться на уровне сердца, манжета охватывает плечо по меньшей мере на 2/3, не наползая на локтевой сгиб; использование узкой или короткой манжеты приводит к ложному завышению АД. Уровень систолического АД определяется при появлении I фазы тонов Короткова; диастолическое АД у взрослых людей соответствует V фазе Короткова (исчезновение тонов), у детей – IV фазе (резкое ослабление тонов). При первом осмотре больного врач обязан измерить АД на обеих руках в положении лежа и стоя, а при соответ-ствующих показаниях – и на ногах. Учитывая возможность спонтанных колебаний АД диагноз «артериальная гипертензия» должен основываться на результатах многократного (не менее 2 раз) его измерения в различной обстановке.
При значительных колебаниях уровня АД во время визитов к врачу, при подозрении на гипертонию «белого халата», при клинических признаках эпизодов гипотонии, а также при АГ, рефрактерной к проводимой терапии, рекомендуется проведение суточного мониторирования АД. Кроме того, суточное мониторирование АД позволяет более четко и быстро отслеживать реакции больного на прием назначенных препаратов в стационарных и амбулаторных условиях.
Различают первичную, или эссенциальную, АГ (гипертоническая болезнь), когда причину развития АГ выявить не удается, и вторичные АГ. Вторичные (симптоматические) АГ составляют около 5 % всех случаев хронического или часто повторяющегося повышения как систолического, так и диастолического АД. Их возникновение связано с повреждением органов или систем, оказывающих прямое или опосредованное воздействие на уровень АД. Повышение АД является одним из симптомов заболевания этих органов или систем. Устранение этиологического или ведущего патогенетического фактора часто приводит к нормализации либо к заметному понижению АД. В зависимости от вовлеченности в процесс повышения АД того или иного органа вторичные АГ классифицируют следующим образом: 1) почечные – а) паренхиматозные, б) реноваскулярные, в) после трансплантации почек; 2) эндокринные; 3) гемодинамические (кардиоваскулярные, механические); 4) нейрогенные (очаговые); 5) остальные.
К группе почечных паренхиматозных АГ, составляющих большую часть случаев вторичной АГ, относят АГ при острых и хронических гломерулонефритах и пиелонефритах, поликистозе почек, врожденном или приобретенном обструктивном гидронефрозе, аномалиях почек, диабетическом гломерулосклерозе, волчаночном нефрите, почке при лучевой болезни и т. д. Реноваскулярные АГ (1/3 случаев почечных АГ) могут быть врожденными (например, при фиброзно-мышечной дисплазии почечных артерий) и приобретенными (чаще в результате атеросклеротического сужения почечных артерий или неспецифического аортоартериита). После трансплантации почки АГ возникает при развитии реакций отторжения трансплантата, «трансплантат против хозяина», при стенозе артерии пересаженной почки, а также вследствие осложнений иммуносупрессивной терапии в послеоперационном периоде.
Эндокринные АГ обусловлены феохромоцитомой и другими хромаффинными опухолями, первичным альдостеронизмом (синдром Кона), болезнью и синдромом Иценко – Кушинга, акромегалией и др. Гемодинамические, или кардиоваскулярные, АГ возникают в результате изменений гемодинамики, в основном за счет механических факторов. К ним относятся систолические АГ при атеросклерозе аорты, недостаточности клапанов аорты, открытом артериальном протоке, артериовенозных фистулах, полной атриовентрикулярной блокаде, болезни Педжета, тиреотоксикозе (некоторые авторы относят эту форму к АГ эндокринного типа); систолодиастологическая АГ гемодинамического типа развивается при коарктации аорты. Нейрогенные АГ возникают при очаговых повреждениях и заболеваниях головного и спинного мозга (опухолях, энцефалите, бульбарном полиомиелите, квадриплегии – гипертензивные кризы), при возбуждении сосудодвигательного центра продолговатого мозга, вызванном гиперкапнией и дыхательным ацидозом. К «остальным» АГ можно отнести симптоматические АГ у больных полицитемией, при карциноидном синдроме, острой порфирии, отравлениях свинцом, таллием, передозировке преднизолона, катехоламинов, эфедрина, «сырной болезни» – употреблении вместе с ингибиторами МАО пищевых продуктов, содержащих тирамин (некоторые сорта сыра и красное вино). В эту группу включают АГ у женщин с поздним токсикозом беременных, а также АГ, возникающую у принимающих гормональные контрацептивные средства женщин.
Симптомы и лечение вторичных АГ во многом сходны с таковыми при эссенциальной АГ, хотя есть и определенные клинические особенности. Реноваскулярную АГ можно заподозрить при развитии заболевания в молодом возрасте (до 30 лет), злокачественной, резистентной АГ, при распространенном атеросклерозе, выявлении шума в проекции почечных артерий. При феохромоцитоме возможно постоянное повышение АД либо кризовое течение. Резкое повышение АД (особенно диастолического) при кризах сопровождается выраженной головной болью, потливостью, возбуждением, дрожью. Существенную помощь могут оказать анамнестические данные: если известно, что давление между приступами нормальное, отчетливых указаний на перенесенные психические травмы, нервное перенапряжение нет, при молодом возрасте больных следует подумать в первую очередь о феохромоцитоме. Наличие последней особенно вероятно, если приступы возникают в связи с давлением на поясничную область или изменением положения тела; характерны гипергликемия и лейкоцитоз в момент приступа. Для уточнения диагноза исследуют уровень гормонов мозгового вещества надпочечников и продуктов их обмена в крови и моче, проводят компьютерную томографию надпочечников. При первичном альдостеронизме АГ сочетается с гипокалиемией; больные жалуются на мышечную слабость, судороги; отмечаются полиурия, полидипсия, нарушение толерантности к глюкозе. При коарктации аорты АД на руках выше, чем на ногах, выслушивается систолический шум в проекции грудной аорты спереди и в межлопаточной области. Высокое систолическое давление (выше 160–170 мм рт. ст.) при нормальном или сниженном диастолическом давлении у лиц старше 60–65 лет обычно связано с атеросклеротическим уплотнением аорты.
При ряде заболеваний возможно этиологическое лечение: хирургическое удаление феохромоцитом, аденом надпочечника, реконструктивные операции на сосудах почек, аорте, артериовенозных фистулах; отмена препаратов, повышающих АД, и др. Медикаментозная терапия вторичной АГ существенно не отличается от лечения при эссенциальной АГ. При феохромоцитоме состояние больного может ухудшиться на фоне терапии бета-адреноблокаторами, при реноваскулярной АГ на фоне лечения ингибиторами АПФ возможно нарушение функции почек.
Эссенциальная артериальная гипертензия составляет до 92–95 % всех случаев хронического повышения АД. По данным обследования репрезентативной выборки (1993), около 40 % взрослых людей в России страдают эссенциальной АГ.
Этиология и патогенез. Причины формирования эссенциальной АГ с достоверностью не установлены, хотя отдельные звенья патогенеза этого заболевания известны. Повышение АД может быть обусловлено повышением общего периферического сопротивления в результате вазоконстрикции, увеличением сердечного выброса либо сочетанием этих факторов. В этом процессе могут играть роль активация симпато-адреналовой и ренин-ангиотензиновой систем. Норадреналину, в частности, отводится роль эффекторного агента в теории Г. Ф. Ланга о решающей роли психического перенапряжения и психической травматизации в возникновении гипертонической болезни. Предполагается, что для формирования эссенциальной АГ необходимо сочетание наследственной предрасположенности к заболеванию с неблагоприятными воздействиями на человека внешних факторов (образа жизни в целом, в том числе характера питания, количества натрия в пище). Эпидемиологические исследования подтверждают наличие связи между степенью ожирения и повышением АД, однако увеличение массы тела скорее следует относить к числу предрасполагающих, чем собственно причинных факторов.
Симптомы, течение. Эссенциальная АГ протекает хронически с периодами ухудшения и улучшения. Повышенное АД со временем приводит к изменениям сосудов, нарушениям работы сердца, головного мозга, почек, зрения; эти органы называют «мишенями» АГ. В течении заболевания традиционно выделяют 3 стадии: 1-я – начальная, характеризуется непостоянным (транзиторным) повышением АД, которое быстро нормализуется самостоятельно; на этой стадии поражение органов-мишеней отсутствует. Во 2-й стадии стабильное повышение АД купируется только применением лекарственных средств, имеются начальные признаки поражения одного из органов-мишеней (например, гипертрофия левого желудочка сердца, сужение артерий сетчатки, изменения мочевого осадка, атеросклеротическое поражение аорты, сонных, коронарных артерий). В 3-й стадии заболевания выявляются целые комплексы признаков поражения органов-мишеней, обусловленные органическими изменениями в сосудах и кровоснабжаемых ими органах (стенокардия, инфаркт миокарда, сердечная недостаточность, инсульт, почечная недостаточность и др.).
У многих больных, однако, выявить стадийность заболевания не удается, поэтому в последние годы вместо понятия «стадия», подразумевающего прогрессирование состояния во времени, предложено использовать понятие «степень» АГ, отражающее уровень повышения АД. В зависимости от степени повышения АД предложено выделять гипертензию первой (АД 140–159/90-99 мм рт. ст.), второй (АД 160–179/100-109 мм рт. ст.) и третьей (АД выше 180/110 мм рт. ст.) степени.
Эпидемиологические наблюдения показывают, что даже умеренные повышения АД увеличивают в несколько раз опасность развития в будущем мозгового инсульта и инфаркта миокарда. Для оценки риска развития сердечно-сосудистых заболеваний и выбора лечебной тактики, помимо степени АГ, важнейшую роль играют наличие сопутствующих факторов риска, поражение органов-мишеней и наличие сопутствующих заболеваний. К основным факторам риска развития сердечно-сосудистых осложнений, помимо АГ, относят пол и возраст (мужчины – старше 55 лет, женщины – старше 65 лет), курение, гиперхолестеринемию, указания на преждевременное развитие сердечно-сосудистых заболеваний в семейном анамнезе. Поражение органов-мишеней подразумевает выявление гипертрофии левого желудочка (по данным ЭКГ, эхокардиографии, рентгенографии органов грудной клетки), протеинурию и (или) креатининемию, ультразвуковые признаки атеросклеротического поражения сонных, подвздошных, бедренных артерий, аорты, сужение сосудов сетчатки. Важнейшие сопутствующие клинические состояния, связанные с АГ, включают сосудистые заболевания головного мозга (геморрагический инсульт, инфаркт мозга, транзиторная ишемическая атака), сердца (инфаркт миокарда, стенокардия, застойная сердечная недостаточность и др.), заболевания почек (диабетическая нефропатия, почечная недостаточность), поражения сосудов (рассла-ивающая аневризма аорты, поражение периферических артерий с клиническими проявлениями), гипертоническую ретинопатию (кровоизлияния, экссудаты, отек диска зрительного нерва), сахарный диабет.
Таблица 10. Оценка риска сердечно-сосудистых осложнений у больных АГ
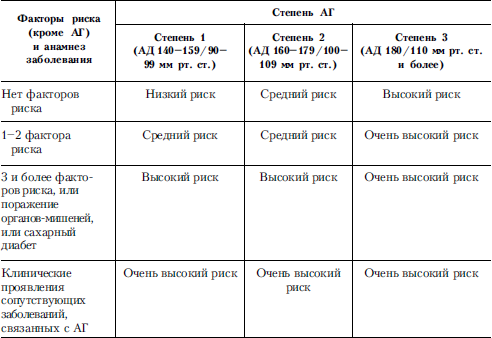
Критерии оценки риска развития других сердечно-сосудистых заболеваний у больных АГ приведены в табл. 10. Группа низкого риска развития сердечно-сосудистых заболеваний (менее 15 % в ближайшие 10 лет) включает мужчин и женщин моложе 55 лет с АГ 1-й степени при отсутствии других факторов риска, поражения органов мишеней и сопутствующих сердечно-сосудистых заболеваний. Группа среднего риска (15–20 % в течение ближайших 10 лет) объединяет пациентов с АГ 2-й степени при отсутствии других факторов риска, поражения органов мишеней и сопутствующих сердечно-сосудистых заболеваний и больных АГ 1-2-й степени с 1–2 другими факторами риска при отсутствии поражения органов-мишеней и сопутствующих заболеваний. Высокий риск развития сердечно-сосудистых заболеваний (более 20 %) отмечается у пациентов с поражением органов-мишеней, множественными другими факторами риска, независимо от степени повышения АД. Группа очень высокого риска (более 30 %) включает пациентов с сопутствующими сердечно-сосудистыми заболеваниями.
Под злокачественной АГ (первичной или вторичной) понимают стойкое повышение АД выше 220/130 мм рт. ст. в сочетании с выраженной ретинопатией, поражением почек. Злокачественная АГ в большинстве случаев обусловлена феохромоцитомой, реже – реноваскулярной гипертонией, первичным гиперальдостеронизмом, паренхиматозными заболеваниями почек, эссенциальной АГ. Злокачественная АГ быстро приводит к развитию гипертрофии левого желудочка с нарушениями сердечного ритма, сердечной недостаточностью, инфарктам миокарда и инсультам, протеинурии и почечной недостаточности.
Лечение. Целью лечения АГ является снижение риска развития сердечно-сосудистых осложнений и летальности, что предполагает снижение уровня АД до целевого (менее 140/90 мм рт. ст.), а также коррекцию всех выявленных факторов риска (например, адекватное лечение гиперхолестеринемии, сахарного диабета). Лечение АГ осуществляется с помощью нефармакологических и фармакологических методов. К нефармакологическому лечению относят: а) понижение массы тела (не менее чем на 5 кг) за счет уменьшения в рационе жиров и углеводов; б) ограничение потребления поваренной соли до 4–5 г в сутки, а при склонности к задержке натрия и воды до 2 г в сутки; в) отказ от курения; г) уменьшение потребления алкоголя по крайней мере до 20–30 мг чистого этанола в сутки для мужчин и до 10–20 мг в сутки для женщин; д) увеличение физической активности (например, ходьба пешком, плавание в течение 30–45 мин 3–4 раза в неделю). Определенную роль играют курортное лечение, методы физиотерапии и лечебной физкультуры, психотерапевтические воздействия.
Немедикаментозные методы лечения рекомендуют всем пациентам с АГ. У пациентов с низким риском развития осложнений немедикаментозная терапия может проводиться в течение 6 мес; у пациентов со средним риском при ее неэффективности в течение 6 мес переходят к медикаментозной терапии. При этом нефармакологические методы лечения постоянно используются в качестве фона для успешного проведения фармакологического лечения – изменение образа жизни повышает эффективность медикаментозной терапии, позволяет уменьшить дозы гипотензивных средств и помогает корректировать другие факторы риска сердечно-сосудистых осложнений АГ.
У пациентов с высоким или очень высоким риском развития сердечнососудистых осложнений медикаментозную терапию АГ начинают безотлагательно. Фармакологическое лечение основано на так называемом «ступенчатом» принципе, который предусматривает назначение в определенной последовательности лекарств с различной точкой приложения их действия до момента нормализации АД, а при неудаче – переход к альтернативному плану. Поскольку курсовое лечение АГ малоэффективно (в большинстве случаев АГ нельзя вылечить, ее необходимо лечить всю жизнь), пациент должен получать индивидуально подобранную гипотензивную терапию постоянно. Для длительного лечения АГ в настоящее время используют бета-адреноблокаторы, диуретики, ингибиторы ангиотензин-превращающего фермента (АПФ), блокаторы ангиотензиновых рецепторов, антагонисты кальция, альфа-адреноблокаторы. Раунатин, резерпин и комбинированные препараты, содержащие резерпин, считаются малоэффективными.
Гипотензивное лечение в объеме первой ступени подразумевает использование для приема внутрь одного препарата, начиная с минимальных его доз. В большинстве случаев используют бета-адреноблокатор или диуретик, поскольку применение этих лекарственных средств достоверно снижает риск развития инсульта, инфаркта миокарда и внезапной смерти; в последние годы в качестве гипотензивных средств первой линии рекомендовано также использование ингибиторов АПФ. При хорошем эффекте дозу препарата постепенно повышают до достижения желаемого уровня АД. При плохой переносимости или недостаточной эффективности возможен переход на другое гипотензивное средство. При недостаточном эффекте монотерапии добавляют второй препарат (например, бета-адреноблокатор + диуретик, ингибитор АПФ + диуретик, антагонист кальция дигидропиридинового ряда + диуретик). При необходимости к терапии добавляют третий препарат (например, бета-адреноблокатор + диуретик + ингибитор АПФ, бета-адреноблокатор + диуретик + альфа-адреноблокатор). При выборе этих сочетаний принимают во внимание противопоказания, возможные побочные эффекты препаратов, взаимодействие лекарственных веществ. Не рекомендуется комбинированное лечение препаратами однонаправленного действия (например, бета-адреноблокатор + верапамил или дильтиазем; антагонист кальция дигидропиридинового ряда + альфа-адреноблокатор). При отсутствии необходимости в экстренном снижении АД или побочных явлений интервал между ступенями лечения состав-ляет около 4 нед. При стабилизации АД на протяжении года можно попытаться уменьшить дозы препаратов или их количество.
При подборе гипотензивной терапии предпочтение отдается длительно действующим лекарственным средствам, позволяющим при однократном приеме эффективно контролировать АД на протяжении суток. Это позволяет плавно снизить АД и предупредить повышение его в утренние часы (когда часто развиваются инфаркты миокарда и инсульты); кроме того, однократный в сутки прием лекарств безусловно комфортнее для пациента. Длительным действием обладают некоторые бета-адреноблокаторы – бисопролол (конкор), бетаксолол (локрен), метопролол-ретард (бета-локзок), ингибиторы АПФ – периндоприл (престариум), фозиноприл (моноприл), трандалоприл (гоптен), блокаторы ангиотензиновых рецепторов – вальсартан (диован), ирбесартан (апровель); антагонисты кальция – амлодипин (норваск), фелодипин (плендил), изоптин-ретард; альфа-адреноблокаторы – доксазозин (кардура). Применение короткодействующих гемодинамически активных препаратов (капотена, коринфара, клофелина) для длительной терапии АГ не рекомендуется, эти препараты используются для купирования гипертонического криза.
При выборе гипотензивной терапии необходимо учитывать весь спектр сопутствующей патологии. Бета-адреноблокаторам отдают предпочтение, если у больного имеются ишемическая болезнь сердца (стенокардия, перенесенный инфаркт миокарда), тахиаритмии. В последние годы показана целесообразность применения малых доз бета-адреноблокаторов при сердечной недостаточности. Противопоказаниями к назначению бета-адреноблокаторов служат обструктивные заболевания легких, сосудов, нарушения атриовентрикулярной проводимости. Начальная терапия может проводиться анаприлином в дозе 80 мг в сутки (разделенной на четыре приема); урежение пульса до 70–60 в 1 мин наступает через 2–3 дня, а стойкое понижение АД к концу 1-й – началу 2-й недели лечения. Вместо анаприлина могут быть использованы атенолол в начальной дозе 50 мг в сутки в 2 приема, метопролол в дозе 100 мг в 2 приема с увеличением при необходимости дозы препаратов. После подбора терапии при отсутствии побочных эффектов целесообразно перейти на лечение пролонгированными препаратами.
Диуретику отдают предпочтение при сопутствующей сердечной недостаточности, у пожилых больных, при изолированной систолической гипертензии. Гипотиазид в начальной дозе 12,5-25 мг в сутки больные принимают 1 раз в 1–2 дня, при необходимости дозу увеличивают до 50-100 мг в сутки в 1–2 приема (утром и днем). Длительный прием диуретика может вызвать гипокалиемию, поэтому целесообразно комбинировать прием гипотиазида с ингибитором АПФ. Если больной не получает ингибиторов АПФ, возможно использование комбинированного препарата, содержащего гипотиазид и калийсберегающий диуретик триамтерен (триампур). У части больных в результате систематического приема тиазидных диуретиков в больших дозах возрастает концентрация в плазме триглицеридов и в меньшей степени холестерина, что требует врачебного контроля; возможны декомпенсация сахарного диабета, нарушения половой функции у мужчин. Более безопасна терапия метаболически нейтральным диуретиком индапамидом; в длительно действующей форме (арифон-ретард) препарат эффективен в дозе 1,5 мг 1 раз в сутки.
Использование ингибиторов АПФ целесообразно при наличии сопутствующей сердечной недостаточности, после перенесенного инфаркта миокарда, при диабетической нефропатии, а также при гипертрофии левого желудочка и протеинурии (обладают кардио– и нефропротективным действием). Их использование противопоказано во время беременности, лактации, в детском возрасте, при двустороннем стенозе почечных артерий, гиперкалиемии, аортальном или субаортальном стенозе, состоянии после трансплантации почки. Побочные эффекты – гипотония, кашель, отек Квинке, ухудшение функции почек – наблюдаются редко. Чаще других используют каптоприл (капотен) в дозе 25–50 мг 2–3 раза в сутки, эналаприл (ренитек) в дозе 5-20 мг 1–2 раза в сутки, периндоприл (престариум) в дозе 4–8 мг 1 раз в сутки, фозиноприл (моноприл) в дозе 10–40 мг 1 раз в сутки.
Антагонисты ангиотензиновых рецепторов (лозартан по 50-100 мг в сутки, вальзартан по 80-160 мг в сутки, ирбезартан по 8-16 мг в сутки) используют при непереносимости ингибиторов АПФ (кашель) по тем же показаниям. Антагонисты кальция дигидропиридинового ряда (амлодипин по 2,5-10 мг 1 раз в сутки, фелодипин по 2,5-10 мг 1 раз в сутки и др.) применяют при изолированной систолической гипертензии (когда противопоказаны или неэффективны диуретики). Верапамил показан при сопутствующей ишемической болезни сердца, стенокардии, наджелудочковых нарушениях ритма, если бета-адреноблокаторы противопоказаны (в частности, при обструктивных заболеваниях легких). Антагонисты кальция широко применяются у пожилых больных, у пациентов с диабетической нефропатией (когда противопоказаны или неэффективны ингибиторы АПФ). Верапамил и дильтиазем противопоказаны при нарушении атриовентрикулярной проводимости; нежелательно применение антагонистов кальция при сердечной недостаточности.
Альфа-адреноблокаторы в большинстве случаев не применяются при начальной терапии АГ. Целесообразно использовать их при неэффективности других вазодилататоров, а также у мужчин с аденомой предстательной железы, нарушениями половой функции. Празозин назначают в начальной дозе 0,5 мг 2–3 раза в сутки. Дозу при необходимости можно медленно повышать в течение 2–4 нед до средней терапевтической (4–6 мг в сутки). Необходимо помнить о способности празозина вызывать ортостатическую гипотензию. Более целесообразно и безопасно применение длительно действующего препарата доксазозина. Начальная его доза также составляет 0,5–1 мг 1 раз в сутки, постепенно дозу повышают до средней терапевтической (2–4 мг в сутки).
При выборе гипотензивной терапии необходимо также учитывать влияние препаратов на качество жизни. Так, тиазидные диуретики и неселективные бета-адреноблокаторы могут ухудшать половую функцию мужчин, поэтому в соответствующей ситуации следует отдавать предпочтение безопасным с этой точки зрения лекарственным средствам – пролонгированным антагонистам кальция, кардиоселективным бета-адреноблокаторам, ингибиторам АПФ. Начальное лечение больных АГ часто проводят в амбулаторных условиях. Госпитализация показана при стойком повышении АД до 220/120 мм рт. ст. и неэффективности проводимой гипотензивной терапии, при злокачественной АГ, при подозрении на симптоматическую АГ для уточнения диагноза. Раннее начало лечения и эффективный постоянный контроль уровня АД значительно улучшают прогноз.
АРТЕРИАЛЬНАЯ ГИПОТЕНЗИЯ характеризуется систолическим давлением ниже 100 мм рт. ст., диастолическим давлением – ниже 60 мм рт. ст. Различают первичную и вторичную артериальные гипотензии. Первичная, или эссенциальная, гипотензия проявляется в 2 вариантах: 1) как конституционально-наследственная установка регуляции сосудистого тонуса и АД, не выходящая за физиологические пределы («физиологическая гипотензия»); 2) как хроническое заболевание с типичной симптоматикой: слабость, головокружение, повышенная утомляемость, головная боль, сонливость, вялость, склонность к ортостатическим реакциям, обморокам, укачиванию, повышенная термо– и барочувствительность («нейроциркуляторная астения»).
Вторичная артериальная гипотензия наблюдается при некоторых инфекционных заболеваниях, болезни Аддисона, язвенной болезни, микседеме, анемии, гипогликемии, остром и хроническом гепатите, циррозе печени, при действии лекарственных препаратов и т. д.
Лечение гипотензивных состояний направлено на устранение причины и основного патогенетического фактора, либо оно ограничивается применением тонизирующих средств, вазопрессоров, добавлением в пищу поваренной соли, употреблением кофе, крепкого чая; полезны физические упражнения.
АТЕРОСКЛЕРОЗ – наиболее распространенное хроническое заболевание артерий эластического (аорта, ее ветви) и мышечно-эластического (артерии сердца, головного мозга и др.) типа, с формированием одиночных и множественных очагов липидных, главным образом холестериновых отложений – атеросклеротических бляшек – во внутренней оболочке артерий. Последующие разрастания в ней соединительной ткани (склероз) и кальциноз стенки сосуда приводят к медленно прогрессирующей деформации и сужению его просвета вплоть до полного запустевания (облитерации) артерии и тем самым вызывают хроническую, медленно нарастающую недостаточность кровоснабжения органа, питаемого через пораженную артерию. Кроме того, возможна острая закупорка (окклюзия) просвета артерии либо тромбом, либо (значительно реже) содержимым распавшейся атероматозной бляшки, либо и тем и другим одновременно, что ведет к образованию очагов некроза (инфаркт) или гангрены в питаемом артерией органе (части тела). Атеросклероз встречается с наибольшей частотой у мужчин в возрасте 50–60 и у женщин старше 60 лет.
Патогенез сложен и не вполне расшифрован. Несомненно значение так называемых факторов риска развития атеросклероза. Некоторые из них неустранимы: возраст (атеросклероз чаще развивается у больных в возрасте 40–50 лет и старше), принадлежность к мужскому полу, период постменопаузы у женщин, отягощенная по атеросклерозу семейная наследственность. Другие в той или иной мере устранимы: гиподинамия, артериальная гипертензия, алиментарное ожирение, курение, сахарный диабет. Важнейшую роль в развитии атеросклероза играют нарушения липидного обмена.
Симптомы, течение. Клиническая картина варьирует в зависимости от преимущественной локализации и распространенности процесса, но всегда (за исключением атеросклероза аорты) определяется проявлениями и последствиями ишемии ткани или органа, зависящими как от степени сужения просвета магистральных артерий, так от развития коллатералей. Диагноз обосновывается признаками поражения отдельных сосудистых областей или артерий. Раньше всего и, как правило, тяжелее поражается аорта, особенно ее абдоминальный отдел. Наиболее доказательное проявление атеросклероза – трансмуральный инфаркт миокарда. Диагноз весьма вероятен также при сочетании признаков стеноза каких-либо магистральных артерий и артерий сердца; у лиц зрелого возраста, которые выглядят значительно старше своих лет; в случае отягощенной атеросклерозом и артериальной гипертензией наследственности. Следует учитывать также наличие факторов риска.
Лечение атеросклероза включает немедикаментозные методы и гиполипидемическую терапию. К немедикаментозным методам относят: 1) рациональное питание с уменьшением потребления продуктов, содержащих насыщенные жирные кислоты (животные жиры, сливочное масло, яйца), и увеличением потребления продуктов, содержащих полиненасыщенные жирные кислоты (жидкое растительное масло, рыба, морские продукты), снижением потребления холестерина; 2) двигательную активность в любых формах – соразмерную возрасту и физическим возможностям больного; при этом дозировку упражнений, особенно при целенаправленной тренировке наиболее пораженного органа (артериального бассейна), рекомендует врач; 3) устранение факторов риска развития сердечно-сосудистых заболеваний; в том числе при избыточной массе тела – настойчивое ее снижение до оптимального уровня; систематическое лечение сопутствующих болезней, в особенности артериальной гипертензии, сахарного диабета; отказ от курения и др.
Можно считать доказанным, что снижение уровня атерогенных липидов крови приводит к прекращению прогрессирования атеросклероза, иногда – к обратному развитию уже имеющихся атеросклеротических бляшек, а также к снижению летальности от сердечно-сосудистых заболеваний. Нормальное содержание в плазме холестерина – 3,5–5,2 ммоль/л, триглицеридов – 0,5–2,0 ммоль/л. При гиперлипидемии лечение начинается с неме-дикаментозных методов (диета, дозированные нагрузки), при отсутствии эффекта в течение 3 мес диету ужесточают, при сохранении гиперлипидемии через 3 мес начинают медикаментозную гиполипидемическую терапию (больные при этом продолжают соблюдать диету). Больным с гиперхоле-стеринемией и ишемической болезнью сердца, прогрессирующей стенокардией возможно одновременное назначение диеты и медикаментозной терапии. К основным гиполипидемическим средствам относят секвестранты желчных кислот, никотиновую кислоту, фибраты, статины.
Секвестранты желчных кислот (в частности, холестирамин, суточная доза – 8-30 мг) представляют собой анионообменные смолы. Связывая желчные кислоты в кишечнике, эти препараты препятствуют всасыванию холестерина, увеличивают его выделение и таким образом снижают уровень холестерина на 15–20 %. Являются средствами первого ряда для лечения гиперхолестеринемии. Препараты этой группы не всасываются из желудочно-кишечного тракта, поэтому возможные побочные эффекты ограничиваются тошнотой, рвотой, болью в животе и запорами.
Никотиновая кислота (эндурацин) снижает уровень холестерина на 15–30 % и триглицеридов – на 20–40 %. Показания к применению: все типы гиперлипидемий (гиперхолестеринемия, гипертриглицеридемия), исключая некоторые виды семейной. Использование ограничивается побочными эффектами: «приливы», сухость во рту, кожный зуд, покраснение кожи лица и верхней части тела, боли в животе, рвота, диарея, обострение хронических заболеваний желудочно-кишечного тракта, повышение уровня сахара и мочевой кислоты в крови. Противопоказания: язвенная болезнь желудка и двенадцатиперстной кишки, болезни печени, подагра, сахарный диабет.
Статины (ловастатин 20–80 мг/сут, правастатин 10–40 мг/сут, симвастатин 5-40 мг/сут, флювастатин 20–40 мг/сут) наиболее эффективны для снижения уровня холестерина (блокируют фермент, участвующий в его образовании). Кроме того, статины снижают содержание холестерина в атеросклеротических бляшках и стабилизируют их. Статины применяют при гиперлипидемиях с повышенным уровнем холестерина при повышенном или нормальном уровне триглицеридов. Доказано, что симвастатин (закор) и флювастатин (лескол) при длительном приеме значительно снижают смертность больных ишемической болезнью сердца. Возможные побочные эффекты – нарушения функции печени, миопатия; противопоказания к применению статинов – заболевания печени, беременность, лактация.
Фибраты – фенофибрат (липантил), гемфиброзил – снижают концентрацию триглицеридов в крови на 40–50 %. Наиболее эффективны при гиперлипидемии с повышенным уровнем триглицеридов при нормальном уровне холестерина. Побочные эффекты: желудочно-кишечные расстройства (тошнота, рвота, обострение желчнокаменной болезни), кожный зуд, боли в мышцах и мышечная слабость, задержка воды в организме. Противопоказания: тяжелые заболевания печени и почек с нарушением их функции, беременность, лактация.
Гиполипидемическую терапию подбирают поэтапно. Сначала рекомендуют минимальные дозы препарата, при отсутствии эффекта через 2–3 мес дозу повышают, при неэффективности монотерапии максимальной дозой препарата через 2 мес переходят к комбинированной терапии гиполипидемическими средствами (например, статин + холистирамин, статин + фибрат). При эффективности терапии и отсутствии побочных эффектов гиполипидемическую терапию проводят в течение нескольких лет. В случае рефрактерной гиперлипидемии возможно проведение плазмафереза. Целью гиполипидемической терапии у больных с развившимся атеросклеротическим поражением сосудов (в частности, ишемической болезнью сердца) является снижение уровня холестерина до 3–3,5 ммоль/л.
Помимо борьбы с гиперлипидемией, лечение атеросклероза подразумевает терапию его осложнений – стенокардии, инфаркта миокарда, инсульта и т. д.
Атеросклероз аорты характеризуется следующими проявлениями: постепенно нарастающая, преимущественно систолическая, артериальная гипертензия, короткий систолический (не ромбовидный на ФКГ) шум и акцент II тона в пятой точке и над аортой; над ее бифуркацией и подвздошными артериями; признаки умеренной гипертрофии левого желудочка сердца на ЭКГ при отсутствии диастолической гипертензии в анамнезе; повышение скорости распространения пульсовой волны на тахоосциллограмме. Линейные кальцинаты в стенках дуги и брюшного отдела аорты на рентгенограммах (в боковой проекции) – наиболее доказательный, хотя и поздний диагностический признак. К осложнениям, непосредственно угрожающим жизни больного, относятся аневризма аорты, в том числе расслаивающая. Стенозирующий атеросклероз брюшного отдела аорты, особенно терминальной его части, может осложниться тромбозом области бифуркации с острым нарушением кровоснабжения нижних конечностей (синдром Лериша): острая боль, нарушение чувствительности и движений в обеих ногах, побледнение кожных покровов; возможно возникновение гангрены. Лечение хирургическое; менее эффективна и не всегда допустима тромболитическая терапия. Атеросклероз аорты дифференцируют с неспецифическими и специфическими (сифилитический, бактериальный септический) аортитами. Больных направляют в специализированные учреждения для обследования и решения вопроса о возможности реконструктивной хирургической операции.
При атеросклерозе ветвей дуги аорты наблюдаются симптомы хронической (а при тромботической окклюзии – острой) недостаточности кровоснабжения головного мозга либо верхних конечностей. Возможна реконструктивная хирургическая операция.
Атеросклероз брыжеечных артерий проявляется двумя главными синдромами: брюшной жабой и тромбозом артериальных (часто и венозных) ветвей с инфарктом стенки кишки и брыжейки. Брюшная жаба – приступ коликоподобных болей в животе – возникает вскоре после еды, часто облегчается приемом нитроглицерина, нередки рвота и вздутие кишечника; голодание прекращает приступы брюшной жабы; диагноз затруднителен (редкость синдрома, отсутствие специфических признаков), требует особой ответственности в связи с опасностью несвоевременного распознавания острых абдоминальных болезней. Лечение – дробный прием пищи, нитроглицерин, папаверин 0,04-0,06 г 3–4 раза в день перед едой, панкреатин (1–1,5 г) или панзинорм (1–2 таблетки) после еды. О тромбозе брыжеечных артерий – см. в главе «Хирургические болезни».
Атеросклероз почечных артерий проявляется хронической ишемией почки (часто в виде реноваскулярной артериальной гипертензии) с исходом в артериосклеротический нефросклероз и хроническую почечную недостаточность. Окончательный диагноз устанавливают в специализированных нефрологических или ангиохирургических учреждениях; при невозможности хирургического лечения проводят гипотензивную терапию (см. Артериальная гипертензия). Тромбоз почечной артерии – острый синдром с внезапной болью, болезненностью при ощупывании и при сотрясении поясничной области на стороне тромбоза, острой почечной недостаточностью (олиго– или анурия) и, как правило, высокой артериальной гипертензией; диагностическое обследование и лечение проводится в специализированных учреждениях.
Об атеросклерозе коронарных артерий сердца см. Ишемическая болезнь сердца; об атеросклерозе артерий нижних конечностей – см. в главе «Хирургические болезни», головного мозга – в главе «Нервные болезни».
ГИПЕРТОНИЧЕСКИЙ КРИЗ – клинический синдром, характеризующийся резким повышением АД (по отношению к привычным для больного цифрам; диастолическое давление, как правило, превышает 120 мм рт. ст.) и обострением симптомов, присущих артериальной гипертензии.
Многочисленные клинические наблюдения говорят о том, что нередко кризы развиваются непосредственно вслед за психической травмой. Кроме того, существенную роль играет состояние эндокринной системы. Так, у женщин кризы встречаются значительно чаще, чем у мужчин. Особенно часто они возникают в предменструальный период, а также во время климакса. У мужчин гипертонический криз нередко провоцируется приемом алкоголя. Чрезмерное употребление поваренной соли также может приводить к возникновению гипертонического криза. Известно большое влияние факторов погоды на самочувствие больных эссенциальной артериальной гипертензией – кризы чаще возникают весной и осенью в дни с резкими колебаниями атмосферного давления. Нередко гипертонический криз провоцируется резкой отменой гипотензивных средств (особенно клофелина, бета-адреноблокаторов).
Симптомы, течение. В клинической картине криза на первый план выступают симптомы, связанные с повышением АД. Следует учитывать, что абсолютные величины как максимального, так и минимального давления не играют решающей роли. Больные артериальной гипертензией могут «привыкать» к очень высокому уровню своего давления (200/110-120 мм рт. ст. и более), чувствовать себя при этом удовлетворительно (ощущая, например, только постоянную тяжесть в голове) и сохранять работоспособность. Разумеется, в таких случаях о состоянии криза говорить не приходится. Важна прежде всего быстрота нарастания давления (минуты или часы, но не сутки). Гипертонический криз обычно возникает более или менее внезапно (в некоторых случаях наблюдаются предвестники в виде подавленности, бессонницы, усиления головных болей). Повышается, как правило, и максимальное и минимальное давление, но в разной степени, поэтому пульсовое давление может увеличиваться и уменьшаться.
Наиболее постоянный симптом артериальной гипертензии – сильная головная боль. Она может быть приступообразной и постоянной, тупой и пульсирующей, может локализоваться в области затылка, темени или лба и обусловлена чаще всего расстройствами кровоснабжения головного мозга. При гипертонических кризах головная боль резко усиливается или появляется, если ее до этого не было. Интенсивность ее такова, что для больного мучителен любой шум, ему трудно разговаривать, повернуть голову. Последнее может быть обусловлено и головокружением. Головокружение, потеря равновесия, ощущение, что «все плывет кругом», – частые жалобы больных во время криза. Нередко головная боль и головокружение сочетаются с шумом в ушах. К мозговым симптомам криза относятся тошнота и рвота. Сочетание их с головной болью при тяжелом общем состоянии больного может свидетельствовать о повышении внутричерепного давления и развитии отека мозга. Ухудшение зрения нередко сопровождает развитие криза и является следствием изменений глазного дна (спазма сосудов сетчатки, отека дисков зрительных нервов). Степень расстройств зрения может быть различной: от сетки темных или светлых движущихся точек перед глазами до кратковременной потери зрения.
К частым жалобам больных во время гипертонического криза относятся неприятные ощущения в области сердца: боль, сердцебиение, перебои, одышка. Боль может быть ноющей, колющей (по типу кардиалгии), но нередко имеет характер типичной интенсивной сжимающей загрудинной боли, отдает в левую руку, лопатку, уменьшается после приема нитроглицерина и свидетельствуют о возникновении приступа стенокардии. Реже встречаются проявления сосудистых нарушений в других органах – боли в животе («брюшная жаба»), перемежающаяся хромота.
Непосредственное исследование больного позволяет выявить ряд характерных для криза симптомов. На первый план выступают признаки нарушенной деятельности центральной и вегетативной нервной системы. Больные возбуждены, раздражительны, кожа влажная, гиперемированная. Нередко на лице, шее, груди появляются красные пятна; возникают озноб, мышечная дрожь, температура повышается до субфебрильных цифр. В других случаях, наоборот, очевидно резкое угнетение нервной системы: вялость, оглушенность, сонливость. Могут наблюдаться мышечные подергивания и даже судороги, между приступами которых больной находится в коматозном состоянии. Расстройства речи, односторонние слабость и выпадение болевой чувствительности (в более легких случаях ощущение ползания мурашек, покалывание в руках и ногах – парестезии) в конечностях говорят о преходящих очаговых нарушениях в ЦНС.
Обязательным проявлением гемодинамических нарушений при кризе является только повышение АД. В остальном картина сердечно-сосудистой патологии многообразна. Пульс нередко ускорен, однако ощущение сердцебиения может и не сопровождаться тахикардией. Иногда наблюдается брадикардия. Из нарушений сердечного ритма чаще других встречается экстрасистолия. Границы относительной тупости сердца, как правило, расширены влево из-за гипертрофии левого желудочка, наблюдающейся при длительной артериальной гипертензии. При аускультации отмечается резкий акцент, иногда расщепление II тона над аортой. Если гипертонический криз возник у больного с выраженными органическими изменениями в сердце, нередко можно выявить признаки острой сердечной недостаточности: пульс становится частым, а тоны сердца глухими, в нижних отделах легких начинают выслушиваться незвонкие застойные хрипы – развивается приступ сердечной астмы, в тяжелых случаях – отек легких (чаще возникает именно левожелудочковая недостаточность). На ЭКГ во время гипертонического криза могут наблюдаться признаки систолической перегрузки левого желудочка в виде депрессии сегмента ST и уплощения зубца Г в левых грудных отведениях.
Поскольку при гипертоническом кризе поражаются сосуды различных областей, могут наблюдаться патологические изменения в разных органах. Так, у многих больных в моче во время криза или после него появляются белок, эритроциты (если они были и раньше, нарастает количество патологических элементов), что свидетельствует об ухудшении почечного кровообращения. Отмеченные разнообразные симптомы часто сочетаются в характерные симптомокомплексы, что позволяет различать два вида кризов. Это подразделение в известной мере условно: нередко криз протекает с клиническими признаками, часть которых характерна для первого вида, а другая часть – для второго.
Кризы первого вида (гиперкинетические) наблюдаются преимущественно в ранних стадиях артериальной гипертензии, развиваются остро, сопровождаются возбуждением больных, обилием «вегетативных знаков» (мышечная дрожь, усиленное потоотделение, красные пятна на коже, сердцебиение, к концу криза полиурия, иногда обильный жидкий стул) и протекают кратковременно (не более 3–4 ч). Для этих кризов характерно преимущественное повышение систолического АД, нарастание пульсового давления, учащение пульса. Кризам первого вида свойственно преобладание в крови адреналина, который, как известно, обладает способностью повышать обмен веществ, вызывать гипергликемию, тахикардию, рост систолического давления.
Кризам второго вида (гипокинетическим), возникающим, как правило, в поздних стадиях заболевания на фоне высокого исходного уровня АД, свойственны менее острое начало, более постепенное развитие, сравнительно длительное (от нескольких часов до 4–5 дней) и тяжелое течение. Эти больные выглядят вялыми, заторможенными. У них особенно резко выражены мозговые и сердечные симптомы. Систолическое и диастолическое давление в этих случаях очень высокое, но преобладает подъем диастолического давления, поэтому пульсовое давление несколько уменьшается. Тахикардии нет или она выражена незначительно. Для кризов второго типа характерно преобладание в крови норадреналина, который прежде всего повышает периферическое сосудистое сопротивление и, соответственно, диастолическое давление.
Для оценки необходимого объема неотложной помощи практически важно подразделение гипертонических кризов на неосложненные и осложненные. Всегда есть угроза, что преходящие сосудистые расстройства вызовут необратимые изменения в тканях мозга, сердца – приведут к развитию инфаркта миокарда, нарушению мозгового кровообращения с появлением очаговых неврологических расстройств и даже к смерти от инсульта. Другие возможные осложнения криза – отек головного мозга, характеризующийся головной болью, несистемным головокружением, выраженной тошнотой и рвотой, судорогами, спутанностью сознания, комой; острое нарушение мозгового кровообращения; сердечная недостаточность – в этом случае пульс становится частым, тоны сердца глухими, в нижних отделах легких начинают выслушиваться незвонкие застойные хрипы – развивается приступ сердечной астмы, в тяжелых случаях отек легких; расслаивание аневризмы аорты.
Диагноз гипертонического криза основывается на следующих основных критериях: 1) относительно внезапное начало; 2) индивидуально высокий подъем АД; 3) субъективные расстройства и объективные симптомы церебрального, кардиального и вегетативного характера.
Лечение неосложненного гипертонического криза проводится с учетом возможных осложнений избыточной гипотензивной терапии – медикаментозных коллапсов и снижения мозгового кровотока с развитием ишемии головного мозга. Особенно осторожно следует снижать АД при вертебробазилярной недостаточности и появлении очаговой неврологической симптоматики на фоне гипертонического криза. Саморегуляция мозгового кровообращения сохраняется при цифрах систолического и диастолического АД примерно на 25 % ниже привычных для больного величин – это минимально допустимый уровень. Поскольку снижение АД тем не менее может быть резким, больной во время оказания неотложной помощи должен находиться в горизонтальном положении.
Терапию неосложненного криза целесообразно начинать с приема 10–20 мг нифедипина (коринфара) под язык; препарат особенно показан при гипокинетическом варианте гипертонического криза. Лечение нифедипином отличается хорошей предсказуемостью терапевтического эффекта: в подавляющем большинстве случаев через 5-30 мин начинается постепенное падение систолического и диастолического АД (на 20–25 %) и улучшается самочувствие пациентов, что позволяет обходиться без некомфортного для пациента парентерального применения гипотензивных средств. При отсутствии эффекта прием нифедипина можно повторить через 30 мин. Продолжительность действия принятого таким образом препарата – 4–5 ч, что позволяет начать в это время подбор плановой гипотензивной терапии. Возможные побочные эффекты нифедипина связаны с его вазодилатирующим действием: артериальная гипотония в сочетании с рефлекторной тахикардией, а также сонливость, головная боль, головокружение, гиперемия кожи лица и шеи. С особой осторожностью нифедипин используют у пациентов с острой коронарной недостаточностью (при инфаркте миокарда, нестабильной стенокардии), тяжелой сердечной недостаточностью, в случае выраженной гипертрофии левого желудочка (при стенозе устья аорты, гипертрофической кардиомиопатии), а также при остром нарушении мозгового кровообращения.
При приеме под язык ингибитора ангиотензин-превращающего фермента (АПФ) каптоприла (капотена) в дозе 25–50 мг реакция на препарат менее предсказуема (возможно развитие коллапса). При сублингвальном приеме каптоприла гипотензивное действие развивается через 10 мин и сохраняется около 1 ч. Весьма безопасным и эффективным средством для плавного снижения АД следует считать парентеральное введение ингибиторов АПФ, в частности эналаприлата (энапа) – активного метаболита эналаприла. Эналаприлат вводят в/в струйно в течение 5 мин в дозе 0,625-1,25 мг. Внутривенное введение ингибиторов АПФ особенно показано при гипертоническом кризе у больных с обострением ишемической болезни сердца, застойной сердечной недостаточностью (когда использование антагонистов кальция, в том числе коринфара, нежелательно). Начало эффекта наблюдается через 15 мин после введения, максимум действия – через 30 мин, продолжительность действия – около 6 ч.
При гиперкинетическом варианте гипертонического криза, а также при синдроме отмены клонидина (клофелина) возможен сублингвальный прием клофелина в дозе 0,075 мг. Гипотензивное действие развивается через 15–30 мин, продолжительность действия – несколько часов. Побочные эффекты: сухость во рту, сонливость, ортостатические реакции. Прием клонидина противопоказан при брадикардии, синдроме слабости синусового узла, атриовентрикулярной блокаде II–III степени; нежелательно его применение при остром инфаркте миокарда, выраженной энцефалопатии, депрессии. При значительной тахикардии возможен сублингвальный прием пропранолола в дозе 10–20 мг.
При выраженной неврологической симптоматике с угрозой развития острого нарушения мозгового кровообращения целесообразно в/в введение дибазола, сульфата магния, эуфиллина. Дибазол (5-10 мл 0,5 %-ного раствора) оказывает умеренное гипотензивное действие (резкое снижение АД может в этой ситуации ухудшить состояние больного), гипотензивный эффект развивается через 10–15 мин и сохраняется 1–2 ч. Сульфат магния обладает сосудорасширяющим, седативным и противосудорожным действием, уменьшает отек мозга. Применение его особенно показано при кризе, сопровождающемся развитием судорожного синдрома (в частности, при эклампсии беременных), а также при появлении желудочковых нарушений ритма на фоне повышения АД. Поскольку требуется быстрый терапевтический эффект, 5-10 мл 20– или 25 %-ного раствора препарата вводят в/в струйно медленно в течение 5–7 мин (пожилым больным особенно осторожно, так как возможны нарушения дыхания). Гипотензивный эффект развивается через 15–25 мин после введения. Применение сульфата магния противопоказано при атриовентрикулярной блокаде II и III степени, почечной недостаточности. Эуфиллин (10 мл 2,4 %-ного раствора в/в струйно или капельно) также показан при осложнении криза церебральными расстройствами. Препарат несколько снижает АД, оказывает умеренное диуретическое действие, улучшает мозговое кровообращение. Пожилым пациентам эуфиллин вводят с осторожностью ввиду возможности развития тахикардии и нарушений сердечного ритма. Противопоказано применение эуфиллина при эпилепсии, в острой фазе инфаркта миокарда, при пароксизмальной тахикардии, частой экстрасистолии.
Мочегонные средства используют главным образом при сопутствующей кризу острой левожелудочковой недостаточности, а также в случае повышения АД у пациента с застойной сердечной недостаточностью, хронической почечной недостаточностью. Лазикс вводят в/в (2–6 мл); возможен также сублингвальный прием фуросемида в дозе 40 мг. Гипотензивное действие развивается через 2–3 мин после введения и обусловлено на первом этапе вазодилатирующими свойствами препарата (расширяет периферические вены, снижает преднагрузку), а уже затем диуретическим действием и снижением объема циркулирующей крови. Мочегонные препараты не заменяют другие гипотензивные средства (поскольку в большинстве случаев гипертонический криз обусловлен вазоконстрикцией при нормальном или даже сниженном объеме циркулирующей крови), а дополняют и усиливают их эффект. Применение мочегонных средств не показано при развитии на фоне криза мозговой симптоматики, эклампсии.
В случае криза, осложненного тяжелой стенокардией, развитием инфаркта миокарда или острой левожелудочковой недостаточности при отсутствии выраженной мозговой симптоматики, показано в/в капельное введение нитратов (нитроглицерина либо изосорбиддинитрата). Гипотензивное действие развивается через 2–5 мин от начала инфузии. Возможные побочные эффекты – головная боль, тошнота, тахикардия. При развитии на фоне гипертонического криза ангинозного статуса, тахикардии и нарушений ритма, расслаивания аневризмы аорты и при отсутствии признаков сердечной недостаточности целесообразно также в/в введение бета-адреноблокаторов (обзидана). Необходимое условие – возможность тщательного мониторирования АД, частоты сердечных сокращений и ЭКГ (в связи с опасностью развития брадикардии, блокады сердца и др.).
При выраженном возбуждении, тревоге, страхе смерти и вегетативной симптоматике (дрожь, тошнота и т. д.) иногда возникает необходимость применения препаратов, обладающих успокаивающим и снотворным действием: дроперидола (2 мл 0,25 %-ного раствора в 10 мл изотонического раствора хлорида натрия в/в струйно) и диазепама (реланиум – 2 мл 0,5 %-ного раствора в/м или в/в струйно медленно). Дроперидол обладает собственным достаточно выраженным гипотензивным действием, применение противопоказано при экстрапирамидных расстройствах. Диазепам особенно показан при осложнении гипертонического криза судорожным синдромом. В то же время следует учитывать, что седативные и снотворные средства могут «замазывать» неврологическую клинику, затрудняя своевременную диагностику осложнений гипертонического криза, в частности, нарушения мозгового кровообращения.
Для быстрой коррекции повышенного АД при подозрении на расслаивание аневризмы аорты (когда оптимальный уровень систолического АД – 100–120 мм рт. ст.) используют в/в введение нитропруссида натрия, при его отсутствии – нитратов (нитроглицерина, изосорбида динитрата) или нифедипина (10–20 мг сублингвально) в сочетании с в/в введением бетаадреноблокаторов (пропранолол – по 1 мг каждые 3–5 мин до достижения частоты сердечных сокращений 50–60 в 1 мин или до достижения общей дозы 0,15 мг/кг). При непереносимости бета-адреноблокаторов используют верапамил в/в в дозе 0,05 мг/кг.
После начала гипотензивной терапии желательно врачебное наблюдение в течение не менее 6 ч для своевременного выявления возможных осложнений гипертонического криза (в первую очередь – нарушения мозгового кровообращения и инфаркта миокарда) и побочных эффектов лекарственной терапии (например, ортостатической гипотензии). При развитии ортостатической гипотензии рекомендуют постельный режим, проводят мониторирование АД; при значительном снижении АД возможно в/в капельное введение жидкостей (например, изотонического раствора хлорида натрия), при упорной гипотензии к терапии добавляют вазопрессоры (например, допамин). Госпитализации подлежат пациенты с впервые возникшим гипертоническим кризом и при осложненном его течении; в остальных случаях вопрос решается индивидуально.
ВАРИКОЗНОЕ РАСШИРЕНИЕ ВЕН – см. в главе «Хирургические болезни».
ВАСКУЛИТЫ – см. в главе «Хирургические болезни».
ВЕГЕТАТИВНО-СОСУДИСТАЯ ДИСТОНИЯ – см. Вегетативная дистония в главе «Нервные болезни».
ГИПЕРТОНИЧЕСКАЯ БОЛЕЗНЬ – см. Артериальная гипертензия.
ИНФАРКТ МИОКАРДА – заболевание сердца, обусловленное острой недостаточностью его кровоснабжения, с возникновением очага некроза в сердечной мышце; важнейшая клиническая форма ишемической болезни сердца.
Патогенез. Непосредственной причиной инфаркта миокарда является острая ишемия миокарда, чаще всего вследствие разрыва или расщепления атеросклеротической бляшки с образованием тромба в коронарной артерии и повышением агрегации тромбоцитов. Активированные тромбоциты могут выделять вазоактивные соединения, что приводит к сегментарному спазму вблизи атеросклеротической бляшки и усугублению ишемии миокарда. Возникающая при этом интенсивная боль вызывает выброс катехоламинов, развивается тахикардия, которая увеличивает потребность миокарда в кислороде и укорачивает время диастолического наполнения, усугубляя таким образом ишемию миокарда. Другой «порочный круг» связан с локальным нарушением сократительной функции миокарда вследствие его ишемии, дилатацией левого желудочка и дальнейшим ухудшением коронарного кровообращения.
Симптомы, течение. Началом инфаркта миокарда считают появление приступа интенсивной и продолжительной боли за грудиной или в левой половине грудной клетки. Больные описывают боль как сжимающую, давящую, раздирающую, жгучую. Обычно она иррадиирует в левое плечо, руку, лопатку. Нередко при инфаркте в отличие от приступа стенокардии боль распространяется вправо от грудины, иногда захватывает подложечную область и «отдает» в обе лопатки. Интенсивность боли при инфаркте значительно превышает таковую при обычной стенокардии; длительность ее исчисляется десятками минут, часами, а иногда сутками (ангинозный статус). В течение приступа бывают периоды некоторого ослабления боли, однако полностью она не исчезает и после непродолжительного периода затихания возобновляется с новой силой. Повторный, многократный прием нитроглицерина при инфаркте миокарда боль не снимает. Часто болевой приступ сопровождается страхом смерти. При обследовании обращает внимание беспокойное поведение больного в начальном периоде болевого приступа. Такая картина характерна для классического ангинозного варианта начала инфаркта миокарда.
При гастралгическом варианте инфаркта миокарда боль локализуется в подложечной области. Трудность диагностики этого варианта усугубляется тем, что нередко наблюдаются и желудочно-кишечные расстройства (рвота, вздутие живота, явления пареза кишечника). Гастралгический вариант часто встречается при инфаркте задней стенки левого желудочка.
В некоторых случаях, особенно у пожилых людей с выраженным кардиосклерозом, болевой синдром отсутствует или выражен незначительно, ведущим клиническим проявлением острого инфаркта миокарда служит приступ удушья – сердечной астмы, такие случаи относятся к астматическому варианту начала инфаркта миокарда. Больной принимает возвышенное положение, ловит ртом воздух, кожа приобретает синюшный оттенок, покрывается крупными каплями пота. Частота дыхания достигает 30–40 в 1 мин. Дыхание становится клокочущим, над легкими выслушиваются обильные влажные крупнопузырчатые хрипы, появляется кашель, иногда с пенистой розовой мокротой. Сердце увеличивается влево.
Иногда инфаркт миокарда дебютирует пароксизмальным нарушением ритма, чаще желудочковой тахикардией или мерцанием предсердий. Иногда болевой синдром при этом отступает на второй план или отсутствует (аритмическая форма инфаркта миокарда).
Инфаркт миокарда может начинаться или сочетаться с картиной острой мозговой сосудистой катастрофы – спутанность сознания, расстройства речи (церебральная форма). В основе церебральной симптоматики лежат нарушения мозгового кровообращения вследствие уменьшения сердечного выброса и спазма сосудов мозга.
При инфаркте миокарда, не осложненном сосудистой и сердечной недостаточностью, обычные методы обследования могут не обнаружить существенных отклонений от нормы. В начальном периоде болевого приступа в таких случаях отмечаются умеренная брадикардия и повышение АД, в дальнейшем сменяющиеся тахикардией и иногда снижением систолического давления с соответствующим уменьшением пульсового давления. Гипотония и брадикардия при затянувшемся болевом приступе могут быть проявлениями рефлекторного шока. Границы сердца и звучность тонов могут не претерпевать изменений. Внезапное появление систолического шума может свидетельствовать об инфаркте сосочковой мышцы с развитием митральной недостаточности либо о разрыве межжелудочковой перегородки. Определенное диагностическое значение в распознавании инфаркта нередко имеет появление в конце болевого приступа шума трения перикарда.
Обширные, захватывающие всю глубину мышцы сердца (трансмуральные) инфаркты часто вызывают грубые нарушения в работе аппарата кровообращения. Нарушение сократительной способности левого желудочка сердца вследствие некроза участка мышцы при инфаркте может вести к развитию острой левожелудочковой недостаточности. Клиническим ее проявлением служит приступ тягостной инспираторной одышки – сердечной астмы или отека легких.
Иногда при обширном инфаркте передней стенки видна патологическая пульсация прекордиальной области, обусловленная формированием острой аневризмы сердца. Обычно определяется тахикардия, тоны сердца становятся глухими, нередко выслушивается ритм галопа. АД чаще повышено, однако в некоторых случаях удушье сопровождается падением АД, и такое сочетание прогностически крайне неблагоприятно.
Недостаточность левого желудочка при остром инфаркте не всегда проявляется яркой картиной сердечной астмы. Во многих случаях отмечаются только умеренный цианоз, небольшая одышка и застойные влажные хрипы над нижнезадними отделами легких в сочетании с тахикардией и ритмом галопа. Нередко подобная симптоматика предшествует появлению удушья. Практически важно помнить, что при всяком приступе сердечной астмы у пожилых людей следует подозревать развитие инфаркта миокарда как причину острой левожелудочковой недостаточности.
В острейшем периоде инфаркта миокарда возможна внезапная клиническая смерть вследствие фибрилляции желудочков (реже асистолии). Желудочковые эктопические аритмии в первые часы после острого приступа часто отражают восстановление проходимости венечной артерии (лизис тромба), наступившее либо спонтанно, либо под действием тромболитической терапии (стрептокиназа и другие тромболитические препараты).
Помимо острой левожелудочковой недостаточности с развитием отека легких и нарушений ритма, течение острой стадии инфаркта миокарда может осложниться кардиогенным шоком, в происхождении которого основное значение имеют резкое ослабление сократительной способности миокарда (при поражении примерно 40 % миокарда левого желудочка) и падение тонуса периферических сосудов. При осмотре состояние больного тяжелое, черты лица заострены, кожа бледная, иногда с цианотичной мраморностью, покрыта мелким потом, пульс частый, малый, иногда нитевидный, АД ниже 90/60 мм рт. ст., а иногда не определяется. Развитие кардиогенного шока при инфаркте миокарда значительно ухудшает прогноз (летальность составляет около 80 %).
В остром периоде наблюдаются повышение температуры тела (со 2–3 сут); лейкоцитоз, сменяющийся стойким повышением СОЭ; в сыворотке крови – преходящий прирост гликемии, азотемии, уровня фибриногена, активности ферментов – креатинфосфокиназы и ее миокардиального изофермента (в пределах первых 48 ч), АсАТ (в пределах 72 ч), ЛДГ и ее изофермента ЛДГ1 (в пределах 5 сут); эпистенокардический перикардит (боль в области грудины, особенно при дыхании, нередко шум трения перикарда, выслушиваемый у левого края грудины).
В диагностике инфаркта миокарда огромное значение имеет электрокардиографическое исследование, помогающее не только поставить диагноз, но и определить локализацию инфаркта миокарда, обширность, глубину и зачастую стадию процесса. Изменения на ЭКГ при инфаркте миокарда заключаются в дугообразном подъеме сегмента ST, так что нисходящее колено зубца R не доходит до изоэлектрической линии, переходит, описывая типичную кривую, в зубец Т. В дальнейшем появляются уширенные (не менее 0,04 с) зубцы Q, снижается амплитуда зубцов R или возникает QS-форма желудочкового комплекса (иногда лишь спустя 24–48 ч и даже 3–5 дней от начала инфаркта миокарда). При нетрансмуральном инфаркте миокарда (инфаркте миокарда без зубца Q) изменения ЭКГ ограничиваются депрессией сегмента ST или формированием глубоких «коронарных» зубцов Т в нескольких отведениях. При инфаркте передней стенки изменения выявляются в I и II стандартных отведениях, усиленном отведении от левой руки (aVL) и соответствующих грудных отведениях. При высоком боковом инфаркте миокарда изменения могут регистрироваться только в отведении aVL и для подтверждения диагноза необходимо снять высокие грудные отведения. При инфаркте задней стенки эти изменения обнаруживаются во II, III стандартных отведениях и усиленном отведении от правой ноги (aVF). При инфаркте миокарда высоких отделов задней стенки левого желудочка (заднебазальном) изменения в стандартных отведениях не регистрируются, диагноз устанавливают на основании высоких зубцов R и Т в отведениях V1-V2. Около 1/4 всех крупноочаговых инфарктов миокарда либо не сопровождаются убедительными изменениями на ЭКГ (особенно при повторных инфарктах, при внутрижелудочковых блокадах), либо такие изменения выявляются лишь в дополнительных отведениях. Диагностически доказательны не изменения на одной ЭКГ, а только определенная последовательность изменений комплекса QRS и сегмента ST, зарегистрированная на серии ЭКГ.
Осложнения госпитального периода инфаркта миокарда: эйфория, некритичное поведение, вплоть до психотического состояния; возобновление болей в груди вследствие рецидива инфаркта, появления фибринозного перикардита, резких колебаний частоты и регулярности ритма сердца, присоединения инфаркта легкого (плеврит!), внешний разрыв миокарда; пароксизмы тахиаритмии, а также ранние (вблизи зубца Т предшествующего комплекса) политопные и групповые желудочковые экстрасистолы; атриовентрикулярная блокада II–III степени; синдром слабости синусового узла; аневризма левого желудочка; внезапная смерть (аритмия терминального характера или разрыв сердца с гемотампонадой перикарда); острая сердечная недостаточность; кардиогенный шок; тромбоэмболии в системе легочной артерии. Редкие осложнения: эмболический инфаркт головного мозга; тромбоэмболии ветвей брыжеечной артерии; профузное кровотечение из острых трофических язв слизистой оболочки желудка, кишечника; острое расширение желудка; эмболия артерий нижних конечностей; «постинфарктный синдром» (синдром Дресслера); разрыв межжелудочковой перегородки; разрыв папиллярной мышцы. Сердечная недостаточность нередко проявляется впервые лишь тогда, когда больной начинает ходить, и оказывается причиной «поздних» инфарктов легких (тромбоэмболия ветвей легочной артерии).
Диагноз инфаркта миокарда доказателен при наличии у больного по меньшей мере двух из следующих клинических признаков: характерный ангинозный приступ, гиперферментемия в типичные сроки, характерные изменения на ЭКГ. Типичная клиническая картина болевого приступа с появлением (в характерной последовательности) лейкоцитоза, гипертермии, увеличенной СОЭ, признаков перикардита заставляет предполагать инфаркт миокарда и проводить соответствующее лечение больного даже в том случае, если на ЭКГ отсутствуют доказательные для инфаркта изменения. Диагноз подтверждается анализом дальнейшего течения болезни (выявление гиперферментемии, осложнений, в особенности левожелудочковой недостаточности). Подобным же образом обосновывается ретроспективное диагностическое предположение об инфаркте миокарда, осложняющем течение других болезней или послеоперационного периода. При затяжном болевом синдроме и отсутствии динамики на ЭКГ для уточнения диагноза проводится эхокардиография, позволяющая выявить локальные нарушения сократимости миокарда.
Для диагноза мелкоочагового инфаркта необходимо наличие у больного названных выше 3 компонентов, но интенсивность и продолжительность болевого приступа, реактивные сдвиги со стороны крови, температуры тела, активности ферментов сыворотки, а также изменения ЭКГ выражены обычно в меньшей степени. Достоверность диагноза, основанного лишь на появлении отрицательных зубцов Т на ЭКГ в отсутствие убедительных клинико-лабораторных данных, сомнительна. Как правило, мелкоочаговый инфаркт наблюдается у лиц, много лет страдающих ишемической болезнью сердца и кардиосклерозом с различными его осложнениями, число и тяжесть которых, а также склонность к рецидивированию, возрастают с присоединением инфаркта. Если же мелкоочаговый инфаркт миокарда возникает в ранней, начальной фазе ишемической болезни сердца, то нередко он оказывается предвестником тяжелого трансмурального инфаркта, развивающегося несколько дней или недель спустя. Этими двумя особенностями определяются клиническая и прогностическая оценка мелкоочагового инфаркта и выбор тактики лечения.
Дифференциальный диагноз инфаркта миокарда проводят с перикардитом, эмболией легочных артерий, спонтанным пневмотораксом, массивным внутренним кровотечением, острым панкреатитом, расслаивающей гематомой аорты. Мелкоочаговый инфаркт миокарда отличают от коронарогенной очаговой дистрофии миокарда, от дисгормональной (климактерической) кардиопатии (см. Кардиалгии).
Лечение. Неотложные мероприятия в острой стадии неосложненного инфаркта миокарда направлены на купирование болевого синдрома, уменьшение работы сердца и потребности миокарда в кислороде, ограничение размеров инфаркта миокарда, лечение и профилактику его осложнений.
Купирование болевого приступа при остром инфаркте миокарда – одна из важнейших задач, поскольку боль вызывает активацию симпатоадреналовой системы и, соответственно, повышение сосудистого сопротивления, частоты и силы сердечных сокращений. Все это обусловливает повышение потребности миокарда в кислороде и усугубление ишемии. Общепринятая тактика следующая: если предварительный повторный прием нитроглицерина (по 0,0005 г под язык) боль не снял, необходима терапия наркотическими анальгетиками. Препаратом выбора для купирования болевого синдрома при инфаркте миокарда является морфин, обладающий анальгетическим, седативным действием и благоприятным влиянием на гемодинамику вследствие вазодилатирующих свойств: 1 мл 1%-ного раствора разводят изотоническим раствором хлорида натрия до 20 мл (при этом 1 мл полученного раствора содержит 0,5 мг активного вещества) и вводят в/в дробно, 2–5 мг каждые 5-15 мин до полного устранения болевого синдрома либо до появления побочных эффектов (гипотензии, угнетения дыхания, рвоты). Не рекомендуется вводить более 60 мг морфина в течение 12 ч. Внутривенное введение атропина в дозе 0,5 мг позволяет сгладить вагомиметические эффекты морфина на сердечный ритм и АД (брадикардию и гипотензию) и купирует тошноту и рвоту, иногда возникающие при в/в введении морфина. Для лечения рвоты более безопасно в/в введение 10–20 мг метоклопрамида (церукала, реглана). Угнетение дыхательного центра развивается через 7 мин после в/в введения морфина, сохраняется около 15 мин и проявляется нарушением частоты, глубины и ритма дыхательных движений. Если пациент в сознании, можно контролировать его дыхание, громко командуя: «вдох, выдох». При значительном угнетении дыхания используется налоксон, однако он блокирует не только влияние морфина на дыхательный центр, но и обезболивающее действие препарата.
Иногда ангинозные боли удается снять только применением наркоза с закисью азота, обладающей седативным и анальгезирующим действием, в смеси с кислородом. Начинают с ингаляции кислорода в течение 1–3 мин, затем используется закись азота (20 %) с кислородом (80 %) с постепенным повышением концентрации закиси азота до 80 %; после засыпания больного переходят на поддерживающую концентрацию газов – по 50 %. Закись азота не влияет на функцию левого желудочка. Возникновение побочных эффектов – тошноты, рвоты, возбуждения или спутанности сознания – является показанием для уменьшения концентрации закиси азота или отмены ингаляции. При выходе из наркоза ингалируют чистый кислород в течение 10 мин для предупреждения артериальной гипоксемии. Вообще, кислородотерапия показана в первые 2–3 ч всем пациентам при остром инфаркте миокарда в связи с частым развитием гипоксемии даже при неосложненном течении заболевания и особенно необходима при застое в малом круге кровообращения. Ингаляция увлажненного кислорода через носовой катетер проводится со скоростью 4 л/мин.
Для восстановления коронарного кровотока в острейшей стадии инфаркта миокарда при отсутствии противопоказаний используют системный тромболизис. Внутривенное введение тромболитических средств не требует каких-либо сложных врачебных манипуляций, специального оборудования и достаточно эффективно, если начато в первые часы заболевания (оптимально – на догоспитальном этапе). Установлены следующие показания к назначению тромболитиков при остром инфаркте миокарда: 1) сроки – менее 12 ч от начала возникновения болевого синдрома (чем раньше начат тромболизис, тем больше процент восстановления кардиомиоцитов, тем ниже летальность); 2) ишемия миокарда (ангинозный приступ) сохраняется более 30 мин несмотря на прием нитроглицерина; 3) подъем ST более 0,1 мВ по крайней мере в двух стандартных отведениях ЭКГ и более 0,2 мВ в двух смежных грудных отведениях (т. е. признаки острейшей стадии крупноочагового инфаркта миокарда) либо остро возникшая блокада левой ножки пучка Гиса, маскирующая очаговые изменения на ЭКГ.
Основные противопоказания к назначению тромболитической терапии подразделяют на абсолютные и относительные. Абсолютные противопоказания: тяжелая травма, хирургическое вмешательство или травма головы в предшествующие 3 мес, желудочно-кишечное либо другое внутреннее кровотечение (легочное, маточное, гематурия и др., за исключением менструального) в течение предшествующего месяца, геморрагический инсульт в анамнезе или любой другой инсульт в течение предшествующего года, склонность к кровотечениям, подозрение на расслаивающую аневризму аорты. Относительные противопоказания: преходящее нарушение мозгового кровообращения в течение предшествующих 6 мес, любая внутричерепная патология, не являющаяся абсолютным противопоказанием, обострение язвенной болезни желудка или двенадцатиперстной кишки, лечение непрямыми антикоагулянтами, беременность, пункция сосудов, не поддающихся прижатию, травматичная или длительная (более 10 мин) реанимация, тяжелая артериальная гипертензия, рефрактерная к терапии, недавнее лечение патологии сетчатки лазером, беременность.
Для тромболитической терапии наиболее часто используется стрептокиназа. Преимуществами ее являются наименьшая вероятность внутричерепного кровоизлияния (препарат выбора у пожилых пациентов и при артериальной гипертензии); отсутствие необходимости лабораторного контроля (если не проводится гепаринотерапия), а также относительно невысокая стоимость. К недостаткам стрептокиназы относятся антигенные свойства, она чаще других тромболитиков вызывает аллергические реакции, гипотонию и брадикардию.
Методика внутривенного введения стрептокиназы: стрептокиназу вводят только через периферические вены, попытки катетеризации центральных вен недопустимы; перед инфузией возможно в/в введение 5–6 мл 25 %-ного сульфата магния либо 10 мл кормагнезина – 200 в/в струйно, медленно (за 5 мин); «нагрузочная» доза аспирина (250–300 мг – разжевать) дается всегда, за исключением случаев, когда аспирин противопоказан (аллергические и псевдоаллергические реакции); 1 500 000 ИЕ стрептокиназы разводят в 100 мл изотонического раствора хлорида натрия и вводят в/в за 30 мин.
Одновременного назначения гепарина при использовании стрептокиназы не требуется – предполагают, что стрептокиназа сама обладает антикоагуляционными и антиагрегационными свойствами. Показано, что внутривенное введение гепарина не снижает летальность и частоту рецидивов инфаркта миокарда, а эффективность его подкожного применения сомнительна. Если гепарин по каким-либо причинам был введен ранее, это не является препятствием к проведению тромболизиса. Рекомендуется назначение гепарина через 4 ч после прекращения инфузии стрептокиназы. Рекомендовавшееся ранее использование гидрокортизона для профилактики анафилаксии признано не только малоэффективным, но и небезопасным в острейшей стадии инфаркта миокарда (глюкокортикоиды увеличивают риск разрыва миокарда).
К основным осложнениям тромболизиса относятся, в первую очередь, кровотечения (в том числе наиболее грозные – внутричерепные), развивающиеся вследствие угнетения процессов свертывания крови и лизиса кровяных сгустков. Риск развития инсульта при системном тромболизисе составляет 0,5–1,5 %, обычно инсульт развивается в 1-е сутки после проведения тромболизиса. Для остановки незначительного кровотечения (из места пункции, изо рта, носа) достаточно сдавления кровоточащего участка. При более значимых кровотечениях (желудочно-кишечном, внутричерепном) необходима внутривенная инфузия аминокапроновой кислоты – 100 мл 5%-ного раствора вводят в течение 30 мин и далее 1 г/ч до остановки кровотечения или транексамовой кислоты по 1–1,5 г 3–4 раза в сутки в/в капельно; кроме того, эффективно переливание свежезамороженной плазмы. Следует однако помнить о том, что при использовании антифибринолитических средств возрастает риск реокклюзии коронарной артерии и реинфаркта, поэтому применять их необходимо лишь при угрожающих жизни кровотечениях.
Типичными осложнениями эффективного тромболизиса являются аритмии, возникающие после восстановления коронарного кровообращения (реперфузионные). Не требуют интенсивной терапии медленный узловой или желудочковый ритм (при частоте сердечных сокращений менее 120 в 1 мин и стабильной гемодинамике); наджелудочковая и желудочковая экстрасистолия (в том числе аллоритмированная); атриовентрикулярная блокада I и II (типа Мобитц I) степени. Требуют неотложной терапии фибрилляция желудочков (необходимы дефибрилляция, комплекс стандартных реанимационых мероприятий); двунаправленная веретенообразная желудочковая тахикардия типа «пируэт» (показаны дефибрилляция, введение сульфата магния внутривенно струйно); иные разновидности желудочковой тахикардии (используют введение лидокаина либо проводят кардиоверсию); стойкая суправентрикулярная тахикардия (купируется в/в струйным введением верапамила или новокаинамида); атриовентрикулярная блокада II (типа Мобитц II) и III степени, синоатриальная блокада (в/в струйно вводят атропин в дозе до 2,5 мг, при необходимости проводят экстренную электрокардиостимуляцию).
Тромбо лизис может осложниться развитием аллергических реакций. Сыпь, зуд, периорбитальный отек встречаются в 4,4 % случаев, тяжелые реакции (отек Квинке, анафилактический шок) – в 1,7 % случаев. При подозрении на развитие анафилактоидной реакции необходимо немедленно остановить инфузию стрепто киназы и ввести в/в болюсно 150 мг преднизолона. При выраженном угнетении гемодинамики и появлении признаков анафилактического шока вводят в/в 1 мл 1%-ного раствора адреналина, продолжая введение стероидных гормонов в/в капельно. При лихорадке назначают аспирин или парацетамол.
Рецидивирование болевого синдрома после тромболизиса купируется в/в дробным введением наркотических анальгетиков. При нарастании ишемических изменений на ЭКГ показано в/в капельное введение нитроглицерина или, если инфузия уже налажена, увеличение ее скорости.
При артериальной гипотонии в большинстве случаев бывает достаточно временно прекратить инфузию тромболитика и приподнять ноги пациента; при необходимости уровень АД корректируется введением жидкости, вазопрессоров (допамина или норадреналина в/в капельно до стабилизации систолического АД на уровне 90-100 мм рт. ст.).
Клинические признаки восстановления коронарного кровотока включают прекращение ангинозных приступов через 30–60 мин после введения тромболитика, стабилизацию гемодинамики, исчезновение признаков левожелудочковой недостаточности, быструю (в течение нескольких часов) динамику ЭКГ с приближением сегмента ST к изолинии и формированием патологического зубца Q, отрицательного зубца Т (возможно внезапное увеличение степени подъема сегмента ST с последующим его быстрым снижением), появление реперфузионных аритмий (ускоренного идиовентрикулярного ритма, желудочковой экстрасистолии и др.), быструю динамику МВ-КФК (резкое повышение ее активности на 20–40 %).
Для предупреждения или ограничения тромбоза венечных артерий, профилактики внутрисердечного, венозного тромбоза, тромбоэмболических осложнений (особенно частых у больных обширным передним инфарктом миокарда, при низком сердечном выбросе, мерцательной аритмии) показано в/в введение гепарина на догоспитальном этапе в дозе 10 000-15 000 ЕД. В условиях кардиоблока переходят на длительную в/в инфузию гепарина со скоростью 1000 ЕД/ч под контролем активированного частичного тромбопластинового времени; при отсутствии возможности четкого лабораторного контроля гепарин вводят п/к по 5 000-10 000 ЕД 4 раза в сутки. Альтернативой может, по-видимому, служить подкожное введение низкомолекулярного гепарина 2 раза в сутки (более безопасное, комфортное для пациента и не требующее лабораторного контроля).
Внутривенное введение нитратов при остром инфаркте миокарда помогает купировать болевой синдром, левожелудочковую недостаточность, артериальную гипертензию, уменьшает размеры зоны некроза и летальность. Внутривенное введение нитратов показано в острой стадии инфаркта миокарда при рецидивировании болевого синдрома, сердечной недостаточности, артериальной гипертензии. При артериальной гипотонии (систолическом АД менее 90 мм рт. ст.) введение нитратов противопоказано. Растворы нитратов для в/в введения готовят следующим образом: 10 мл 0,1 %-ного раствора (либо 1 мл 1%-ного раствора) нитроглицерина или 10 мл 0,1 %-ного раствора изосорбида динитрата (например, изокета) разводят в 100 мл изотонического раствора хлорида натрия (20 мл препарата – в 200 мл и т. д.); таким образом 1 мл приготовленного раствора содержит 100 мкг препарата. Нитраты вводят в/в капельно со скоростью 5–10 мкг/мин с последующим увеличением скорости на 20 мкг/мин каждые 5 мин до достижения желаемого эффекта под постоянным контролем АД и частоты сердечных сокращений. Обычно эффект достигается при скорости введения 50 100 мкг/мин, максимальная скорость введения – 400 мкг/мин. При отсутствии дозатора начальная скорость введения составляет обычно 6–8 капель в 1 мин; ее увеличивают под контролем АД и частоты сердечных сокращений в случае сохранения болевого синдрома при условии стабильной гемодинамики. Максимальная скорость введения – 30 капель в 1 мин.
Продолжительность инфузии нитратов 24–48 ч; за 2–3 ч до ее окончания внутрь дают первую дозу нитратов. Важно избегать передозировки нитратов – уменьшение сердечного выброса и систолического АД ниже 80 мм рт. ст. могут приводить к ухудшению коронарного кровообращения и к увеличению размеров инфаркта миокарда.
Бета-адреноблокаторы устраняют или ослабляют симпатическое влияние на сердце (повышенное в первые 48 ч после инфаркта миокарда вследствие самого заболевания и в результате реакции на боль). Снижая потребность миокарда в кислороде, они способствуют купированию болевого синдрома, уменьшению размеров инфаркта миокарда, подавляют желудочковые аритмии, уменьшают риск разрыва миокарда и повышают таким образом выживаемость пациентов. Кроме того, согласно экспериментальным данным, бета-адреноблокаторы позволяют отсрочить гибель ишемизированных кардиомиоцитов, т. е. увеличивают время от начала возникновения болевого синдрома, в течение которого тромболизис окажется эффективным. При отсутствии противопоказаний бета-адреноблокаторы назначают всем больным острым инфарктом миокарда. При упорном болевом синдроме, тахикардии, артериальной гипертензии в первые 2–4 ч заболевания показано в/в дробное введение пропранолола (1 мг в минуту каждые 3–5 мин до общей дозы 10 мг) под контролем АД, частоты сердечных сокращений и ЭКГ. При адекватной терапии частота сердечных сокращений в покое находится в пределах 40–60 в 1 мин. При развитии брадикардии, падении систолического АД ниже 100 мм рт. ст., появлении признаков сердечной недостаточности или выявлении атриовентрикулярной блокады бета-адреноблокаторы не назначают либо их введение прекращают. При эффективности в/в применения бета-адреноблокаторов пациента переводят на пероральный прием (80-240 мг пропранола в сутки внутрь в 4 приема, первую дозу дают спустя 1 ч после в/в введения препарата). В дальнейшем обычно переходят на пролонгированные формы бета-адреноблокаторов (атенолол, метопролол и др.), минимальная продолжительность терапии – не менее 12–18 мес, максимальная – всю жизнь. После длительного приема бета-адреноблокаторов отменять их следует постепенно во избежание синдрома отмены.
С первого дня инфаркта миокарда всем больным показано назначение ацетилсалициловой кислоты (аспирина) в малых дозах. В первый прием необходимо разжевать 250 мг, далее аспирин принимают 1 раз в сутки по 100–250 мг. Аспирин противопоказан при обострении язвенной болезни, при его непереносимости, а также при «аспириновой» бронхиальной астме.
Лечение осложнений. Частые желудочковые экстрасистолы высоких градаций по Лауну (ранние типа R на Т, политопные, групповые, «пробежки» тахикардии) в первые часы инфаркта миокарда могут быть следствием реканализации (в том числе спонтанной) просвета коронарной артерии, но вместе с тем – предвестником скорого возникновения желудочковой тахикардии либо фибрилляции желудочков. Препарат выбора для лечения желудочковых нарушений ритма – лидокаин – вводят в/в болюсом из расчета 1 мг/кг с последующей капельной инфузией 2–4 мг/мин. Не рекомендуется применявшееся ранее профилактическое назначение лидокаина всем больным острым инфарктом миокарда (препарат увеличивает летальность вследствие асистолии). Больным с застойной сердечной недостаточностью, заболеваниями печени лидокаин вводят в дозе, сниженной вдвое.
При желудочковой тахикардии, трепетании предсердий и мерцательной аритмии с высокой частотой сердечных сокращений и нестабильной гемодинамикой средством выбора является дефибрилляция. При мерцательной тахиаритмии и стабильной гемодинамике используют пропранолол (анаприлин, обзидан) для урежения частоты сердечных сокращений.
При развитии атриовентрикулярной блокады II–III степени в/в вводят 1 мл 0,1 %-ного раствора атропина, при неэффективности пробной терапии атропином и появлении обмороков (приступов Морганьи – Адамса – Стокса) показана временная электрокардиостимуляция. Если полная атриовентрикулярная блокада при инфаркте миокарда задней (нижней) стенки нередко оказывается преходящей, то при переднеперегородочном инфаркте миокарда она резко ухудшает ближайший прогноз и требует электрокардиостимуляции, не всегда, к сожалению, улучшающей прогноз. Блокада ветвей пучка Гиса обычно не требует специального медикаментозного лечения.
При острой левожелудочковой недостаточности с развитием сердечной астмы или отека легких одновременно с наркотическими анальгетиками и нитроглицерином в/в струйно вводят 40-120 мг (4-12 мл) раствора фуросемида (лазикса). Застойные явления вынуждают к назначению ингибиторов АПФ и диуретических препаратов (фуросемид, гипотиазид, триампур).
При кардиогенном шоке, т. е. при артериальной гипотензии (АД ниже 90/60 мм рт. ст.), сочетающейся с анурией либо олигурией (менее 8 капель мочи в 1 мин по катетеру), нарушениями сознания и с острой сердечной недостаточностью (застойные явления в легких с одышкой, цианозом; синдром малого сердечного выброса; отек легких), необходимо прежде всего купировать ангинозную боль, как это описано при ангинозном приступе. При отсутствии отека легких в/в быстро вводят 250–500 мл жидкости, при недостаточном эффекте прибегают к инфузии вазопрессоров. При выраженной артериальной гипотонии (систолическое АД менее 70 мм рт. ст.) в/в капельно вводят норадреналин со скоростью 0,5-30 мкг/кг/мин. Если систолическое АД составляет 70–90 мм рт. ст., предпочтение отдают допамину (из расчета 25 мг допамина на 125 мл раствора; при этом скорость введения 1 мл/мин, т. е. 16–18 капель в 1 мин, соответствует инфузии 200 мкг препарата в 1 мин). Скорость введения допамина может и должна изменяться в зависимости от реакции сердечной деятельности и сосудистого тонуса, а также объема выделяемой мочи. При отсутствии эффекта на фоне внутривенного капельного введения допамина со скоростью 20 мкг/ кг/мин переходят на инфузию норадреналина. Прогноз крайне серьезен, особенно если кардиогенный шок сочетается с отеком легких. Признаком преодоления кардиогенного шока служит возобновление диуреза в объеме 1 мл и более в минуту; не следует ориентироваться только на повышение уровня АД. В специализированных отделениях выбор тактики лечения шока и контроль за ходом лечения облегчаются получением информации о давлении в легочной артерии, об объеме циркулирующей крови, о параметрах центральной гемодинамики, оксигенизации и рН крови, величине минутного диуреза, а также о рентгенографической картине кровенаполнения легких и некоторых других данных.
При появлении признаков острого перикардита целесообразна терапия аспирином. Глюкокортикоиды не назначают, так как они замедляют образование рубцовой ткани и увеличивают риск разрыва миокарда. При тромбоэмболии ветвей легочной артерии гепаринотерапия необходима тем более, чем более достоверен диагноз; ее следует сочетать с лечением недостаточности сердца (нередко латентной), являющейся причиной периферического, часто бессимптомного флеботромбоза (источник тромбоэмболии). В специализированных отделениях проводится тромболитическая терапия.
Больной острым инфарктом миокарда подлежит обязательной ранней госпитализации в блок интенсивной терапии сразу же при отсутствии болевого синдрома либо после его купирования. При подозрении на осложненное течение острого инфаркта миокарда вызывают (если есть возможность) специализированную бригаду интенсивной терапии, до приезда которой весь комплекс лечебных мероприятий по обезболиванию и борьбе с осложнениями инфаркта миокарда осуществляется на месте (за исключением тех случаев, когда инфаркт миокарда развился на улице и пациента необходимо как можно скорее перенести в машину). Больного с острым инфарктом миокарда транспортируют после купирования опасных для жизни осложнений от места, где возник болевой приступ, до койки в реанимационном отделении больницы на одних и тех же носилках в своей одежде. Никаких лишних перекладываний и переодеваний не допускается. Больной не подлежит санитарной обработке.
В условиях стационара, помимо медикаментозной терапии, проводятся реабилитационные мероприятия. Активность больного в постели – с первого дня; при неосложненном течении инфаркта миокарда разрешается присаживание на кровати к концу первых суток, вставание – на следующий день. Сроки перевода больного на режим амбулаторной или санаторной реабилитации, а также возвращение к работе и трудоустройство определяются индивидуально.
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА – хронический патологический процесс, обусловленный недостаточностью кровоснабжения миокарда; в подавляющем большинстве (97–98 %) случаев является следствием атеросклероза коронарных артерий сердца. Основные клинические формы – стенокардия, инфаркт миокарда и кардиосклероз; две первых – острые, а кардиосклероз – хроническая формы болезни. Они встречаются у больных как изолированно, так и в сочетаниях, в том числе и с различными их осложнениями и последствиями (сердечная недостаточность, нарушения сердечного ритма и внутрисердечной проводимости, тромбоэмболии и др.). Этим определяется широкий диапазон лечебных и профилактических мер. В периоде ремиссии болезни показано санаторно-курортное лечение; в климатических условиях средней полосы России – на протяжении всего года, в условиях южных курортов – в нежаркие месяцы года.
Прогноз и трудоспособность зависят от частоты обострений болезни, а также от характера и стойкости нарушений функций сердца (и других органов), наступивших в результате осложнений заболевания.
КАРДИАЛГИИ – боли в области сердца, отличающиеся по своим признакам от стенокардии; характеризуются колющими, жгучими, ноющими, реже давящими болевыми ощущениями в области сердца; они могут иррадиировать по всей левой половине грудной клетки, левой руке и левой лопатке; они бывают мимолетными (молниеносный «прокол»), непродолжительными (минуты, часы) и очень долгими (дни, недели, месяцы). Как правило, кардиалгии не прекращаются после приема нитратов. Наличие кардиалгии не исключает у некоторых больных атеросклероза венечных артерий сердца и может иногда перемежаться или сочетаться с истинными приступами стенокардии.
Любая боль в левой половине груди может расцениваться как кардиалгия, пока не уточнен диагноз. Кардиалгии возникают при ряде клинических синдромов и патологических состояний.
Кардиалгия при поражениях периферической нервной системы. Шейный остеохондроз и грыжа межпозвоночного диска могут вызывать сдавление нервных корешков; кардиалгический синдром может быть также следствием раздражения симпатического сплетения позвоночной артерии. В первом и втором случае появление болей в левой половине груди связано с определенными положениями и движениями руки, головы, но не с физическим напряжением; боли могут усиливаться или возникать в ночное время, при натяжении шейно-грудных корешков (отведение руки за спину, вытягивание ее в сторону). Наблюдается повышение или понижение рефлексов и гипо– или гиперестезия на руке. В третьем случае – при сдавлении симпатического сплетения позвоночной артерии – к описанным симптомам иногда присоединяется отечность кисти, что связано с нарушением вазоконстрикторной симпатической иннервации; при надавливании на голову в направлении продольной оси позвоночника и при сгибании головы, повернутой в сторону поражения, возникает боль.
Необходимо лечение основного заболевания. Прогноз благоприятный.
Кардиалгия может быть следствием шейно-плечевого синдрома, появляющегося в результате сдавления подключичных артерий, вены и плечевого сплетения при дополнительном шейном ребре (синдром Фальконера – Ведделя) или при патологической гипертрофии («синдроме») передней лестничной мышцы (синдром Наффцигера). К особенностям болевого синдрома в этих случаях относится появление болей при ношении небольших тяжестей в руке, при работе с поднятыми руками. При осмотре определяется утолщенная болезненная передняя лестничная мышца, отмечается расширение подкожных вен над большой грудной мышцей, понижение температуры, а иногда и отечность кисти, снижение АД на лучевой артерии на стороне поражения. На рентгенограмме может быть выявлено дополнительное ребро, увеличение поперечного отростка VII шейного позвонка.
Лечение. При дополнительном шейном ребре в случае тяжелого болевого синдрома и сдавления подключичных сосудов показано удаление этого ребра; при синдроме передней лестничной мышцы в легких случаях назначают анальгин, индометацин (метиндол) в обычных дозах, при тяжелых поражениях вводят в гипертрофированную переднюю лестничную мышцу 2 %-ный раствор новокаина (2 мл) или раствор гидрокортизона (2 мл) – 2–3 раза, через день. В очень тяжелых случаях приходится прибегать к рассечению мышцы. Прогноз обычно благоприятный.
Кардиалгия может возникать при левосторонней межреберной невралгии, опоясывающем герпесе, невриноме корешков (в последнем случае боль может быть настолько интенсивной, что даже не уступает введению морфина – это имеет диагностическое значение). При опоясывающем лишае иногда отмечаются изменения на ЭКГ в виде снижения сегмента ST, уплощения или инверсии зубца Т. Необходимо лечение соответствующих заболеваний.
Болезненное утолщение реберных хрящей (чаще II–IV ребер), или синдром Титце, – довольно распространенная болезнь у лиц старше 40 лет, сопровождающаяся кардиалгией. Этиология неизвестна. В основе патогенеза – асептическое воспаление реберных хрящей.
Лечение симптоматическое (анальгин, ибупрофен или бруфен).
Прогноз благоприятный.
Кардиалгия может наблюдаться при высоком стоянии диафрагмы, обусловленном вздутием желудка или кишечника, ожирением и т. п. (синдром Ремхельда). Боли возникают нередко после еды, если больной лежит, но исчезают при переходе в вертикальное положение, при ходьбе; иногда они сочетаются с настоящей стенокардией (дифференциация несложна уже при правильно собранном анамнезе).
Кардиалгия может быть обусловлена диафрагмальной грыжей, возникающей чаще в пожилом возрасте при растяжении пищеводного отверстия диафрагмы, а также при травматическом разрыве купола диафрагмы. Ноющие боли, загрудинные или иной локализации, возникают в результате смещения органов средостения или ущемления желудка, или при образов ании язвы в иролабирующей части желудка. Боли появляются сразу после приема пищи или в горизонтальном положении, иногда по ночам (при поздней еде). Боль исчезает при ходьбе, после отрыжки, при переходе в вертикальное положение. Часто кардиалгический синдром сочетается у этих больных с признаками железодефицитной анемии, обусловленной повторными кровотечениями. При ущемлении грыжи возможно появление вскоре после еды сильнейшей загрудинной боли, которая не прекращается от применения обычных анальгезирующих средств, морфина, нитратов, но исчезает внезапно при перемене положения тела (обычно в вертикальном положении). Диагноз устанавливают рентгенологически (исследование с опущенным головным концом тела). Возможно сочетание со стенокардией.
Пептическая язва пищевода, кардиоспазм, эзофагит могут сопровождаться кардиалгией, отличительной особенностью которой является отчетливая связь с прохождением пищи по пищеводу.
При расположении поперечной ободочной кишки над печенью (синдром Килайдити) может возникать либо сильнейшая боль справа от грудины (при ущемлении кишки), либо ноющая загрудинная боль (при вздутии кишечника). Заподозрить это заболевание можно при обнаружении тимпанита над печенью; диагноз устанавливается рентгенологически. Прогноз обычно благоприятный.
Кардиалгический синдром может наблюдаться при первичной легочной гипертонии, инфаркте легкого (он может сопровождаться и приступом стенокардии), парапневмоническом плеврите. Ноющие и колющие боли в области сердца могут возникать при миокардите (один из признаков рецидива ревмокардита), перикардите.
Лечение и прогноз определяются основным заболеванием.
Синдром передней грудной стенки – появление болей и болезненности в области сердца после окончания острого периода инфаркта миокарда, будучи типичным вариантом кардиалгии, может при нечетко собранном анамнезе имитировать рецидив коронарной атаки. Патогенез синдрома неясен. Ноющие боли могут быть разной интенсивности, иногда они выражены резко, в других случаях субъективные ощущения почти отсутствуют, отмечается лишь болезненность околосердечной области.
Лечение – анальгезирующие препараты. Прогноз собственно кардиалгии благоприятен.
Дисгормональные кардиопатии проявляются выраженными кардиалгиями, но независимо от них могут появляться и некоторые нарушения деятельности сердца, регистрируемые в виде желудочковых экстрасистолий, отрицательного зубца Т чаще в отведениях V1-V4, реже – и в остальных грудных отведениях ЭКГ, легкого смещения вниз сегмента ST в тех же отведениях (признак необязательный), преходящих блокад ножек пучка Гиса. В этих случаях следует говорить уже не о кардиалгии (хотя она обычно имеет место), а о кардиопатии (миокардиопатии). Патогенез болевого синдрома и нарушений деятельности сердца при дисгормональных состояниях остается недостаточно выясненным. Дисгормональные кардиопатии могут возникать при тиреотоксикозе и других эндокринных заболеваниях.
Наиболее выражены эти изменения при климаксе, когда очень часто возникает климактерическая кардиалгия, реже климактерическая кардиопатия. Синдром возникает на фоне вегетативных нарушений, характерных для климакса, иногда за несколько лет до прекращения менструаций, реже – через несколько лет после наступления аменореи. Больные жалуются на чувство тяжести, стеснения за грудиной, чаще слева от нее, режущую, жгучую, прокалывающую боль в области верхушечного толчка.
Боль может быть кратковременной, продолжительной (часы, недели, месяцы), иногда возникает в ночное время, имитируя стенокардию покоя. Нередки жалобы на нехватку воздуха: при этом речь идет не об истинной одышке, а о чувстве неудовлетворенности вдохом, крылья носа не расширяются, вспомогательные мышцы (объективный признак одышки) в дыхании не участвуют. Боль, как правило, не провоцируется физическим напряжением, частоту и интенсивность приступов не сокращает постельный режим, нитраты боли не прекращают или приводят к их ослаблению через длительный промежуток времени (при стенокардии – через несколько минут!), чаще нитраты вызывают лишь сильную головную боль. Нередки жалобы на приступы потери сознания, однако в тех случаях, когда врачу удается наблюдать эти эпизоды, речь идет практически об истерическом припадке с мелкими клоническими судорогами. Возможны и обмороки. Обычно боль сопровождается «приливами», потоотделением, парестезиями; больные раздражительны, эмоционально лабильны, настроение снижено. Иногда предъявляются жалобы на сильные головные боли, сердцебиение, чувство остановки сердца, спазмы в горле, головокружения. При осмотре выявляется небольшая тахикардия, возможна сосудистая дистония. Приступ заканчивается ощущением резкой слабости, профузным потоотделением, полиурией. Кардиалгия может сопровождаться страхом смерти.
Появление изменений на ЭКГ, прежде всего отрицательных зубцов Т, которые могут быть глубокими и симметричными, требует дифференциации с очаговыми поражениями миокарда (ишемия, мелкоочаговый инфаркт). Отличительные электрокардиографические признаки климактерической кардиопатии: отсутствие противоположного направления зубца Т смещению сегмента ST (смещается вниз при отрицательном зубце Т, а при инфаркте миокарда смещается кверху при отрицательном зубце T); отрицательный зубец Т сохраняется неделями (нередко месяцами и годами), с несоответствующими болевому синдрому колебаниями, вплоть до появления положительного зубца Т (при инфаркте он постепенно нормализуется); при кардиопатии в отличие от инфаркта отрицательный зубец Т становится положительным через 1 ч после приема 40 мг индерала (индераловая проба) или 5 г хлорида калия (проба с хлоридом калия). Отвергнуть наличие инфаркта миокарда помогает определение активности ферментов в крови, миоглобина в крови и моче. В отличие от климактерической кардиопатии при ишемии миокарда отрицательный зубец Т сохраняется 1–2 дня. Важнейшую роль в дифференциальной диагностике играет правильно собранный анамнез. Во всех сомнительных случаях до выяснения диагноза необходимо лечить больных, как при инфаркте миокарда.
В лечении климактерической кардиалгии и кардиопатии основную роль играет психотерапия: разъяснение больным полной безопасности как болевого синдрома (его несвязанности со стенокардией), так и обнаруживаемых изменений на ЭКГ. Постельный режим не показан. Как правило, больные сохраняют трудоспособность. Медикаментозная терапия сводится к назначению препаратов валерианы (в частности, капель Зеленина) в случае упорной кардиалгии. При климактерической кардиопатии, сопровождающейся появлением отрицательных зубцов Т, хороший эффект (нормализация ЭКГ, прекращение боли) дают верапамил (изоптин), анаприлин (индерал) в дозе 40 мг 1–3 раза в сутки (при выраженной брадикардии, нарушениях проводимости не назначать!). Половые гормоны используют лишь при других тяжелых проявлениях климакса. Важнейший показатель эффективности терапии – исчезновение или существенное ослабление боли независимо от показателей ЭКГ. Прогноз благоприятный.
Дисгормональная кардиопатия с клинической картиной, подобной описанной выше, наблюдается при лечении половыми гормонами аденомы или рака предстательной железы. Терапия собственно кардиопатии та же.
Кардиалгия, желудочковая экстрасистолия встречаются в период полового созревания (пубертатное сердце). При этом синдроме наблюдаются и вегетативные, и поведенческие особенности дисгормонального состояния, хотя они существенно менее выражены, чем при климаксе. Специальное лечение не проводится. Прогноз благоприятный.
Все особенности климактерической кардиопатии (включая и появление отрицательного зубца Т на ЭКГ) могут наблюдаться перед началом и в первые дни менструации – предменструальный синдром. Специальная терапия не проводится.
КАРДИОМИОПАТИИ – первичные невоспалительные поражения миокарда невыясненной этиологии (идиопатические), не связанные с клапанными пороками или внутрисердечными шунтами, артериальной или легочной гипертензией, ишемической болезнью сердца или системными заболеваниями (диффузные заболевания соединительной ткани, амилоидоз, гемохроматоз и др.). Патогенез кардиомиопатии неясен. Предполагается участие генетических факторов, ферментных и эндокринных нарушений (в частности, в симпатико-адреналовой системе), не исключается роль вирусной инфекции и иммунологических сдвигов. Основные формы кардиомиопатий: гипертрофическая (обструктивная и необструктивная), дилатационная (застойная) и рестриктивная (встречается редко).
Гипертрофическая кардиомиопатия характеризуется гипертрофией стенок и уменьшением объема полости левого желудочка, нормальной или усиленной его сократимостью и нарушением расслабления (диастолическая дисфункция). Необструктивная форма характеризуется увеличением размеров сердца вследствие диффузной гипертрофии стенок левого желудочка, реже только верхушки сердца. У верхушки сердца или у мечевидного отростка выслушивается систолический шум, нередко пресистолический ритм галопа. При асимметричной гипертрофии межжелудочковой перегородки с сужением путей оттока левого желудочка (обструктивная форма) возникают симптомы мышечного субаортального стеноза: боли за грудиной (больные описывают типичную стенокардию напряжения), приступы головокружения со склонностью к обморочным состояниям, приступообразная ночная одышка, громкий систолический шум в третьем-четвертом межреберье у левого края грудины, не проводящийся на сонные артерии, с максимумом в середине систолы, иногда сочетающийся с систолическим шумом регургитации, обусловленным «сосочковой» митральной недостаточностью. Нередки аритмия (желудочковая, наджелудочковая тахикардия, мерцательная аритмия) и нарушения внутрисердечной проводимости (блокады). Прогрессирование гипертрофии может приводить к развитию сердечной недостаточности сначала левожелудочковой, затем тотальной (в этой стадии часто появляется протодиастолический ритм галопа). На ЭКГ – признаки гипертрофии левого желудочка и межжелудочковой перегородки: глубокие неуширенные зубцы Q во II, III, aVF, V4_6 отведениях в сочетании с высоким зубцом R. Эхокардиография – наиболее надежный метод выявления гипертрофии стенок желудочков и межжелудочковой перегородки. Помогает диагностике зондирование полостей сердца и радионуклидная вентрикулография.
Лечение. При гипертрофической кардиомиопатии применяют средства, снижающие сократимость миокарда – бета-адреноблокаторы (пропранолол и др.), антагонисты кальция (изоптин и др.). Для профилактики угрожающих жизни аритмий возможно использование амиодарона (кордарона). При развитии сердечной недостаточности ограничивают физические нагрузки, назначают диету с уменьшенным содержанием соли и жидкости, мочегонные средства. Применение вазодилататоров (нитратов, ингибиторов АПФ) и сердечных гликозидов при обструкции выносящего тракта левого желудочка нецелесообразно. При неэффективности консервативной терапии и выраженной обструкции выносящего тракта левого желудочка возможна хирургическая коррекция субаортального стеноза.
Дилатационная кардиомиопатия проявляется резким расширением всех камер сердца со снижением сократительной функции левого желудочка. Характерны нарушения сердечного ритма, неуклонно прогрессирующая, рефрактерная к терапии сердечная недостаточность, развитие тромбозов и тромбоэмболий. При осмотре обращают на себя внимание расширение границ сердца, аускультативная картина относительной недостаточности митрального и трикуспидального клапанов. На ЭКГ часто выявляется низкий вольтаж комплексов QRS, патологический зубец Q, депрессия сегмента ST, блокада левой ножки пучка Гиса; при рентгенографии органов грудной клетки – кардиомегалия, при эхокардиографии – расширение правого и левого желудочков.
Дифференциальный диагноз проводят с миокардитом и миокардиодистрофиями (т. е. с теми состояниями, которые без должных оснований иногда именуют вторичными кардиомиопатиями), а также с постинфарктным кардиосклерозом, митральным пороком сердца.
Лечение дилатационной кардиомиопатии подразумевает коррекцию сердечной недостаточности и включает диету с ограничением поваренной соли и жидкости, применение вазодилататоров (ингибиторов АПФ) и мочегонных средств. В последние годы показано, что терапия бета-адреноблокаторами улучшает прогноз при дилатационной кардиомиопатии.
КАРДИОСКЛЕРОЗ – поражение мышцы (миокардиосклероз) и клапанов сердца вследствие развития в них рубцовой ткани в виде участков различной величины (от микроскопических до крупных Рубцовых очагов и полей) и распространенности, замещающих миокард или (и) деформирующих клапаны. Является исходом ревматизма и миокардитов разной природы (миокардитический кардиосклероз) либо атеросклероза коронарных артерий (коронарогенный атеросклеротический кардиосклероз). Клиническое значение кардиосклероза другого происхождения (исход дистрофии и гипертрофии миокарда, травмы сердца, других его болезней) невелико.
Диагноз. Проявлениями миокардиосклероза служат стабильные аритмии и нарушения внутрисердечной проводимости, хроническая сердечная недостаточность. Атеросклеротический кардиосклероз может вызывать клапанные пороки почти исключительно в форме недостаточности митрального (папиллярный порок) или аортального клапанов; при атеросклеротическом кардиосклерозе могут возникать приступы стенокардии, а также может развиться хроническая аневризма сердца. Течение чаще медленно прогрессирующее вследствие хронически рецидивирующего (ревматизм) или прогрессирующего (атеросклероз) характера основной болезни.
Лечение основной болезни; патогенетическая терапия отдельных синдромов; аритмий, атриовентрикулярной блокады, хронической сердечной недостаточности (учитывая, что при кардиосклерозе толерантность миокарда к сердечным гликозидам, как правило, снижается).
КОЛЛАПС – одна из форм острой сосудистой недостаточности, характеризующаяся резким падением сосудистого тонуса или быстрым уменьшением массы циркулирующей крови, что приводит к уменьшению венозного притока к сердцу, падению артериального и венозного давления, гипоксии мозга и угнетению жизненных функций организма. Причины: острые инфекции (брюшной и сыпной тифы, менингоэнцефалит, пневмония и др.), острая кровопотеря, болезни эндокринной и нервной системы (опухоли, сирингомиелия и др.), экзогенные интоксикации (отравления окисью углерода, фосфорорганическими соединениями и др.), спинномозговая и эпидуральная анестезия, ортостатическое перераспределение крови (передозировка некоторых лекарственных средств – ганглиоблокаторов, инсулина, гипотензивных препаратов и др.), острые заболевания органов брюшной полости (перитонит и др.). Коллапс может быть осложнением острого нарушения сократительной функции миокарда, объединяемого понятием «синдром малого сердечного выброса», который возникает в остром периоде инфаркта миокарда, при резко выраженной тахикардии, глубокой брадикардии, нарушениях функции синусового узла и др.
Имеются различия между понятиями «коллапс» и «шок». Шоком в отличие от коллапса называют реакцию организма на сверхсильное, особенно болевое, раздражение, сопровождающуюся более тяжелыми расстройствами жизненно важных функций нервной и эндокринной систем, кровообращения, дыхания, обменных процессов и часто выделительной функции почек.
Симптомы. Большей частью внезапно развиваются ощущения общей слабости, головокружение, больной жалуется на зябкость, озноб, жажду; температура тела снижена. Черты лица заострены, конечности холодные, кожные покровы и слизистые оболочки бледны с цианотичным оттенком, лоб, виски, иногда все тело покрыто холодным потом, малый и слабый пульс, обычно учащенный, вены спавшиеся, АД понижено. Сердце не расширено, тоны его глухие, иногда аритмичные, дыхание поверхностное, учащенное, но, несмотря на одышку, больной не испытывает удушья, лежит с низко расположенной головой. Диурез снижен. Сознание сохранено или затемнено, к окружающему больной безучастен, реакция зрачков на свет вялая, наблюдаются тремор пальцев рук, иногда судороги. Объем циркулирующей крови всегда снижен, часто определяются декомпенсированный метаболический ацидоз, гематокрит повышен. Дифференциальный диагноз проводят с обмороком, при котором функциональные нарушения выражены значительно слабее, АД нормальное, а также с сердечной недостаточностью, отличающейся от коллапса ортопноэ, увеличением объема циркулирующей крови, нормальным АД.
Лечение неотложное. В зависимости от причины – остановка кровотечения, удаление из организма токсических веществ, применение специфических антидотов, устранение гипоксии и др. Больного согревают, укладывают с приподнятыми ногами. Проводится трансфузия кровезаменителей (полиглюкин, гемодез, реополиглюкин, солевые растворы) и лишь по строгим показаниям – компонентов крови. При недостаточном эффекте добавляют 1–2 мл 1 %-ного раствора мезатона или капельно 1 мл 0,2 %-ного раствора норадреналина (при геморрагическом коллапсе вазопрессорные препараты применяют только после восстановления объема крови). При ацидозе в/в вводят растворы гидрокарбоната натрия (50-100 мл 8,4 %-ного раствора или 100–200 мл 4,5 %-ного раствора). При синдроме малого сердечного выброса применяют антиаритмические препараты (если он обусловлен аритмией), допамин (капельно в/в 25-100-200 мг в 5 %-ном растворе глюкозы или изотоническом растворе хлорида натрия), экстренную электрокардиостимуляцию и др.
Прогноз определяется причиной коллапса и степенью сосудистых расстройств.
ЛЕГОЧНОЕ СЕРДЦЕ – увеличение правого желудочка сердца вследствие заболеваний, нарушающих структуру и (или) функцию легких (за исключением случаев первичного поражения левых отделов сердца, врожденных пороков сердца).
Этиология. Различают: 1) васкулярную форму легочного сердца – при легочных васкулитах, первичной легочной гипертензии, горной болезни, тромбоэмболии легочных артерий; 2) бронхолегочную форму, наблюдавшуюся при диффузном поражении бронхов и легочной паренхимы – при бронхиальной астме, бронхиолите, хроническом обструктивном бронхите, эмфиземе легких, диффузном пневмосклерозе и фиброзах легких в исходе неспецифических пневмоний, туберкулезе, при пневмокониозе, саркоидозе, синдроме Хаммена – Рича и др; 3) торакодиафрагмальную форму легочного сердца, развивающуюся при значительных нарушениях вентиляции и кровотока в легких вследствие деформации грудной клетки (кифосколиозы и др.), патологии плевры, диафрагмы (при торакопластике, массивном фибротораксе, пикквикском синдроме и т. п.).
Патогенез. Ведущее значение имеет легочная артериальная гипертензия, обусловленная патологическим повышением сопротивления кровотоку при гипертонии легочных артериол – первичной (при первичной легочной гипертензии) или в ответ на альвеолярную гипоксию (при горной болезни, нарушениях вентиляции альвеол у больных с бронхиальной обструкцией, кифосколиозом и др.) либо вследствие анатомического уменьшения просвета артериального легочного русла за счет склероза, облитерации (в зонах пневмосклероза, легочного фиброза, при васкулитах), тромбоза или тромбоэмболии, после хирургического иссечения (при пульмонэктомии). При дыхательной недостаточности у больных с обширным поражением ткани легких патогенетическое значение имеет и нагрузка сердца вследствие компенсаторного повышения объема кровообращения за счет усиленного венозного возврата крови к сердцу. Повышение давления в малом круге кровообращения приводит к гипертрофии и дилатации правого желудочка, а в дальнейшем – к правожелудочковой сердечной недостаточности.
Классификация. По особенностям развития выделяют острое легочное сердце, развивающееся за несколько часов или дней (например, при массивной тромбоэмболии легочных артерий, клапанном пневмотораксе), подострое (развивается за недели, месяцы при повторных тромбоэмболиях легочных артерий, первичной легочной гипертензии, лимфогенном карциноматозе легких, тяжелом течении бронхиальной астмы, бронхиолитов) и хроническое, формирующееся на фоне многолетней дыхательной недостаточности.
В развитии хронического легочного сердца выделяют три стадии: I стадия (доклиническая) характеризуется транзиторной легочной гипертензией с признаками напряженной деятельности правого желудочка, которые выявляются только при инструментальном исследовании; II стадия определяется по наличию признаков гипертрофии правого желудочка и стабильной легочной гипертензии при отсутствии недостаточности кровообращения; III стадия, или стадия декомпенсированного легочного сердца (легочно-сердечная недостаточность), наступает со времени появления первых симптомов недостаточности правого желудочка.
Клинические проявления. Острое легочное сердце проявляется болью за грудиной, резко учащенным дыханием, падением АД, вплоть до развития коллапса, пепельно-серым диффузным цианозом, расширением границ сердца вправо, иногда появлением подложечной пульсации; нарастающей тахикардией, усилением и акцентом II тона сердца над легочным стволом; отклонением электрической оси сердца вправо и электрокардиографическими признаками перегрузки правого предсердия; повышением венозного давления, набуханием шейных вен, увеличением печени, нередко сопровождающимся болями в правом подреберье.
Хроническое легочное сердце до стадии декомпенсации распознается по симптомам гиперфункции, затем гипертрофии правого желудочка на фоне артериальной гипертензии, выявляемых вначале с помощью ЭКГ, рентгенологического исследования грудной клетки, эхокардиографии, а в последующем и по клиническим признакам: появлению выраженного сердечного толчка (сотрясение передней грудной стенки при сокращениях сердца), пульсации правого желудочка, определяемой пальпаторно за мечевидным отростком, усилению и постоянному акценту II тона сердца над легочным стволом при нередком усилении I тона над нижней частью грудины. В стадии декомпенсации появляется правожелудочковая недостаточность: тахикардия; акроцианоз; набухание шейных вен, сохраняющееся на вдохе (их набухание только на выдохе может быть обусловлено бронхиальной обструкцией), никтурия; увеличение печени, периферические отеки (см. Сердечная недостаточность).
Лечение. Проводится лечение основного заболевания (ликвидация пневмоторакса, тромболитическая терапия или хирургическое вмешательство при тромбоэмболии легочных артерий, терапия бронхиальной астмы и т. д.), а также меры, направленные на устранение дыхательной недостаточности. По показаниям применяют бронхолитики, отхаркивающие средства, оксигенотерапию.
В целях снижения артериальной легочной гипертензии при хроническом легочном сердце могут быть применены эуфиллин (в/в, в свечах), антагонисты кальция дигидропиридинового ряда (нифедипин, амлодипин, исрадипин), дильтиазем.
При развитии сердечной недостаточности применяют мочегонные средства; если диуретики применяются часто, преимущества имеют калийсберегающие препараты (триампур, альдактон и др.). При гипокалиемии применяют препараты калия. Лечение сердечными гликозидами проводится с большой осторожностью, поскольку гипоксемия, гиперкапния и ацидоз повышают чувствительность миокарда к токсическому действию гликозидов. Во избежание развития фибрилляции желудочков внутривенное введение сердечных гликозидов нельзя сочетать с одновременным введением эуфиллина, препаратов кальция (антагонисты по влиянию на гетеротопный автоматизм миокарда). По той же причине не следует вводить в/в сердечные гликозиды на фоне интоксикации адреномиметиками у больных с бронхиальной обструкцией (астматический статус и др.). Поддерживающая терапия дигоксином у больных с декомпенсированным хроническим легочным сердцем подбирается с учетом снижения толерантности к токсическому действию препаратов в случае нарастания дыхательной недостаточности.
Учитывая высокую вероятность тромбоэмболических осложнений у пациентов с легочным сердцем, при тромбозе вен показана длительная антикоагулянтная терапия.
Профилактика состоит в предупреждении, а также своевременном и эффективном лечении болезней, осложняющихся развитием легочного сердца. Больные хроническими бронхолегочными заболеваниями подлежат диспансерному наблюдению в целях предупреждения обострений и проведения рациональной терапии дыхательной недостаточности. Большое значение имеет правильное трудоустройство больных с ограничением физической нагрузки, способствующей возрастанию легочной гипертензии.
МИОКАРДИОДИСТРОФИЯ – невоспалительное поражение сердечной мышцы в результате нарушений ее метаболизма под влиянием внесердечных факторов.
Этиология. Острые и хронические экзогенные интоксикации, в том числе алкогольная, эндокринные и обменные нарушения (тиреотоксикоз, микседема, синдром Кушинга, ожирение, сахарный диабет, авитаминозы, голодание), анемии, патологический климакс, физическое перенапряжение («солдатское сердце»), инфекции (в том числе тонзиллярная), физические агенты (радиация, невесомость, перегревание), системные заболевания (диффузные заболевания соединительной ткани, нейромышечная дистрофия и др.). К миокардиодистрофиям относят также отложение в миокарде патологических продуктов обмена или нормальных метаболитов: амилоида, железа (при гемохроматозе), гликогена и др. Некоторые формы миокардиодистрофии нередко называют также миокардиопатиями (алкогольная, климактерическая, амилоидная).
Патогенез. Изменение течения биохимических процессов в миокарде с последующим нарушением микроструктур и сократительной функции мышечных волокон. Эти изменения до определенного предела обратимы.
Симптомы нередко маскируются проявлениями основного заболевания. Отмечается повышенная утомляемость, небольшая одышка при физических напряжениях, приглушение I тона сердца на верхушке, иногда умеренная тахикардия. При анемии часто выслушивается систолический шум над верхушкой и легочной артерией, при тиреотоксикозе нередки боли в области сердца, выраженная тахикардия, повышение систолического и пульсового давления, мерцательная аритмия; при микседеме – одышка, редкий пульс, гипотензия, глухость сердечных тонов, рано появляются признаки сердечной недостаточности. При прогрессирующем течении миокардиодистрофии любой этиологии развивается сердечная недостаточность, возникают нарушения сердечного ритма. Изменения ЭКГ чаще умеренные, выражаются в снижении, уплощении или инверсии зубцов Т; при микседеме – снижение вольтажа; при электролитных нарушениях – изменения, наблюдающиеся при гипо– и гиперкалиемии, при гипомагниемии и др. Дифференциальный диагноз проводят с хронической ишемической болезнью сердца, миокардитами, кардиомиопатиями.
Лечение. Устранение основного патологического процесса, вызвавшего миокардиодистрофию. Регулирование режима труда, предупреждение физических нагрузок, рациональное питание (коррекция обменных нарушений), санация хронических очагов инфекции. Назначают средства, способствующие нормализации обмена в миокарде – рибоксин (0,6–2,4 г в сутки), оротат калия (1 г в сутки), кокарбоксилазу (50-100 мг в сутки) и др., по показаниям – бета-адреноблокаторы.
Прогноз при адекватной терапии благоприятный.
МИОКАРДИТ – воспалительное поражение сердечной мышцы.
Классификация. По этиологии различают миокардиты: ревматический, инфекционный (инфекционно-аллергический, пара– и метаинфекционный), связанный с вирусной, бактериальной, риккетсиозной и другими инфекциями; аллергический (лекарственный, сывороточный, поствакцинальный, при бронхиальной астме и др.); миокардиты при системных болезнях соединительной ткани, паразитарных инфекциях, саркоидозе, травмах, ожогах, воздействии ионизирующего излучения; идиопатический миокардит Абрамова – Фидлера невыясненной этиологии. По распространенности поражения миокарда различают очаговый и диффузный микардит. Течение заболевания может быть острым (длительность до 3 мес), подострым (длительность 3–6 мес) и хроническим (рецидивирующим).
В патогенезе миокардита ведущая роль в большинстве случаев принадлежит различным аллергическим и иммунологическим сдвигам.
Симптомы, течение. Инфекционно-аллергический миокардит (наиболее распространенная форма неревматического миокардита) начинается в отличие от ревматического, как правило, на фоне инфекции (чаще – вирусной) или вскоре после нее. Отмечаются недомогание, длительная колющая или ноющая боль в области сердца, сердцебиение и «перебои» в работе сердца, одышка, в ряде случаев умеренная боль в суставах. Температура тела чаще субфебрильная или нормальная. Начало заболевания может быть малосимптомным или скрытым.
При осмотре нередко удается выявить тахикардию, возможно появление пресистолического, а в более поздних стадиях – протодиастолического ритма галопа. Короткий функциональный систолический шум на верхушке сердца или в пятой точке и приглушение тонов не являются достоверными признаками миокардита, в то же время исчезновение функционального систолического шума в процессе лечения, обусловленное прекращением пролабирования створки митрального клапана, так же как и восстановление звучности тонов сердца, свидетельствует об улучшении состояния миокарда.
Степень выраженности симптомов в значительной мере определяется распространенностью и остротой прогрессирования процесса. При диффузных формах сравнительно рано увеличиваются размеры сердца, появляются признаки сердечной недостаточности, нарушения сердечного ритма (тахикардия, реже брадикардия, эктопические аритмии) и внутрисердечной проводимости.
При обследовании выявляют повышение активности лактатдегидрогеназы и креатинфосфокиназы, на ЭКГ – различные нарушения сердечного ритма и проводимости, изменения конечной части желудочкового комплекса, при диффузном миокардите возможно формирование патологического зубца Q (признак кардиосклероза). Изменения ЭКГ, гиперферментемия, кардиомегалия, застойная сердечная недостаточность и кардиогенный шок относятся к большим признакам поражения миокарда; тахикардия, ослабление I тона и ритм галопа – к малым. Диагноз миокардита считается достоверным при сочетании предшествующей инфекции с одним большим и двумя малыми признаками.
Идиопатический миокардит отличается более тяжелым, иногда злокачественным течением с развитием кардиомегалии (вследствие резко выраженной дилатации сердца), тяжелых нарушений ритма и проводимости, сердечной недостаточности; нередко образуются пристеночные тромбы в полостях сердца с тромбоэмболиями по большому и малому кругам кровообращения. При осмотре выявляется расширение границ сердца, глухость сердечных тонов; на ЭКГ – изменения сегмента ST и зубцаТ,патологический зубец Q, нарушения ритма и проводимости; при эхокардиографии – кардиомегалия, дилатация камер сердца, снижение сердечного выброса, диффузное снижение сократимости миокарда.
При миокардитах, связанных с системными заболеваниями соединительной ткани, вирусной инфекцией (вирусы группы Коксаки и др.), нередко развивается сопутствующий перикардит с появлением характерного болевого синдрома, иногда – шума трения перикарда, подъема сегмента ST на ЭКГ.
Дифференциальный диагноз при миокардите следует проводить с ишемической болезнью сердца (особенно у лиц пожилого возраста), миокардиодистрофией, кардиомиопатиями, перикардитом.
Лечение. Режим, как правило, постельный. Проводится терапия нестероидными противовоспалительными препаратами в следующих суточных дозах: вольтарен (ортофен) – 0,025 г 3–4 раза в сутки, ибупрофен (бруфен) – 0,2–0,4 г 3 раза в сутки, индометацин – 0,025 г 3–4 раза в сутки. Глюкокортикоиды (иреднизолон 15–60 мг в сутки) применяют при тяжелом течении миокардита, неэффективности терапии нестероидными противовоспалительными средствами, в случае развития перикардита. При сердечной недостаточности используют вазодилататоры (ингибиторы АПФ), мочегонные средства – фуросемид (лазикс) по 0,04 г/сут и др. При необходимости применяют дигоксин (по 0,25-0,5 мг/сут) с учетом повышенной чувствительности больных миокардитом к гликозидам. При развитии аритмий показана антиаритмическая терапия (новокаинамид и др.), в случае тромбоэмболических осложнений – тромболитики, гепарин, антиагреганты.
Прогноз при пара– и метаинфекционных, лекарственных, паразитарных миокардитах в большинстве случаев благоприятный. Хуже прогноз при миокардитах, связанных с системными заболеваниями соединительной ткани, и особенно при идиопатическом миокардите.
НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ. Сердечная недоста точность и сосудистая недостаточность являются самостоятельными формами недостаточности кровообращения, которые нередко осложняют одна другую. Для проведения целенаправленной терапии необходимо выявление ведущей формы.
НЕЙРОЦИРКУЛЯТОРНАЯ ДИСТОНИЯ – см. Вегетативная дистония в главе «Нервные болезни».
ПЕРИКАРДИТ – острое или хроническое воспаление околосердечной сумки. Различают фибринозный, серозно-фибринозный, геморрагический, ксантоматозный, гнойный, гнилостный перикардиты.
Этиология: инфекция (вирусы, бактерии, риккетсии, грибы, простейшие), инфаркт миокарда, системные заболевания соединительной ткани (ревматизм, ревматоидный артрит, системная красная волчанка), уремия, травма, в том числе операционная, ионизирующее излучение, метастазирующие опухоли (рак легкого, молочной железы и др.) и гемобластозы, паразитарные инвазии; для некоторых перикардитов причины их возникновения не установлены (идиопатические).
Патогенез – часто аллергический или аутоиммунный, при инфекционном перикардите инфекция может быть пусковым механизмом; не исключается и прямое повреждение оболочек сердца бактериальным или другими агентами.
Симптомы, течение определяются основным заболеванием и характером выпота, его количеством и темпом накопления. Начальные симптомы: недомогание, повышение температуры тела, загрудинные или прекордиальные боли. Для боли при перикардите характерно постепенное нарастание, но на высоте процесса (при появлении экссудата) боль может уменьшиться или исчезнуть; она связана с дыханием и зависит от положения тела (обычно уменьшается в положении сидя с наклоном вперед). Боль чаще носит режущий или колющий характер, локализуется за грудиной, может иррадиировать в шею, спину, плечи, эпигастральную область, длится, как правило, несколько дней. Характерна связь болевого синдрома с дыханием и положением тела. Часто выслушивается шум трения перикарда различной интенсивности и распространенности. Накопление экссудата сопровождается исчезновением прекордиальных болей и шума трения перикарда, появлением одышки, цианоза, набуханием шейных вен, ослаблением сердечного толчка, расширением сердечной тупости, однако при умеренном количестве выпота сердечная недостаточность обычно выражена умеренно. Вследствие снижения диастолического наполнения уменьшается ударный объем сердца, тоны сердца становятся глухими, пульс малым и частым, нередко парадоксальным (падение наполнения и напряжения пульса во время вдоха). При констриктивном (сдавливающем) перикардите в результате деформирующих сращений в области предсердий нередко возникает мерцательная аритмия или трепетание предсердий; в начале диастолы выслушивается громкий перикардтон. При быстром накоплении экссудата может развиться тампонада сердца с цианозом, набуханием вен шеи, тахикардией, ослаблением пульса, снижением АД, мучительными приступами одышки, иногда с потерей сознания, быстро нарастающим венозным застоем (асцит, гепатомегалия). При констриктивном перикардите с прогрессирующим Рубцовым сдавлением сердца нарастает нарушение кровообращения в печени и в системе воротной вены. Обнаруживаются высокое центральное венозное давление, портальная гипертензия, асцит (псевдоцирроз Пика), появляются периферические отеки; ортопноэ, как правило, отсутствует. Распространение воспалительного процесса на ткани средостения и плевру ведет к медиастиноперикардиту или плевриту, при переходе воспаления с эпикарда на миокард (поверхностные слои) развивается миоперикардит.
На ЭКГ в первые дни болезни отмечается конкордатный подъем сегмента ST в стандартных и грудных отведениях, в последующем сегмент ST смещается к изоэлектрической линии, зубец Т уплощается или подвергается инверсии; при значительном скоплении выпота уменьшается вольтаж комплекса QRS. При рентгенологическом исследовании обнаруживается увеличение поперечника сердца и трапециевидная конфигурация сердечной тени с ослаблением пульсации сердечного контура. При длительном течении перикардита наблюдается кальцификация перикарда (панцирное сердце). Надежным методом выявления перикардиального выпота служит эхокардиография. Дифференциальный диагноз проводят с начальным периодом острого инфаркта миокарда и острым миокардитом; выпот в перикард может быть обусловлен микседемой, тяжелой сердечной недостаточностью.
Лечение. При инфекционных и пиогенных перикардитах (стафилококковых, пневмококковых и др.) применяют антибиотики в соответствии с установленным или предполагаемым возбудителем (пенициллины, аминогликозиды, цефалоспорины и др.). При паразитарных перикардитах назначают противопаразитарные средства. При аллергической или инфекционно-аллергической природе перикардита применяют нестероидные противовоспалительные средства в следующих дозах: ацетилсалициловая кислота по 1 г 3–4 раза в сутки, диклофенакнатрий (вольтарен, ортофен) по 0,025 г 3–4 раза в сутки, ибупрофен (бруфен) по 0,4 г 3 раза в сутки, индометацин (метиндол) по 0,025 г 3–4 раза в сутки. Глюкокортикоиды (преднизолон по 20–60 мг/сут) применяют в случае развития перикардита на фоне системного заболевания соединительной ткани, активного ревматизма, при инфаркте миокарда, при стойком туберкулезном экссудативном перикардите, а также при тяжело протекающем идиопатическом перикардите. При гнойных перикардитах, злокачественных опухолях глюкокортикоиды не показаны. При застойных явлениях применяют мочегонные средства – фуросемид (лазикс) внутрь или в/м 40 мг и более, гипотиазид по 50-100 мг внутрь и др. В случае угрозы тампонады сердца производят лечебную пункцию перикарда. Пункция перикарда может осложниться повреждением миокарда или коронарных артерий с развитием гемоперикарда и фатальными нарушениями ритма, поэтому при наличии абсолютных показаний эту процедуру может выполнять только квалифицированный специалист в условиях стационара. Хирургическое лечение (перикардэктомия) применяется при констриктивном перикардите в случае значительного нарушения кровообращения и при гнойном перикардите.
Прогноз наиболее неблагоприятен при опухолевых и гнойных перикардитах.
ПОРОКИ СЕРДЦА ВРОЖДЕННЫЕ внутриутробные аномалии развития сердца (в том числе его клапанов, перегородок) и крупных сосудов. Частота их неодинакова в разных регионах, в среднем они наблюдаются приблизительно у 7 из 100 живых новорожденных. В небольшой части случаев врожденные пороки имеют генетическую природу, основными же причинами их развития считают экзогенные воздействия на органогенез преимущественно в I триместре беременности (вирусные, например краснуха, и другие заболевания матери, алкоголизм, применение некоторых лекарственных средств, воздействие ионизирующего излучения и др.). Все врожденные пороки могут осложняться инфекционным эндокардитом с появлением дополнительных клапанных поражений.
Классификация. Предложено несколько классификаций врожденных пороков сердца, общим для которых является принцип подразделения пороков по их влиянию на гемодинамику. Наиболее обобщающая систематизация пороков характеризуется объединением их, в основном по влиянию на легочный кровоток, в следующие 4 группы.
I. Пороки с неизмененным (или мало измененным) легочным кровотоком: аномалии расположения сердца, аномалии дуги аорты, ее коарктация взрослого типа, стеноз аорты, атрезия аортального клапана; недостаточность клапана легочного ствола; митральные стеноз, атрезия и недостаточность митрального клапана; трехпредсердное сердце, пороки венечных артерий и проводящей системы сердца.
II. Пороки с гиперволемией малого круга кровообращения: 1) не сопровождающиеся ранним цианозом – открытый артериальный проток, дефекты межпредсердной и межжелудочковой перегородок, синдром Лютамбаше, аортолегочный свищ, коарктация аорты детского типа; 2) сопровождающиеся цианозом – трикуспидальная атрезия с большим дефектом межжелудочковой перегородки, открытый артериальный проток с выраженной легочной гипертензией и током крови из легочного ствола в аорту.
III. Пороки с гиповолемией малого круга кровообращения: 1) не сопровождающиеся цианозом – изолированный стеноз легочного ствола; 2) сопровождающиеся цианозом – триада, тетрада и пентада Фалло, трикуспидальная атрезия с сужением легочного ствола или малым дефектом межжелудочковой перегородки, аномалия Эбштейна (смещение створок трикуспидального клапана в правый желудочек), гипоплазия правого желудочка.
IV. Комбинированные пороки с нарушением взаимоотношений между различными отделами сердца и крупными сосудами: транспозиция аорты и легочного ствола (полная и корригированная), их отхождение от одного из желудочков, синдром Тауссиг – Бинга, общий артериальный ствол, трехкамерное сердце с единым желудочком и др.
Приведенное подразделение пороков имеет практическое значение для их клинической и особенно рентгенологической диагностики, так как отсутствие или наличие изменений гемодинамики в малом круге кровообращения и их характер позволяют отнести порок к одной из групп I–III или предположить пороки IV группы, для диагностики которых необходима, как правило, ангиокардиография. Некоторые врожденные пороки сердца (особенно IV группы) встречаются весьма редко и только у детей. У взрослых из пороков I–II групп чаще выявляются аномалии расположения сердца (прежде всего декстрокардия), аномалии дуги аорты, ее коарктация, аортальный стеноз, открытый артериальный проток, дефекты межпредсердной и межжелудочковой перегородок; из пороков III группы – изолированный стеноз легочного ствола, триада и тетрада Фалло.
Клинические проявления и течение определяются видом порока, характером гемодинамических нарушений и сроками наступления декомпенсации кровообращения. Пороки, сопровождающиеся ранним цианозом (так называемые «синие» пороки), проявляются сразу или вскоре после рождения ребенка. Многие пороки, особенно I и II группы, долгие годы имеют бессимптомное течение, выявляются случайно при профилактическом медицинском обследовании ребенка или при появлении первых клинических признаков нарушений гемодинамики уже в зрелом возрасте больного. Пороки III и IV группы могут относительно рано осложняться сердечной недостаточностью, приводящей к летальному исходу.
Диагноз устанавливают путем комплексного исследования сердца. Аускультация сердца имеет значение для диагноза вида порока в основном только при клапанных пороках, аналогичных приобретенным, т. е. при недостаточности клапанов или стенозах клапанных отверстий (см. Пороки сердца приобретенные), в меньшей степени – при открытом артериальном протоке и дефекте межжелудочковой перегородки. Первичное диагностическое обследование при подозрении на врожденный порок сердца обязательно включает электрокардиографию, эхокардиографию и рентгенологическое исследование сердца и легких, которые в большинстве случаев позволяют выявить совокупность прямых (при эхокардиографии) и косвенных признаков определенного порока. В случае выявления изолированного клапанного поражения проводится дифференциальный диагноз с приобретенным пороком. Более полное диагностическое обследование больного, включающее при необходимости ангиокардиографию и зондирование камер сердца, проводится в кардиохирургическом стационаре.
Лечение хирургическое. В случае, когда операция невозможна, больному назначают режим ограниченной физической активности, отдаляющий сроки декомпенсации порока, а при наступлении сердечной недостаточности проводят преимущественно симптоматическое ее лечение. Некоторые врожденные пороки сердца (главным образом I группы) специального лечения не требуют.
Ниже изложены отдельные врожденные пороки сердца, встречающиеся у взрослых наиболее часто.
Декстрокардия – дистопия сердца в грудной полости с расположением большей его части справа от средней линии тела. Такую аномалию расположения сердца без инверсии его полостей называют декстроверсией. Последняя обычно сочетается с другими врожденными пороками сердца. Наиболее часто встречается декстрокардия с инверсией предсердий и желудочков (ее называют истинной, или зеркальной), которая может быть одним из проявлений полного обратного расположения внутренних органов. Зеркальная декстрокардия не сочетается, как правило, с другими врожденными пороками сердца, гемодинамические нарушения при ней отсутствуют.
Диагноз предполагают при обнаружении праворасположенного верхушечного толчка сердца и соответствующих изменений перкуторных границ относительной сердечной тупости. Подтверждают диагноз электрокардиографическое и рентгенологическое исследования. На ЭКГ при истинной декстрокардии зубцы Р, R и Т в отведениях aVL и I направлены вниз, а в отведении aVR – вверх, т. е. отмечается картина, наблюдаемая у здорового человека при взаимной замене расположения электродов на левой и правой руке; в грудных отведениях амплитуда зубцов R по направлению к левым отведениям не возрастает, а убывает. ЭКГ принимает привычный вид, если электроды на конечностях поменять местами, а грудные установить в сим-метричные левым правые позиции. Рентгенологически определяется зеркальное изображение сердечно-сосудистого пучка; при этом правый контур тени сердца образован левым желудочком, а левый – правым предсердием. При полном обратном расположении органов печень пальпаторно, перкуторно и рентгенологически обнаруживается слева; следует помнить и сообщать больным, что при этой аномалии аппендикс расположен слева.
Лечение при декстрокардии, не сочетающейся с другими пороками сердца, не проводится.
Дефект межжелудочковой перегородки один из самых частых врожденных пороков сердца, в том числе у взрослых. Дефект локализуется в мембранной или мышечной части перегородки, иногда перегородка полностью отсутствует. Если дефект располагается выше наджелудочного гребня у корня аорты или непосредственно в нем, то обычно этому пороку сопутствует недостаточность аортального клапана.
Гемодинамические нарушения, связанные с дефектом перегородки, определяются его размерами и соотношением давления в большом и малом кругах кровообращения. Малые дефекты (0,5–1,5 см) характеризуются сбросом через дефект слева направо небольших объемов крови, что практически не нарушает гемодинамику. Чем больше дефект и объем сбрасываемой через него крови, тем раньше возникают гиперволемия и гипертензия в малом круге, склероз легочных сосудов, перегрузка левого и правого желудочков сердца с исходом в сердечную недостаточность. Наиболее тяжело порок протекает при высокой легочной гипертензии (комплекс Эйзенменгера) со сбросом крови через дефект справа налево, что сопровождается выраженной артериальной гипоксемией.
Симптомы порока при большом дефекте появляются на первом году жизни: дети отстают в развитии, малоподвижны, бледны; по мере нарастания легочной гипертензии появляется одышка, цианоз при нагрузке, формируется сердечный горб. В III–IV межреберьях по левому краю грудины определяются интенсивный систолический шум и соответствующее ему систолическое дрожание. Обнаруживается усиление и акцент II тона сердца над легочным стволом. Половина больных с большими дефектами перегородки не доживают до 1 года из-за развития тяжелой сердечной недостаточности или присоединения инфекционного эндокардита.
При малом дефекте мышечной части перегородки (болезнь Толочинова – Роже) порок многие годы может быть бессимптомным (дети нормально развиваются умственно и физически) или проявляться преимущественно частыми пневмониями. В первые 10 лет жизни возможно спонтанное закрытие небольшого дефекта; если дефект остается, в последующие годы постепенно нарастает легочная гипертензия, приводящая к сердечной недостаточности. Интенсивность систолического шума зависит от объемной скорости сброса крови через дефект. По мере нарастания легочной гипертензии шум ослабевает (может исчезнуть совсем), в то время как усиление и акцент II тона над легочным стволом нарастают; у некоторых больных появляется диастолический шум Грэхема Стилла вследствие относительной недостаточности клапана легочного ствола. Диастолический шум может быть обусловлен также сопутствующей дефекту недостаточностью аортального клапана, о наличии которой следует думать при значительном снижении диастолического и повышении пульсового АД, раннем появлении признаков выраженной гипертрофии левого желудочка.
Диагноз дефекта межжелудочковой перегородки устанавливают по данным цветной допплерэхокардиографии, левой вентрикулографии и зондирования сердца. Изменения ЭКГ и данные рентгенологического исследования сердца и легких различаются при разных размерах дефекта и разной степени легочной гипертензии; правильно предположить диагноз они помогают лишь при явных признаках гипертрофии обоих желудочков и выраженной гипертензии малого круга кровообращения.
Лечение при малых дефектах без легочной гипертензии часто не требуется. Хирургическое лечение показано больным, у которых сброс крови через дефект составляет более объема легочного кровотока.
Операцию предпочтительно выполнять в возрасте 4-12 лет, если она не производится ранее по неотложным показаниям. Небольшие дефекты ушивают, при крупных дефектах (более 2/3 площади межжелудочковой перегородки) производят их пластическое закрытие заплатами из аутоперикарда или полимерных материалов. Выздоровления добиваются у 95 % оперированных больных. При сопутствующей недостаточности аортального клапана производят его протезирование.
Дефект межпредсердной перегородки среди взрослых чаще наблюдается у женщин. Низкие дефекты первичной перегородки, в отличие от высоких дефектов вторичной перегородки, располагаются вблизи атриовентрикулярных клапанов и сочетаются, как правило, с аномалиями их развития, в том числе иногда с врожденным митральным стенозом (синдром Лютамбаше).
Гемодинамические нарушения характеризуются сбросом крови через дефект из левого в правое предсердие, что приводит к перегрузке объемом (тем большей, чем больше дефект) правого желудочка и малого круга кровообращения. Однако из-за приспособительного снижения сопротивления легочных сосудов давление в них изменяется мало вплоть до стадии, когда развивается их склероз. В этой стадии легочная гипертензия может нарастать довольно быстро и приводить к реверсии шунта через дефект – сбросу крови справа налево.
Симптомы порока при небольшом дефекте могут отсутствовать в течение десятилетий. Более типичны ограничение с юности переносимости высокой физической нагрузки вследствие появления при ней одышки, ощущения тяжести или нарушений ритма сердца, а также повышенная склонность к респираторным инфекциям. По мере нарастания легочной гипертензии основной становится жалоба на одышку при все меньшей нагрузке, а при реверсии шунта появляется цианоз (вначале периодический – при нагрузке, затем стойкий) и постепенно нарастают проявления правожелудочковой сердечной недостаточности. У больных с большим дефектом может быть сердечный горб. Аускультативно определяются расщепление и акцент II тона над легочным стволом, у части больных – систолический шум во II–III межреберьях слева от грудины, который усиливается при задержке дыхания на выдохе. Возможна мерцательная аритмия, не характерная для других врожденных пороков сердца.
Диагноз предполагают при обнаружении наряду с описанными симптомами признаков выраженной гипертрофии правого желудочка (в том числе по данным эхо– и электрокардиографии), рентгенологически определяемых признаков гиперволемии малого круга кровообращения (усиление артериального легочного рисунка) и характерной пульсации корней легких. Существенное диагностическое значение может иметь цветная допплерэхокардиография. Дифференциальный диагноз проводят чаще всего с первичной легочной гипертензией (при ней легочный рисунок обеднен) и с митральным стенозом. В отличие от последнего, при дефекте межпредсердной перегородки существенной дилатации левого предсердия не отмечается; кроме того, митральный стеноз надежно исключается эхокардиографией. Окончательно подтверждают диагноз катетеризацией предсердий, а также ангиокардиографией с введением контраста в левое предсердие.
Лечение – ушивание или пластика дефекта. Продолжительность жизни неоперированных больных в среднем около 40 лет.
Коарктация аорты – сужение перешейка аорты на границе ее дуги и нисходящего отдела, обычно ниже (в 90 % случаев) отхождения левой подключичной артерии. Встречается преимущественно у мужчин. Выделяют два основных типа порока: взрослый (изолированная коарктация аорты) и детский – с открытым артериальным протоком. При детском типе различают предуктальную (выше отхождения протока) и постдуктальную (ниже отхождения протока) коарктацию.
Гемодинамические нарушения при взрослом типе порока характеризуются усиленной работой левого желудочка сердца на преодоление сопротивления в аорте, повышением АД проксимальнее коарктации и его снижением в дистальных от нее артериях, в том числе почечных, что включает ренальные механизмы развития артериальной гипертензии, которая увеличивает нагрузку на левый желудочек. При детском типе с постдуктальной коарктацией эти изменения дополняются значительной гиперволемией малого круга кровообращения (из-за увеличения под влиянием высокого АД сброса крови через проток слева направо) и увеличением нагрузки на правый желудочек сердца. В случае предуктального варианта коарктации сброс крови через проток направляется справа налево.
Симптомы порока становятся отчетливее с возрастом. Больные жалуются на зябкость стоп, утомляемость ног при ходьбе, беге, нередко на головные боли, частое головокружение, чувство пульсации в голове, сердцебиение в форме сильных ударов, иногда носовые кровотечения. У лиц старше 12 лет часто заметно преобладание физического развития плечевого пояса при тонких ногах, узком тазе («атлетическое телосложение»), Пальпаторно обнаруживается усиленный верхушечный толчок сердца, иногда также пульсации межреберных артерий (через них осуществляется коллатеральное кровоснабжение тканей), изредка – систолическое дрожание во II–III межреберьях. Во многих случаях у основания сердца выслушивается систолический шум, характерными чертами которого являются отдаленность от I тона сердца и проведение на брахиоцефальные артерии и в межлопаточное пространство. Основной симптом порока – более низкое АД на ногах, чем на руках (в норме соотношение обратное). Если АД и артериальный пульс снижены также на левой руке (по сравнению с их величиной на правой), можно предполагать коарктацию проксимальнее отхождения левой подключичной артерии. Изменения ЭКГ соответствуют гипертрофии левого желудочка, но при детском типе порока электрическая ось сердца обычно отклонена вправо.
Диагноз предполагают по специфическому различию АД на руках и ногах и подтверждают рентгенологическими исследованиями. На рентгенограмме более чем в половине случаев выявляется узурация нижних краев ребер расширенными межреберными артериями и иногда хорошо видно само сужение перешейка аорты. В кардиохирургическом стационаре диагноз подтверждают аортографией и исследованием разницы АД в восходящем и нисходящем отделах аорты путем ее катетеризации.
Лечение состоит в иссечении суженного участка аорты с заменой его протезом или созданием анастомоза конец в конец либо в операции создания шунта. Оптимальный возраст для операции при благоприятном течении порока – 8-14 лет.
Открытый артериальный (боталлов) проток порок, обусловленный незаращенпем после рождения ребенка сосуда, соединяющего у плода аорту с легочным стволом. Изредка он сочетается с другими врожденными пороками, особенно часто – с дефектом межжелудочковой перегородки.
Гемодинамические нарушения характеризуются сбросом крови из аорты в легочный ствол, что приводит к гиперволемии малого круга кровообращения и повышает нагрузку на оба желудочка сердца.
Симптомы при небольшом сечении протока могут долгое время отсутствовать; дети развиваются нормально. Чем больше сечение протока, тем раньше проявляются отставание ребенка в развитии, утомляемость, склонность к респираторным инфекциям, одышка при нагрузке. У детей с большим объемом сброса крови через проток рано развиваются легочная гипертензия и сердечная недостаточность, рефрактерная к лечению. В типичных случаях заметно повышается пульсовое АД за счет как роста систолического, так и особенно снижения диастолического АД. Основной симптом – непрерывный систолодиастолический шум («шум поезда в тоннеле», «машинный шум») во втором межреберье слева от грудины, который на глубоком вдохе ослабевает, а при задержке дыхания на выдохе усиливается. В отдельных случаях выслушивается только систолический или только диастолический шум, причем шумы ослабевают по мере нарастания легочной гипертензии, иногда не выслушиваются. В редких для этого порока случаях значительной легочной гипертензии с изменением направления сброса по протоку появляется диффузный цианоз с преобладающей выраженностью на пальцах стоп.
Диагноз абсолютно подтверждается аортографией (виден сброс контраста через проток) и катетеризацией сердца и легочного ствола (отмечается повышение давления и насыщения крови кислородом в легочном стволе), однако он достаточно достоверно устанавливается и без этих исследований с помощью допплерэхокардиографии (регистрация шунтового потока) и рентгенологического исследования. Последнее выявляет усиление легочного рисунка за счет артериального русла, выбухание дуги (расширение) легочного ствола и аорты, их усиленную пульсацию, увеличение левого желудочка.
Лечение состоит в перевязке открытого артериального протока.
Стеноз аорты в зависимости от его локализации подразделяют на надклапанный, клапанный (наиболее частый) и подклапанный (в выходном тракте левого желудочка).
Гемодинамические нарушения формируются препятствием току крови из левого желудочка в аорту, создающим градиент давления между ними. От степени стеноза зависит уровень перегрузки левого желудочка, приводящей к его гипертрофии, а в поздних стадиях порока – к декомпенсации. Надклапанный стеноз (напоминающий коарктацию) обычно сопровождается изменениями интимы аорты, которые могут распространяться на брахиоцефальные артерии и устья коронарных артерий, нарушая в них кровоток.
Симптомы клапанного стеноза и принципы его диагностики и лечения такие же, как при приобретенном аортальном стенозе (см. Пороки сердца приобретенные). При редком подклапанном стенозе описаны характерные изменения внешности больных (низко расположенные уши, выпяченные губы, косоглазие) и признаки умственной отсталости.
Стеноз легочного ствола бывает чаще изолированным, тоже сочетается с другими аномалиями, в частности с дефектами перегородок. Сочетание стеноза легочного ствола с межпредсердным сообщением называют триадой Фалло (третий компонент триады – гипертрофия правого желудочка).
В большинстве случаев изолированный стеноз легочного ствола бывает клапанным, весьма редко встречаются инфундибулярный (подклапанный) изолированный стеноз и стеноз, обусловленный гипоплазией клапанного кольца.
Гемодинамические нарушения определяются высоким сопротивлением кровотоку в зоне стеноза, что приводит к перегрузке, гипертрофии, а затем дистрофии и декомпенсации правого желудочка сердца. По мере нарастания давления в правом предсердии возможно открытие овального окна с формированием межпредсердного сообщения, но чаще последнее бывает обусловлено сопутствующим дефектом перегородки либо врожденным овальным окном.
Симптомы умеренного изолированного стеноза появляются через несколько лет, в течение которых дети развиваются нормально. Относительно ранними являются одышка при физической нагрузке, утомляемость, иногда головокружения, склонность к обморокам. В последующем появляются боли за грудиной, сердцебиение, одышка нарастает. При резко выраженном стенозе у детей рано развивается правожелудочковая сердечная недостаточность с появлением периферического цианоза. Наличие диффузного цианоза свидетельствует о межпредсердном сообщении. Объективно выявляются признаки гипертрофии правого желудочка (сердечный толчок, нередко сердечный горб, пальпируемая пульсация желудочка в подложечной области); грубый систолический шум и систолическое дрожание во втором межреберье слева от грудины, расщепление II тона с ослаблением его над легочным стволом. На ЭКГ определяются признаки гипертрофии и перегрузки правого желудочка и предсердия. Рентгенологически выявляется их увеличение, а также обеднение легочного рисунка, иногда также постстенотическое расширение легочного ствола.
Диагноз уточняют в кардиохирургическом стационаре катетеризацией сердца с измерением градиента давления между правым желудочком и легочным стволом и правой вентрикулографией.
Лечение – вальвулопластика, которую при триаде Фалло сочетают с закрытием межпредсердного сообщения. Вальвулотомия менее эффективна.
Тетрада Фалло – сложный врожденный порок сердца, характеризующийся сочетанием стеноза легочного ствола с большим дефектом межжелудочковой перегородки и декстропозицией аорты, а также выраженной гипертрофией правого желудочка. Иногда порок сочетается с дефектом межпредсердной перегородки (пентада Фалло) или с открытым артериальным протоком.
Гемодинамические нарушения определяются стенозом легочного ствола (см. выше) и дефектом межжелудочковой перегородки. Характерны гиповолемия малого круга кровообращения и сброс венозной крови через дефект перегородки в аорту, что является причиной диффузного цианоза. Реже (при небольшом стенозе ствола) кровь сбрасывается через дефект слева направо (так называемая бледная форма тетрады Фалло).
Симптомы порока формируются в раннем детском возрасте. У детей с тяжелой формой тетрады Фалло диффузный цианоз появляется в первые месяцы после рождения: вначале при плаче, крике, но вскоре становится стойким. Чаще цианоз появляется в сроки, когда ребенок начинает ходить, иногда только в возрасте 6-10 лет (позднее появление). Для тяжелого течения характерны приступы резкого усиления одышки и цианоза, при которых возможны кома и смерть от расстройств мозгового кровообращения. В то же время тетрада Фалло – один из немногих «синих» пороков, встречающихся у взрослых (преимущественно молодого возраста). Больные жалуются на одышку, боли за грудиной (испытывают облегчение в положении на корточках), склонность к обморокам. Выявляются диффузный цианоз, ногти в форме часовых стекол, симптом барабанных пальцев, отставание в физическом развитии. Во II межреберье слева от грудины выслушивается обычно грубый систолический шум, там же иногда определяется систолическое дрожание; II тон над легочным стволом ослаблен. На ЭКГ отмечается значительное отклонение электрической оси сердца вправо. При рентгенологическом исследовании определяются обедненный легочный рисунок (при хорошо развитых коллатералях он может быть нормальным), уменьшение или отсутствие дуги легочного ствола и характерные изменения контуров сердечной тени: в прямой проекции она имеет форму деревянного башмачка, во втором косом положении маленький левый желудочек располагается в виде шапочки на увеличенных правых отделах сердца.
Диагноз предполагают по характерным жалобам и внешнему виду больных при указании в анамнезе на появление цианоза в раннем детстве. Окончательная диагностика порока основывается на данных ангиокардиографии и катетеризации сердца.
Лечение может быть паллиативным – наложение аортолегочных анастомозов. Радикальная коррекция порока состоит в устранении стеноза и закрытии дефекта межжелудочковой перегородки.
ПОРОКИ СЕРДЦА ПРИОБРЕТЕННЫЕ поражения сердечного клапана (клапанов), створки которого оказываются неспособными к полному раскрытию (стеноз) клапанного отверстия или к смыканию (недостаточность клапана) или к тому и другому (комбинированный порок).
Этиология и патогенез. Этиология стеноза и комбинированного порока ревматическая, недостаточности клапанов – обычно ревматическая, редко септическая, атеросклеротическая, травматическая, сифилитическая. Стеноз образуется вследствие рубцового сращения или рубцовой ригидности створок клапана, подклапанных структур; недостаточность клапана – вследствие их разрушения, повреждения или рубцовой деформации. Пораженные клапаны образуют препятствие прохождению крови – анатомическое при стенозе, динамическое при недостаточности. Последнее заключается в том, что часть крови хотя и проходит через отверстие, но в следующую фазу сердечного цикла возвращается обратно. К эффективному объему добавляется «паразитический», совершающий маятникообразное движение по обе стороны пораженного клапана. Значительная клапанная недостаточность осложняется относительным стенозом (за счет увеличения объема крови). Препятствие прохождению крови ведет к перегрузке, гипертрофии и расширению вышележащих камер сердца. Расширение более значительно при недостаточности клапана, когда вышележащая камера растягивается дополнительным количеством крови. При стенозе атриовентрикулярного отверстия снижено наполнение нижележащей камеры (левого желудочка при митральном стенозе, правого при трикуспидальном); гипертрофии и расширения желудочка нет. При недостаточности клапана наполнение соответствующего желудочка увеличено, желудочек расширен и гипертрофирован. Затруднение работы сердца вследствие неправильного функционирования клапана и дистрофия гипертрофированного миокарда приводит к развитию сердечной недостаточности.
Диагноз должен содержать указание на этиологию (доказанную или вероятную) порока, его форму, наличие сердечной недостаточности (если она имеется, то и на ее степень). Следует учитывать, что анамнестические указания на этиологию порока – ревматизм, сепсис, сифилис, травму не всегда достаточно четки, а указания на частые ангины малоспецифичны.
Собственно порок проявляется почти исключительно акустическими признаками. Эхокардиографическое исследование позволяет обнаружить стеноз и оценить его степень; в режиме секторального сканирования степень митрального стеноза (площадь левого атриовентрикулярного отверстия) определяется с большой точностью. О недостаточности клапанов судят по косвенным признакам – дилатации и объемной перегрузке камер. При допплеркардиографическом исследовании обнаруживается обратный ток крови (недостаточность клапана).
Лечение собственно порока может быть только хирургическим. Для уточнения показаний к такому лечению необходима своевременная консультация специалиста-кардиохирурга. Консервативная терапия сводится к предупреждению и лечению рецидива основного процесса и осложнений, к лечению и предупреждению сердечной недостаточности, а также нарушений сердечного ритма. Большое значение имеют своевременная и адекватная профессиональная ориентация и трудоустройство больного.
Митральный порок – поражение митрального клапана, сопровождающееся затруднением прохождения крови из малого круга в большой на уровне левого атриовентрикулярного отверстия. Сердечная недостаточность проявляется преимущественно в форме застойной левожелудочковой, затем – и правожелудочковой недостаточности.
Симптомы, течение. При повышении давления в малом круге появляются жалобы на одышку (более выраженную при стенозе), сердцебиение, кашель, при нарастании правожелудочковой недостаточности – на задержку жидкости и боль в правом подреберье. При осмотре и пальпации могут обнаружиться признаки застойной правожелудочковой недостаточности, в выраженных случаях заметен характерный цианотичный румянец щек и губ. Нередко бывает экстрасистолия. Мерцательная аритмия при недостаточности встречается не реже, чем при стенозе (при одинаковой тяжести порока). Гипертрофия правого желудочка проявляется усиленным эпигастральным сердечным толчком. При значительном расширении полости правого желудочка появляется систолический шум относительной трикуспидальной недостаточности. Он может быть громким и распространяться к верхушке сердца, что нередко ведет к гипердиагностике митральной недостаточности. Несмотря на расширение легочной артерии, вследствие перегрузки малого круга может возникнуть систолический шум относительного пульмонального стеноза. Этот шум часто интерпретируется в качестве митрального шума (из-за совпадения зон выслушивания этих шумов). При высокой легочной гипертензии у левого края грудины может выявиться усиливающийся на вдохе диастолический шум относительной пульмональной недостаточности (шум Грэхема Стилла). Рентгенологически обнаруживаются увеличение левого предсердия и застойные изменения в легких. Увеличение правых камер сердца ведет к расширению сердечной тени не столько вправо, сколько влево. Однако у больных с митральной недостаточностью расширение сердечной тени влево может быть обусловлено и увеличением левого желудочка. Присоединение вторичной легочной гипертензии ведет к значительному расширению тени главных ветвей легочной артерии. Электрокардиографически обычно распознается гипертрофия левого предсердия. «Определенные» ЭКГ-признаки гипертрофии правого желудочка появляются поздно и непостоянно; «возможные» указания на гипертрофию правого желудочка ненадежны. Наиболее информативное исследование – эхокардиография – позволяет выявить увеличение левого предсердия, сращение, кальциноз и утолщение створок клапана при митральном стенозе; при допплер-эхокардиографии можно оценить степень митральной регургитации при недостаточности митрального клапана.
Диагноз. Необходимо наличие акустических признаков стеноза клапанного отверстия или клапанной недостаточности. Для гемодинамически существенного митрального порока обязательно увеличение тени левого предсердия. Митральный стеноз и недостаточность митрального клапана диагностируются не только на основании специфических для каждого из этих пороков акустических признаков, но и с помощью рентгенографии и эхокардиографии.
Дифференциальный диагноз: исключить другие приобретенные и врожденные пороки, в частности дефект межпредсердной перегородки (трехчленный ритм, сходные нарушения гемодинамики), миокардит, миокардиопатию, сдавливающий перикардит, ишемическую болезнь сердца, легочносердечную недостаточность при хронических обструктивных заболеваниях легких, первичную легочную гипертензию, тиреотоксикоз, а также пролапс митральной створки. Своеобразной формой порока является синдром пролабирования митрального клапана.
Прогноз и трудоспособность определяется степенью сердечной недостаточности.
Митральный стеноз. Специфические акустические признаки: 1) диастолический шум у верхушки, представленный двумя компонентами: низкочастотным, «рокочущим» протодиастолическим («мезодиастолическим») и нарастающим к I тону пресистолическим или одним из них; 2) высокочастотный «щелкающий» протодиастолический экстратон – митральный щелчок. Характерен усиленный («хлопающий») I тон, образующий вместе с II тоном и митральным щелчком трехчленный «ритм перепела». Один из двух диастолических шумов нередко принимается за систолический, что приводит к гипердиагностике митральной недостаточности.
При незначительном сужении левого атриовентрикулярного отверстия (площадь отверстия более 1,5 см2) одышка появляется только при значительных нагрузках (I функциональный класс хронической сердечной недостаточности по классификации Нью-Йоркской кардиологической ассоциации). Приступов удушья и ортопноэ нет. Сердце не расширено. Диастолический (преимущественно пресистолический) шум может быть слабым. При умеренном стенозе (площадь атриовентрикулярного отверстия от 1 до 1,5 см2) одышка появляется при менее значительных нагрузках (II функциональный класс сердечной недостаточности), приступы удушья нехарактерны. Диастолический шум (оба компонента, при мерцательной аритмии – только протодиастолический) интенсивный. У верхушки часто выражено диастолическое дрожание. Расширение сердца влево может быть значительным, признаков вторичной легочной гипертензии обычно нет. Прогрессирующая сердечная недостаточность может развиться и при умеренном стенозе, но не так быстро и неотвратимо, как при резком. Для резкого стеноза (площадь атриовентрикулярного отверстия 1 см2 и менее) характерна одышка при незначительных и минимальных нагрузках (III, IV функциональные классы сердечной недостаточности), приступы удушья, ортопноэ. Нередко обнаруживается значительное расширение сердца влево, а также признаки высокой вторичной легочной гипертензии. Диастолический шум представлен преимущественно или исключительно протодиастолическим компонентом. При наиболее резком стенозе диастолического дрожания нет, диастолический шум слабый или отсутствует. В этих случаях акустическим проявлением стеноза оказывается «ритм перепела» с систолическим шумом относительной трикуспидальной недостаточности. Но при грубых деформациях клапанных створок (вследствие фиброза и кальциноза) хлопающий I тон перестает выслушиваться, так же как и «ритм перепела». Резкий митральный стеноз предопределяет развитие прогрессирующей сердечной недостаточности.
Показания к хирургическому лечению возникают у больных с резким стенозом или с умеренным стенозом в прогрессирующих стадиях. При развитии мерцательной аритмии применяют сердечные гликозиды, при сердечной недостаточности показаны диуретики (гипотиазид, фуросемид), спиронолактон. При необходимости для снижения частоты сердечных сокращений используют бета-адреноблокаторы, верапамил. Некоторые авторы не рекомендуют прием антагонистов кальция дигидропиридинового рдда.
Недостаточность митрального клапана. Ключом к диагнозу является умение распознать специфический митральный систолический шум – обязательный симптом этого порока. Шум ранний, наслаивается на I тон (или замещает его), высокочастотный, различного тембра. Выслушивается шум у верхушки сердца, характерно распространение влево, может распространяться на прекордиальную область. Митральный систолический шум следует отличать от аортального и трикуспидального (см. ниже), а также от шума относительного пульмонального стеноза. Последний отличается от митрального следующими признаками: 1) локализацией в зоне Боткина – Эрба (может проводиться к верхушке); 2) «дующим губным» тембром, приближающимся к звучанию согласной «ф-ф-ф»; 3) веретенообразной конфигурацией; 4) тем, что он не наслаивается на I тон.
При незначительной недостаточности жалоб нет. Систолический шум может быть коротким, локализоваться на ограниченном участке у верхушки. I тон часто сохранен. Выраженного усиления верхушечного толчка нет. Сердце существенно не увеличено. При умеренной недостаточности могут появиться жалобы на сердцебиение, повышенную утомляемость, умеренную одышку, задержку жидкости. Эпизодически отмечается пастозность голеней. Печень не увеличена. Почти обязательно пальпируется медленный, «прилипающий» истинный усиленный верхушечный толчок (отличать от характерного для стеноза «отрывистого» толчка – пальпаторного эквивалента хлопающего I тона). Сердце всегда значительно расширено влево. Шум занимает всю систолу. I тон обычно ослаблен. Часто обнаруживается III тон. При значительной недостаточности митрального клапана симптомы сердечной недостаточности могут быть выраженными вплоть до признаков отечно-дистрофической стадии, но могут оставаться и едва уловимыми. Тон I у верхушки, как правило, отсутствует, систолический шум интенсивный. Обычно обнаруживается интенсивный патологический III тон. Значительное увеличение левого желудочка рентгенологически распознается не столько по расширению сердца влево, сколько по расширению кзади. Для диагноза выраженной митральной недостаточности имеют значение только «определенные» ЭКГ-признаки гипертрофии левого желудочка с отрицательным асимметричным («по вторичному типу») зубцом Т в левых грудных отведениях. «Амплитудные» ЭКГ-указания на «возможную» гипертрофию левого желудочка ненадежны.
При комбинированном митральном пороке следует ориентироваться на такие признаки существенной недостаточности митрального клапана, как значительное расширение сердца влево и усиленный верхушечный толчок. Если у больного с сердечной недостаточностью (IIA стадии или более) этих признаков нет, то тяжесть состояния определяется наличием выраженного митрального стеноза.
Лечение: при выраженных клинических проявлениях возможно оперативное лечение (протезирование митрального клапана). При развитии сердечной недостаточности используют диуретики, ингибиторы АПФ, при мерцательной аритмии – сердечные гликозиды, для урежения частоты сердечных сокращений возможно применение бета-адреноблокаторов.
Аортальный порок. Симптомы, течение определяются формой порока (аортальный стеноз или недостаточность аортального клапана) и тяжестью гемодинамических расстройств.
Аортальный стеноз может быть ревматическим (атеросклеротическим) или врожденным. Недостаточность выброса крови в аорту может приводить к недостаточности мозгового и коронарного кровообращения (в первую очередь при нагрузке и переходе в вертикальное положение), что проявляется как субъективными, так и объективными признаками. Диагноз основывается на наличии специфического систолического шума. Его признаки: 1) наличие на основании сердца – во втором межреберье справа от грудины (слева от грудины в точке Боткина и даже у верхушки шум может быть столь же или более интенсивным); 2) проведение на сонные артерии, в яремную и подключичную ямки; 3) характерный «грубый» тембр; 4) веретенообразная конфигурация; 5) шум не наслаивается на I тон и никогда не достигает аортального компонента II тона; 6) шум резко ослабевает или исчезает после короткой диастолы (аритмия, тахикардия), усиливается после длинной. Характерны расщепление I тона и ослабление аортального компонента II тона.
Симптомы зависят от степени стеноза и гемодинамических расстройств. Стадия порока определяется наличием хотя бы одного из нижеперечисленных «достаточных» признаков более тяжелой стадии. Стадия I: только акустические признаки порока. Ранний максимум амплитуды веретенообразного шума. Стадия II: субъективных расстройств еще нет. Максимум шума смещается к середине систолы. ЭКГ-признаки – гипертрофия левого желудочка. Аортальная конфигурация сердца: постстенотическое расширение восходящей аорты, подчеркнутая талия. Стадия III: могут появиться субъективные расстройства – головокружение, потемнение в глазах, стенокардия при физических нагрузках. Пульс редкий, малый, с медленным подъемом. Систолическое дрожание на сонных артериях, на основании сердца. Низкое систолическое и пульсовое давление. Деформация каротидной сфигмограммы в форме «петушиного гребня» с медленным подъемом и зазубренностью анакроты. Стадия IV: выраженные расстройства мозгового или коронарного кровообращения при незначительных нагрузках. Митрализация порока с появлением хотя бы одного из следующих признаков застойной левожелудочковой недостаточности: выраженная одышка при умеренных физических нагрузках, эпизоды сердечной астмы, пресистолический ритм галопа с усиленным патологическим IV тоном (постоянно или эпизодически). У некоторых больных – мерцательная аритмия. На ЭКГ могут обнаруживаться признаки прогрессирования гипертрофии левого желудочка, очаговые изменения миокарда, блокада левой ножки пучка Гиса. Летальный исход обычно наступает в этой стадии, нередко – в предыдущей. Стадия V (терминальная) успевает развиться только у некоторых больных. Ее признаками являются кардиомегалия, правожелудочковая недостаточность, частые (неоднократные в течение недели) приступы сердечной астмы, тяжелая стенокардия.
Дифференциальный диагноз. Следует исключить врожденные пороки, в том числе подклапанный и надклапанный стеноз, а также коарктацию аорты, субаортальный мышечный стеноз (см. Кардиомиопатия), склеротическое поражение восходящей аорты, относительный пульмональный стеноз (физиологический или патологический).
Лечение. Медикаментозная терапия малоэффективна. В поздних стадиях для лечения стенокардии применяют бета-адреноблокаторы в малых дозах, при развитии сердечной недостаточности – мочегонные средства (гипотиазид, фуросемид, спиронолактон). Не рекомендуется использование вазодилататоров – нитратов, ингибиторов АПФ, антагонистов кальция дигидропиридинового ряда. Возможно хирургическое лечение (комиссуротомия, имплантация искусственного клапана).
Недостаточность аортального клапана. Этиология обычно ревматическая. Редкие причины этого порока – инфекционный эндокардит, атеросклероз аорты и др.
На первый план выступают нарушения гемодинамики в артериальном звене большого круга. Страдает его функция сглаживания пульсирующих колебаний давления, кровенаполнения и кровотока. Падение диастолического давления в аорте ведет к недостаточности коронарного кровообращения. Последняя способствует развитию более ранней и тяжелой несостоятельности перегруженного и гипертрофированного левого желудочка; к тоногенной дилатации присоединяется миогенная. Относительно рано развивается застойная левожелудочковая недостаточность, «митрализация» порока. При этом у части больных развивается относительная митральная недостаточность.
Симптомы, течение. Характерным признаком является специфический высокочастотный дующий диастолический шум в зоне Боткина – Эрба, II тон ослаблен или отсутствует. Стадия I: только диастолический шум. В следующих стадиях обнаруживаются перечисляемые ниже признаки более тяжелой степени нарушения гемодинамики. Стадия II: субъективных расстройств нет. Диастолическое давление ниже 55 мм рт. ст. при систолическом давлении более 115 мм рт. ст. Иногда – слабо выраженные периферические симптомы (см. ниже). Стадия III: субъективные расстройства отсутствуют или выражены умеренно (сердцебиение, умеренная стенокардия, головокружение, ощущение пульсации в голове, в других областях). Диастолическое давление ниже 40 мм рт. ст., систолическое давление обычно 140–150 мм рт. ст. и выше. Выраженные периферические признаки аортальной недостаточности (хотя бы один из них): «пляска» каротид; пульсация брюшной аорты; псевдокапиллярный пульс, пульс частый, скорый, высокий; двойной шум Дюрозье над бедренной артерией. Усиленный куполообразный верхушечный толчок смещен влево и вниз. Обычно появляется «сопровождающий» систолический шум относительного аортального стеноза. Рентгенологически – аортальная конфигурация, сердце увеличено. Возможно появление ЭКГ-признаков гипертрофии левого желудочка. Стадия IV: выраженная стенокардия, левожелудочковая недостаточность с одышкой при умеренных нагрузках. Возможны мерцательная аритмия и другие нарушения сердечного ритма. Стадия V: тяжелая стенокардия. Выраженная застойная левожелудочковая недостаточность с частыми (повторными в течение месяца) приступами сердечной астмы. У многих больных – одышка при незначительных нагрузках. Правожелудочковая недостаточность развивается лишь в виде исключения.
Лечение сердечной недостаточности требует применения диуретиков, ингибиторов АПФ. Использование сердечных гликозидов может сопровождаться невыгодным при этом пороке удлинением диастолы, показания к их назначению уточняются в зависимости от индивидуальной реакции на пробное лечение малыми дозами. Антиангинальные препараты (нитраты) применяют при необходимости. Возможно хирургическое лечение (имплантация искусственного клапана).
Трикуспидальный порок обычно комбинируется с митральным пороком.
Диагноз ставят на основании выявления специфических шумов недостаточности или (и) стеноза. Эти шумы отличаются локализацией у левого края грудины на уровне пятого-шестого межреберий и, главное, усилением их на вдохе. При комбинированном пороке пресистолический шум трикуспидального стеноза начинается, достигает максимума и заканчивается раньше, чем митральный пресистолический шум, обнаруживаемый у этого же больного. Четко выявляется его веретенообразная конфигурация. Трикуспидальный щелчок следует после митрального, усиливается на вдохе и также тяготеет к грудине. Для диагноза гемодинамически существенного трикуспидального порока обязательно наличие признаков застойной правожелудочковой недостаточности, для существенной трикуспидальной недостаточности – пульсации шейных вен, печени. Выраженность пульсации соответствует степени трикуспидальной недостаточности. У больных с резко выраженным трикуспидальным стенозом при мерцательной аритмии пульсация шейных вен и печени не определяется.
Митрально-аортальный порок. Резко выраженный митральный стеноз с плохим наполнением левого желудочка может смягчить симптомы аортального стеноза, который уже не оказывает существенного препятствия уменьшенному выбросу в аорту. В то же время у некоторых больных с резко выраженным аортальным и митральным стенозом единственным акустическим признаком последнего является интенсивный I тон у верхушки и его запаздывание; иногда отсутствует и этот признак.
Митрально-трикуспидальный порок. Органический трикуспидальный порок сопровождает митральный приблизительно в 15 % случаев; относительная недостаточность трикуспидального клапана обнаруживается у большинства больных в поздних стадиях митрального порока. Определить значение в развитии правожелудочковой недостаточности именно трикуспидального порока в принципе невозможно, так как все соответствующие клинические признаки могут быть обусловлены и одним митральным пороком. Это не относится к пульсации шейных вен и печени, которая является специфическим признаком трикуспидальной недостаточности.
ПРОЛАПС МИТРАЛЬНОГО КЛАПАНА выбухание, выпячива ние, в некоторых случаях выворачивание одной или обеих створок митрального клапана в полость левого предсердия во время систолы левого желудочка. Может быть врожденным (самостоятельным или в рамках другого заболевания – синдромов Марфана, Элерса – Данлоса и др.) или приобретенным (при ишемической болезни сердца, кардиомиопатии, ревматизме, миокардите).
Симптомы, течение. Пролапс митрального клапана часто протекает без клинических проявлений. Возможные проявления: боль в области сердца (обычно давящая, жгучая, в 3–4 межреберьях слева от грудины, длится часами), сердцебиение и перебои в работе сердца (выявляются желудочковая и предсердная экстрасистолия, нарушения атриовентрикулярной проводимости, мерцательная аритмия и др. нарушения ритма и проводимости), часто – признаки вегетативной дистонии (головная боль, головокружение, повышенная утомляемость, чувство нехватки воздуха, вегетативные кризы). Нередко у этих пациентов выявляются признаки синдрома слабости соединительной ткани. При выслушивании сердца характерны «щелчок» митрального клапана и поздний систолический шум митральной регургитации. Диагноз уточняется при эхокардиографии.
Возможные осложнения: инфекционный эндокардит, разрыв хорды с тяжелой митральной недостаточностью, эмболия сосудов головного мозга; редкие случаи внезапной смерти связывают с фатальными нарушениями сердечного ритма.
Лечение – умеренное ограничение физической активности; по показаниям применяют бета-адренобокаторы (пропранолол 60-120 мг в сутки, метоиролол 50–75 мг в сутки, атенолол 50 мг в сутки и др).
СЕРДЕЧНАЯ АСТМА И ОТЕК ЛЕГКИХ клинические синдромы, характеризующиеся пароксизмами затрудненного дыхания вследствие выпотевания в легочную ткань серозной жидкости с образованием (усилением) отека – интерстициального (при сердечной астме) и альвеолярного, со вспениванием богатого белком транссудата (при отеке легких).
Этиология, патогенез. Причинами сердечной астмы (СА) и отека легких (OЛ) в большинстве случаев являются первичная острая левожелудочковая недостаточность (инфаркт миокарда, другие острые и подострые формы ИБС, гипертонический криз и другие пароксизмальные формы артериальной гипертензии, острый нефрит, острая левожелудочковая недостаточность у больных кардиомиопатией и др.) либо острые проявления хронической левожелудочковой недостаточности (митральный или аортальный порок, хроническая аневризма сердца, другие хронические формы ИБС и пр.). К основному патогенетическому фактору – повышению гидростатического давления в легочных капиллярах обычно присоединяются провоцирующие приступ дополнительные факторы: физическое или эмоциональное напряжение, гиперволемия (гипергидратация, задержка жидкости), увеличение притока крови в систему малого круга при переходе в горизонтальное положение и нарушение центральной регуляции во время сна и другие факторы. Сопровождающие приступ возбуждение, подъем АД, тахикардия, тахипноэ, усиленная работа дыхательной и вспомогательной мускулатуры повышают нагрузку на сердце и снижают эффективность его работы. Присасывающее действие форсированного вдоха ведет к дополнительному увеличению кровенаполнения легких. Гипоксия и ацидоз сопровождаются дальнейшим ухудшением работы сердца, нарушением центральной регуляции, повышением проницаемости альвеолярной мембраны и снижают эффективность медикаментозной терапии.
Причинами несердечного отека легких могут быть: 1) поражение легочной ткани – инфекционное (см. Пневмония), аллергическое, токсическое, травматическое; тромбоэмболия легочной артерии, инфаркт легкого; синдром Гудпасчера; 2) нарушение водно-электролитного баланса, гиперволемия (инфузионная терапия, почечная недостаточность, эндокринная патология и стероидная терапия, беременность); 3) утопление в соленой воде; 4) нарушение центральной регуляции – при инсульте, субарахноидальном кровоизлиянии, поражении головного мозга (токсическом, инфекционном, травматическом), при перевозбуждении вагусного центра; 5) снижение внутригрудного давления – при быстрой эвакуации жидкости из брюшной полости, жидкости или воздуха из плевральной полости, подъеме на большую высоту, форсированном вдохе; 6) избыточная терапия (инфузионная, медикаментозная, оксигенотерапия) при шоке, ожогах, инфекциях, отравлениях и других тяжелых состояниях, в том числе после тяжелых операций («шоковое легкое»); 7) различные комбинации перечисленных факторов, например пневмония в условиях высокогорья (необходима неотложная эвакуация больного!).
Симптомы, течение, диагноз. Сердечная астма: удушье с кашлем, свистящим дыханием. Обычно приступ начинается ночью: больной просыпается от мучительного ощущения нехватки воздуха – удушья, которое с первых же минут становится резко выраженным, сопровождается страхом смерти. Нередко приступу предшествует физическое переутомление или нервное напряжение. При осмотре положение больного вынужденное: лежать он не может, а потому вскакивает, опирается на подоконник, стол, старается быть поближе к открытому окну. Тяжелобольные не в силах подняться с постели: они сидят, опустив ноги, опираясь руками о кровать. На лице застывает страдальческое выражение, больной возбужден, ловит воздух ртом, кожа лба, шеи, груди, спины покрыта каплями пота, бледность (иногда с сероватым оттенком) при длительном приступе сменяется синюшностью. Голова наклонена вперед, мышцы плечевого пояса напряжены, надключичные ямки сглажены, грудная клетка расширена, межреберья втянуты, на шее видны набухшие вены.
Дыхание во время приступа, как правило, учащенное (30–40 в 1 мин, иногда больше). Во всех случаях дыхание явно затруднено, особенно вдох, либо больному не удается отметить, что для него труднее – вдох или выдох. Из-за одышки больной не в состоянии разговаривать. Приступ может сопровождаться кашлем – сухим или с мокротой, которая часто бывает обильной, жидкой. При осмотре на фоне ослабленного дыхания выслушиваются сухие, нередко скудные мелкопузырчатые хрипы.
Признаки выраженных расстройств сердечно-сосудистой деятельности являются обязательными спутниками приступа СА. Пульс во время приступа достигает 120–150 ударов в 1 мин (резкая тахикардия особенно характерна для больных митральным пороком), полный, иногда аритмичный. Симптоматика зависит и от предшествовавшего приступу состояния органов кровообращения. Если удушье начинается на фоне компенсации, может наблюдаться отчетливая динамика пульса: ритмичный, нормальной частоты и наполнения в начале приступа, он становится затем (при длительном тяжелом течении приступа) частым, малым, аритмичным (экстрасистолия). Часто во время приступа выявляется повышенное АД, которое может затем падать, сигнализируя о присоединении острой сосудистой недостаточности. Выслушивание сердца во время удушья затруднено из-за шумного дыхания и обилия хрипов. Обычно определяются глухость тонов сердца, иногда ритм галопа или аритмия (экстрасистолия, мерцательная аритмия). В некоторых случаях при перкуссии удается выявить расширение границ относительной тупости сердца, свидетельствующее об остром расширении его (это подтверждается рентгенологическим исследованием во время приступа).
Клиническая картина СА у разных больных и даже повторных приступов у одного и того же больного может быть различной. В одних случаях приступ не имеет предвестников (например, при митральном стенозе), в других – больные на протяжении нескольких дней до приступа отмечают ухудшение самочувствия, усиление одышки, сердцебиение, приступы сухого кашля, а иногда минутное ощущение удушья, которое возникало ночью и проходило после нескольких глубоких вдохов. Продолжительность приступа – от нескольких минут до многих часов. В легких случаях, проснувшись от удушья, больной садится в постели или встает, открывает окно, и через несколько минут приступ заканчивается без лечения; он снова засыпает. При тяжелом течении СА приступы удушья возникают иногда несколько раз в сутки, продолжительны, купируются только применением всего комплекса терапевтических мероприятий. Иногда приступ не поддается лечению, затягивается, состояние больного становится крайне тяжелым: лицо синюшное, пульс нитевидный, АД низкое, дыхание поверхностное, больной принимает более низкое положение в постели. Возникает угроза смерти больного при клинической картине шока или угнетения дыхательного центра. Более частой причиной смерти является осложнение приступа С А отеком легких.
Следует учитывать, что набухание слизистой оболочки бронхов может сопровождаться нарушением бронхиальной проходимости; дифференциальный диагноз с бронхиальной астмой очень важен, поскольку при бронхиальной астме (в противоположность СА) противопоказаны (опасны) наркотические анальгетики и показаны бета-адренергические препараты. Следует оценить анамнез (заболевание сердца или легких, эффективность бета-адренергических препаратов) и обратить внимание на затрудненный, удлиненный выдох (при бронхиальной астме).
Отек легких (OЛ) возникает более или менее внезапно, часто ночью, во время сна, с пробуждением больного в состоянии удушья либо днем при физическом усилии или волнении. Во многих случаях наблюдаются предвестники приступа в виде частого покашливания, нарастания влажных хрипов в легких. С началом приступа больной принимает вертикальное положение, лицо выражает страх и растерянность, приобретает бледносерый или серо-цианотичный оттенок. При гипертоническом кризе и остром нарушении мозгового кровообращения оно может быть резко гиперемированным, а при пороке сердца иметь характерный «митральный» (цианотичный румянец на щеках) вид. Больной ощущает мучительное удушье, которому нередко сопутствуют стеснение или давящая боль в груди. Дыхание резко учащено, на расстоянии слышны клокочущие хрипы, кашель становится все более частым, сопровождается выделением большого количества светлой или розовой пенистой мокроты. В тяжелых случаях пена течет изо рта и носа. Больной не в состоянии определить, что для него труднее – вдох или выдох; из-за одышки и кашля он не может говорить. Нарастает цианоз, набухают шейные вены, кожа покрывается холодным, липким потом.
При выслушивании легких в начале приступа, когда могут преобладать явления отека в межуточной (интерстициальной) ткани, симптоматика может быть скудной: определяются только небольшое количество мелкопузырчатых и единичные крупнопузырчатые хрипы. В разгар приступа выслушиваются обильные разнокалиберные влажные хрипы над различными участками легких. Дыхание над этими участками ослаблено, перкуторный звук укорочен. Участки укороченного перкуторного звука могут чередоваться с участками коробочного звука (ателектаз одних сегментов легких и острая эмфизема других).
Пульс обычно резко учащен, нередко до 140–150 ударов в 1 мин. В начале приступа он удовлетворительного наполнения. В более редких и, как правило, очень тяжелых случаях наблюдается резкая брадикардия. Выявляются симптомы, зависящие от заболевания, на фоне которого развился ОЛ; границы тупости сердца, как правило, расширены влево, тоны глухие, часто вообще не выслушиваются из-за шумного дыхания и обильных хрипов. АД зависит от исходного уровня, который может быть нормальным, повышенным или пониженным.
При длительном течении отека легких АД обычно падает, наполнение пульса слабеет, его трудно прощупать. Дыхание становится поверхностным, менее частым, больной принимает горизонтальное положение, у него нет сил откашлять мокроту. Смерть наступает от асфиксии. Иногда весь приступ, заканчивающийся смертью больного, продолжается несколько минут (молниеносная форма); чаще он длится несколько часов и прекращается лишь после энергичных лечебных мероприятий. Очень важно не забывать о возможности волнообразного течения ОЛ, когда у больного, выведенного из приступа, развивается повторный тяжелый приступ, нередко заканчивающийся смертью больного.
Приступ удушья, сопровождающийся клокочущим дыханием, выделением пенистой жидкой мокроты, обильными влажными хрипами в легких, столь характерен, что в этих случаях диагноз ОЛ не представляет затруднений. Рентгенологически при ОЛ выявляются расширение тени средостения, снижение прозрачности легочных полей, расширение корней легких, линии Керли (признак отека междольковых перегородок – горизонтальные параллельные полоски длиной 0,3–0,5 см вблизи наружных синусов или вдоль междолевой плевры), плевральный выпот. Однако и без рентгенологического исследования приступ удушья при бронхиальной астме, сопровождающийся свистящими хрипами на фоне резко удлиненного выдоха, скудной вязкой мокротой, трудно спутать с ОЛ.
В некоторых случаях не так просто различить ОЛ и СА. При последней нет обильной пенистой мокроты и клокочущего дыхания, влажные хрипы выслушиваются преимущественно в нижних отделах легких. Однако следует учитывать, что ОЛ не всегда протекает со всеми указанными характерными симптомами: мокрота не всегда жидкая и пенистая, иногда больной выделяет всего 2–3 плевка бесцветной, розовой или даже желтоватой слизистой мокроты. Количество влажных хрипов в легких может быть и небольшим, но обычно уже на расстоянии слышны клокочущие хрипы. Бывают и приступы удушья, не сопровождающиеся ни клокочущим дыханием, ни влажными хрипами в легких, ни выделением мокроты, но с рентгенологической картиной ОЛ. Это может зависеть от преимущественного скопления жидкости в интерстициальной ткани, а не в альвеолах. В других случаях при тяжелом состоянии больного отсутствие обычных признаков ОЛ может объясняться закупоркой бронхов мокротой. Всякий тяжелый приступ удушья у больного, страдающего заболеванием сердца, вынуждает думать о возможности ОЛ.
Пенистую мокроту при ОЛ следует отличать от пенистой, нередко окрашенной кровью, слюны, выделяемой при эпилептическом приступе и при истерии. «Клокочущее» дыхание у агонизирующих больных не является специфическим признаком ОЛ.
Лечение – экстренное, уже на стадии предвестников (возможный летальный исход). Последовательность терапевтических мероприятий во многом определяется их доступностью, временем, которое потребуется для их осуществления. Больному необходимо придать возвышенное положение – сидя, спустив ноги с кровати. При этом под действием силы тяжести происходит перераспределение крови, депонирование ее в венах ног и, соответственно, разгрузка малого круга кровообращения. Обязательно вдыхание кислорода, так как всякий отек легких вызывает кислородное голодание организма.
Медикаментозная терапия должна быть направлена на снижение возбудимости дыхательного центра и разгрузку малого круга кровообращения. Первой цели служит введение морфина: помимо избирательного действия на дыхательный центр, морфин уменьшает приток крови к сердцу и застой в легких за счет снижения возбудимости сосудодвигательных центров, оказывает общее успокаивающее действие на больного. Морфин вводят п/к или в/в дробно в дозе 1 мл 1%-ного раствора. Уже через 5-10 мин после инъекции дыхание облегчается, больной успокаивается. При нарушении ритма дыхания (дыхание типа Чейна – Стокса), угнетении дыхательного центра (дыхание становится поверхностным, менее частым, больной принимает более низкое положение в постели) морфин вводить не следует. Осторожность требуется и в тех случаях, когда характер приступа неясен (не исключена бронхиальная астма).
Для того чтобы уменьшить явления застоя в легких, прибегают к введению мочегонных средств. Наиболее эффективно в/в струйное введение лазикса (фуросемида). При СА начинают с 40 мг, при ОЛ доза может быть увеличена до 200 мг. При внутривенном введении фуросемид не только уменьшает объем циркулирующей крови, но и оказывает венодилатирующее действие, уменьшая за счет этого венозный возврат к сердцу. Эффект развивается через несколько минут и продолжается 2–3 ч.
В целях депонирования крови на периферии и разгрузки малого круга кровообращения внутривенно капельно вводят венозные вазодилататоры – нитроглицерин либо изосорбид-динитрат. Начальная скорость введения препаратов – 5-15 мкг/мин, каждые 5 мин скорость введения увеличивают на 10 мкг/мин до улучшения параметров гемодинамики и регресса признаков левожелудочковой недостаточности либо до снижения систолического АД до 100 мм рт. ст. При начальных явлениях левожелудочковой недостаточности и невозможности парентерального введения прибегают к сублингвальному приему нитроглицерина (1–2 таблетки каждые 10–20 мин).
В ряде случаев монотерапия нитроглицерином оказывается достаточной, заметное улучшение наступает через 5-15 мин.
Лечение ОЛ проводят под постоянным (с интервалом 1–2 мин) контролем систолического АД, которое не должно снижаться более чем на исходного или ниже 100–110 мм рт. ст. Особая осторожность
требуется при сочетанном применении препаратов, а также у лиц пожилого возраста и при высокой артериальной гипертензии в анамнезе. При резком снижении систолического АД необходимы экстренные мероприятия (опустить голову, поднять ноги, начать введение вазопрессоров). При ОЛ на фоне артериальной гипотонии с самого начала показано в/в капельное введение допамина со скоростью 3-10 мкг/кг/мин, а по мере стабилизации гемодинамики к терапии добавляют нитраты и мочегонные. Венозные жгуты на конечности (попеременно по 15 мин) или венозное кровопускание (200–300 мл из локтевой вены) могут быть рекомендованы в качестве вынужденной замены «внутреннего кровопускания» – перераспределения кровенаполнения, проводимого обычно с помощью нитроглицерина и фуросемида.
При наличии мерцательной тахиаритмии показана быстрая дигитализация (дигоксин в/в по 1 мл 0,025 %-ного раствора 1–2 раза в сутки), при пароксизмальных нарушениях ритма – электроимпульсная терапия. При выраженном эмоциональном фоне, артериальной гипертензии используют нейролептик дроперидол – 2 мл 0,25 %-ного раствора вводят в/в струйно. При поражении альвеолярной мембраны (пневмония, аллергический компонент) применяют преднизолон или гидрокортизон. Поскольку верхние дыхательные пути при ОЛ часто заполнены слизью, пенистыми выделениями, необходимо отсосать их через катетер, соединенный с отсосом. Специализированная помощь включает при необходимости и такие меры, как интубация или трахеотомия, искусственное аппаратное дыхание, которые применяются в самых тяжелых случаях.
Во многих случаях, особенно при токсическом, аллергическом и инфекционном происхождении ОЛ с поражением альвеолярно-капиллярной мембраны с успехом применяют большие дозы глюкокортикостероидов. Преднизолона гемисукцинат (бисукцинат) повторно по 0,025-0,15 г – по 3–6 ампул (до 1200–1500 мг/сут) или гидрокортизона гемисукцинат – 0,125–300 мг (до 1200–1500 мг/сут) вводят капельно в вену в изотоническом растворе хлорида натрия, глюкозы или другого инфузионного раствора.
Показания к госпитализации могут возникать в стадии предвестников и после выведения из приступа СА. Выведение из ОЛ проводится на месте силами специализированной реанимационной кардиологической бригады скорой помощи. После выведения из ОЛ госпитализация в блок интенсивной терапии осуществляется силами этой же бригады (угроза рецидива ОЛ). О лечении СА и ОЛ – см. также Инфаркт миокарда.
Прогноз серьезный во всех стадиях и во многом определяется тяжестью основного заболевания и адекватностью лечебных мероприятий. Особенно серьезен прогноз при сочетании развернутого ОЛ с артериальной гипотонией.
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ клинический синдром, обусловленный нарушением насосной функции сердца, которое приводит к неспособности миокарда удовлетворять метаболические потребности тканей; проявление и следствие заболеваний, поражающих миокард или затрудняющих работу сердца: ишемической болезни сердца, артериальной гипертензии, пороков сердца, диффузных заболеваний легких, миокардита, кардиомиопатий (в том числе алкогольной) и др.
О клинике и лечении острой левожелудочковой сердечной недостаточности (СН) – см. Сердечная астма, отек легких.
Сердечная недостаточность хроническая. Патогенез. Заболевание сердечно-сосудистой системы приводит к снижению сердечного выброса и, в ответ на это, к активации приспособительных реакций, направленных на поддержание кровотока в жизненно важных органах (тахикардия, сужение сосудов). В частности, уменьшение количества импульсов с артериальных и кардиопульмональных рецепторов по механизму обратной связи повышает активность симпато-адреналовой системы; насосная функция сердца при этом повышается за счет увеличения частоты и силы сердечных сокращений, клинически это проявляется тахикардией. Однако в дальнейшем количество и чувствительность бета|-адренорецепторов в сердце уменьшается, и оно пе-рестает адекватно реагировать на катехоламины. Кроме того, постоянная активация симпато-адреналовой системы может провоцировать ишемию миокарда и нарушения сердечного ритма, что ухудшает прогноз при СН. Ишемия почек приводит к активации ренинангиотензин-альдостероновой системы. Образующийся ангиотензин II обладает выраженным сосудо-суживающим действием, стимулирует выброс норадреналина и секрецию альдостерона в коре надпочечников, что ведет к задержке натрия и воды в организме и увеличению объема циркулирующей крови. Эти приспособительные реакции приводят, однако, к увеличению нагрузки на миокард, а синтезирующийся в миокарде ангиотензин II способствует гипертрофии и фиброзу миокарда и сосудов. Таким образом, компенсаторные поначалу реакции в дальнейшем еще больше затрудняют работу сердца, приводят к нежелательной перестройке структуры и функции сердечно-сосудистой системы, появлению клинических признаков СН.
Симптомы, течение неодинаковы при различных формах и стадиях СН. При левожелудочковой недостаточности наблюдаются застойные явления в малом круге кровообращения: одышка, приступы удушья (чаще – по ночам), сухой кашель, иногда – кровохарканье, ортопноэ, аускультативные (влажные незвонкие мелкопузырчатые хрипы ниже уровня лопаток) и рентгенологические признаки застоя в легких, тахикардия, разлитой и смещенный влево верхушечный толчок.
При правожелудочковой недостаточности застойные явления наблюдаются в большом круге кровообращения; возможны жалобы на чувство распирания в животе, тяжесть и боль в правом подреберье, жажду, уменьшение диуреза; при обследовании выявляют цианоз, набухание шейных вен, увеличение печени, отеки – полостные и периферические, застойную почку (олигурия, протеинурия, микрогематурия), нарушения функции желудочно-кишечного тракта.
Подтвердить наличие СН можно с помощью ультразвуковых методов исследования. Эхокардиография позволяет оценить сокращения левого желудочка, допплер-эхокардиография – его диастолическую функцию.
Кроме того, при эхокардиографии можно уточнить причину СН (локальные нарушения сократимости миокарда при ИБС, поражение клапанов, перикарда, врожденные пороки сердца и др.). При рентгенологическом исследовании нередко обнаруживаются кардиомегалия, застойные явления в легких, гидроторакс; при декомпенсированной СН – признаки интрестициального или альвеолярного отека легких.
Стадии развития и степень тяжести СН. Широко используется отечественная классификация, предполагающая выделение 3 стадий хронической СН. Стадия I – начальная скрытая недостаточность кровообращения, проявляется только при физической нагрузке (одышка, сердцебиение, утомляемость), в покое эти явления исчезают; гемодинамика не нарушена. Стадия II – выраженная длительная недостаточность кровообращения, характеризуется нарушениями гемодинамики (застой в одном из кругов кровообращения при НК IIA или в обоих кругах кровообращения при НК IIБ). Стадия III – конечная дистрофическая стадия, с тяжелыми нарушениями гемодинамики, стойкими изменениями обмена веществ, необратимыми изменениями в органах и тканях.
Наиболее существенные «прямые» проявления СН, определяющие качество жизни больного, оцениваются по шкале, принятой в международной практике, – модифицированной классификации Нью-Йоркской кардио-логической ассоциации. Функциональные классы (ФК) определяются по-явлением тягостной одышки, сердцебиения, чрезмерного утомления или ангинозной боли – хотя бы одного из этих субъективных проявлений СН. Эти проявления отсутствуют при ФК 0. При классах I–IV они возникают при нагрузках той или иной интенсивности: ФК I – при нагрузках выше ординарных (при быстрой ходьбе по ровному месту или при подъеме по отлогому склону); ФК II – при ординарных, сопровождающих повседневную жизнедеятельность, умеренных нагрузках (появляются, когда больной идет наравне с другими людьми своего возраста по ровному месту); ФК III – при незначительных, менее ординарных нагрузках, которые заставляют останавливаться при ходьбе по ровному месту в обычном темпе, при небыстром подъеме на один этаж; ФК IV – при минимальных нагрузках (несколько шагов по комнате, надевание халата, рубашки) или в покое. Следует объективно оценивать субъективные симптомы и убедиться, что они обусловлены именно СН, а не другой причиной, такой, например, как заболевание легких или невротическая реакция. В сомнительных случаях необходимо исключить легочную, почечную недостаточность, цирроз печени, микседему.
Лечение. Нефармакологические методы лечения СН включают ограничение употребления поваренной соли до 5–6 г в сутки (при прогрессировании СН – до 1,5–2 г в сутки), снижение массы тела при ожирении, ограничение потребления жидкости до 1–1,5 л в сутки, разумное ограничение физической активности (постельный режим при острой или декомпенсированной СН, регулярные индивидуально подобранные физические нагрузки при стабильном течении СН). Необходимо помнить, что длительное (более 1–2 нед) применение бессолевой диеты, особенно в сочетании с мочегонной терапией, может привести к опасному солевому истощению.
Медикаментозная терапия неодинакова при различных формах, проявлениях и происхождении СН. При хронической СН адекватная медикаментозная терапия должна быть постоянной – необоснованная ее отмена зачастую приводит к декомпенсации.
Использование ингибиторов АПФ целесообразно у всех пациентов с застойной СН, поскольку они достоверно уменьшают летальность этих больных. Ингибирование АПФ приводит к снижению концентрации биологически активного ангиотензина, уменьшению разрушения брадикинина и синтеза альдостерона. В результате расширяются артериальные и венозные сосуды, снижается АД, в организме задерживается калий. В отличие от многих других вазодилататоров ингибиторы АПФ, как правило, не вызывают рефлекторную тахикардию. При лечении СН предпочтение отдается каптоприлу (капотену) и эналаприлу (ренитеку) как наиболее изученным препаратам. Учитывая возможность артериальной гипотензии, особенно в начале лечения, терапию начинают с минимальных доз ингибиторов АПФ (6,25 мг каптоприла 2–3 раза в сутки, 2,5 мг эналаприла 2 раза в сутки), удваивая суточную дозу каждые 1–2 нед при хорошем самочувствии пациента и отсутствии побочных эффектов (гипотонии, кашля, азотемии, гиперкалиемии). При хорошей переносимости дозу капотена доводят до 75 мг в сутки, дозу эналаприла – до 20 мг в сутки.
Сердечные гликозиды, безусловно, показаны при мерцательной аритмии и застойной СН, возможно их применение в небольших дозах для лечения тяжелой СН (III–IV функциональный класс по классификации Нью-Йоркской кардиологической ассоциации) на фоне синусового ритма. Они противопоказаны при обструктивной гипертрофической кардиомиопатии, при тяжелой гипо– и гиперкалиемии, при гиперкальциемии, атриовентрикулярной блокаде, синдроме WPW, синдроме слабости синусового узла, желудочковых экстрасистолах – частых, парных, политопных, аллоритмированных, а также при пароксизмах желудочковой тахикардии.
Терапия сердечными гликозидами проводится в два этапа: вначале (2–3 сут) дается насыщающая доза, затем суточная доза уменьшается в 1,5–2 раза. В последующем поддерживающую дозу уточняют в зависимости от индивидуальной реакции больного, с тем чтобы частота пульса удерживалась на уровне 52–68 в 1 мин в покое и не превышала 90-100 в 1 мин после минимальных нагрузок. Наиболее широко применяется дигоксин, назначаемый 2–3 раза в сутки в таблетках по 0,25 мг или парентерально по 0,5–1,5 мл 0,025 %-ного раствора (период насыщения), затем по 0,25-0,5 мг (поддерживающая доза) в сутки. Начинать лечение с в/в введения дигоксина целесообразно при мерцательной тахиаритмии, тяжелой СН (когда всасывание лекарственных средств из желудочно-кишечного тракта снижено). При лечении СН у пациентов с синусовым ритмом применяют малые дозы (0,25 мг дигоксина в сутки), поскольку при превышении этих доз возрастает риск развития нарушений сердечного ритма и внезапной смерти. Подбор доз сердечных гликозидов, как правило, должен производиться в стационаре.
При появлении симптомов гликозидной интоксикации (анорексия, тошнота, рвота, брадикардия, появление желудочковых экстрасистол, предсердной тахикардии, развитие атриовентрикулярной блокады, в тяжелых случаях – нарушения зрения и др.) лечение сердечными гликозидами следует немедленно прекратить, не ограничиваясь снижением дозы. С исчезновением признаков передозировки, но не ранее чем через 2–3 дня лечение возобновляют с уменьшением суточной дозы на 25–75 %. Корытообразная депрессия сегмента ST на ЭКГ – проявление насыщения миокарда сердечными гликозидами (а не дигиталисной интоксикации), однако ее появление должно насторожить врача. Больной и его близкие должны быть ознакомлены с индивидуальной схемой лечения сердечными гликозидами и с признаками их передозировки.
Диуретики показаны при задержке жидкости в организме. Их назначают в минимальных эффективных дозах, как правило, на фоне лечения ингибиторами АПФ (что уменьшает риск развития гипокалиемии), часто в сочетании с сердечными тликозидами. Схему лечения отрабатывают индивидуально и корригируют в ходе лечения; необходимо добиться положительного диуреза: + 800 (до 1000 мл) в активной фазе лечения + 200 мл для поддерживающей терапии. Возможно прерывистое лечение, когда препарат назначают 1-2-3 раза в неделю (что позволяет избежать гипокалиемии), или ежедневный прием слабейшего из эффективных для данного больного диуретиков (например, гипотиазида в индивидуально подобранной дозе). Основными осложнениями диуретической терапии являются гипокалиемия, гипонатриемия, гипокальциемия (петлевые диуретики), гипохлоремический алкалоз, дегидратация и гиповолемия – иногда с формированием и прогрессированием флеботромбоза. Реже (преимущественно при длительном массивном лечении диуретиками) возникают гипергликемия, гиперурикемия и другие побочные проявления. Следует особо предостеречь против опасного для жизни назначения диуретиков при дегидратации (сухая слизистая оболочка щек).
Гидрохлортиазид (гипотиазид) применяют при нетяжелой СН в таблетках по 25 и 100 мг или в составе триампура (таблетки, содержащие 12,5 мг гипотиазида и 25 мг калийсберегающего диуретика триамтерена). Суточная доза гипотиазида – 25-100 мг в один или два приема. Начало действия – через 1–2 ч после приема, продолжительность – 12 ч. При более тяжелой СН используют мощный петлевой диуретик фуросемид (лазикс) в таблетках по 40 мг или парентерально (2 мл 1%-ного раствора лазикса). Дозу (обычно от 20 до 240 мг в сутки) подбирают индивидуально под контролем диуреза. У больных, ранее не получавших диуретиков, лечение начинают с небольших доз (20–40 мг в сутки); если больной уже длительное время получает мочегонные средства, начальная доза фуросемида, безусловно, должна быть выше. При приеме внутрь начало действия фуросемида – через 30–60 мин, продолжительность – 4–8 ч. Внутривенное введение лазикса целесообразно при тяжелой СН, когда всасывание препаратов из желудочно-кишечного тракта затруднено. Быстрое действие и присущий фуросемиду начальный внепочечный эффект перераспределения крови с разгрузкой малого круга делают особенно ценным внутривенное введение его в дозе 40-120 мг в неотложных случаях (сердечная астма, отек легких). При внутривенном введении начало действия – через 5 мин, продолжительность действия – 2–3 ч.
Спиронолактон (верошпирон) представляет собой антагонист гормона коры надпочечников, способствует выделению натрия и воды и задерживает в организме калий; возможные побочные эффекты – тошнота, кожная сыпь, гинекомастия у мужчин, дисменорея у женщин. Особенно целесообразно применение верошпирона при вторичном гиперальдостеронизме, развивающемся у пациентов, длительно страдающих тяжелой СН. При непереносимости ингибиторов АПФ верошпирон принимают в дозе 150–300 мг в сутки в 1–2 приема (в первую половину дня). При комбинировании ингибиторов АПФ и верошпирона суточная доза последнего не превышает 50 мг, необходим регулярный контроль уровня калия в крови. Клинический эффект проявляется обычно на 3-4-й день терапии – увеличивается диурез, исчезают жажда, сухость во рту. Применение верошпирона не показано при анурии, острой и хронической почечной недостаточности, гиперкалиемии.
При рефрактерности к диуретикам используют внутривенное введение лазикса, совместное применение мочегонных средств с различным механизмом действия (например, гипотиазид + фуросемид, фуросемид + спиронолактон, гипотиазид + фуросемид + спиронолактон). Об эффективности терапии помимо увеличения суточного диуреза, уменьшения отеков и массы тела свидетельствует уменьшение одышки и отчасти сокращение размеров печени. Попытки достичь с помощью массивной диуретической терапии значительного сокращения размеров печени нередко безуспешны и чреваты опасностью необратимого нарушения водно-солевого баланса. При выраженных полостных отеках (гидротораксе, гидроперикарде, но только вынужденно – при массивном асците) эвакуация жидкости может быть механической (пункция).
Доказано, что длительная терапия бета-адреноблокаторами улучшает прогноз у больных застойной СН. Наиболее целесообразно применение длительно действующих бета-адреноблокаторов при стойкой тахикардии, стенокардии. Учитывая опасность развития побочных эффектов (в первую очередь, гипотензии) терапию начинают с минимальных доз (начальная суточная доза метопролола составляет 12,5 мг, бисопролола 1,25 мг). При хорошей переносимости дозу удваивают каждые 2 нед оптимальная суточная доза метопролола составляет 150 мг, для бисопролола – 10 мг.
При выявлении опасных для жизни желудочковых нарушений ритма (например, пароксизмов желудочковой тахикардии) и невозможности применения бета-адреноблокаторов (или их неэффективности) к терапии добавляют кордарон в дозе 200 мг в сутки или соталол (начиная с 20 мг 2 раза в сутки и постепенно увеличивая дозу максимально до 160 мг 2 раза в сутки); исключение составляют нарушения сердечного ритма при дигиталисной интоксикации.
Трудоспособность в I стадии сохранена; тяжелый физический труд противопоказан; во IIA стадии трудоспособность ограничена или утрачена; во IIБ – утрачена, в III стадии больные нуждаются в постоянном постороннем уходе.
Профилактика СН сводится к профилактике и лечению основного заболевания, профориентации, трудоустройству. Систематическое адекватное лечение СН, предупреждение и энергичное лечение интеркуррентных заболеваний предупреждает (тормозит) прогрессирование СН.
СОСУДИСТАЯ НЕДОСТАТОЧНОСТЬ – несоответствие между вместимостью сосудистого русла и объемом циркулирующей крови вследствие недостаточности сосудистого тонуса или (и) объема циркулирующей крови (гиповолемия). Дефицит венозного возврата (кровенаполнения сердца) может нарушить насосную функцию сердца. В таких случаях возникают изменения преимущественно по типу левожелудочковой недостаточности выброса с явлениями ишемии мозга, сердца, почек и других органов, при гиповолемии – с централизацией кровообращения. Возможно развитие синдрома диссеминированного внутрисосудистого свертывания.
СОСУДИСТАЯ НЕДОСТАТОЧНОСТЬ ОСТРАЯ см. Коллапс, Обморок, а также главу «Принципы лечения терминальных состояний».
СОСУДИСТАЯ НЕДОСТАТОЧНОСТЬ ХРОНИЧЕСКАЯ см. Артериальная гипотензия.
СТЕНОКАРДИЯ (грудная жаба) – приступы внезапной боли в груди вследствие острого недостатка кровоснабжения миокарда – клиническая форма ишемической болезни сердца.
Патогенез. В большинстве случаев стенокардия обусловлена атеросклерозом венечных артерий сердца; в начальной стадии ограничивается расширение просвета артерии и возникает острый дефицит кровоснабжения миокарда при значительных физических или (и) эмоциональных перенапряжениях; резкий атеросклероз с сужением просвета артерии на 75 % и более вызывает такой дефицит уже при умеренных напряжениях. Появлению приступа способствует снижение притока крови к устьям коронарных артерий (артериальная, особенно диастолическая гипотензия любого, в том числе лекарственного, происхождения или падение сердечного выброса при тахиаритмии, венозной гипотензии); патологические рефлекторные влияния со стороны желчных путей, пищевода, шейного и грудного отделов позвоночника при сопутствующих их заболеваниях; острое сужение просвета коронарной артерии (патогенез нестабильной стенокардии связывают с разрывом или расщеплением атеросклеротической бляшки, образованием тромба в коронарной артерии, повышением агрегации тромбоцитов). Основные механизмы стихания приступа: быстрое и значительное снижение уровня работы сердечной мышцы (прекращение нагрузки, действие нитроглицерина), восстановление адекватности притока крови к коронарным артериям. Основные условия снижения частоты и прекращения приступов: приспособление режима нагрузок больного к резервным возможностям его коронарного русла; развитие путей окольного кровоснабжения миокарда; стихание проявлений сопутствующих заболеваний; стабилизация системного кровообращения; развитие фиброза миокарда в зоне его ишемии.
Симптомы, течение. При стенокардии боль всегда отличается следующими признаками: 1) носит характер приступа, т. е. имеет четко выраженное время возникновения и прекращения, затихания; 2) возникает при определенных условиях, обстоятельствах; 3) начинает стихать или совсем прекращается под влиянием нитроглицерина (через 1–3 мин после его сублингвального приема). Условия появления приступа стенокардии напряжения: чаще всего – ходьба (боль при ускорении движения, при подъеме в гору, при резком встречном ветре, при ходьбе после еды или с тяжелой ношей), но также и иное физическое усилие или (и) значительное эмоциональное напряжение. Обусловленность боли физическим усилием проявляется в том, что при его продолжении или возрастании неотвратимо возрастает и интенсивность боли, а при прекращении усилия боль стихает или исчезает в течение нескольких минут. Названные три особенности боли достаточны для постановки клинического диагноза приступа стенокардии и для отграничения его от различных болевых ощущений в области сердца и вообще в груди, не являющихся стенокардией.
Распознать стенокардию часто удается при первом же обращении больного, тогда как для отклонения этого диагноза необходимы наблюдение за течением болезни и анализ данных неоднократных расспросов и обследований больного. Следующие признаки дополняют клиническую характеристику стенокардии, но их отсутствие не исключает этот диагноз: 1) локализация боли за грудиной (наиболее типична!), редко – в области шеи, в нижней челюсти и зубах, в руках, в надплечье и лопатке (чаще слева), в области сердца; 2) характер боли – давящий, сжимающий, реже – жгучий (подобно изжоге) или ощущение инородного тела в груди (иногда больной может испытывать не болевое, а тягостное ощущение за грудиной и тогда он отрицает наличие собственно боли); 3) одновременные с приступом повышения АД, бледность покровов, испарина, колебания частоты пульса, появление экстрасистол. Все это характеризует стенокардию напряжения. Тщательность врачебного расспроса определяет своевременность и правильность диагностики болезни. Следует иметь в виду, что нередко больной, испытывая типичные для стенокардии ощущения, не сообщает о них врачу как о «не относящихся к сердцу» или, напротив, фиксирует внимание на диагностически второстепенных ощущениях «в области сердца».
У большинства больных течение стенокардии характеризуется относительной стабильностью. Под этим понимают некоторую давность возникновения признаков стенокардии, приступы которой за этот период мало изменялись по частоте и силе, наступают при повторении одних и тех же либо при возникновении аналогичных условий, отсутствуют вне этих условий и стихают в условиях покоя (стенокардия напряжения) либо после приема нитроглицерина. Интенсивность стабильной стенокардии квалифицируют так называемым функциональным классом (ФК). К I ФК относят лиц, у которых стабильная стенокардия проявляется редкими приступами, вызываемыми только избыточными физическими напряжениями. Если приступы стабильной стенокардии возникают и при обычных нагрузках, хотя и не всегда, такую стенокардию относят ко II ФК, а в случае приступов при малых (бытовых) нагрузках – к III ФК. IV ФК фиксируют у больных с приступами при минимальных нагрузках, а иногда и в покое.
Стенокардия покоя в отличие от стенокардии напряжения возникает вне связи с физическим усилием, чаще по ночам, но в остальном сохраняет все черты тяжелого приступа грудной жабы и нередко сопровождается ощущением нехватки воздуха, удушьем. Особо следует остановиться на той разновидности стенокардии покоя, которая называется декубитальной (стенокардия de cubitas): приступ возникает в горизонтальном положении больного, чаще ночью. Обычно она развивается у больных с выраженным кардиосклерозом и явлениями сердечной недостаточности. Болевые приступы при декубитальной стенокардии объясняются тем, что в горизонтальном положении усиливается приток крови к сердцу и возрастает нагрузка на миокард. В подобных случаях болевой приступ лучше купируется в положении сидя или стоя. Ангинозные приступы у таких больных возникают не только в горизонтальном положении, но и при малейшей физической нагрузке (стенокардия IV ФК); идентичность болевых приступов помогает установить правильный диагноз. Помимо нитроглицерина, хороший эффект (нередко предупреждающий возникновение приступов) оказывает назначение вазодилятаторов и мочегонных средств.
Стенокардия должна особенно настораживать врача, если: приступ возник впервые, особенно если впервые возникшие приступы учащаются и усиливаются с первых же недель болезни; течение стенокардии утрачивает свою стабильность: частота приступов нарастает, они возникают в иных, чем прежде, условиях (при меньших нагрузках, напряжениях), появляются и вне напряжений (в покое, ранним утром), как бы переходят из I–II ФК в III–IV ФК; т. е. течение стенокардии изменилось, приобретя существенно новые характеристики, она стала нестабильной. Изменения ЭКГ (снижение сегмента ST, инверсия зубцов Т, аритмии), а также небольшое повышение активности ферментов сыворотки крови (КФК, ЛДГ, ЛДГ1, АсАТ), как правило, отсутствуют в таких случаях. Нестабильная стенокардия не всегда завершается инфарктом миокарда (вероятность развития инфаркта составляет около 30 %); это необходимо учитывать в клинической диагностике.
Изредка встречается так называемая вариантная (вазоспастическая) форма стенокардии, отличающаяся спонтанным характером приступа, регистрируемыми на ЭКГ резкими подъемами сегмента ST, рефрактерностью к бетаблокаторам, но чувствительностью к антагонистам кальция (верапамил, коринфар и др.).
Основой диагноза любой из форм и вариантов течения стенокардии является правильно построенный и тщательно проведенный расспрос больного. При нетипичном болевом синдроме наличие ишемии миокарда нередко удается подтвердить при суточном ЭКГ-мониторировании, нагрузочных пробах с электрокардиографией, стресс-эхокардиографии, а также с помощью радионуклидных методов исследования сердца. Тактику установления диагноза определяет следующая схематическая последовательность решения основных вопросов: коронарная (ангинозная) ли природа боли? имеются ли признаки нестабильной стенокардии? не связано ли настоящее обострение в течение ишемической болезни сердца с влиянием внесердечных (сопутствующих) заболеваний? Лишь убедительно аргументированный отрицательный ответ на первый из трех вопросов дает право на поиск другой причины (источника) болей: обнаружение у больного другой болезни в качестве источника его болевых ощущений не может исключить наличие у него одновременно и приступов грудной жабы как проявления ишемической болезни сердца. О болях в области сердца нестенокардического характера – см. Кардиалгии.
Лечение. Важнейшим тактическим моментом является купирование болевых приступов. Если приступ развился при физической нагрузке, больной должен остановиться, а лучше сесть или лечь. Основным лекарственным средством для купирования приступа стенокардии традиционно остается нитроглицерин в таблетках по 0,0005 г. Возможно также использование препарата в виде дозированных ингаляций (нитролингвал, нитроминт). Альтернативой нитроглицерину при купировании приступа стенокардии может быть изосорбида динитрат, также применяемый в виде таблеток сублингвально (нитросорбит) или в виде спрея (изокет, Изо Мак спрей). Артериальная гипертензия во время приступа не требует экстренных лекарственных мер, так как снижение АД наступает спонтанно у большинства больных.
Нитроглицерин должен всосаться в слизистую оболочку полости рта, поэтому таблетку следует помещать под язык. Больного следует предупредить, что после приема нитроглицерина могут возникнуть чувство распирания в голове и головная боль, иногда – головокружение, обморочное состояние в вертикальном положении тела, поэтому начинать лечение лучше в положении лежа или сидя в глубоком кресле. Если нитроглицерин плохо переносится, то можно рекомендовать одновременный прием валидола под язык.
В случае эффективности нитроглицерина приступ стенокардии проходит через 2–3 мин. Если через несколько минут после приема препарата боли не исчезли, можно принять его повторно. Как правило, «опытный» пациент всегда имеет с собой нитроглицерин, принимает его самостоятельно и вызывает врача лишь в случае неэффективности препарата.
Использование нитроглицерина имеет дифференциально-диагностическое значение: если после приема третьей таблетки болевой приступ не купируется, затягивается более чем на 10–20 мин, диагноз стенокардии должен быть подвергнут сомнению. Дифференциальный диагноз между острым инфарктом миокарда и кардиалгией в большинстве случаев может быть проведен при помощи электрокардиографического исследования. При выявлении каких-либо изменений на ЭКГ заболевание расценивается как острый инфаркт миокарда с соответствующей врачебной тактикой. Следует учитывать, что, помимо тягостного ощущения для пациента, стенокардия опасна возможностью рефлекторного спазма других венечных артерий и увеличения зоны ишемии миокарда. Тяжелые болевые приступы, кроме того, могут быть причиной развития болевого шока с острой сосудистой недостаточностью, поэтому неэффективность повторного приема нитроглицерина расценивается как показание для в/в дробного введения морфина.
Общие принципы лечения: внушение больному необходимости избегать нагрузок, приводящих к приступу, пользоваться нитроглицерином без опасений, принимать его «профилактически» в предвидении напряжения, чреватого приступом; устранение эмоционального напряжения, в том числе вызванного страхом, тревогой в связи с болезнью (психотерапевтические воздействия, назначение транквилизаторов – см. главу «Психотропные средства в соматической медицине»); лечение сопутствующих заболеваний, особенно органов пищеварения; меры профилактики атеросклероза; сохранение и постепенное расширение пределов физической активности (с учетом функциональных возможностей больного).
Лечение в межприступном периоде. Специальными исследованиями показано, что уменьшить смертность больных стенокардией можно с помощью постоянного приема ими аспирина в дозе 80-300 мг 1 раз в сутки, бета-адреноблокаторов (например, пропранололав в индивидуально подобранной дозе, предпочтительнее – кардиоселективных и липофильных препаратов, например метопролола в дозе 50-100 мг 2 раза в сутки) и, при наличии показаний, гиполипидемических средств. Пролонгированные нитраты не продлевают жизнь, но заметно улучшают ее качество. При стенокардии I–II ФК нитраты назначают только «по требованию» – для купирования болевых приступов и профилактически перед нагрузкой. При стенокардии III–IV ФК назначают пролонгированные нитраты (изосорбид-5-мононитрат или изосорбид динитрат). При непереносимости нитратов и бета-блокаторов средством выбора становятся антагонисты кальция (верапамил, дильтиазем, амлодипин), предпочтительно назначение пролонгированных препаратов. Для профилактики приступов стенокардии можно также использовать предуктал (20 мг 3 раза в сутки), оказывающий антигипоксическое действие при ишемии миокарда.
Лечение нестабильной стенокардии проводится в условиях специализированного кардиологического учреждения (отделения) и, по сути, незначительно отличается от лечения острого инфаркта миокарда. Болевой синдром, не купирующийся применением нитратов в течение 20 мин, является показанием для внутривенного дробного введения наркотических анальгетиков (обычно – морфина). Нитроглицерин применяют в/в капельно, чтобы быстрее достичь терапевтической концентрации препарата в крови. Показаны бета-адреноблокаторы (могут сначала вводиться в/в, чаще сразу применяются перорально), при их непереносимости используют антагонисты кальция (верапамил, дильтиазем). В связи с тем что в патогенезе нестабильной стенокардии определенную роль играет тромбоз венечных артерий, лечение больного при обострении коронарной недостаточности включает применение антикоагулянтов. В момент болевого приступа, особенно тяжелого, требующего повторных инъекций наркотических анальгетиков, т. е. при непосредственной угрозе развития инфаркта миокарда, в/в струйно вводят гепарин, обычно в дозе 10 000 ЕД. Дальнейшее лечение антикоагулянтами проводится в стационаре при условии лабораторного контроля за состоянием свертывающей системы крови. Показано, что прием малых доз аспирина при нестабильной стенокардии уменьшает риск развития инфаркта миокарда.
Проводится также лечение сопутствующих заболеваний – артериальной гипертензии, заболеваний органов пищеварения и др.
Прогноз при отсутствии осложнений сравнительно благоприятный. Трудоспособность сохраняется, но с ограничением работ, требующих значительных физических усилий.
ЭНДОКАРДИТ – воспаление клапанного или пристеночного эндокарда при ревматизме, реже при инфекции, в том числе септической и грибковой, при системных заболеваниях соединительной ткани, интоксикациях (уремия).
Инфекционный (септический) эндокардит септическое заболевание с локализацией основного очага инфекции на клапанах сердца, пристеночном эндокарде, реже – на эндотелии аорты и крупных сосудов. Подострый инфекционный эндокардит диагностируется, если заболевание продолжается более 6–8 нед.
Этиология. Чаще возбудителями болезни являются стрептококки (зеленящий, золотистый, белый) или стафилококки, реже грамотрицательные бактерии (кишечная, синегнойная палочки, протей и др.), пневмококки, грибы, L-формы бактерий и др.
Патогенез. Источником бактериемии могут быть гнойные отиты, гаймориты, синуситы, хроническая инфекция мочевыводящих путей (циститы, уретриты), операции в полости рта (тонзиллэктомия, экстракция кариозных зубов) и др. Циркуляция микробов в крови приводит к поражению клапанов сердца при ослаблении резистентности организма. Значительно чаще поражаются измененные клапаны при приобретенных и врожденных пороках сердца, клапанные протезы. Извращение иммунологических реакций, образование иммунных комплексов и отложение их в тканях обусловливает поражение различных органов и систем (сосудов, миокарда, почек, печени, нервной системы, селезенки и др.). Эмболические осложнения в результате отрыва фрагментов вегетаций приводят к развитию инфарктов селезенки, почек, миокарда, головного мозга, мезентериального тромбоза и др.
Симптомы, течение. Клиническая симптоматика, как правило, возникает через 2 нед после развития бактеремии. Характерны лихорадка неправильного типа, нередко с ознобом и потом, признаки интоксикации – боли в суставах, мышцах, головная боль, быстрая утомляемость, анорексия, прогрессирующее похудание. Следует учитывать, однако, что инфекционный эндокардит может протекать и без высокой лихорадки, особенно у пожилых, ослабленных пациентов, при застойной сердечной, печеночной, почечной недостаточности. Повторная (каждые 3 ч) термометрия помогает выявить редкие подъемы температуры, возникающие в определенное время («свечи» Яновского).
Нередко выявляется бледность кожных покровов и слизистых оболочек; характерный цвет «кофе с молоком» встречается в последние годы не часто. К периферическим симптомам инфекционного эндокардита относят геморрагические высыпания на коже, слизистых оболочках, переходной складке конъюнктивы (симптом Лукина), плотные болезненные гиперемированные узелки в подкожной клетчатке пальцев кистей или на возвышении большого пальца ладоней (узелки Ослера), мелкие эритематозные высыпания на ладонях и подошвах (повреждения Джейнуэя), округлые или овальные геморрагические высыпания с бледным центром на глазном дне (пятна Рота); в настоящее время эти признаки встречаются сравнительно нечасто. При длительном течении заболевания на фоне хронической интоксикации и гипоксии формируются барабанные пальцы и часовые стекла. Признаки поражения опорно-двигательного аппарата включают распространенные артралгии, миалгии.
При первичном эндокардите, развившемся на интактных клапанах, вначале может выслушиваться систолический шум по левому краю грудины вследствие образования вегетаций на полулунных клапанах. В дальнейшем, при формировании аортальной недостаточности, на аорте начинает выслушиваться диастолический шум, усиливающийся при наклоне пациента вперед; диастолическое давление снижается. В последние годы при инфекционном эндокардите все чаще наблюдается митральная недостаточность. При первичном поражении митрального клапана на верхушке появляется систолический шум, быстро нарастающий по интенсивности и распространенности. При инфицировании венозной системы (например, у наркоманов, при инфицировании постоянных венозных катетеров) возможно образование вегетаций на трикуспидальном клапане, клапанах легочного ствола с развитием инфарктов легких. Осложнения: формирование порока сердца, разрыв клапанов, прогрессирующая сердечная недостаточность; возможно развитие инфаркта миокарда в результате эмболий в коронарные артерии.
При вторичном эндокардите изменяются характер и локализация имевшихся ранее шумов вследствие прогрессирующей деформации клапанов или формирования нового порока. При поражении миокарда нарастает дилатация полостей сердца, глухость тонов, появляются аритмии, нарушения проводимости, признаки сердечной недостаточности. Возможно также развитие абсцессов в надклапанном и подклапанном пространстве, перикардита.
Часто отмечаются увеличение печени, легкая желтуха, увеличение селезенки. Могут наблюдаться нарушение функции почек вследствие развития гломерулонефрита или эмболических инфарктов почек (гематурия, протеинурия, азотемия). Возможно поражение ЦНС (нарушение мозгового кровообращения, менингит, абсцесс головного мозга). Возможны и другие осложнения.
Лабораторные данные: гипохромная анемия, умеренная лейкопения и сдвиг лейкоцитарной формулы влево, значительное увеличение СОЭ (30–50 мм/ч и более), гипергаммаглобулинемия. В посевах крови, проводимых многократно до применения антибиотиков, у многих больных удается обнаружить возбудителя эндокардита и определить его чувствительность к антибиотикам. Помогает диагностике эхокардиография, позволяющая выявить вегетации на клапанах и хордах, повреждения клапанов, миокардиальные абсцессы, а также оценить наличие, выраженность и динамику клапанной регургитации.
Острый инфекционный эндокардит рассматривается как осложнение сепсиса, по этиологии, патогенезу и клинике такая форма заболевания существенно не отличается от подострой формы. Характерно более острое течение (заболевание длится до 6 нед от появления первых симптомов), быстрое формирование деструкции и перфорации створок клапанов, множественные тромбоэмболии, прогрессирующая сердечная недостаточность.
Лечение инфекционного эндокардита должно быть ранним и этиотропным с учетом бактериологических данных. Применяют бактерицидные антибиотики, желательно в индивидуализированных дозах в зависимости от концентрации антибиотика в крови и чувствительности к нему возбудителя. При неизвестном возбудителе лечение начинают с применения высоких доз бензилпенициллина в/м или в/в до 18–20 млн ЕД и более в сочетании с гентамицином 80 мг в/в 2 раза в сутки. При отсутствии эффекта или после бактериологического уточнения назначают полусинтетические пенициллины (оксациллин или ампициллин в/м до 12 г/сут), цефалоспорины (например, кефзол до 8-10 г в/в и др.). При аллергии к пенициллинам с самого начала используют цефалоспорины (с осторожностью ввиду возможности перекрестных аллергических реакций). Антибиотикотерапия может быть пересмотрена после выявления возбудителя эндокардита и определения его чувствительности к антибиотикам. Продолжительность антибактериальной терапии определяется состоянием больного и должна быть не менее 4–6 нед; преждевременное прекращение терапии или неоправданное снижение дозы антибиотиков может способствовать возникновению рецидивов болезни и формированию рефрактерности микробного возбудителя к антибиотикам.
При сниженной иммунореактивности организма антибактериальные средства комбинируют с пассивной иммунотерапией (при стафилококковом эндокардите – с антистафилококковой плазмой или антистафилоккоковым гамма-глобулином), с применением иммуномодуляторов (Т-активин и др.). При возникновении осложнений, связанных с гиперсенсибилизацией (диффузный гломерулонефрит, васкулит, миокардит и др.), оправданно сочетание антибактериальных средств с короткими курсами терапии глюкокортикоидами в средних дозах (преднизолон 15–30 мг/сут).
Инфекционный эндокардит можно считать излеченным, если в течение 2 мес после прекращения антибиотикотерапии сохраняется нормальная температура тела, нет лабораторных признаков воспаления, повторные посевы крови стерильны. При неэффективности антибиотикотерапии в течение 3 нед, а также при рефрактерной сердечной недостаточности, повторных тромбоэмболиях, при развитии абсцесса миокарда или клапанного кольца показано хирургическое удаление пораженного клапана с последующим протезированием его. Активный инфекционный эндокардит не является противопоказанием к оперативному лечению.
Прогноз всегда серьезный, однако при длительной и упорной терапии в значительной части случаев наступает выздоровление и восстановление трудоспособности.
Профилактика: своевременная санация хронических очагов инфекции в полости рта, миндалинах, носоглотке, околоносовых пазухах и др., активная антибактериальная терапия острых стрептококковых и стафилококковых заболеваний (ангины и др.). Закаливание организма. Предупредительная рациональная антибактериальная профилактика (короткими курсами) у больных с пороками сердца при возникновении интеркуррентных заболеваний, при проведении оперативных вмешательств и инвазивных инструментальных исследований (катетеризация сердца, почек и др.). Диспансерное наблюдение лиц, перенесших острые стрептококковые, стафилококковые инфекции.






