Глава 6. СИНДРОМ ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЕРТЫВАНИЯ КРОВИ (ДВС-СИНДРОМ)
Диссеминированное внутрисосудистое свертывание крови представляет собой один из самых распространенных патологических процессов, развертывающихся в организме при его тяжелых повреждениях. Острая массивная кровопотеря любого происхождения, любое обширное повреждение тканей, любая тяжелая инфекция могут привести к падению артериального давления или выбросу в кровь больших количеств тканевого тромбопластина. Как только произойдет остановка кровотока, немедленно начинается процесс тромбообразования. При местной остановке кровотока происходит местный тромбоз, а при шоке, когда периферический кровоток останавливается повсеместно, развивается диссеминированное внутрисосудистое свертывание крови – ДВС-синдром. Он обязательно сопровождается развитием полиорганной патологии. Именно полиорганная недостаточность, возникающая на фоне тяжелых заболеваний, повреждений, позволяет врачу, даже лишенному какой-либо лабораторной помощи, с большой долей вероятности подозревать развитие ДВС-синдрома и, главное, проводить необходимые трансфузиологические лечебные действия.
Этиология и патогенез. В норме в сосудах постоянно происходят два противоположных, но уравновешенных процесса: пристеночное микротромбирование и растворение (фибринолиз) образующихся сгустков. Свертывание крови и фибринолиз регулируются естественными антикоагулянтами и антипротеазами (антитромбином III, кофактором гепарина II, ингибитором внешнего пути активации свертывания крови, протеинами S и С, С1-ингибитором, ?1-антитрипсином, ?2-макроглоблулином, ?2-антиплазмином, ингибитором тканевого активатора плазминогена).
При повреждении сосудистой стенки процесс свертывания крови локализован и ограничен. Он протекает в следующей последовательности: повреждение – кровотечение – тромбоз – фибринолиз – элиминация мишеней фагоцитоза (продукты деградации фибрина, осколки клеточных мембран и др.) – заживление – восстановление целостности и сосудистой стенки и жизнеспособности сосуда.
При чрезмерно большом поступлении в кровоток активаторов свертывания крови (в большинстве случаев – тканевого тромбопластина) равновесие между тромбообразованием и фибринолизом нарушается. Активируется свертывание крови. Процесс микротромбирования становится диссеминированным, не связанным непосредственно с местом повреждения тканей, развивается гиперкоагуляционная фаза ДВС-синдрома. В это время взятая в пробирку кровь быстро свертывается, но образуется рыхлый, легко сокращающийся сгусток. В картине болезни – только общая тяжесть состояния и полиорганная патология. Если диссеминированное микротромбирование не будет остановлено переливанием свежезамороженной плазмы, гепарином, процесс приведет к истощению факторов свертывания, возникнет геморрагический синдром, появятся петехии на коже, кровотечение из раневой поверхности. При этом кровь в пробирке, на простыне не свертывается. Описанная картина свидетельствует о переходе гиперкоагуляционной фазы ДВС-синдрома в гипокоагуляционную, требующую немедленного восполнения истощенных факторов свертывания – переливания свежезамороженной плазмы (СЗП), тромбоцитов и, как правило, проведения ряда реанимационных мероприятий.
Способствует развитию ДВС-синдрома целый ряд патологических состояний: выброс тканевых факторов (активируют внешний путь свертывания); акушерская патология: преждевременная отслойка, разрывы плаценты, эмболия околоплодными водами, антенатальная гибель плода, плодоразрушающие операции, кесарево сечение, пузырный занос, аборт во II триместре беременности; внутрисосудистый гемолиз, несовместимые трансфузии компонентов крови, отравление гемолитическими ядами, гемолитико-уремический синдром; онкологические заболевания: муцинпродуцирующие аденокарциномы, диссеминированные формы рака, острый промиелоцитарный лейкоз; массивные повреждения тканей – ожоги, отморожения, электротравма, синдром длительного сдавливания, огнестрельные ранения, переломы трубчатых костей, осложненные жировой эмболией, оперативные вмешательства, связанные с массивным повреждением тканей, острые и подострые воспалительно-деструктивные процессы: панкреонекроз, перитонит. Предрасполагают к развитию ДВС-синдрома: повреждение эндотелия сосудов (запускает внутренний механизм свертывания), аневризма аорты, ангиоматоз, прогрессирующий атеросклероз сосудов, васкулиты. Развитию ДВС-синдрома могут способствовать тяжелые инфекции: продукты жизнедеятельности микроорганизмов, а также воспалительные изменения органов, выброс медиаторов воспаления активируют тканевые факторы свертывания. Сепсис сам по себе является сочетанием генерализованной инфекции и ДВС-синдрома.
Хронический ДВС-синдром развивается при умеренной, но продолжительной активации гемостаза. При этом регуляторные механизмы работают на пределе своих возможностей и при небольшой дополнительной нагрузке возможен их срыв. Тогда хронический ДВС-синдром переходит в острый. Хронический ДВС-синдром характерен для больных злокачественными опухолями, иммунокомплексной патологией, коллагенозами, хроническими воспалительными процессами. Граница между острым и хроническим ДВСсиндромом нечеткая, нередко эти процессы сменяют друг друга. Определяет остроту течения ДВС-синдрома динамика основного заболевания.
Хронический ДВС-синдром надо отличать от гиперкоагуляционного синдрома, который способствует развитию ДВС-синдрома, но принципиально отличается от него как патогенетически, так и по клиническим и лабораторным данным. Гиперкоагуляционный синдром есть повышенная готовность к свертыванию крови, компенсированная противосвертывающими механизмами. Поэтому при нем нет ни локальных, ни диссеминированных тромбов в сосудистой системе, в то же время быстро формируется сгусток крови в пробирке, при этом он рыхлый, укорочено время свертывания крови по Ли – Уайту, повышены агрегационные показатели тромбоцитов в ответ на добавление различных агонистов (ристоцетин, АДФ, коллаген, арахидоновая кислота), удлинен фибринолиз. Самочувствие при гиперкоагуляционном синдроме чаще всего может оставаться хорошим, хотя иногда появляются некоторые отклонения: «тяжесть в голове» и головные боли, быстрая утомляемость, кровь при взятии из вены сворачивается в игле; в местах пункции вены легко тромбируются – выходят «из строя». Причинами формирования и поддержания в определенных временных рамках гиперкоагуляционного синдрома являются, с одной стороны, стимуляция и активация механизмов, направленных на усиление свертывания крови, а с другой стороны, активация противосвертывающих систем.
По патофизиологическим механизмам и патогенетическим особенностям в гиперкоагуляционном синдроме можно выделить ряд основных форм: а) гиперкоагуляционный синдром при полиглобулии характеризуется наличием избытка клеток в циркуляторном русле (эритроцитозы и гипертромбоцитозы), что приводит к стазам крови преимущественно в системе микроциркуляции; дальнейшее сгущение крови, например спровоцированное диуретиками, может привести к тромбозам и ДВС-синдрому; б) гиперкоагуляционный синдром при гематогенных тромбофилиях, т. е. при определенных дефектах клеточных и плазменных элементов свертывания крови, может наблюдаться при дефиците AT III, аномалии системы протеина С, мутантном V факторе Leiden, гипергомоцистеинемии, мутантном протромбине 20210A, наличии волчаночного антикоагулянта – аутоантител к фосфолипидам, синдроме «липких тромбоцитов», резком повышении уровня фактора Виллебранда и активности VIII фактора; в) гиперкоагуляционный синдром при травматизации или нарушении целостности сосудистой стенки сопровождается формированием тромба, однако он строго локализован, и в системе гемостаза при этом может наблюдаться развитие гиперкоагуляционного синдрома, а не только активный местный тромбоз; именно поэтому в этой группе больных может осуществляться быстрый переход гиперкоагуляционного синдрома через короткую фазу гиперкоагуляции диссеминированного внутрисосудистого свертывания в гипокоагуляционную фазу ДВС-синдрома; кроме того, при наличии длительного локального кровотечения, развивающегося при неполноценной остановке кровоточивости – неполноценном тромбозе (язвенная болезнь желудка и двенадцатиперстной кишки, неспецифический язвенный колит и другие формы патологии), «зияющие сосуды» с кровоточивостью всегда будут сопровождаться гиперкоагуляционным синдромом и, как следствие, при этих формах патологии легко осуществляется переход гиперкоагуляционного синдрома в острый ДВС-синдром; г) гиперкоагуляционный синдром вследствие изменений гемостаза при различного рода тромбоцитопенических состояниях (апластическая анемия); д) гиперкоагуляционный синдром при опухолях, которые, являясь по площади поражения небольшими, сопровождаются формированием выраженных признаков гиперкоагуляционнного синдрома вследствие клеточного распада и выброса в кровь тканевого тромбопластина.
Клиническая картина и диагностика. Клиническая картина складывается из симптомов основной патологии и синдрома диссеминированного внутрисосудистого свертывания. При остром течении гиперкоагуляционная фаза может быть затяжной, но может протекать быстро и в считаные минуты смениться гипокоагуляцией. При гиперкоагуляционной фазе острого ДВС-синдрома выявляется повышенное потребление факторов свертывания, тромбоцитов, адгезивных молекул (фибриногена, фибронектина), первичных антикоагулянтов-антипротеаз (антитромбина III, протеина С) и компонентов системы фибринолиза (плазминогена, тканевого активатора плазминогена и др.). Принципиальное отличие гиперкоагуляционного синдрома от гиперкоагуляционной фазы ДВС заключается в отсутствии признаков полиорганной патологии и потребления факторов свертывания; фибринолитическая активность снижена и повышена агрегация тромбоцитов, визуально образование сгустка крови в пробирке ускорено. Гипокоагуляционная фаза острого ДВС-синдрома характеризуется лабораторными маркерами потребления (сгусток в пробирке либо не образуется, либо он рыхлый и быстро растворяется). Выражен диффузный геморрагический диатез (кровоточивость гематомно-петехиального типа): появляются петехии и экхимозы в местах инъекций, наложения манжетки тонометра, в местах механического трения, кровотечение из операционной раны, метроррагии (при акушерскогинекологической патологии), носовое и желудочно-кишечное кровотечения, кровоизлияния в кожу, слизистые оболочки, паренхиматозные органы. В результате кровоизлияния в надпочечники возможно развитие острой надпочечниковой недостаточности.
При массивной кровопотере ДВС-синдром развивается вследствие уменьшения объема циркулирующей крови, падения артериального давления с последующим развитием стойкой гипотонии, гипоксии, появлением признаков полиорганной недостаточности и метаболического ацидоза. Организм отвечает на массивную кровопотерю спазмом периферических сосудов (развивается централизация кровообращения), выбросом в сосудистое русло эритроцитов из депо (селезенка, кожа, мышечные капилляры) и увеличением объема циркулирующей плазмы. Вследствие гемодилюции улучшается текучесть крови, снижается ее вязкость. Если при этом значительно уменьшается мышечная активность, то сокращается потребность организма в объеме циркулирующей крови и потребность в кислороде. Увеличиваются частота дыхания, сердечный выброс, улучшается отдача кислорода в тканях и его утилизация, происходит перераспределение органного кровотока, в результате которого доставка кислорода обеспечивается в «порядке важности»: сердце, легкие, головной мозг, печень, почки. Кроме того, очень часто острая массивная кровопотеря происходит у больных, исходно имеющих нарушения в системе свертывания, обусловленные наличием опухоли, инфекции, дефектов в клеточном или плазменном составе крови или сосудистой стенки. Нередко эти нарушения проявляются формированием гиперкоагуляционного синдрома, наличие которого определяет тяжесть течения синдрома острой массивной кровопотери, трансфузиологическую тактику ее восполнения и предупреждения развития острого ДВС-синдрома. Необходимо подчеркнуть, что причиной гибели больных при острой массивной кровопотере является не столько потеря кислородоносителя – гемоглобина, компенсируемая обездвиженностью и подключением кислорода в носовые катетеры, сколько развитие ДВС-синдрома. В табл. 7 приведены основные дифференциальнодиагностические признаки гиперкоагуляционного синдрома и обеих фаз ДВС-синдрома.
Дифференцировать гиперкоагуляционный синдром и гиперкоагуляционную фазу ДВС-синдрома можно клинически. Если у больного появляются признаки полиорганной патологии, даже не очень резко выраженные, – заторможенность, односложность и быстрая истощаемость в ответах на вопросы, глухость тонов сердца, участки бронхиального дыхания в легких, небольшое увеличение печени, снижение диуреза и появление протеинурии и цилиндрурии, снижение перистальтики кишечника, – все вместе взятое неопровержимо свидетельствует о развитии гиперкоагуляционной фазы синдрома ДВС крови. Эта фаза в отличие от гиперкоагуляционного синдрома является смертельно опасной патологией, которую необходимо интенсивно лечить прежде всего переливанием свежезамороженной плазмы.
Таблица 7. Признаки гиперкоагуляционного синдрома и различных фаз ДВС-синдрома
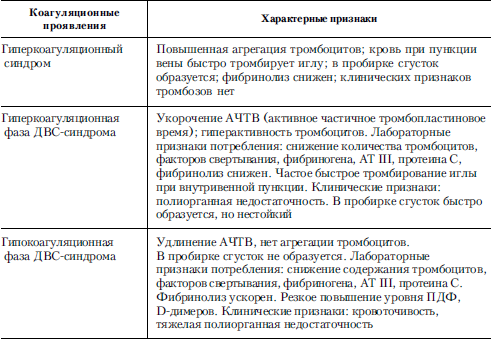
Следует еще раз подчеркнуть, что незамеченный вовремя гиперкоагуляционный синдром, который не имеет специфической клинической картины, очень быстро может перейти в гиперкоагуляционную фазу синдрома ДВС, а затем, в достаточно короткий срок, в гипокоагуляционную фазу ДВС-синдрома с ее неуправляемым потреблением в многочисленных микротромбах тромбоцитов, плазменных факторов свертывания, нарушением равновесного состояния между системами свертывания и фибринолиза, что клинически проявляется тотальной кровоточивостью и рецидивами органных кровотечений.
Лечение. При полиглобулии, характеризующейся наличием избытка эритроцитов и/или тромбоцитов в циркуляторном русле, проводится непосредственная терапия основного заболевания. При эритремии необходимо проводить эритроцитаферез. Гиперагрегабельность тромбоцитов требует назначения антиагрегантов (аспирин, тиклид, плавикс), при наличии гиперкоагуляции (укорочено АЧТВ, удлинение фибринолиза) проводят лечение низкомолекулярными гепаринами (фраксипарин, клексан или фрагмин). По показаниям (прогрессия опухолевого роста) назначаются цитостатики. При проведении эритроцитафереза пациенту вводится гепарин и назначаются антиагреганты (преимущественно аспирин).
При патологии иммунных комплексов эффективны антиагреганты, низкомолекулярные гепарины и различные варианты плазмафереза. При аутоиммунной агрессии (системная красная волчанка и др.) наряду с использованием стероидных гормонов эффективна терапия гепарином, антиагрегантами, плазмаферезом. Гиперкоагуляционный синдром при аутоиммунном веновенулите удается нивелировать путем сочетания внутривенного введения нефракционированного гепарина, антиагрегантов (тиклид или плавикс), стероидных гормонов (дексаметазона) и цитостатиков (винкристин, циклофосфан).
Гиперкоагуляционный синдром при атеросклеротическом повреждении сосудов (часто коронарных артерий) наряду с традиционной терапией ишемической болезни сердца (нитраты, (3-блокаторы, антагонисты кальция и др.) требует применения антиагрегантов (аспирин, тиклид, плавикс), иногда их комбинаций (аспирин + плавикс) в адекватных дозах. Исследование агрегационных показателей тромбоцитов должно показать заблокированность агрегации тромбоцитов (отсутствие второй волны агрегации и наличие феномена дезагрегации тромбоцитов). Кроме того, пациенты должны получать антикоагулянтную терапию; предпочтение отдается пероральным препаратам – синкумар (непрямой антикоагулянт) или сулодексид (комплекс глюкозаминог ликанов). При лечении антиагрегантами и антикоагулянтами необходимо добиться исчезновения признаков гиперкоагуляции (нормализация АЧТВ, тромбинового времени, протробиновый индекс должен быть снижен до 60–75 %).
Терапия гиперкоагуляционного синдрома при гематогенных тромбофилиях: при тромбозах на фоне дефицита антитромбина III назначают в/в введение очищенных препаратов антитромбина III, а при их отсутствии – большие объемы свежезамороженной плазмы (1–1,5 л); проводится терапия антиагрегантами и непрямыми антикоагулянтами (синкумар, кумадин); при дефиците протеина С показаны переливания больным препаратов протеина С. В терапии гиперкоагуляционного синдрома при гетерозиготном дефиците протеина С необходимо избегать назначения непрямых антикоагулянтов (синкумара, кумадина), так как они снижают концентрацию протеина С в крови и могут усилить тромбогенность. В этих ситуациях предпочтительно использовать низкомолекулярные гепарины, комбинации антиагрегантов (например, аспирин + тиклид или аспирин + плавикс). При наличии V фактора Leiden широко используют непрямые антикоагулянты.
Гипергомоцистеинемический гиперкоагуляционный синдром лечится небольшими дозами витаминов В12, В6, фолиевой кислоты. В терапии гиперкоагуляционного синдрома при антифосфолипидном синдроме и наличии аутоантител волчаночного типа предпочтение отдается аспирину, низкомолекулярным гепаринам и повторным процедурам лечебного плазмафереза. При синдроме «липких тромбоцитов» необходимо добиться блокады агрегации тромбоцитов. С этой целью применяют антиагреганты, часто их комбинации: аспирин + тиклид, аспирин + плавикс. При проведении агрегатометрии в целях контроля эффективности терапии необходимо зафиксировать феномен дезагрегации тромбоцитов в ответ на добавление ристоцетина и АДФ. При повышении уровня фактора VIII и фактора Виллебранда гиперкоагуляционный синдром купируется путем сочетания медикаментозных и экстракорпоральных методов терапии. Часто назначаются низкомолекулярные гепарины или непрямые антикоагулянты (синкумар, кумадин), антиагреганты в сочетании с обычными или селективными методами плазмафереза.
Гиперкоагуляционный синдром при травматизации и разрыве целостности сосудистой стенки в первую очередь требует остановки кровотечения и местного гемостаза. Так как этот тип гиперкоагуляционного синдрома легко переходит в гиперкоагуляционную фазу ДВС-синдрома, то в его терапии преимущество отдается внутривенным трансфузиям достаточных объемов свежезамороженной плазмы. Терапия гиперкоагуляционного синдрома при различных вариантах тромбоцитопений проводится дифференцированно, с учетом генеза тромбоцитопенического синдрома. При апластической анемии часто гиперкоагуляционный синдром не требует никакой коррекции. Однако при появлении кровоточивости или локальных кровотечений трансфузии концентрата тромбоцитов должны сочетаться с переливаниями свежезамороженной плазмы.
Гиперкоагуляционный синдром при опухолях отличается интенсивностью и устойчивостью к проводимой терапии. Зачастую прямые и непрямые антикоагулянты, антиагреганты дают слабый и кратковременный эффект. Этот вариант гиперкоагуляционного синдрома, как правило, купируется только после ликвидации опухолевого процесса в сочетании с антикоагулянтной и дезагрегантной терапией. Нередко таким пациентам показаны трансфузии свежезамороженной плазмы.
Гиперкоагуляционный синдром при гемолизе требует адекватной терапии гемолитического процесса (стероидные гормоны, цитостатики, спленэктомия и др.). Иногда определенной эффективностью обладают дезагреганты – курантил, трентал.
Поскольку гиперкоагуляционные синдромы могут длиться часы, дни, недели, месяцы и даже годы, продолжительность и варианты их терапии определяются в каждом конкретном случае индивидуально и иногда носят пожизненный характер. При выявлении ДВС-синдрома показан перевод больного в реанимационное отделение, при необходимости – подключение ИВЛ. Необходимо воздействовать на причины возникновения ДВС (антибактериальная терапия при сепсисе).
Коррекция гемостаза. В фазе гиперкоагуляции при отсутствии активного кровотечения вводят гепарин в/в медленно в изотоническом растворе хлорида натрия 1000 ЕД в час. Свежезамороженная плазма – минимум 1000 мл в/в быстрой инфузией под контролем центрального венозного давления. В стадии гипокоагуляции – трансфузии свежезамороженной плазмы 1000 мл и более до достижения нормокоагуляции, повторяя трансфузии каждые 6–8 ч. При геморрагическом синдроме, сочетающемся с тромбоцитопенией, показано введение тромбоцитной массы. При восстановлении объема крови физиологическим раствором следует опасаться перегрузки системы кровообращения, отека легкого. Коррекция газового состава крови: подача кислорода, введение растворов гидрокарбоната натрия. Для улучшения почечного кровотока при гипотонии – субинотропные дозы допамина; растворенный в 5 %-ном растворе глюкозы до 0,05 %-ной концентрации препарат вводят с начальной скоростью 1–5 мкг/кг/мин. При развитии почечной недостаточности – гемодиализ. Для снижения концентрации иммунных комплексов, продуктов фибринолиза, бактериальных токсинов показан плазмаферез.
Профилактика повторного возникновения ДВС состоит в ликвидации или предупреждении возникновения условий, которые провоцируют ДВС (лечение основного заболевания, введение гепарина при гиперкоагуляции, повторные трансфузии СЗП).
Лечение острой массивной кровопотери. Стратегическими принципами трансфузионной терапии острой массивной кровопотери, как правило сочетающейся с ДВС-синдромом, являются восстановление органного кровотока (перфузии) путем достижения необходимого объема циркулирующей крови, поддержание уровня факторов свертывания в количествах, достаточных для гемостаза, с одной стороны, и противостояния избыточному диссеминированному свертыванию – с другой, восполнение количества циркулирующих эритроцитов (переносчиков кислорода) до уровня, обеспечивающего минимально достаточное потребление кислорода в тканях. Используются солевые растворы, коллоиды (альбумин, препараты гидрооксиэтил-крахмала, желатины и декстраны), компоненты крови – СЗП, эритроциты, тромбоциты, криопреципитат.
Каждый переливаемый компонент крови решает свою специфическую задачу. Переливание СЗП необходимо для восполнения или предупреждения дефицита плазменных факторов свертывания при остром ДВС-синдроме – развившемся или неминуемо ожидаемом вследствие планируемой обширной операции. Эритроциты переливают при появлении признаков кислородной недостаточности (одышка, тахикардия). Тромбоциты назначают при необходимости восполнения развившейся тромбоцитопении потребления или дилюционной тромбоцитопении, когда их уровень нерезко снижен (менее 100 · 109/л), но их агрегационная способность нарушена из-за ДВС-синдрома и имеет место тромбоцитопеническая петехиальная кровоточивость.
Одной идеальной трансфузионной среды для решения всех задач, стоящих перед трансфузиологом, проводящим интенсивную терапию острой массивной кровопотери, не существует. Каждая среда имеет свой адрес. Тип и количество переливаемой жидкости определяется сочетанием многих факторов: тяжестью травмы или операции, длительностью кровотечения до достижения гемостаза, объемом кровопотери, наличием сопутствующих заболеваний, полом и возрастом пациентов, а также уровнем обеспеченности трансфузионными средами и местом проведения (догоспитальный или госпитальный этап). Переливание цельной крови в плановой хирургической деятельности в целях восполнения острой массивной кровопотери противопоказано из-за возможности углубления тяжести ДВС-синдрома, циркуляторной перегрузки, особенно у детей и лиц пожилого возраста. Цельная консервированная кровь, прошедшая весь необходимый предтрансфузионный контроль, переливается лишь в исключительных случаях – только при отсутствии у трансфузиолога эритроцитной массы.
Действия трансфузиолога во многом зависят от причины острой массивной кровопотери и исходного состояния пациента. Можно рекомендовать следующую принципиальную схему действий.
1. При наружном кровотечении осуществить временную остановку кровотечения сдавлением или наложением жгута. Следует помнить, что активное трансфузиологическое пособие до остановки кровотечения ухудшает прогноз.
2. Обеспечить адекватную подачу кислорода (интраназальные катетеры, масочная спонтанная или искусственная неинвазивная вентиляция, интубация трахеи и перевод на принудительную искусственную вентиляцию легких).
3. Пунктировать и катетеризировать вену, начав с локтевой вены. Взять кровь на исследование групповой принадлежности по эритроцитарным антигенам, общий клинический анализ (Hb, Ht, эритроциты, тромбоциты, лейкоциты, лейкоцитарная формула крови, в дальнейшем – ретикулоциты).
4. Отправить пробу крови на биохимическое исследование (креатинин, калий, натрий, хлориды, кислотно-основное состояние, общий белок, альбумин, билирубин, трансаминазы) и на коагулологическое исследование (протромбин, АЧТВ, тромбиновое время, фибриноген, время свертывания, в отдельную пробирку берется кровь для характеристики образующегося сгустка).
5. Приступить к переливанию солевого раствора в объеме 1–2 л со скоростью до 100 мл/мин до повышения АД и его стабилизации на уровне среднего артериального давления не ниже 60 мм рт. ст.
6. Катетеризировать мочевой пузырь.
7. При отсутствии стабилизации гемодинамики пунктировать и катетеризировать вторую вену, желательно центральную, для контроля центрального венозного давления (ЦВД) и получения второго венозного доступа, начав переливание коллоидных растворов (наиболее оптимально переливание СЗП).
8. При продолжающемся кровотечении, отсутствии стабилизации показателей гемодинамики, нарастающей бледности и появлении загруженности приступить к переливанию эритроцитов (при отсутствии одногруппных эритроцитов возможно переливание эритроцитов группы 0(I)Rh отрицательной, но не более 500 мл).
9. Предельно сократить время транспортировки больного в госпиталь.
10. Все растворы переливаются теплыми, необходимо поддерживать температуру тела пациента около 37 °C.
11. Критерием адекватности восполнения дефицита циркулирующей жидкости являются ЦВД и почасовой диурез. Пока ЦВД не достигнет 8-12 см вод. ст. и почасовой диурез не станет более 30 мл/ч, больной нуждается в проведении инфузионной терапии с достаточно высокой объемной скоростью введения (до 100 мл/мин), после достижения этих показателей можно переходить на более медленное переливание (20–40 мл/мин).
12. Соотношение объемов переливания СЗП и эритроцитов, если их назначение показано, должно составлять, как правило, 3:1. Адекватная доставка кислорода и обеспечение систолического АД на уровне 90 мм рт. ст. в условиях компенсированного ОЦК, отсутствия гипотермии и прекращения активного кровотечения позволяет уменьшить интенсивность трансфузионной терапии (при сохранении контроля за показателями гемодинамики, коагулограммы и транспорта кислорода).
13. Переливание концентрата тромбоцитов показано при снижении их уровня ниже 100 · 109/л, но только при появлении петехиальной кровоточивости (терапевтической дозой является переливание 4–6 доз концентрата тромбоцитов, возможно использование полидонорского концентрата тромбоцитов).
14. Если пациент до развития острой массивной кровопотери имел дефицит циркулирующих эритроцитов, плазмы, тромбоцитов или плазменных факторов свертывания, их восполнение надо начинать одновременно с переливанием солевых растворов, контролируя степень гемодилюции.
15. Периодический контроль показателей коагулограммы (1–2 раза в сутки), в том числе качественная оценка сгустка в пробирке, количества тромбоцитов (раз в сутки), концентрационных показателей красной крови (каждые 6–8 ч), ЭКГ-мониторинга, кислотно-основного состояния, транспорта кислорода и гемодинамики, необходим для корректировки трансфузионной терапии.
16. При переливании эритроцитной массы или СЗП со скоростью более 1-й дозы (200–250 мл) за 5 мин показано введение 5-10 мл 10 %-ного раствора хлорида кальция на каждые две дозы эритроцитной массы или СЗП для предупреждения цитратной интоксикации и гипокальциемии.
Течение и прогноз зависят от эффективности лечения основного заболевания, своевременности диагностики, своевременности и правильности лечения ДВС-синдрома. Причины смерти – острая почечная недостаточность; дыхательная недостаточность; кровоизлияние в головной мозг, надпочечники; острая кровопотеря, приводящая к развитию шока.






