Глава 1. ОСНОВЫ АНТИБАКТЕРИАЛЬНОЙ ХИМИОТЕРАПИИ
В современной химиотерапии бактериальных инфекций ведущее место занимают антибиотики, их полусинтетические и синтетические аналоги и производные, синтетические лекарственные средства (сульфаниламиды, хинолоны и др.); ограниченно применяют также препараты из лекарственных растений и животных тканей.
АНТИБИОТИКИ. Группа антибиотиков объединяет химиотерапевтические вещества, образующиеся при биосинтезе микроорганизмов, их производные и аналоги, вещества, полученные путем химического синтеза или выделенные из природных источников (ткани животных и растений), обладающие способностью избирательно подавлять в организме возбудителей заболеваний (бактерии, грибы, простейшие, вирусы) или задерживать развитие злокачественных новообразований. Помимо прямого действия на возбудителей заболеваний, многие антибиотики оказывают иммуномодулирующий эффект. Например, циклоспорин обладает выраженной способностью подавлять иммунитет, что используется при трансплантации органов и тканей, лечении аутоиммунных заболеваний.
В настоящее время в России применяют около 200 антибиотиков, относящихся к 30 различным группам. Наиболее широко используют беталактамы (пенициллины, цефалоспорины, карбапенемы, монобактамы), аминогликозиды (гентамицин, тобрамицин, амикацин и др.), хинолоны и фторхинолоны, макролиды (эритромицин, олеандомицин и др.), линкосамиды (линкомицин, клиндамицин), гликопептиды (ванкомицин), ансамакролиды (рифампицин), тетрациклины (тетрациклин, доксициклин) и др.
Путем химической и микробиологической трансформации созданы так называемые полусинтетические антибиотики, обладающие такими ценными свойствами, как кислото– и ферментоустойчивость, расширенный спектр антимикробного действия, лучшее распределение в тканях и жидкостях организма, меньшее число побочных эффектов.
По типу антимикробного действия антибиотики разделяют на бактериостатические и бактерицидные. Бактерицидные антибиотики необратимо подавляют рост микроорганизмов, действуя на пролиферирующую клетку (бета-лактамы, рифампицин) или на клетку в покое (аминогликозиды, полимиксины). Антибиотики бактериостатического действия (тетрациклины, левомицетин, макролиды, линкомицин) только временно останавливают рост бактерий, а эрадикация (удаление из организма) микробов осуществляется за счет иммунной системы макроорганизма. Это разделение имеет практическое значение при выборе наиболее эффективного средства терапии. Например, при нарушениях иммунитета, тяжелых септических процессах обязательно применение антибиотиков с выраженным бактерицидным типом действия.
Значение механизма действия антибиотиков на клеточном и молекулярном уровнях позволяет судить не только о направленности химиотерапевтического эффекта («мишень»), но и о степени его специфичности. Так, например, бета-лактамы (пенициллины, цефалоспорины) воздействуют на специфические белки клеточной стенки бактерий, отсутствующие у животных и человека. Поэтому избирательность действия бета-лактамов является их уникальным свойством, определяющим высокий химиотерапевтический индекс (выраженный разрыв между лечебными и токсическими дозами) и низкий уровень токсичности, что позволяет вводить эти препараты в больших дозах без опасности развития побочных эффектов.
При сравнительном анализе антибиотиков их оценивают по показателям эффективности и безвредности, определяемым выраженностью антимикробного действия в организме, скоростью развития устойчивости у микроорганизмов в процессе лечения, отсутствием перекрестной устойчивости по отношению к другим химиопрепаратам, степенью проникновения в очаги поражения, созданием терапевтических концентраций в тканях и жидкостях больного и продолжительностью их поддержания, сохранением действия в различных условиях среды. Важными свойствами являются также стабильность при хранении, удобство применения при разных методах введения, высокий химиотерапевтический индекс, отсутствие или слабая выраженность токсических побочных явлений, а также аллергизации больного.
Лечебное действие антибиотика определяется активностью в отношении возбудителя заболевания. При этом антибиотикотерапия в каждом случае является компромиссом между опасностью развития побочных реакций и ожидаемым терапевтическим эффектом.
Спектр антибактериального действия – основная характеристика при выборе антибиотика, наиболее эффективного в конкретной клинической ситуации. По спектру противомикробного действия различают антибиотики, действующие преимущественно на грамположительную микрофлору (бензилпенициллины, макролиды, ванкомицин), на грамположительную и грамотрицательную микрофлору (полусинтетические пенициллины, цефалоспорины, фторхинолоны, карбапенемы), преимущественно на грамотрицательную микрофлору (аминогликозиды, полимиксины); противогрибковые антибиотики (амфотерицин, нистатин). Это разделение достаточно условно, поскольку в результате приобретенной резистентности многие антибиотики широкого спектра действия утратили активность в отношении ряда микроорганизмов, например тетрациклины в настоящее время малоэффективны в отношении пневмо-, стафило– и гонококков, энтеробактерий. При тяжелом течении заболеваний антибиотикотерапию обычно начинают и проводят до выделения возбудителя и определения его чувствительности к антибиотикам (антибиотикограмма). Для эмпирической антибиотикотерапии выбирают препарат, наиболее эффективный при инфекции определенной органной локализации. После уточнения микробиологического диагноза первоначальную терапию корректируют с учетом свойств антибиотиков и антибиотикограммы выделенного возбудителя.
В большинстве случаев врач стоит перед необходимостью выбора оптимального препарата из числа средств, близких по спектру действия. Например, при инфекциях, вызываемых пневмококками (пневмония, менингит и др.), возможно применение ряда антибактериальных препаратов (пенициллины, макролиды, тетрациклины, сульфаниламиды и др.). В таких случаях необходимо привлекать дополнительные характеристики антибиотика для обоснования целесообразности выбора (переносимость, степень проникновения в очаг инфекции через клеточные и тканевые барьеры, наличие или отсутствие перекрестной аллергии и др.). При тяжелом течении инфекции в начальной стадии заболевания предпочтение всегда следует отдавать антибиотикам, действующим бактерицидно (пенициллины, цефалоспорины, аминогликозиды); бактериостатики (тетрациклины, левомицетин, макролиды, сульфаниламиды и др.) следует применять лишь в стадии долечивания или при среднетяжелом течении заболевания. В зависимости от особенностей течения заболевания (степень тяжести, острое или хроническое течение), переносимости антибиотика, вида возбудителя и его антибиотикочувствительности назначают препараты первой очереди или второй очереди (альтернативные). Перечень основных антибиотиков, эффективных при инфекционных воспалительных заболеваниях, суточные дозы для взрослых и детей, способы введения этих препаратов приведены в табл. 1, рекомендуемые комбинации антибиотиков – в табл. 2.
Таблица 1. Суточные дозы и способы введения антибиотиков1
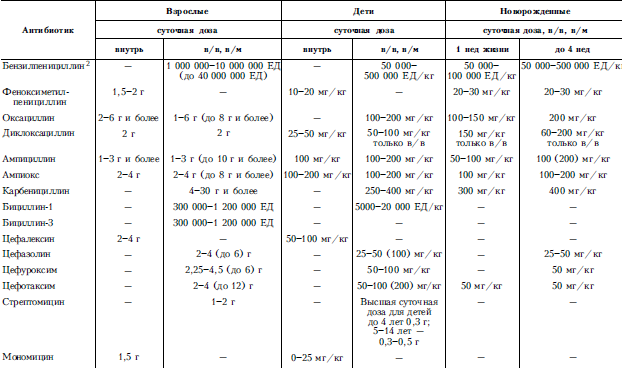
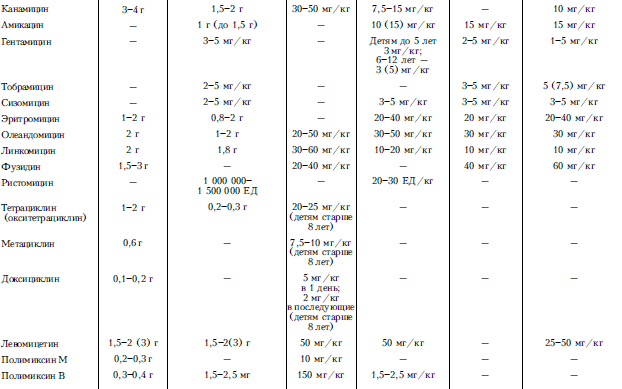
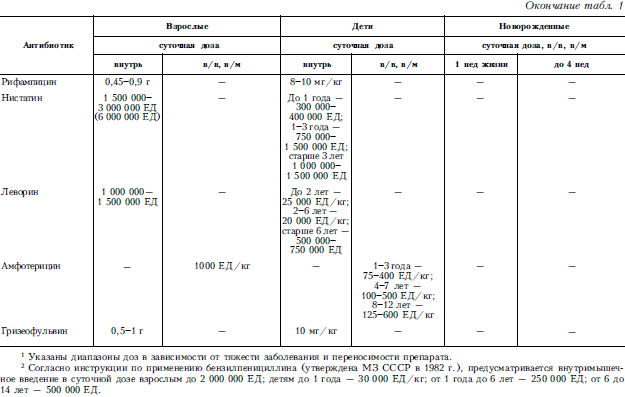
Задачей антибиотикотерапии является достижение терапевтической концентрации препарата в крови и тканях и поддержание ее на необходимом уровне. Эффективные концентрации в очаге инфекции обеспечиваются не только применением препарата в терапевтической дозе, но и способом введения (внутрь, парентерально, местно и т. д.). В процессе терапии возможна последовательная смена способов введения, например внутривенно, а затем внутрь, а также сочетание местного и общего назначения антибиотиков. При тяжелом течении заболевания антибиотики назначают парентерально, что обеспечивает быстрое проникновение препарата в кровь и ткани.
В группу бета-лактамных антибиотиков (бета-лактамов) входят пенициллины, цефалоспорины, карбапенемы и монобактамы. Общим фрагментом в химической структуре бета-лактамных антибиотиков является бета-лактамное кольцо, позволяющее этим препаратам инактивировать ферменты, участвующие в синтезе наружной мембраны микроорганизмов. Антибиотики этой группы обладают бактерицидным типом действия, высокой активностью в отношении прежде всего грамположительных бактерий, быстрым наступлением антибактериального эффекта и преимущественным влиянием на бактерии в стадии пролиферации. Бета-лактамы способны проникать в клетку и воздействовать на находящихся внутри нее возбудителей; в процессе лечения к ним медленно развивается устойчивость микроорганизмов. Бета-лактамные антибиотики имеют низкую токсичность и хорошо переносятся даже при длительном применении в больших дозах.
Пенициллины. Пенициллинам свойственны высокая химиотерапевтическая эффективность и избирательность антимикробного эффекта. Действие направлено на «мишени» в клетках микроорганизмов, отсутствующие у животных клеток; эффект этих антибиотиков высокоизбирательный, что приближает их к идеальным препаратам. Антимикробный эффект пенициллинов сходен с действием физиологически активных веществ, обеспечивающих иммунные реакции организма, например лизоцима.
К недостаткам пенициллинов следует отнести возможность сенсибилизации и развития аллергических реакций, быстрое выведение из организма, преимущественный эффект лишь в стадии деления микробной клетки. Благодаря созданию полусинтетических пенициллинов сохранены положительные качества природного антибиотика и приобретены существенные преимущества по спектру действия, фармакокинетике и другим важным для практики свойствам.
Пенициллины включают следующие основные группы: 1) биосинтетические (бензилпенициллин, его соли и эфиры, феноксиметилпенициллин); 2) полу синтетические: а) активные преимущественно в отношении грамположительных бактерий (оксациллин и др.); б) широкого спектра действия (ампициллин, амоксициллин, карбенициллин, тикарциллин, азлоциллин, мезлоциллин, пиперациллин и др.).
Таблица 2. Рекомендуемые комбинации антибиотиков1

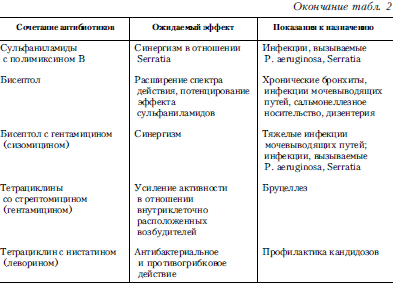
Биосинтетические пенициллины.
Бензилпенициллин и феноксиметилпенициллин обладают практически однозначной антибактериальной активностью. Преимуществом феноксиметилпенициллина является возможность приема внутрь, что обусловлено его устойчивостью в кислой среде желудка.
Природные пенициллины назначают главным образом при стрептококковых инфекциях – при лечении ангины, рожи, скарлатины, инфекций мягких тканей, а также внебольничной пневмонии, сепсиса, раневых инфекций, подострого септического эндокардита (в сочетании с гентамицином), отита, острого и хронического остеомиелита, сифилиса, гонореи, инфекций почек и мочевыводящих путей, при лечении инфекций в акушерско-гинекологической практике, в клинике болезней уха, горла и носа, глазных инфекций. Пенициллин является наиболее широко показанным антибиотиком в лечении детей различных возрастных групп.
Несмотря на широкое распространение устойчивых микроорганизмов, природные пенициллины остаются антибиотиками выбора при лечении инфекций, вызываемых чувствительными штаммами стафило-, пневмо-, стрептококков и других возбудителей. Пенициллины рекомендуют назначать без определения антибиотикограммы при скарлатине, роже, карбункуле, сифилисе. Подтверждение чувствительности возбудителя обязательно при менингите, эндокардите, сепсисе и других тяжело протекающих гнойных процессах и крайне желательно при заболеваниях легких и дыхательного тракта, мочевыводящих путей.
Пенициллины длительного действия называют депопенициллинами. Из них наибольшее значение имеют бензатинпенициллины (бициллины); применяют также новокаиновые (прокаиновые) соли. Бициллины обеспечивают длительную концентрацию антибиотика в крови, однако на низком уровне. Наибольшая продолжительность обнаружения депопенициллинов в сыворотке крови – 10–14 сут после однократного введения; предложены сочетания различных солей и производных пенициллина, обеспечивающих высокую концентрацию антибиотика в течение первых суток после введения, а затем – длительное ее поддержание на низком уровне. Бициллины находят наиболее широкое применение при профилактике ревматизма, терапии сифилиса по соответствующим схемам. Специфические побочные эффекты – местные инфильтраты, сосудистые осложнения при случайном введении препарата в артерию или вену.
Пенициллиназоустойчивые полусинтетические (антистафилококковые) пенициллины – в частности, оксациллин – по спектру и механизму антимикробного действия и низкой токсичности близки к бензилпенициллину, однако в отличие от него активны в отношении пенициллиназообразующих стафилококков. Оксациллин и другие полу синтетические пенициллины эффективны при лечении тяжелых инфекций различной локализации, вызванных множественно-устойчивыми стафилококками (инфекции кожи, мягких тканей, пневмония, инфекционный эндокардит, менингит, сепсис). Устойчивые к оксациллину штаммы стафилококка (метициллинорезистентные штаммы – по названию первого антистафилококкового пенициллина – метициллина) устойчивы и к другим пенициллинам, цефалоспоринам, карбапенемам, макролидам и многим другим антибиотикам.
Полусинтетические пенициллины широкого спектра действия – ампициллин, амоксициллин – существенно расширяют возможности лечения процессов, вызванных грамотрицательными возбудителями, устойчивыми к таким традиционным антибиотикам, как тетрациклины, левомицетин, стрептомицин и др.
Ампициллин менее, чем бензилпенициллин, активен в отношении грамположительных кокков (стафило-, пневмо-, стрептококки). К ампициллину чувствительны большинство менингококков и гонококков. Антибиотик высокоактивен в отношении многих грамотрицательных бактерий (протей, сальмонеллы, шигеллы, многие штаммы кишечной и гемофильной палочек, клебсиелл). Однако ампициллин, как и бензилпенициллин, разрушается беталактамазой и поэтому неэффективен при инфекциях, вызванных пенициллиназообразующими штаммами стафилококков, грамотрицательных бактерий (кишечные палочки, протей, клебсиеллы, энтеробактер). Синегнойные палочки устойчивы к ампициллину.
Ампициллин кислотоустойчив и поэтому активен как при приеме внутрь, так и при парентеральном введении. В то же время его биодоступность при приеме внутрь невелика (20–40 %), поэтому препарат применяется главным образом парентерально при неосложненных внебольничных инфекциях дыхательных, мочевых, желчных путей, в комбинации с аминогликозидами – при сепсисе, эндокардите, менингите. Расширенный антимикробный спектр действия ампициллина и антистафилококковая активность оксациллина использованы в комбинированном препарате ампициллин/оксациллин (ампиокс).
Амоксициллин – аналог ампициллина со схожим спектром антимикробного действия. Более эффективен в отношении пневмококков, активен при инфицировании Helicobacter pylori. Устойчив в кислой среде, эффективен при приеме внутрь. Применяется при заболеваниях дыхательных путей (острый бронхит, внебольничная пневмония), мочевыводящих путей (острый цистит, пиелонефрит), некоторых кишечных инфекциях (брюшной тиф, сальмонеллез), при стоматологических вмешательствах, для профилактики инфекционного эндокардита, а также для эрадикации Helicobacter pylori при язвенной болезни желудка и двенадцатиперстной кишки.
Эффективность антибиотиков, содержащих бета-лактамное кольцо, существенно повышается при использовании их в комбинации с ингибиторами бета-лактамаз (клавулановой кислотой, сульбактамом) – препаратами, блокирующими выработку микроорганизмами ферментов, разрушающих беталактамное кольцо. Комбинированные препараты амоксициллин/клавуланат, ампициллин/сульбактам имеют более широкий спектр действия и применяются главным образом при лечении острых и хронических внебольничных инфекций дыхательных путей, мочевыводящих путей, а также при инфекциях кожи и мягких тканей, костей, суставов, органов брюшной полости, малого таза и др.
Карбоксипенициллины (карбенициллин, тикарциллин) обладают более широким антимикробным спектром, чем ампициллин; они действуют на синегнойные палочки, индолположительные штаммы протеев, серратии. Однако они менее активны, чем ампициллин, в отношении кишечных палочек, клебсиелл и стафилококков. Карбенициллин чувствителен к действию кислоты желудочного сока и его вводят лишь парентерально (в/в или в/м). Имеются производные карбенициллина для приема внутрь (карфециллин), которые обеспечивают меньшие концентрации в крови, чем при парентеральном введении, и применяются при инфекциях средней тяжести (в основном при поражении мочевыводящих путей). Возможные побочные эффекты карбоксипенициллинов: гипернатриемия, гипокалиемия, кровоточивость. В настоящее время карбоксипенициллины в комбинации с аминогликозидами или фторхинолонами применяются главным образом при внутрибольничных инфекциях, вызванных чувствительными штаммами синегнойной палочки. Эффективность карбоксипенициллинов повышается при комбинировании их с ингибиторами бета-лактамаз, примером может служить ингибиторзащищенный препарат тикарциллин/ клавуланат, применяемый при внутрибольничных инфекциях дыхательных путей (пневмония, абсцесс легкого, эмпиема плевры), осложненных инфекциях мочевыводящих путей, органов брюшной полости и малого таза, сепсисе и др.
Ацилуреидопенициллины значительно превышают по спектру действия и эффективности рассмотренные выше классические производные пенициллинов. К этой группе относят азлоциллин, мезлоциллин, пиперациллин. Эти антибиотики сохранили все достоинства пенициллинов широкого спектра (ампициллин) – высокую бактерицидность, избирательность действия, благоприятные фармакокинетические характеристики, низкую токсичность. По сравнению с карбоксипенициллинами более активны, лучше переносятся. Азлоциллин является препаратом с направленным действием на псевдомонады (спнегнойные палочки), в 4–8 раз превышая активность карбенициллина; препарат активен в отношении клебсиеллы, серратии. Еще более широким спектром действия обладают мезлоциллин и пиперациллин. В то же время препараты этой группы разрушаются под воздействием беталактамаз стафилококков и грамотрицательных бактерий; наиболее широким спектром и высоким уровнем антибактериальной активности среди пенициллинов обладает ингибиторзащищенный препарат пиперациллин/ тазобактам. Ацилуреидопенициллины в комбинации с аминогликозидами применяются главным образом при синегнойной инфекции; пиперациллин/тазобактам используется при лечении внутрибольничной инфекции различной локализации (включая инфекции нижних дыхательных путей, кожи, органов брюшной полости и малого таза, желчных, мочевыводящих путей и др.), сепсисе.
Цефалоспорины – бактерицидные антибиотики, обладающие широким спектром антимикробного действия, охватывающим большое число так называемых проблемных возбудителей, в том числе пенициллиназообразующие стафилококки, энтеробактерии, в частности клебсиеллы. Как правило, цефалоспорины хорошо переносятся, их аллергизирующее действие выражено относительно мало (нет полной перекрестной аллергии с пенициллинами).
Цефалоспорины объединяют в следующие основные группы. 1. Препараты I поколения (классические): а) для парентерального введения (цефалотин, цефазолин); б) для перорального применения (цефалексин); в) цефалоспорины с более выраженной устойчивостью к бета-лактамазам (цефазолин). 2. Препараты II поколения: а) для парентерального применения (цефуроксим и др.); б) для перорального введения (цефуроксим аксетил, цефаклор). 3. Цефалоспорины III поколения: цефоперазон, цефотаксим, цефтриаксон, цефтазидим и др. 4. Цефалоспорины IV поколения: цефепим и др.
Общие показания к применению цефалоспоринов: 1) инфекции, вызываемые возбудителями, нечувствительными к пенициллинам, как, например, клебсиеллы и другие энтеробактерии (в соответствии с антибиотикограммой); 2) в случае аллергии к пенициллинам цефалоспорины являются антибиотиком резерва первой очереди; 3) при тяжелом течении инфекции и эмпирическом начале лечения до установления этиологического фактора в комбинации с аминогликозидами или полусинтетическими пенициллинами, особенно ацилуреидопенициллинами (азлоциллин, мезлоциллин, пиперациллин).
Применение цефалоспоринов не показано при инфекциях, вызванных стрепто-, пневмо-, энтеро– и менингококками, шигеллами, сальмонеллами.
Препараты I поколения активны главным образом в отношении грамположительных кокков; устойчивы к бета-лактамазам, продуцируемым стафилококками, но разрушаются бета-лактамазами грамотрицательных бактерий. Самым старым цефалоспорином является цефалотин. Основным показанием к его назначению служат инфекции, вызванные стафилококками, при аллергических явлениях у больного на препараты пенициллина. Цефалотин превосходит препараты пенициллина при инфекциях мочевых и дыхательных путей и других локализаций (сепсисе, инфекционном эндокардите и др.) средней тяжести. Цефалотин превосходит препараты группы оксациллина по способности проникать в лимфатические узлы, легко инактивируется в организме.
Цефалексин эффективен при приеме внутрь, быстро и полно всасывается (независимо от приема пищи). Максимальная концентрация достигается через 1–1,5 ч. По спектру действия цефалексин близок к цефалотину, однако эффективность цефалотина, применяемого парентерально, превосходит цефалексин. Препарат хорошо переносится, тяжелые побочные явления не зарегистрированы. Легкие побочные эффекты со стороны желудочно-кишечного тракта возможны, но они носят преходящий характер.
Препарат активен в отношении стафилококков, гемолитических стрептококков, пневмококков, нейссерий, коринебактерий и клостридий, не действует на энтеробактерии; используется главным образом при тонзиллофарингите, внебольничных инфекциях кожи и мягких тканей. Цефалексин можно сочетать с аминогликозидами и пенициллинами широкого спектра (ампициллин).
Цефазолин (кефзол, цефамезин) обладает устойчивостью к бета-лактамазам стафилококков, широким спектром действия и активностью в отношении кишечных палочек и клебсиелл. Особенно успешно применяется короткими курсами для профилактики инфекции при хирургических вмешательствах. Хорошо переносится при в/м введении, создает высокие концентрации в желчных путях и желчном пузыре.
Цефалоспорины II поколения отличаются более широким спектром действия, эффективны в отношении энтеробактерий. Основные представители этой группы – цефаклор, цефуроксим.
Цефаклор используется для перорального применения (принимается каждые 8 ч) при инфекциях дыхательных, мочевыводящих путей, кожи, мягких тканей и др. По сравнению с цефаклором, цефуроксим устойчивее к бета-лактамазам, активнее в отношении стафилококков, гемофильной палочки, в более высоких концентрациях накапливается в бронхах и мокроте. Цефуроксим не всасывается при приеме внутрь; для перорального приема используется этерифицированное производное этого препарата – цефуроксим аксетил (расщепляется в кишечнике с освобождением цефуроксима).
К цефалоспоринам III поколения относят многие антибиотики, часть из которых действительно обладает серьезными клиническими преимуществами.
Цефоперазон показан при инфекциях, вызванных синегнойными палочками, при заболеваниях желчных путей благодаря высокой концентрации в желчном пузыре. Комбинированный препарат цефоперазон/сульбактам может применяться при различных внутрибольничных инфекциях.
Цефотаксим (клафоран) – важнейший представитель цефалоспоринов III поколения. Характеризуется высокой антимикробной активностью, широким спектром действия, включая клебсиеллы, энтеробактеры, индолположительные протеи, провиденсии и серратии. В организме до 30 % антибиотика инактивируется, чем объясняет наблюдаемое иногда несоответствие между высокой активностью in vitro и эффективностью в клинике. Это особенно относится к бактероидам, псевдомонадам, энтеро– и стафилококкам. Применяется при тяжелых внутри– и внебольничных инфекциях дыхательных и мочевыводящих путей, сепсисе, инфекционном эндокардите, менингите, острой гонорее и др.
Цефтриаксон (роцефин) отличается от цефотаксима длительностью достигаемых в организме больного концентраций (8 ч и более после однократного введения), что позволяет вводить его 1–2 раза в сутки. Препарат отличается высокой стабильностью при хранении; 40–60 % антибиотика выводится с желчью и мочой.
Цефтазидим эффективен в отношении синегнойной палочки, используется при подтвержденной или вероятной синегнойной инфекции (в реанимации, онкологии, гематологии), при инфекциях на фоне иммунодефицита и нейтропении.
Цефалоспорины IV поколения (цефепим) характеризуются высокой активностью в отношении грамотрицательных бактерий (включая синегнойную палочку), применяются при внутрибольничных инфекциях дыхательных, мочевыводящих путей, сепсисе, перитоните и др., а также при инфекциях на фоне нейтропении.
Побочные явления при применении цефалоспоринов: аллергические реакции, обратимые лейко– и тромбоцитопения; боль в месте введения (особенно при в/м введении цефалотина), тромбофлебит в месте в/в введения; передозирование цефалоридина (а иногда и цефалотина) и комбинация с потенциально нефротоксическими веществами может приводить к поражению почек; желудочно-кишечные расстройства при пероральном введении (наблюдаются редко и носят преходящий характер); ложноположительные реакции на сахар в моче; при одновременном введении цефалоспоринов и приеме алкоголя наблюдаются антабусподобные реакции.
Монобактамы. Азтреонам активен в отношении грамотрицательных аэробных микроорганизмов, включая штаммы, продуцирующие пенициллиназу, практически неэффективен в отношении грамположительных аэробных и анаэробных бактерий. Применяется только парентерально в первую очередь для лечения инфекций мочевыводящих путей (пиелонефрит, уретрит, цистит, простатит), вызванных грамотрицательными микроорганизмами, особенно при непереносимости пенициллинов, цефалоспоринов, аминогликозидов. При использовании в качестве эмпирической терапии для расширения спектра действия может комбинироваться с антибиотиками, влияющими на грамположительную флору (оксациллин, цефалоспорины, ванкомицин) и аэробы (метронидазол).
Карбапенемы (имипенем, меропенем) – антибиотики широкого спектра действия, активные в отношении большинства грамотрицательных бактерий (кишечная палочка, протей, клебсиелла и др.), анаэробов, некоторых грамположительных кокков (стрепто-, стафило-, гоно-, менингококки), актиномицетов. Используются только парентерально для лечения тяжелых внутрибольничных инфекций различной локализации (пневмония, инфекция органов брюшной полости и малого таза, кожи, мягких тканей, костей и суставов), инфекционного эндокардита и сепсиса; при угрожающих жизни инфекциях неустановленной этиологии могут применяться в качестве средств первого ряда. Побочные явления – аллергические реакции, флебиты, диспепсия, головокружение, судороги и др. По сравнению с имипенемом, меропенем лучше переносится. Карбапенемы не комбинируются с другими беталактамами.
Аминогликозиды. В эту группу входит большое число как природных, так и полусинтетических антибиотиков с близкой структурой, антимикробным спектром, механизмом действия, характером побочных явлений. Аминогликозиды ингибируют синтез белка рибосомами, действуют бактерицидно. Основные показания для назначения: внутрибольничные тяжелые инфекции различной локализации, вызванные грамотрицательными микроорганизмами, в том числе устойчивыми к другим антибиотикам, и инфекции мочевых путей. Основные побочные эффекты – ототоксическое, нефротоксическое действие, аллергические реакции; при быстром в/в введении возможно развитие нейромышечной блокады с остановкой дыхания.
Как и при лечении другими антибиотиками, при назначении аминогликозидов следует стремиться к предварительному определению чувствительности к антибиотикам (антибиотикограммы).
Аминогликозиды объединяют в следующие основные группы. Препараты I поколения: стрептомицин, неомицин, мономицин, канамицин. Препараты II поколения: гентамицин, тобрамицин, нетилмицин. Препараты III поколения: амикацин.
Стрептомицин активен в отношении микобактерий туберкулеза и многих других возбудителей. Однако в связи с быстрым развитием устойчивости, высокой ототоксичностью и созданием более эффективных препаратов этой группы применение стрептомицина ограничивается очень узкими показаниями и лишь в комбинации с другими антибиотиками. Монотерапия стрептомицином в настоящее время считается бессмысленной. Возможно включение его в различные схемы комбинированной терапии туберкулеза. При таких инфекционных заболеваниях, как бруцеллез, чума, туляремия, мелиоидоз, стрептомицин можно назначать в комбинации с препаратами тетрациклинов.
Противопоказания к назначению стрептомицина: аллергия, поражения VIII пары черепных нервов, тяжелые нарушения выделительной функции почек, сочетания с другими ото– или нефротоксичными препаратами, беременность, стрептомицин не применяют новорожденным и детям раннего возраста. Основное побочное явление при лечении стрептомицином – ототоксичность; нарушение слуха нередко носит необратимый характер, поэтому при применении стрептомицина каждые 4 нед необходима аудиометрия. Вестибулярным нарушениям предшествуют головная боль, тошнота, нистагм и др.
Неомицин. Ввиду высокой ото– и нефротоксичности неомицин применяют лишь внутрь в качестве орального антисептика (при энтеритах, для предоперационной санации кишечника) и в виде лекарственных форм для местного применения (мази, присыпки, аэрозоли, используемые при гнойных заболеваниях кожи, инфицированных ранах) в комбинации с другими препаратами (бацитрацин, полимиксин) и с кортикостероидами. Неомицин действует главным образом на инфекции, вызванные грамотрицательными возбудителями, а тсисзке стафилококками, малоактивен в отношении синегнойных палочек, стрептококков, энтерококков. Микроорганизмы, нечувствительные к неомицину, обладают полной перекрестной устойчивостью к канамицину, паромомицину (мономицину), частичной – к стрептомицину и гентамицину.
Мономицин по спектру антимикробного действия близок к неомицину и канамицину, высокоэффективен в отношении большинства грамотрицательных, грамположительных и кислотоустойчивых бактерий, малоактивен в отношении стрепто-, пневмо– и энтерококков. Кумулятивное ото– и нефротоксическое действие мономицина более выражено, чем у других аминогликозидов. Мономицин показан для лечения кожного лейшманиоза, при котором препарат дает некоторый эффект (0,25 г 3 раза в сутки в/м). Может применяться внутрь в качестве кишечного антисептика. Препарат растворяют в воде и назначают взрослым в дозе 0,25 г 4–6 раз в сутки, детям по 10–25 мг/кг в сутки.
Канамицин обладает широким спектром действия, охватывающим большое число грамположительных и грамотрицательных микроорганизмов, включая протеи, клебсиеллы, энтеробактерии, стафилококки. Активен в отношении микобактерий туберкулеза; неэффективен при синегнойной инфекции. В связи с широким распространением микроорганизмов, образующих инактивирующие канамицин ферменты, применение канамицина целесообразно лишь при установлении чувствительности к нему выделенного возбудителя. Сохраняет свое значение как препарат II ряда в схемах комбинированной химиотерапии туберкулеза. Местно (в виде таблеток) применяется в качестве кишечного антисептика. На основе канамицина выпускается полусинтетический антибиотик амикацин, один из наиболее эффективных в настоящее время препаратов этой группы (см. ниже).
Гентамицин – основной и наиболее широко применяемый из современных аминогликозидов препарат широкого спектра антимикробного действия. К гентамицину высокочувствительны энтеробактерии, кишечные палочки, клебсиеллы, гемофильные палочки, индолположительные протеи, синегнойные палочки, шигеллы, серратии, грамположительные кокки, в том числе стафилококки. Умеренная или штаммозависимая активность отмечается к стрепто-, пневмо– и гонококкам, сальмонеллам. Энтерококки, менингококки и клостридии относительно устойчивы к гентамицину. Перекрестная устойчивость (обычно неполная) наблюдается к неомицину, стрептомицину (мономицину), тобрамицину. Активность гентамицина в организме снижается в присутствии ионов Na, К, Mg, Са, а также различных солей – карбонатов, сульфатов, хлоридов, фосфатов, нитратов. В анаэробных условиях антимикробный эффект гентамицина резко снижается. Действие гентамицина зависит от рН среды; его оптимум – в щелочной среде (рН 7,8). Несмотря на незначительное проникновение в желчные пути, антибиотик активируется в щелочной среде желчи и может оказывать эффект при соответствующей локализации инфекционного процесса.
Гентамицин практически не всасывается при введении внутрь, вводится в/в или в/м. Не проникает внутрь клеток, в организме практически не метаболизируется, почти полностью выделяется в неизмененном виде с мочой. Период полувыведения гентамицина при в/м введении составляет: у новорожденных – 3,3 ч, грудных детей – 2 ч, детей до 15 лет – 1,6 ч, взрослых – 2 ч. Гентамицин обладает низким химиотерапевтическим индексом, поэтому во избежание токсических явлений нельзя превосходить концентрации 10 мкг/мл. Рекомендуется, особенно у больных с пониженной выделительной функцией почек, проводить лечение под контролем концентрации препарата в крови.
Основные показания к применению гентамицина: тяжелые септические инфекции, вызванные чувствительными штаммами (инфекционный эндокардит, сепсис, внутрибольничная пневмония, перитонит и др.); возможно сочетание с синергидно действующими полусинтетическими пенициллинами широкого спектра (ампициллин, карбенициллин, азлоциллин) или цефалоспоринами. Эффективность комбинации основана на том, что гентамицин действует на микробы, находящиеся в состоянии как пролиферации, так и покоя. Кроме того, препарат назначают при тяжелых инфекциях почек и мочевых путей.
На основе гентамицина выпускают различные лекарственные формы для местного применения (мази, кремы, аэрозоли и др.). Местное назначение гентамицина высокоэффективно при тяжелых инфекциях кожи и мягких тканей, особенно вызванных синегнойной палочкой. Основным методом назначения гентамицина является в/в введение в суточных дозах для взрослых в среднем 2–3 мг/кг; обычно дозу делят на 3 введения. Продолжительность курса лечения не должна превышать 7-10 дней, повторные курсы возможны через 7-10 дней. Вследствие опасности нейромышечной блокады и высоких концентраций в перилимфе внутреннего уха при необходимости в/в введения следует применять медленные инфузии, используя концентрации антибиотика не выше 1 мг на 1 мл раствора. Разработана методика однократного введения всей суточной дозы гентамицина и других аминогликозидов, позволяющая уменьшить ото– и нефротоксичность препарата при сохранении эффективности лечения. Этот режим дозирования более удобен для пациента и медицинского персонала и выгоден экономически.
При нарушенной выделительной функции почек может наблюдаться кумуляция гентамицина, поэтому для предупреждения токсических явлений необходимо корректировать индивидуальные дозы. Как правило, лечение у взрослых начинают с нагрузочной дозы 80 мг, а затем в зависимости от клиренса креатинина снижают дозы на 50 % и меняют режим введения.
Побочные явления при лечении гентамицином носят общий для аминогликозидов характер и проявляются ото– и нефротоксичностью. Особая осторожность требуется у больных с поражением почек, у престарелых, при сочетании с другими нефротоксическим веществами – цефалоридином, диуретиками. Опасность нейромышечной блокады может возрастать при сочетании с веществами, обладающими курареподобным действием.
Сизомицин – природный антибиотик из группы гентамицина. По спектру действия близок к гентамицину и тобрамицину, однако превосходит гентамицин по антимикробному действию на протеи, серратии, клебсиеллы, энтеробактер, псевдомонады. У микроорганизмов, нечувствительных к другим аминогликозидам, не наблюдается полной перекрестной устойчивости с сизомицином. Препарат обладает устойчивостью к большинству ферментов, образуемых гентамицинорезистентными микроорганизмами, что обеспечивает неполную перекрестную устойчивость и возможность получения хорошего эффекта при инфекциях, вызванных резистентными к гентамицину возбудителями. Терапевтическая концентрация сизомицина (4–6 мкг/мл) достигается при введении средних суточных доз антибиотика (3 мг/кг) и охватывает широкий круг грамотрицательных микроорганизмов и стафилококков, устойчивых к другим антибиотикам. В сочетании с полу синтетическими пенициллинами широкого спектра и цефалоспоринами антимикробный эффект сизомицина усиливается.
При в/м введении сизомицин быстро всасывается, максимальная концентрация его в сыворотке крови достигается через 30 мин. Период полувыведения 2–2,5 ч. При нарушении выделительной функции почек возможна кумуляция препарата. Наиболее высокие концентрации сизомицина обнаруживаются в почках; в плевральных и брюшной полости создаются концентрации, близкие к обнаруживаемым в крови. Сизомицин плохо проникает через гематоэнцефалический барьер, выводится из организма в неизмененном виде с мочой (в течение 24 ч 80–84 % введенной дозы). Концентрация антибиотика в моче после введения 1 мг/кг в течение первых 8 ч составляет около 100 мкг/мл.
Сизомицин назначают при тяжелых инфекционно-воспалительных заболеваниях, вызванных грамотрицательными микроорганизмами, устойчивыми к другим антибиотикам, а также стафилококками, устойчивыми к полу синтетическим пенициллинам.
Препарат эффективен при лечении сепсиса, септического эндокардита, перитонита, инфекций мочевыводящих и желчных путей, органов дыхания (пневмония, эмпиема плевры, абсцесс легкого), инфекции кожи и мягких тканей, инфицированных ожогов. Показаниями к применению сизомицина являются также гнойно-септические заболевания у больных с лейкозами, злокачественными новообразованиями, на фоне лечения цитостатиками и лучевой терапии, при других иммунодефицитных состояниях. По данным ряда авторов, сизомицин в меньшей степени, чем другие аминогликозиды, влияет на иммунную систему организма, что является основанием для преимущественного применения его (в сравнении с другими аминогликозидами) в педиатрии, в том числе у новорожденных.
Назначают в/м или в/в. При инфекциях почек и мочевыводящих путей разовая доза сизомицина составляет 1 мг/кг, суточная 2 мг/кг. В отличие от гентамицина и других аминогликозидов сизомицин вводят не 3, а 2 раза в сутки. При тяжелых инфекциях (сепсис, перитонит, деструктивная пневмония) суточную дозу увеличивают до 3 мг/кг. При угрожающих жизни состояниях в первые 2–3 дня суточная доза может быть увеличена до максимальной – 4 мг/кг.
Суточная доза сизомицина у новорожденных и детей до 1 года составляет 4 мг/кг (максимальная 5 мг/кг), от 1 года до 14 лет – 3 мг/кг (максимальная 4 мг/кг), старше 14 лет – доза взрослых. Продолжительность курса лечения 7-10 дней. При нарушении выделительной функции почек необходимо снижение доз и увеличение интервалов между введениями.
Тобрамицин – природный аминогликозид, по спектру антимикробного действия и фармакокинетике близкий к гентамицину. По влиянию на синегнойные палочки превосходит активность гентамицина; нет и полной перекрестной устойчивости в отношении этого микроорганизма с гентамицином.
Показания к применению тобрамицина близки к гентамицину и сизомицину; дозы и интервалы между введениями, а также токсичность соответствуют гентамицину.
Нетилмицин – производное сизомицина. По спектру действия близок к гентамицину, но активен в отношении некоторых гентамицинорезистентных возбудителей. Нетилмицин, как и гентамицин, оказывает активное действие на большинство грамотрицательных бактерий; гентамицин более активен в отношении серратий, синегнойных палочек.
Наиболее важным свойством нетилмицина является активность при инфекциях, вызванных штаммами энтеробактерий и синегнойных палочек, устойчивых к гентамицину и тобрамицину. К таким возбудителям относятся синегнойные палочки, протеи, энтеробактер, клебсиеллы; устойчивые к гентамицину протеи, морганеллы и провиденсии обычно устойчивы и к нетилмицину. При сочетании с пенициллинами и цефалоспоринами наблюдается усиление антимикробного эффекта. К нетилмицину чувствительны множественно-устойчивые (в том числе к полусинтетическим пенициллинам) стафилококки.
Максимальная концентрация нетилмицина после в/м введения (около 4 мкг/мл) достигается через 30–40 мин, период полувыведения составляет 2–2,5 ч. При в/в введении концентрация препарата снижается быстрее, чем у гентамицина. Как и другие аминогликозиды, нетилмицин выделяется почками в неизмененном виде. Плохо связывается белками сыворотки крови, проникает в ткани и жидкости, кроме цереброспинальной.
Нетилмицин как в виде монотерапии, так и в сочетании с беталактамными антибиотиками является высокоэффективным средством лечения инфекций почек, мочевыводящих и желчных путей, легких и плевры, перитонита. В ряде случаев нетилмицин эффективнее гентамицина; по данным некоторых авторов, его действие близко к действию амикацина при устойчивых к гентамицину инфекциях. Ототоксичность препарата меньше, чем у гентамицина и тобрамицина.
Амикацин – полусинтетическое производное канамицина; по сравнению с другими аминогликозидами в наибольшей степени защищен от инактивирующих ферментов, образуемых устойчивыми к аминогликозидам возбудителями. Спектр его действия шире, чем у гентамицина и тобрамицина; эффективен в отношении большинства устойчивых не только к традиционным аминогликозидам, но и к гентамицину или тобрамицину микроорганизмов. Спектр действия амикацина охватывает большое число «проблемных» возбудителей: синегнойные палочки, кишечные палочки, протеи, клебсиеллы, энтеробактеры, серратии, провиденсии, а также менингококки, гонококки, гемофильные палочки. Наиболее важное свойство амикацина – его активность в отношении большинства устойчивых к гентамицину энтеробактерий (более 80 %), синегнойных палочек (более 25–85 %). Устойчивость к амикацину у грамотрицательных микроорганизмов даже на фоне широкого применения этого антибиотика наблюдается крайне редко (до 1 % штаммов). Стафилококки, в том числе устойчивые к пенициллину и гентамицину, как правило, чувствительны к амикацину.
Амикацин в сочетании с иенициллинами и цефалосиоринами (карбенициллин, мезлоциллин, азлоциллин, цефотаксим, цефалотин, цефазолин, цефтазидим) обладает синергидным действием. Имеются данные о синергидности амикацина и триметоприма в отношении клебсиелл, серратий, кишечных, но не синегнойных палочек.
По фармакокинетике амикацин близок к канамицину. После в/м введения 0,5 г амикацина пик его концентрации достигается через 1 ч. Период полувыведения – 2,3 ч. При в/в введении быстро достигается высокий уровень амикацина в крови. Выделяется почти полностью с мочой в неизменном виде. В случаях нарушения выделительной функции почек выведение препарата значительно задерживается. Амикацин слабо связывается с белками сыворотки крови, не проникает через гематоэнцефалический барьер.
Основные показания к применению: тяжелые инфекции различной локализации, вызванные возбудителями, устойчивыми к другим аминогликозидам.
Левомицетин (хлорамфеникол) – антибиотик широкого спектра действия, активен в отношении многих грамположительных и грамотрицательных микробов, риккетсий, спирохет, хламидий. Среди энтеробактерий чувствительны кишечная палочка, энтеробактеры, клебсиеллы, возбудители чумы, сальмонеллы, шигеллы. Многие микроорганизмы, устойчивые к пенициллинам, тетрациклинам, аминогликозидам и другим антибиотикам, как правило, устойчивы и к левомицетину. В обычных дозах действует бактериостатически, нарушая синтез белка микроорганизмов. Левомицетин быстро и полно (до 90 %) всасывается при приеме внутрь. Время снижения концентрации наполовину – 3,5 ч. Наибольшая концентрация достигается в печени, почках; антибиотик проникает через гематоэнцефалический барьер, обнаруживается в цереброспинальной жидкости в концентрациях, составляющих 30–50 % его уровня в крови. Назначают в дозе 0,25-0,5 г на прием 3–4 раза в сутки.
Ввиду возможности развития тяжелых гематотоксических явлений – апластической анемии, панцитопении, носящей необратимый характер, и наличия не менее эффективных, но хорошо переносимых антибиотиков показания к применению левомицетина ограничены. Это брюшной тиф, паратифы, генерализованные формы сальмонеллеза, бруцеллез, туляремия, риккетсиозы, хламидиозы, менингиты, вызванные чувствительными возбудителями. Категорически не рекомендуется применение левомицетина в амбулаторной практике. Местно левомицетин используют в виде водных растворов и мазей для профилактики и лечения инфекционных заболеваний глаз.
Тетрациклины. В эту группу входит ряд природных и полу синтетических антибиотиков бактериостатического действия (нарушают синтез белка микроорганизма). Из природных тетрациклинов применяют тетрациклин и окситетрациклин, обладающие близкими свойствами. После внедрения более эффективных антибиотиков (полусинтетические пенициллины, аминогликозиды и др.) и широкого распространения устойчивых форм микроорганизмов применение тетрациклинов резко ограничено. Из-за побочных явлений (накопление в костях и зубах) применение всех тетрациклинов запрещено у детей до 8 лет.
Показаниями к применению тетрациклинов в настоящее время являются инфекции кожи, в особенности акне, дыхательных путей (хронические бронхиты, внебольничная пневмония); микоплазмозы, бруцеллез (в сочетании со стрептомицином), холера, возвратный тиф, мелиоидоз (в сочетании со стрептомицином), орнитоз, риккетсиозы, туляремия, трахома, неспецифические уретриты. Показаниями к применению препаратов II ряда служат: актиномикоз, сибирская язва, балантидиаз, эризипелоид, гонорея, лептоспирозы, листериозы, сифилис, нокардиоз, чума, мягкий шанкр и др. Тетрациклины не показаны к применению при инфекциях, вызванных стафилококками, пневмококками, менингитах, для профилактических целей в хирургии. Противопоказания к применению тетрациклинов: аллергия к антибиотикам этой группы, миастении, беременность, возраст до 8 лет, тяжелые поражения печени и почек.
Побочные явления: поражение желудочно-кишечного тракта, суперинфекции, микозы, поражение печени (при передозировке), отложение в костях и тканях, фотодерматозы, кумуляция при недостаточности почек, развитие кандидозов.
Распространенные ранее фиксированные комбинации на основе тетрациклинов, например олететрин (тетраолеан), по современным представлениям являются нерациональными с точки зрения как эффективности, так и побочных явлений.
Доксициклин (вибрамицин) – полусинтетическое производное окситетрациклина, наиболее широко применяемый препарат этой группы. Обладает рядом преимуществ по сравнению с природными тетрациклинами – более активен в отношении пневмококков, лучше переносится. Всасывается в значительно больших количествах, чем природные тетрациклины; его применяют обычно в дозе 0,1 г 1 раз в сутки (таблетки или капсулы).
Доксициклин необходимо принимать после еды, при вертикальном положении пациента, запивая большим объемом жидкости; при приеме в положении лежа или сидя препарат может задержаться на слизистой оболочке пищевода и вызвать ее поражение (вплоть до язв).
Ансамакролиды. Рифампицин – полусинтетический антибиотик широкого спектра действия, относящийся к группе ансамицинов. До настоящего времени остается одним из наиболее эффективных антибиотиков для лечения туберкулезной инфекции, в том числе вызванной атипичными формами микобактерий. Кроме того, рифампицин активен в отношении множественно-устойчивых стафило-, стрепто-, энтеро-, гоно– и менингококков, гемофильных палочек. К рифампицину, особенно при монотерапии, быстро возникает устойчивость. Для ее преодоления необходимо использовать короткие курсы или применять антибиотик в комбинациях. Рифампицин – единственный антимикробный препарат, который проникает внутрь клеток макроорганизма и бактерицидно действует на фагоцитированные и персистирующие возбудители. При приеме внутрь быстро и полно всасывается, максимальная концентрация в крови наступает через 2 ч, при в/в введении – через 30 мин.
Хорошо диффундирует в ткани и жидкости макроорганизма и органы, где создаются концентрации, соответствующие или превышающие достигаемые в сыворотке крови. В желчном пузыре обнаруживаются очень высокие концентрации, в почках – незначительные, в плевральной, асцитической, синовиальной жидкостях, в мокроте – терапевтические концентрации. Рифампицин проникает через гематоэнцефалический барьер. Многие комбинации рифампицина с другими антимикробными агентами являются синергидными. Как правило, рифампицин назначают в сочетании с другими противотуберкулезными препаратами – ПАСК и этамбутолом. Синергизм обычно имеет место также в сочетаниях с эритромицином, линкомицином, тетрациклином, аминогликозидами, нитрофуранами, триметопримом. Антагонистический эффект установлен при сочетании с пенициллином, цефалоспоринами, сульфаниламидами.
Основные показания к применению: комбинированная химиотерапия различных форм туберкулеза и лепры; инфекции легких и дыхательных путей, отоларингологические инфекции; инфекции почек, мочевыводящих и желчных путей; инфекции, вызванные неспорообразующими анаэробами (бактероиды, фузобактерии, стрептококки); как препарат выбора при борьбе с носительством менингококков; при инфекциях желудочно-кишечного тракта как альтернатива левомицетину; при лечении гонореи, вызванной пенициллиноустойчивыми возбудителями, остеомиелитов, листериоза.
Противопоказанием к применению рифампицина является склонность к гиперергическим реакциям немедленного типа. В случае нарушения функции почек рифампицин следует применять с осторожностью. Возможно развитие гепатопатии, особенно у страдающих алкоголизмом или при сочетании с другими гепатотоксичными препаратами. При беременности назначение рифампицина противопоказано. Иногда наблюдаются побочные явления со стороны желудочно-кишечного тракта, редко – признаки аллергии.
Макролиды – ряд антибиотиков близкой структуры и механизма действия, активных главным образом в отношении грамположительных микроорганизмов, прежде всего кокков. В обычных дозах оказывают бактериостатическое действие, нарушая синтез белка рибосомами микробной клетки. Различают природные (эритромицин) и полусинтетические (рокситромицин, азитромицин и др.) макролиды.
Эритромицин – высокоактивный антибиотик узкого спектра действия, широко использующийся в амбулаторной практике, особенно в педиатрии. Действует на инфекции, вызванные стафило-, стрепто– и пневмококками. Кроме того, к нему чувствительны актиномицеты, возбудитель сибирской язвы, бактероиды, возбудители коклюша, кампилобактеры, коринебактерии, легионеллы, микоплазмы, гонококки, менингококки, трепонемы. Большинство грамотрицательных микроорганизмов не обладает чувствительностью к эритромицину. Фармакокинетика препарата зависит от многих факторов (лекарственной формы, функционального состояния желудочно-кишечного тракта и т. д.). Эритромицин рекомендуют назначать в начале приема пищи. При приеме 0,5 г достигаются невысокие его концентрации в сыворотке крови, которые при многократном введении препарата несколько повышаются. Эритромицин проникает в ткани, органы и обнаруживается внутриклеточно, особенно интенсивно накапливается в печени, желчном пузыре, предстательной железе; не проникает через неповрежденные мозговые оболочки, но при менингитах может проникать в цереброспинальную жидкость. Эритромицин связывается на 60–90 % с белками сыворотки крови. Время полу-выведения – 1,2 ч. Выделяется главным образом с желчью, в печени метаболизируется; с почками выделяется не более 5 % количества введенного антибиотика.
Эритромицин относится к наиболее хорошо переносимым антибиотикам, обладающим минимальными побочными явлениями. Осложнения со стороны желудочно-кишечного тракта наблюдают у 2–3% больных, аллергические явления – у 6,5 %. Эритромицин в меньшей степени влияет на нормальную микрофлору кишечника, чем препараты широкого спектра. Нет противопоказаний для назначения эритромицина во время беременности. Основными показаниями к его применению служат инфекционные процессы средней тяжести: бронхиты, внебольничные пневмонии, отиты, тонзиллиты, фарингиты. Эритромицин эффективен при акне, пиодермиях, простатите, вызванных чувствительными возбудителями; в качестве альтернативного препарата при аллергии к пенициллину; эритромицин применяют для профилактики ревматизма, при коклюше, дифтерии, лечении сифилиса, а также для эрадикации Helicobacter pylori при язвенной болезни. Препарат является одним из наиболее эффективных средств лечения легионеллезов и инфекций, вызванных микоплазмами.
Новые макролиды – рокситромицин (рулид), азитромицин (сумамед) и др. – по клинической эффективности незначительно отличаются от эритромицина, однако обладают большей продолжительностью действия (что позволяет принимать препарат 1–2 раза в сутки) и лучше переносятся пациентами.
Линкосамиды. В эту группу входят линкомицин и его полу синтетический аналог клиндамицин – препараты бактериостатического действия с узким спектром антимикробной активности. Хотя по химическому строению линкомицин не связан с эритромицином, его биологические свойства близки к макролидам (часто они рассматриваются вместе). Линкомицин активен в отношении большинства грамположительных микроорганизмов – стафилококков (в том числе устойчивых к пенициллину), стрептококков. В отличие от эритромицина действует на фекальные стрептококки, а также на возбудителей сибирской язвы и нокардиоза. Наблюдается синергизм линкомицина с гентамицином и другими аминогликозидами в отношении перечисленных микроорганизмов. В отличие от эритромицина линкомицин не действует на менингококки, гонококки и гемофильные палочки и менее активен в отношении микоплазм. Клиндамицин – полусинтетическое производное линкомицина, обладает определенными преимуществами в сравнении с исходным природным антибиотиком (в частности, обладает несколько большей антимикробной активностью in vitro). Важными свойствами линкомицина и особенно клиндамицина является их действие на неспорообразующие грамотрицательные бактерии (бактероиды).
После приема 0,5 г линкомицина внутрь пик концентрации в сыворотке крови достигается в течение 2–4 ч. При парентеральном введении достигаются более высокие концентрации. Клиндамицин полнее всасывается при приеме внутрь и обеспечивает более высокие (иногда вдвое большие) концентрации в сыворотке крови. В отличие от клиндамицина на всасывание линкомицина оказывает влияние пища (резкое снижение концентрации после еды).
Линкомицин и клиндамицин проникают в различные ткани и жидкости организма. При менингите концентрация линкомицина в цереброспинальной жидкости достигает 40 % обнаруживаемой в сыворотке крови; препарат проникает в абсцессы мозга; при парентеральном введении обнаруживается в высоких концентрациях в желчи, асцитической жидкости, проникает через плацентарный барьер, в костную ткань.
Основные показания к применению: стафилококковые инфекции различной локализации (хорошие результаты отмечаются при остеомиелитах и септических артритах этой этиологии), стрептококковые и пневмококковые инфекции, дифтерия, актиномикоз, хронические бронхиты, пневмонии, вызванные микоплазмой, акне, острые абсцессы. Линкомицин и особенно клиндамицин эффективны при лечении тяжелых анаэробных инфекций, вызванных бактероидами.
Линкомицин и клиндамицин вызывают поражения желудочно-кишечного тракта различной выраженности (тошнота, рвота, боль в животе). Возможно развитие диареи и язвенных колитов при применении линкомицина и особенно клиндамицина. После отмены препаратов эти симптомы могут наблюдаться в течение 1–2 нед. Наиболее опасным осложнением, угрожающим жизни больного, является псевдомембранозный колит, возникающий независимо от продолжительности курса чаще при назначении препаратов внутрь, чем при парентеральном введении. Этиологию этого опасного синдрома, возникающего и помимо антибиотикотерапии, связывают с токсичным микроорганизмом клостридиум диффициле, который усиленно размножается при нарушении нормальной микрофлоры под влиянием антибиотика. Для борьбы с этим осложнением применяют метронизадол, сульфаниламиды, ванкомицин, фузидин.
Гликопептиды. Ванкомицин и другие антибиотики группы гликопептидов обладают узким спектром бактерицидного действия в отношении стафило-, стрепто– и пневмококков (включая штаммы, резистентные к пенициллину), коринебактерий и некоторых других грамположительных возбудителей. Грамотрицательные микроорганизмы полностью резистентны. Помимо ванкомицина в эту группу входят тейкопланин и другие антибиотики, в России выпускают ристомицин. Ванкомицин в меньшей степени, чем другие антибиотики этой группы, но также может вызывать флебиты, озноб, повышение температуры тела, экзантемы, нефротоксические и ототоксические явления. В последние годы возрос интерес к ванкомицину как средству борьбы с тяжелыми инфекциями, вызванными множественноустойчивыми стафилококками (в том числе устойчивыми к полусинтетическим пенициллинам – так называемыми метициллинорезистентными). Ванкомицин применяют у больных, находящихся на хроническом гемодиализе, и с сопутствующими инфекциями; как препарат выбора при аллергии к пенициллинам и цефалоспоринам; при энтерококковых эндокардитах; как препарат выбора при инфекциях, вызванных группой коринебактерий, после хирургических вмешательств на сердце, на фоне иммунодефицита; при инфекциях, вызванных устойчивыми к пенициллину пневмококками.
В будущем значение ванкомицина и других гликопептидов может возрастать как альтернативных резервных антибиотиков.
Ванкомицин высокоэффективен при приеме внутрь (в отличие от обычного в/в пути введения) для борьбы с псевдомембранозными энтероколитами, вызванными клостридиями или энтерококками.
Побочные явления при антибиотикотерапии могут быть отнесены к трем основным группам – аллергические, токсические и связанные с химиотерапевтическим эффектом антибиотиков. Аллергические реакции свойственны многим антибиотикам. Их возникновение не зависит от дозы, но они усиливаются при повторном курсе и увеличении доз. К опасным для жизни аллергическим явлениям относят анафилактический шок, ангионевротический отек гортани, к неопасным для жизни – кожный зуд, крапивницу, конъюнктивит, ринит и др. Аллергические реакции наиболее часто развиваются при применении пенициллинов, особенно парентеральном и местном. Особого внимания требует назначение длительно действующих препаратов антибиотиков. Аллергические явления особенно часто встречаются у больных с повышенной чувствительностью к другим лекарственным препаратам.
Токсические эффекты при антибиотикотерапии наблюдаются значительно чаще, чем аллергические, их выраженность обусловлена дозой введенного препарата, путями введения, взаимодействием с другими лекарствами, состоянием больного. Рациональное применение антибиотиков предусматривает выбор не только наиболее активного, но и наименее токсичного препарата в безвредных дозах. Особое внимание следует уделять новорожденным и детям раннего возраста, пожилым пациентам (вследствие возрастных нарушений процессов метаболизма, водного и электролитного обмена). Нейротоксические явления связаны с возможностью поражения некоторыми антибиотиками слуховых нервов (мономицин, канамицин, стрептомицин, флоримицин, ристомицин), влиянием на вестибулярный аппарат (стрептомицин, флоримицин, канамицин, неомицин, гентамицин). Некоторые антибиотики могут вызывать и другие нейротоксические явления (поражение зрительного нерва, полиневриты, головная боль, нейромышечная блокада). Следует осторожно вводить антибиотики интралюмбально из-за возможности прямого нейротоксического действия.
Нефротоксические явления наблюдаются при применении антибиотиков различных групп: полимиксинов, амфотерицина А, аминогликозидов, гризеофульвина, ристомицина, некоторых пенициллинов (метициллин) и цефалоспоринов (цефалоридин). Особо подвержены нефротоксическим осложнениям больные с нарушением выделительной функции почек. Для предупреждения осложнений необходимо выбирать антибиотик, дозы и схемы его применения в соответствии с функцией почек под постоянным контролем концентрации препарата в моче и крови.
Токсическое действие антибиотиков на желудочно-кишечный тракт связано с местнораздражающим действием на слизистые оболочки и проявляется в виде тошноты, поноса, рвоты, анорексии, боли в животе и др. Угнетение кроветворения наблюдается иногда вплоть до гипо– и апластической анемии при применении левомицетина и амфотерицина В; гемолитические анемии развиваются при применении левомицетина. Эмбриотоксическое действие возможно при лечении беременных стрептомицином, канамицином, неомицином, тетрациклином; в связи с этим применение потенциально токсичных антибиотиков беременным противопоказано.
Побочные явления, связанные с антимикробным эффектом антибиотиков, выражаются в развитии суперинфекции и внутрибольничных инфекций, дисбактериоза и влиянии на состояние иммунитета у больных. Угнетение иммунитета свойственно противоопухолевым антибиотикам. Некоторые антибактериальные антибиотики, например эритромицин, линкомицин, обладают иммуностимулирующим действием.
В целом частота и выраженность побочных явлений при антибиотикотерапии не выше, а иногда и значительно ниже, чем при назначении лекарственных препаратов других групп.
При соблюдении основных принципов рационального назначения антибиотика удается свести к минимуму побочные явления. Антибиотики должны назначаться, как правило, при выделении возбудителя заболевания у данного больного и определении его чувствительности к ряду антибиотиков и химиопрепаратов. При необходимости определяют концентрацию антибиотика в крови, моче и других жидкостях организма для установления оптимальных доз, путей и схем введения.
СИНТЕТИЧЕСКИЕ ХИМИОТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА. Сульфаниламиды – химиотерапевтические средства бактериостатического типа действия, являющиеся производными сульфаниловой кислоты. Сульфаниламиды – препараты относительно широкого спектра активности; инактивируются в сыворотке крови, гнойном экссудате, продуктами распада белков, плохо проникают в очаг воспаления. Обладают бактериостатическим типом действия; как правило, эффект на бактериальную клетку выражен слабее, чем у антибиотиков.
Различают: 1) сульфаниламиды с хорошей всасываемостью, применяющиеся для системного лечения бактериальных (ангины, отиты, синуситы, инфекции дыхательных и мочевых путей и др.) и протозойных инфекций, вызванных чувствительными к сульфаниламидам микроорганизмами (в том числе препараты короткого действия – сульфадимезин, этазол и др.; средней длительности действия – сульфазин и др.; длительного действия – сульфадиметоксин и др.; сверхдлительного действия – сульфален); 2) сульфаниламиды, плохо всасывающиеся из желудочнокишечного тракта и применяющиеся при острой диарее (при бактериальных энтероколитах, дизентерии) – сульгин, фталазол и др.
Преимуществом сульфаниламидов для массового применения в амбулаторной практике стала их низкая цена. Однако их использование ограничено рядом недостатков – быстрым развитием лекарственной устойчивости бактерий, перекрестной устойчивостью в пределах данной группы препаратов, побочными эффектами (диспептические расстройства, аллергические реакции, камнеобразование в почках, изменения состава крови). Сульфаниламиды противопоказаны при тяжелых заболеваниях органов кроветворения и почек, аллергической реакции в анамнезе на какой-либо препарат из этой группы. Низкая эффективность при инфекциях, вызванных устойчивыми микроорганизмами, длительность лечения, непостоянство результатов сводят на нет преимущество сульфаниламидов, которые сохраняют свое значение как компоненты комбинированных препаратов (главным образом с триметопримом).
Котримоксазол – общее наименование для сочетаний сульфаниламидов с триметопримом (синонимы: бисептол, септрин, бактрим и др.). Комбинация триметоприма с сульфаниламидом среднего срока действия – сульфометоксазолом – обладает потенцированным влиянием в отношении многих возбудителей.
Сочетание двух различных по механизму действия бактериостатических веществ приводит к значительному усилению активности в отношении многих возбудителей: стафило-, стрепто– и энтерококков, нейссерий, протеев, кишечных палочек, гемофильных палочек, сальмонелл, шигелл, клостридий, трепонем, псевдомонад, анаэробов. В отношении ряда инфекций средней тяжести сочетания сульфаниламидов и триметоприма являются альтернативными по отношению к антибиотикам. Оба компонента сочетания после введения внутрь быстро и полно всасываются и создают оптимальные концентрации, позволяющие вводить котримоксазол 2 раза в сутки. Высокие концентрации обнаруживаются в почках, легких, предстательной железе. Выводится препарат главным образом с мочой (50 %), лишь некоторая часть инактивируется. Побочные явления те же, что при терапии сульфаниламидами: аллергические реакции, экзантемы, нарушения деятельности желудочно-кишечного тракта; гематотоксические явления – тромбоцитопения, лейкопения – обусловлены триметопримом. Как правило, побочные явления наблюдаются в среднем у 5 % больных и носят обратимый характер. Препарат противопоказан беременным. Хорошие результаты наблюдаются при острых и хронических инфекциях почек и мочевых путей, легких и дыхательных путей, желчных путей, желудочно-кишечного тракта. При сальмонеллезах котримоксазол действует не слабее левомицетина, однако без опасности тяжелых гематотоксических явлений. При тяжелых процессах, вызванных множественно-устойчивыми грамоотрицательными микроорганизмами, возможно сочетание с аминогликозидами (гентамицин, тобрамицин, сизомицин).
Триметоприм в качестве монотерапии, особенно при инфекциях мочевых и дыхательных путей, является почти столь же эффективным, что и котримоксазол. Возможно сочетание триметоприма с рифампицином (в том числе рифаприм), что обеспечивает сверхширокий спектр антимикробного действия.
Хинолоны. Эта группа объединяет синтетические антибактериальные вещества двух поколений: 1) хинолон-карбоновые кислоты (налидиксовая и оксолиниевая кислоты, хиноксацин, пипемидиновая кислота и др.) и 2) фторсодержащие хинолон-карбоновые кислоты.
Налидиксовая кислота (неграм, невиграмон) является основным представителем первого поколения хинолонов узкого спектра действия. Препарат активен в отношении многих энтеробактерий – кишечных палочек, клебсиелл, протеев, цитробактеров, провиденсий, серратий и др. Налидиксовую кислоту назначают внутрь в среднесуточной дозе 4 г (для взрослых). Метаболизируется в печени. Достигаемые в организме концентрации сильно варьируют у разных больных; продукт метаболизма выводится почками, где и достигаются терапевтические концентрации.
Налидиксовая кислота используется главным образом для лечения инфекций мочевых путей. При применении препарата могут возникать побочные явления: нарушения деятельности желудочно-кишечного тракта, нефротоксичность, повышение внутричерепного давления, гематотоксичность и др. С созданием новых препаратов значение налидиксовой кислоты резко уменьшилось.
Фторсодержащие хинолоны. В эту группу входит большое число препаратов широкого антимикробного спектра, высокоактивных в отношении грамположительных и грамотрицательных микроорганизмов, микоплазм, легионелл, хламидий и других возбудителей. Наиболее важные для практики представители хинолонов – ципрофлоксацин, эноксацин, норфлоксацин, офлоксацин, нефлоксацин и др. Фторхинолоны действуют бактерицидно (ингибируют ключевой фермент бактериальной клетки, ответственный за синтез ДНК). При приеме внутрь обеспечиваются высокие концентрации в тканях и органах, имеются и формы для парентерального применения; хинолоны практически не метаболизируются в организме, хорошо проникают в органы и ткани (легкие, печень, почки). Применяются в качестве эмпирической терапии (до установления микробиологического диагноза) при различных инфекциях – мочевыводящих, дыхательных путей, ЦНС (вторичные бактериальные менингиты), инфекций, передающихся половым путем (гонорея, хламидиозы), кишечных инфекциях (сальмонеллез, дизентерия), в хирургической и гинекологической практике, при сепсисе. При назначении хинолонов требуется осторожность, особенно у детей до 18 мес, ввиду возможности развития побочных явлений, иногда тяжелых. Возможные побочные эффекты – поражение желудочно-кишечного тракта и ЦНС, аллергические реакции. По ряду показателей эффект хинолонов близок к тому, который оказывают антибиотики широкого спектра действия, а иногда и превосходят их.
Нитрофураны. Синтетические антибактериальные вещества, применяемые лишь для лечения острых инфекций мочевых путей, профилактики рецидивов при хронических инфекциях. Нитрофураны обладают выраженным побочным действием (на ЦНС, желудочно-кишечный тракт, вызывают аллергию, гематотоксичны). При наличии высокоэффективных и менее токсичных химиотерапевтических средств применение нитрофуранов нецелесообразно.
ПРОТИВОГРИБКОВЫЕ ПРЕПАРАТЫ
Амфотерицин В. Антибиотик группы полиенов, вводится парентерально, активен при бластомикозах, гистоплазмозах, криптококкозах, кандидозах, кокцидиозах.
Нистатин. Полиеновый антибиотик, применяется местно и внутрь, преимущественно для лечения кандидозных поражений кожи, слизистых оболочек, желудочно-кишечного тракта.
Гризеофульвин. Антибиотик, применяемый перорально при дерматофии; неактивен при системных микозах.
Кетоконазол (низорал) применяют внутрь при дерматофитии. В процессе длительной терапии при бластомикозе, гистоплазмозе, кокцидиомикозах могут быть рецидивы. Побочные эффекты возможны со стороны ЦНС (головная боль, головокружение, бессонница и др.), желудочно-кишечного тракта (диспепсия) и др.
Миконазол – препарат группы имидазола. Выпускается для парентерального, местного и вагинального применения. Эффективен при многих дерматофитах и кандидозах.
Флуконазол (дифлюкан) – противогрибковый препарат широкого спектра действия, применяется при криптококкозе, системном кандидозах кожи и слизистых оболочек, для профилактики грибковых инфекций у больных со сниженным иммунитетом. Возможны гепатотоксическое действие, аллергические реакции.
Итраконазол (орунгал) – противогрибковый препарат широкого спектра действия, применяется при грибковых поражениях кожи и слизистых оболочек, системных микозах, в том числе при аспергиллезе, кандидозе, криптококкозе, гистоплазмозе и др. Возможные побочные эффекты: диспепсия, головная боль, головокружение, иногда – кожная сыпь, рвота, повышение уровня печеночных ферментов и др.
Тербинафин (ламизил) – фунгицидный препарат широкого спектра действия, применяется при дерматомикозах, кандидозах кожи и слизистых оболочек. Препарат хорошо переносится, диспептические явления или аллергические реакции встречаются редко.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ. Среди природных и синтети ческих химиотерапевтических веществ пока не найдено высокоэффективных средств лечения важнейших заболеваний вирусной этиологии.
Интерферон – эндогенный низкомолекулярный белок, получаемый из донорской крови. Применяют интраназально для профилактики, лечения гриппа и других ОРВИ.
Интрон А – рекомбинантный альфа-интерферон, оказывает противовирусное, иммуномодулирующее, противоопухолевое действие. Применяют при онкологических заболеваниях, хроническом вирусном гепатите, синдроме приобретенного иммунодефицита.
Полудан – индуктор интерферона. Применяют у взрослых при вирусных заболеваниях глаз.
Ацикловир (зовиракс). Аналог нуклеозида, активный в отношении вирусов простого и опоясывающего герпеса. Применяют внутривенно, местно и перорально.
Фамцикловир – препарат для приема внутрь, применяют при опоясывающем герпесе, рецидивах урогенитального герпеса.
Ганцикловир – по сравнению с ацикловиром более эффективен в отношении цитомегаловируса; применяется при цитомегаловирусной инфекции у больных с иммунодефицитными состояниями.
Амантадин (ремантадин). Синтетический препарат, применяемый внутрь при гриппе типа А. При раннем приеме (в течение 48 ч с момента развития заболевания) облегчает течение гриппа А.






