Проявления эпидемического процесса
Распространение денге/геморрагической лихорадки денге (ЛД/ГЛД) весьма широко. Заболевание встречается более чем в 100 тропических и субтропических странах Юго-Восточной Азии, западной части Тихого океана, Южной и части Северной Америки и Западной Африки, где возникает примерно от 50 до 100 млн случаев ежегодно (WHO, 1997). В этих эндемичных регионах в настоящее время живет более 2,5 млрд человек, подвергающихся риску заражения (см. цв. вклейку, рис. 4). Следует отметить расширение ареала распространения лихорадки. Если в 1980 г. 1,5 млрд человек жили в зоне активной передачи, то к 1998 г. число жителей зоны риска увеличилось до 2,5 – 3,0 млрд человек. Причинами расширения ареала и увеличения заболеваемости лихорадкой являются рост численности населения, урбанизация, интенсификация механизма передачи комарами с помощью транспортных средств и расширения контактов между странами, недостаток профилактических мероприятий.
Эпидемиологическая статистика заболеваемости во многих странах отсутствует, а имеющиеся сведения далеко не полны, так как в основном регистрируются клинически выраженные тяжелые случаи ГЛД. По расчетным данным, в мире ежегодно возникает 50 млн случаев ЛД, в том числе в 500 000 случаев ГЛД нужна госпитализация, преимущественно детей. Темпы роста числа заболеваний ГЛД увеличиваются с каждым годом. Так, если с 1956 по 1980 г. в среднем выявлялось 29 803 случая ГЛД в год, то в 1981 – 1985 гг. статистика увеличилась до 137 504 случаев в год, а в 1986 – 1990 гг. – до 276 692 случаев заболеваний в год.
Уровни заболеваемости ЛД/ГЛД в 1996 г. колебались от 13,6 (Эль-Сальвадор) до 124,0 (Вьетнам) на 100 000 населения. Проблемными регионами являются Юго-Восточная Азия, западная часть Тихого океана и Американский регион в районе Карибских островов. Считается, что в Африканском регионе в связи с наличием переносчиков, быстрым ростом населения, урбанизацией, увеличением международного туризма заболеваемость ЛД будет увеличиваться (Gubler D. J., 1997). Однако крупные вспышки ЛД в Африке возникали редко. Специальный анализ литературы в XIX и XX веках показал, что эпидемии возникали в Занзибаре, Буркина-Фасо, Египте, Южно-Африканской Республике и Сенегале. За последние 50 лет вспышки ЛД зарегистрированы в 15 странах, в том числе на Сейшельских, Коморских островах, острове Реюньон, в Джибути, Кабо-Верде и на Тайване.
В течение последних лет на Южном Тайване постоянно возникали вспышки ЛД, где циркулировало не менее 2 из 4 штаммов вируса. С. – H. Lin [et al.] (2012) описали эпидемиологию лихорадки с 2003 по 2009 г. Установлены важные для данной территории эпидемиологические особенности; в частности, максимальные показатели заболеваемости наблюдались в возрасте 55 – 64 года, сопровождались высокой летальностью.
Эпидемии ЛД носят выраженный сезонный характер. Так, во Вьетнаме нарастание заболеваемости начинается с июня, достигает пика в августе – сентябре и завершается в ноябре. Характерное сезонное распределение заболеваемости связано с температурой окружающего воздуха и количеством переносчиков, которое определяется в основном количеством осадков и в меньшей степени относительной влажностью. Спорадические случаи могут регистрироваться в течение всего года.
Группы риска. В эпидемический процесс вовлекаются в основном дети. В структуре заболевших во Вьетнаме доля детей до 14 лет составила 69,8 %, причем в южной части страны удельный вес детей был самым высоким – 96,7 %. ГЛД чаще встречается у детей до 1 года при первичном заражении и связана, по-видимому, с тем, что они получают антитела от матери. У детей от 3 до 7 лет, подростков и взрослых ГЛД возникает при повторной инфекции. Во Вьетнаме чаще болеет сельское население и жители пригородов.
Восприимчивость к вирусу денге у населения, не имеющего иммунитета, по-видимому, составляет 100 %. Иммунитет типоспецифический, недостаточно изучен. Перенесение болезни, обусловленной одним вирусом, обеспечивает длительную защиту, но не предохраняет от заражения вирусом другого типа, причем это может произойти в тот же сезон. При повторном заражении вирусом другого типа усиливается тяжесть болезни и увеличивается риск развития геморрагической формы лихорадки с шоковым синдромом.
Патогенез и патоморфология. Вирус денге проникает в организм человека, если его укусил зараженный комар. Репликация вируса происходит в регионарных лимфоузлах, сосудистом эндотелии. Вирусемия отмечается с конца инкубационного периода, за несколько часов до клинических проявлений и в течение 3 – 5 дней лихорадочного периода. С кровью вирус ЛД попадает в печень, мышцы, костный мозг, соединительную ткань. Клетки с паразитирующим вирусом подвергаются цитолизу и отторгаются. Вследствие цитолиза поврежденных клеток наступает вторичная вирусемия, сопровождающаяся повторной волной лихорадки.
Морфологические изменения при типичной форме болезни изучены недостаточно в связи с благоприятным течением болезни. При геморрагической форме, кроме дистрофических изменений, обнаруживают множественные геморрагии и кровоизлияния в различные органы ткани.
Клиника. Инкубационный период составляет в среднем 4 – 7 дней с колебаниями от 3 до 14 дней. Болезнь протекает в двух формах: классическая ЛД и ГЛД. Общие симптомы: интоксикационный синдром (слабость, недомогание, головная боль), двухволновая лихорадка (в первые сутки, по окончании инкубационного периода подъем температуры тела до 38 – 41 °C, на 3 – 4-е сутки температура опускается до нормальных значений, затем наблюдается второй пик повышения температуры до высоких цифр); сильный озноб, пятнисто-папулезная сыпь, которая сопровождается зудом и оставляет после себя шелушение.
Классическая форма (костоломная лихорадка) характеризуется доброкачественным течением (без развития геморрагического синдрома): интоксикационный синдром (слабость, вялость), двухволновая лихорадка, сильный озноб, насморк, воспаление и покраснение слизистых оболочек глаз, головная боль, давящая боль в глазных яблоках, светобоязнь, боль в мышцах, суставах, позвоночнике, конечностях, нарушение сна, аппетита, появление горечи во рту; увеличение лимфатических узлов. На 5 – 6-й день появляется пятнистая и папулезная сыпь с локализацией на груди, внутренней поверхности плеч, затем распространяется на туловище и конечности, сопровождается зудом и оставляет после себя шелушение.
Геморрагическая форма (шоковый синдром денге) сопровождается развитием тромбогеморрагического синдрома. Характерны: двухволновая лихорадка, сильный озноб, головная боль, першение в горле и кашель, мышечные и суставные боли, наблюдающиеся редко, отечность лица, покраснение слизистых; точечная сыпь (на разгибательных поверхностях локтевых и коленных суставов); на 3 – 5-й день развивается пятнисто-папулезная сыпь на туловище с распространением на лицо и конечности. Высыпания сопровождаются зудом и оставляют после себя шелушение. Боли в области желудка или по всему животу сопровождаются рвотой (иногда с примесью крови). Может появиться обильный, жидкий стул, многократная рвота; гепатомегалия. Через 2 – 7 дней температура тела может нормализоваться, означая начало процесса выздоровления. При тяжелом течении состояние больного может резко ухудшиться и развиваются геморрагический синдром, гиповолемический шок как результат уменьшения объема крови.
Атипичная форма протекает на фоне: высокой температуры тела; сильных головных болей, мышечных болей; наличия высыпаний (как при классической форме), отсутствия увеличенных лимфатических узлов, что является отличительным признаком.
Летальность при классической ЛД не превышает 0,1 – 0,5 %, при геморрагической – достигает 5 %, а среди детей – 15 – 20 %.
Диагностика основана на идентификации вируса в ПЦР, выявлении сероконверсии с 4-кратным увеличением титров антител в парных сыворотках, взятых до 6-го дня от начала болезни и в период реконвалесценции, антигены в аутопсийной ткани обнаруживаются с помощью флюоресценции. Наличие IgM в сыворотке свидетельствует об острой инфекции.
Лихорадка денге у путешественников. ЛД относят к заболеваниям с высоким риском возникновения у путешественников, посещающих эндемичные страны. Обычно это классическая форма ЛД, которая часто не диагностируется. Инцидентность ЛД колеблется от 10,2 до 30 на 1000 лиц/мес. Она зависит от места, продолжительности путешествия и сезона. Сероэпидемиологические исследования парных сывороток у шведских путешественников в тропические страны показало, что инцидентность ЛД после возвращения по данным серопозитивности составила 6,7: 1000 (Leder K. [et al.], 2013). ЛД среди вернувшихся путешественников составляет 16 % от всех лихорадочных заболеваний (Ratnam I. [et al.], 2013).
Из эндемичных стран ЛД завозится туристами в экономически развитые страны. Лица, зараженные различными серотипами вируса денге, заносят их в страны, где имеются соответствующие переносчики, поэтому возможны повторные случаи лихорадки автохтонного характера.
Активизация эпидемического процесса у путешественников связана с таковой в эндемичных регионах земного шара. Так, в Африке эпидемия лихорадки денге возникла в Кабо-Верде, Сенегале, на островах Индийского океана вблизи Африки (Майотте, Реюньон). С 2009 г. возникли вспышки ЛД в Малазии, на Филиппинах, в Сингапуре, на Шри-Ланке, во Вьетнаме. Среди стран Центральной, Южной Америки и на Карибах вспышки зарегистрированы в Аргентине, Бразилии, Колумбии, Коста-Рике, Доминиканской Республике, Эль-Сальвадоре, Французской Гвиане, Гваделупе, Гондурасе, Перу и Пуэрто-Рико. По материалам Европейской системы слежения за завозными случаями заболеваний ЛД, только от 2 до 8 % завезено из Африки, 54 – 61 % из Азии и 25 – 31 % из Латинской Америки. При сопоставлении показателей лихорадочных заболеваний среди путешественников из Африки, Азии и Южной Америки установлено, что самый высокий показатель лихорадочных заболеваний был у путешествующих по Африке (371: 1000), минимальный (143: 1000) после посещения Южной Америки (Freedman D. O. [et al.], 2006).
ЛД наиболее подробно освещена в американской литературе вследствие высокой частоты заносов путешественниками и возникновения заболеваний автохтонного характера. Доля случаев ЛД и ГЛД среди заболевших лихорадкой путешественников, вернувшихся в США из эндемичных районов, колебалась от 2,9 до 8,0 на 100 больных. ЛД была лидирующей причиной лихорадочных заболеваний у путешественников как в Южную Америку, так и в Азию (Tomashek K. M., 2010). Выявлены локальные вспышки ЛД в США после заноса инфекции.
Увеличение активности ЛД в Азии, Африке привело к росту частоты заносов в США. С 1986 по 1994 г. зарегистрировано 937 случаев ЛД во всех штатах США, прежде всего штаты Нью-Йорк, Массачусетс, Техас, Джоржия, Вашингтон, Флорида и Калифорния (всего 420 случаев, или 45 %) (Rigau-Perez J. G. [et al.], 1997). В более позднем исследовании (Mohammed H. P. [et al.], 2010) сообщается о 1196 подозрительных случаях ЛД в 49 штатах США и округе Колумбия. Из них 334 случая (28 %) были лабораторно подтверждены, 597 (50 %) оказались лабораторно негативными и 265 (22 %) лабораторно не обследованы. Доля лабораторно подтвержденных случаев увеличивалась с 25 до 39 % с 1996 по 2005 г. Идентифицировано 36 вирусов денге, 10 из них принадлежали к типу 1, 11 – к типу 2,7 – ктипу3и8 – ктипу 4. Заражение американских путешественников произошло на Карибах (23 %), в Мексике и странах Центральной Америки (20 %) и Юго-Восточной Азии (17 %).
В 2007 г. около 1 млн случаев ЛД были и зарегистрированы только у американцев. ЛД стала более превалентной по сравнению с малярией среди путешественников, вернувшихся из стран Карибского региона, Южной Америки и Центральной и Юго-Восточной Азии (Gubler D. J., 1997).
R. Luce [et al.] (2010) провели анализ всех случаев ЛД в США с 1996 по 2008 г. До 2005 г. среднее число заболеваний было низким (33,5 случая), а с этого года стало нарастать, составив в среднем в 2006 – 2008 гг. 244 случая. В 2007 г. инцидентность была более 370 на 1 млн путешественников (рис. 5).
Геморрагическая ЛД в США с 1996 по 2008 г. наблюдалась у 19 % больных, в то время как в ранних исследованиях (Gill J., [et al.] (1999) во Флориде доля ГЛД составила 39 %, то есть в 2 раза больше. Отмечена также локальная передача лихорадки во Флориде и Техасе комарами Ae. аegypti и Ae. аlbopictus (Frout A. [et al.], 2010).
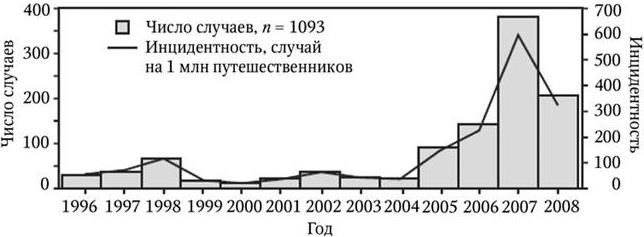
Рис. 5.
Вопрос об аутохтонной ЛД стал возникать чаще в связи с появлением заносов в США, Франции, Греции и другие страны и включением в процесс передачи таких переносчиков, как Ae. albopictus (La Ruche G. [et al.], 2010; Gjenero-Margan I. [еt al.], 2011).
J. M. Brunkard [et al.] (2007) провели сравнительное серологическое обследование населения пограничных территорий – штата Техас и Мексики с целью выявления аутохтонных заболеваний ЛД. Установлены существенные различия в частоте серопревалентности на сравниваемых территориях, свидетельствующие о большей распространенности ЛД в пограничной области Мексики по сравнению с США. Паст-инфекция ЛД у американцев диагностирована в 40 %, а у мексиканцев – в78%случаев, различие обусловлено более благоприятными условиями для размножения комаров, плохим санитарным состоянием населенных пунктов в Мексике, отсутствием кондиционирования воздуха в жилищах людей и др.
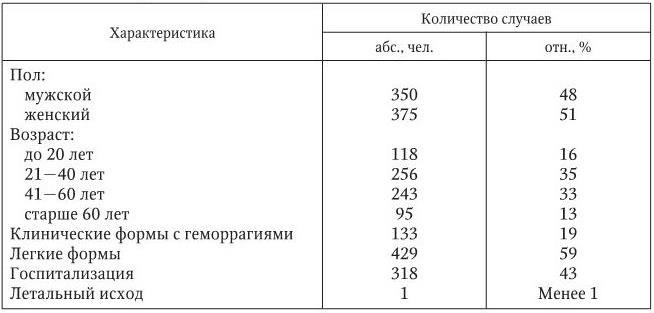
Характеристика лабораторно подтвержденных случаев ЛД среди путешественников США в 2006 – 2008 гг. представлена в табл. 4.
Основными группами риска явились взрослые лица 21 – 60 лет. По состоянию на 28 декабря 2010 г. в США зарегистрировано 436 случаев ЛД в 32 штатах, в том числе в штате Флорида – 125, Нью-Йорк – 116 заболеваний (Knowlton K. [et al.], 2009). Эти и другие авторы отмечают, что в США на границе с Мексикой может возникать ежегодно от 110 000 до 200 000 случаев заболеваний. Об этом свидетельствуют исследования, показавшие, что в 40 % проб сывороток крови жителей Техаса выявлялась сероконверсия и в 2005 г. на границе Техаса с Мексикой зарегистрировано более 7000 случаев заболеваний ЛД.
Таблица 4
Характеристика лабораторно-подтвержденных случаев лихорадки денге среди путешественников США в 2006 – 2008 гг.
Серопревалентность ЛД изучена в США в нескольких группах населения:
– лица, родившиеся в эндемичных странах, но проживающие в США;
– жители неэндемичных стран, которые более 1 года находились на эндемичных территориях;
– лица, родившиеся в неэндемичных странах, но кратковременно путешествовавшие в эндемичной стране.
Частота выявления антител в иммуноферментном анализе (ИФА) в группах – 51,0, 40,0 и 6,9 %. Таким образом, факт рождения в эндемичной стране и длительное путешествие по ней свидетельствуют о высокой превалентности антител к вирусам ЛД (Sanchez-Vegas C. [et al.], 2013).
T. Anderson [et al.] (2011) описали небольшую вспышку ЛД среди миссионеров, находившихся в октябре 2010 г. на Гаити в течение 7 – 11 дней. Интересно отметить, что все миссионеры прошли консультации перед путешествием, но только 48 % имели информацию о ЛД и 24 % использовали репелленты. Из анамнеза следует, что у 29 % заболевших отмечались повторные укусы комарами.
C 3 октября по 25 ноября 2012 г. на оcтрове Мадейра (Португалия) среди местного населения возникла большая вспышка ЛД: заболел 1891 человек. 29 человек были путешественниками из Великобритании, Германии, Франции, Швеции и Финляндии. Болели преимущественно лица от 25 до 64 лет (59,9 %). Доля детей составила 12,7 %.
16 случаев ЛД описано в августе и декабре 2012 г. в Финляндии, куда она была завезена туристами, отдыхавшими в Португалии и заразившимися во время вспышки на о. Мадейра. Выделенный штамм вируса принадлежал серотипу 1, который филогенетически группировался с американским штаммом вируса из Колумбии и Венесуэлы. Переносчиками вируса были комары Аe. aegypti и Ae. albopictus (Huhtamo E. [et al.], 2013).
Анализ заносов ЛД с 1983 по 2005 г. в страны Западной Европы свидетельствует об их происхождении из Таиланда, Индии, Южной Америки, Юго-Восточной Азии и Африки. В 2010 г. геморрагическая ЛД типа 3 завезена туристами в Швецию, Францию с Коморских островов и из Занзибара (Gautret P., 2010). В Швеции, например, 100 завозных случаев ЛД зарегистрированы с ноября 2007 г. по январь 2009 г. В основном шведские путешественники заражались в Таиланде (Heddini A. [et al.], 2009), который ежегодно посещают почти 350 000 граждан Швеции. Только в 2013 г. в Германию завозом обусловлено 870 случаев ЛД. Описан один случай заражения аутохтонной ЛД в Японии с последующим завозом заболевания в Германию. Затруднения в диагностике этого случая связаны с тем, что, помимо высоких титров антител к вирусу денге, у больной выявлены высокие титры антител к вирусу японского энцефалита, ЛЗН и ЖЛ – вирусам семейства Flaviviridae (Schmidt-Chanasit J. [et al.], 2014).
Отмечен рост числа случаев, связанных с завозом, в динамике по годам. Эти данные подтверждаются клинически и широкими серологическими исследованиями.
В последние годы исследователи столкнулись с проблемой заноса ряда заболеваний, протекающих однотипно и связанных с заражением при укусах комаров. В Италии в 2010 г. предпринято специальное исследование с целью выявить истинную распространенность ЛД, лихорадки Чикунгунья и ЛЗН. При обследовании 79 лихорадящих путешественников выявлено 14 случаев ЛД, 1 случай Чикунгунья. Случаев ЛЗН не обнаружено, хотя зараженность комаров вирусом в 2010 г. составила 1,55 % (Gobbi F., 2012).
Заносы ЛД наблюдались не только в те страны, где она обычно не встречается, но и туда, где есть условия для ее распространения (например, Япония). По состоянию на 16 июня 2010 г. в Японию завезено 50 случаев, в том числе 3 ЛД из Танзании, которая как поставщик инфекции ранее не упоминалась (Moi M. L. [et al.], 2010). Наблюдались аналогичные заносы ЛД из тропических стран в Норвегию, во Францию.
D. Warrilow [et al.] (2012) провели анализ 140 случаев импортированной ЛД в Квинсленде (Австралия) в 2002 – 2010 гг. Большинство больных (77,9 %) заразились при путешествии в страны Азии: 26,4 % – вИндонезии, 10,7 % – вТаиланде, в 7,1 % – наФилиппинах, в 6,4 % – вИндиииТиморе соответственно,в5 % – во Вьетнаме и еще в 6 странах Азии. 13,6 % заражений наблюдалось в Папуа – Новая Гвинея.
В настоящее время большое внимание уделяют аутохтонным случаям заболеваний, которые возникают после завоза инфекции в страну с последующим местным распространением переносчиками (Chen L. H. [et al.], 2010, 2012; Tomasello D. [et al.], 2013). Так, в 2007 – 2012 гг. возникло 9237 аутохтонных случаев в Италии, Франции, Греции и на острове Мадейра, вызванных вирусом типа DENV-1 (Sousa C. A. [et al.], 2012). В Израиле, странах Европы, а также в США имеет место широкое распространение переносчика ЛД и лихорадки Чикунгунья — Ae. аlbopictus. В связи с этим Е. Leshem [et al.] (2012) провели в Израиле территориальное сопоставление между распространением комаров Ae. аlbopictus и живущих на этих территориях больных ЛД (41 человек) и 15 больных лихорадкой Чикунгунья из числа путешественников. Хотя авторы не обнаружили прямой связи между этими явлениями, они предполагают, что аутохтонные заболевания среди населения вполне возможны, но их выявление затруднено из-за отсутствия иммуносерологического мониторинга населения.
В России, по-видимому, завозные случаи до 2009 г. также имели место, но ранее не диагностировались и не регистрировались. Лишь в последние годы появились сообщения о случаях завоза в Москву (Сайфуллин М. А. [и др.], 2012), Ярославль (Андреева Н. П. [и др.], 2012), Новосибирск (Хохлова Н. И. [и др.], 2013, 2014) и Новокузнецк (Середа Т. В. [и др.], 2013), Липецк (Слюсарева Г. П. [и др.], 2014; и др.).
Динамика завозов в Россию: 2009 г. – 10 случаев, 2010 г. – 26 случаев, 2011 г. – 21 случай. 55 человек были в Южной и Юго-Восточной Азии. У 10,5 % больных были геморрагические формы, доля которых в России была существенно меньше (19 %) по сравнению с зарубежными (американскими) данными.
Описание 14 завозных случаев лихорадки у жителей Новосибирска свидетельствует о том, что все они заболели через 5 – 12 дней после приезда из Таиланда. Заболевшие поступили в стационар на 3 – 9-й день болезни с лихорадкой, ознобами, миалгиями и/или артралгиями. Лихорадочный период продолжался 3 – 8 дней. У 11 пациентов выявлена сыпь, у 10 – фарингит, у большинства – гепатоспленомегалия. Диагноз ЛД подтвержден обнаружением IgM в иммуноферментном анализе (ИФА), РНК вируса в ПЦР у 7 пациентов (Хохлова Н. И. [и др.], 2013). Только с мая 2011 по февраль 2014 г. в инфекционной больнице ЛД диагностирована у 34 человек, 32 из них заразились в Таиланде (Хохлова Н. И. [и др.], 2014).
В Санкт-Петербурге в 2012 и 2013 гг. зарегистрировано 22 случая ЛД у туристов, посетивших преимущественно Таиланд, Индию и Мексику. Диагностика заболевания в половине случаев была неправильной. Нередко при наличии специфической сыпи ставился диагноз токсикодермии (Нечаев В. В. [и др.], 2014). Не учитывался эпиданамнез у заболевших.
С учетом эпидемической ситуации и увеличением завозов ЛД в РФ в ЦНИИ эпидемиологии разработан и применен набор реагентов для выявления и дифференцировки типов вируса денге в биологическом материале методом обратной транскрипции в ПЦР (Колясникова Н. М. [и др.], 2013).
Мероприятия. В регионах, неблагополучных по ЛД независимо от ее формы, мероприятия должны быть направлены на все 3 звена эпидемического процесса. Они проводятся в соответствии с рекомендациями ВОЗ (WHO, 2009). В нашей стране при отсутствии переносчиков лихорадки мероприятия могут быть ограничены воздействием только на первое звено (источник инфекции). В южных регионах РФ, где имеются переносчики ЛД, необходимо проводить мероприятия в отношении всех трех звеньев эпидемического процесса.
Мероприятия, касающиеся источников инфекции. При выявлении случая заболевания ЛД/ГЛД и установления диагноза необходимо определить границы очага, в пределах которого комары могут передавать инфекцию людям. Как правило, таким очагом является весь населенный пункт. В случае заболевания туриста из страны, где нет условий для передачи инфекции (нет соответствующих переносчиков) в проведении мероприятий нет необходимости.
Больные и бессимптомные носители как источники инфекции нуждаются в защите от нападения переносчиков, их изолируют в помещения, недоступные для переносчиков. Больные ГЛД обязательно подлежат госпитализации, которая проводится по клиническим (жизненным) показаниям.
Мероприятия в отношении переносчиков включают их уничтожение (дезинсекция) и предупреждение их выплода. Они проводятся в следующих направлениях:
– снижение числа мест выплода переносчиков, то есть ликвидация водоемов, не имеющих хозяйственного значения;
– предупреждение возникновения новых мест выплода переносчиков (недопустимо засорение территории бытовым мусором, кожурой апельсинов, консервными банками и пр., где может скапливаться вода);
– истребление в водоемах переносчиков химическими и биологическими методами, например применение 1 % темофоса (10 г гранул на 100 л воды) против личиночной стадии перед началом сезонного подъема или предполагаемой вспышки заболеваний; во Вьетнаме Фан Ван Тханг (1999) апробировал биологический метод борьбы с личинками комаров Аe. аegypti путем заселения бытовых емкостей и резервуаров для хранения питьевой воды мезоциклопами, активно уничтожающими личинок комаров (Лекции по тропической медицине: в 10 ч. Часть 1. Геморрагические лихорадки, 2010).
– истребление взрослых комаров в природе (распыление с самолетов) и местах их дневок, то есть в жилище человека и подсобных помещениях (подворная обработка) с помощью различных инсектицидов, в частности малатиона.
Важное значение имеет работа с населением, которое должно знать о способах предупреждения размножения комаров, соблюдении санитарно-гигиенических требований по сбору, хранению и утилизации бытового мусора. Особенно важна такая работа с лицами, которые планируют совершать путешествия в неблагополучные по ЛД/ГЛД страны.
Мероприятия, направленные на восприимчивый организм, заключаются главным образом в защите от нападения членистоногих (защитная одежда, репелленты). Защита от комаров включает использование пологов над спальными местами и установление сеток на окна и двери жилых и производственных помещений. Для предупреждения заражений среди туристов, направляющихся в эндемичные по ЛД страны, важное значение приобретает врачебная консультация. Кроме того, в эндемичных регионах основной акцент делается на выявление лихорадящих больных среди контактных в пределах очага, исследование у них парных сывороток и изоляцию таких лиц от комаров.
Что касается специфической профилактики, то универсальной вакцины против ЛД, включающей все серотипы возбудителей, пока не существует, хотя моновакцины из каждого типа возбудителей получены. Ведущиеся в этом направлении исследования пока не обнадеживают. По сообщению T. P. Monath (2007), испытываются живые аттенуированные вакцины против ЛД и ЖЛ.
Поскольку ГЛД относится к инфекциям, подлежащим международному эпидемиологическому надзору, то на границах государств, свободных от этого заболевания, должны проводиться санитарно-ограничительные мероприятия в отношении переносчиков в транспортных средствах (дезинсекция), больных пассажиров и персонала (Guidelines for diagnostic, treatment, prevention and control, WHO, 2009).






