Эпидемиология. Механизм развития эпидемического процесса
Источники инфекции. Эпидемиологические закономерности ВГЛ Эбола и Марбург в настоящее время до конца не изучены. Остается неясным вопрос об источниках возбудителей. Исследование 30 000 млекопитающих, птиц, рептилий, амфибий, членистоногих с 1976 по 1998 г. показало, что вирус Эбола не был выявлен, за исключением некоторых генетических следов у 6 грызунов из Центральной Африканской Республики. Следы вируса Эбола были обнаружены в трупах горилл и шимпанзе, ставших источниками инфекции для людей во время вспышки 2001 – 2003 гг. Однако высокая летальность от инфекции обезьян этих видов не позволила считать их резервуаром инфекции (Pourrut X. [et al.], 2005). В настоящее время установлено, что источниками инфекции являются человекообразные и нечеловекообразные приматы (Rollin P. E. [et al.], 1999; 2012).
Обе инфекции эндемичны, приурочены к территориям Центральной Африки. Поэтому важно выявление резервуара вирусов в природе и механизмов их циркуляции. В первых из изученных эпидемий ВГЛ отмечена связь заболевших с приматами – африканскими обезьянами. Кроме эпидемии ВГЛ Марбург в 3 европейских городах, в последние годы была также установлена причастность обезьян как источников к нескольким эпидемиям этой лихорадки. Так, в 3 эпидемиях ВГЛ Эбола в Габоне в 1994 – 1996 гг. описана возможная роль обезьян. Первая эпидемия ВГЛ возникла у жителей на территории золотодобывающих поселков, где наблюдали случаи смерти обезьян. Вторая эпидемия началась с того, что все заболевшие (18 человек) снимали шкуру с трупов обезьян. В третьей эпидемии охотник из лагеря лесорубов умер от ВГЛ в начале июня, а в августе стало известно, что в соседнем лесу умерло несколько шимпанзе; позднее заболели еще два охотника, а в поселках заболели родственники лесорубов. В Кот д’Ивуаре, в национальном парке, от дикой шимпанзе заразилась сотрудница парка, причем у нее был выделен новый субтип вируса Эбола. Все эти примеры говорят о том, что несомненна роль обезьян как источников, но не как резервуара вирусов Марбург и Эбола для человека. После экспериментального заражения обезьяны выделяют вирус со слюной, мочой. Инфекция у обезьян протекает очень тяжело, как правило, с летальным исходом. Именно это обстоятельство позволяет сделать вывод, что обезьяны не являются естественным резервуаром вирусов в открытой природе, а сами переносят смертельную инфекцию. Остается неясным механизм поддержания циркуляции вирусов в межэпидемическом периоде.
Многочисленные экологические исследования по выявлению резервуара вируса Эбола проведены во время эпидемии в Конго в 1995 г. Было собрано более 3500 экземпляров грызунов, летучих мышей, рептилий, птиц, амфибий. Все тесты на присутствие у них вируса и антител к нему были отрицательными. Учитывая это обстоятельство, высказано предположение о значении летучих мышей как резервуаров инфекции. При экспериментальном заражении различных позвоночных животных вирусом Эбола только летучие мыши оказались инфицированными (Swanepoel R. L. [et al.], 1996). Отсутствие клинических признаков у зараженных мышей свидетельствует о том, что именно они резервуар инфекции. В 2002 – 2003 гг. среди 679 летучих мышей, отловленных в Габоне и Республике Конго, у 13 найдены фрагменты РНК вируса Эбола (Leroy E. M. [et al.], 2005). Среди них идентифицированы особи 3 типов, которые являются резервуарами вируса (Pourrut X. [et al.], 2005). Продолжение поиска резервуара вируса Эбола предпринято путем выявления антител к вирусу Эбола у фруктовых летучих мышей (Hayman D. T. [et al.], 2010; 2012). Эти же авторы в 2008 г. обнаружили антитела у единичных особей мышей Eidolonhelvum, которые обитали в курятниках. Последующее исследование 88 сывороток крови других видов фруктовых летучих мышей в районе Аккра (Гана) показало наличие антител к вирусу у 36,9 % особей. Попытки выявления резервуара вируса Эбола «Рестон» проведены среди летучих мышей на Филиппинах. Антитела выявлены у 31 % летучих мышей только одного вида (Taniguchi S. [еt al.], 2011). В Африке подобные летучие мыши были инфицированы вирусами Эбола Заир и Марбург (Towner J. S. [et al.], 2009).
В Кении исследованы печень, селезенка, легкие 272 летучих фруктовых мышей на наличие вируса Марбург. РНК вируса обнаружена в объединенном материале мышей Rousettus aegyptiacus, обитающих в пещере.
Риск заражения людей от особей из естественного резервуара происходит редко, за исключением тех случаев, когда люди контактируют с больными животными (гориллами, шимпанзе), то есть с источниками инфекции. В последние годы на первый план выходит заражение людей от крупных летучих мышей, мясо которых традиционно употребляется в пищу местным населением в Конго, Гвинее, Сьерра-Леоне как в сыром, так и в обжаренном виде, при этом инактивация вируса не происходит.
Все наблюдения и описания эпидемий ВГЛ Эбола и Марбург свидетельствуют о том, что больной человек является необычайно опасным источником инфекции. Он наиболее заразен в остром периоде болезни. Вирусы содержатся в крови, носоглоточной слизи, моче, фекалиях, конъюнктивальной жидкости пациентов. После эпидемии Эбола в Конго в 1995 г. были проведены проспективные наблюдения за переболевшими, чтобы установить длительность выделения вирусов реконвалесцентами. Эти наблюдения продолжались в течение 6 – 12 мес. от начала болезни. Установлено, что в крови вирус постоянно находится в первые 3 – 6 дней, но выявляется с 7 – 16-го дня болезни. В моче, фекалиях людей, у которых есть вирус в слюне, сперме, вагинальной слизи, вирусы обнаруживали в течение 3 мес. от начала заболевания. Например, РНК вируса Эбола с помощью ПЦР обнаруживали до 82 – 91-го дня в ректальных, вагинальных и конъюнктивальных смывах, а в сперме – до 101 дня. Таким образом, больной является источником инфекции не только в остром периоде болезни, но и в периоде реконвалесценции.
Механизм передачи. Пути циркуляции вирусов Эбола и Марбург в природе неизвестны. Резервуаром инфекции считаются летучие мыши, от которых заражаются приматы и человек. В то же время имеется достаточно наблюдений, свидетельствующих о путях заражения человека от человека. Среди них:
– гемо-контактный путь реализуется при контакте с выделениями и с предметами, загрязненными кровью и другими секретами больного; факторами риска являются нарушение целостности кожных покровов у соприкасавшихся с больным, контакт с жидкостями организма, рвотными массами; во время вспышки лихорадки Эбола в Судане контакт с больным приводил к заражению в 10 – 20 % случаев (Dowell S. F. [et al.], 1999);
– половой путь распространения;
– воздушно-капельный путь распространения возможен с учетом данных об эпидемиях и очагах (в условиях эксперимента H. M. Weingartl [et al.]. (2012) доказали, что инфицированные свиньи, которых содержат в соседних клетках с обезьянами, могут эффективно передавать вирус Эбола и обосновали гипотезу аэрогенной передачи вируса от свиней приматам, прямого контакта между животными и приматами не было);
– трансмиссивной путь заражения лихорадками Эбола отрицается на основании экспериментов по заражению комаров рода Aedes и Culex вирусом «Рестон» и отсутствии у них репликации вируса (Turell M. J. [et al.], 1996);
– искусственные пути заражения людей реализуются при проведении медицинских лечебно-диагностических процедур – инъекций, операций, реанимационных мероприятий. Доказана роль плохо обеззараженных инструментов в заражении пациентов стационаров.
При реализации искусственных путей заражения людей отмечается самая высокая летальность при ВГЛ – до 100 %. Внутрибольничные заражения пациентов и медицинского персонала – одна из самых серьезных проблем в борьбе с ВГЛ.
Патогенез и клиника лихорадки Эбола. Воротами инфекции являются микротравмы кожи, слизистые оболочки респираторного, пищеварительного тракта и половых путей. На месте входных ворот инфекции видимых изменений не развивается. Вирус поражает многие типы клеток: моноциты, макрофаги, дендритные, эндотелиальные клетки, фибробласты, гепатоциты, клетки надпочечников и эпителия (некроз, апоптоз), он играет роль пускового механизма противовоспалительных цитокинов. Уже в первые часы после заражения блокируется система комплемента, наступает паралич иммунной системы.
Характерна быстрая генерализация инфекции с развитием общей интоксикации и тромбогеморрагического синдрома. При обследовании населения в эндемичных районаху7%обнаружены антитела к вирусу Эбола, что позволяет допустить возможность легкого и даже бессимптомного течения инфекции, которые остаются невыявленными.
Инкубационный период продолжается от 4 до 6 дней. По клинической симптоматике лихорадка Эбола сходна с лихорадкой Марбург. Различная тяжесть болезни и частота летальных исходов при эпидемических вспышках в различных регионах связана с биологическими и антигенными различиями выделенных штаммов вируса.
Патогенез лихорадки Марбург. Воротами инфекции служат поврежденная кожа, слизистые оболочки (ротовая полость, глаза). Характерна диссеминация вируса. Размножение его может происходить в различных органах и тканях (печень, селезенка, легкие, костный мозг, яички и др.). Вирус длительно обнаруживается в крови, сперме (до 12 нед.). Патогистологические изменения отмечаются в печени (ожирение печеночных клеток, некробиоз отдельных клеток, клеточная инфильтрация), почках (поражение эпителия почечных канальцев), селезенке, миокарде, легких. Множественные мелкие кровоизлияния в различных органах (головной мозг и др.). Клинические проявления мало отличаются от таковых при лихорадке Эбола.
Клинические проявления лихорадки Эбола были детально изучены во время вспышки заболевания в 1995 г. в городе Киквит (Заир), а также в 2007 – 2008 гг. в Уганде (Bwaka M. A. [et al.], 1999; MacNeil А. [et al.], 2010). Cредний инкубационный период во вспышках составил 12,7 ± 4,3 дня, а в некоторых случаях продолжался до 25 дней. Во время эпидемии Эбола в Киквите инкубационный период у медицинских работников был 6,2 дня с колебаниями от 5 до 8 дней (Bwaka M. A. [et al.], 1999). Минимальный инкубационный период – 2 сут.
В целом определено, что инкубационный период при геморрагических лихорадках Эбола и Марбург может колебаться от 2 до 21 сут. Заболевание начинается всегда остро и без предвестников. Начальная стадия болезни характеризуется быстрым повышением температуры тела до 39 – 40,5 °C с выраженными ознобами, сильной головной болью, нарастающей слабостью. Одновременно развивается диарея энтеритного характера, иногда – тошнота и рвота, боли в эпигастрии. С 3 – 4-гo дня болезни присоединяются боли в животе, жидкий, водянистый стул, у половины больных отмечается примесь крови в стуле или наблюдаются признаки желудочно-кишечного кровотечения. У отдельных больных появляется рвота с примесью желчи и крови в рвотных массах.
Важным клиническим симптомом считается развитие острого фарингита и тонзиллита со своеобразным ощущением «шара в горле». Отмечается покраснение слизистой оболочки глотки, кончик и края языка также красные; на твердом и мягком небе, языке появляются пузырьки, при вскрытии которых образуются поверхностные эрозии.
Позднее присоединяются сухой кашель, одышка и боли в грудной клетке. Появляются симптомы дегидратации (сухость слизистых оболочек, снижение тургора кожи, олигоанурия). К 5 – 7-му дню болезни состояние больных ухудшается, появляется обильная сливающаяся макуло-папулезная и геморрагическая петехиальная сыпь. Размеры элементов геморрагической сыпи нередко увеличиваются до экхимозов (рис. 17).
После эпидемии лихорадки Эбола были изучены клинические проявления у 123 переболевших и контактных лиц (Rowe A. K. [et al.], 1999). Установлено, что артралгии и миалгии наблюдались у 48,0 и 23,8 % реконвалесцентов против 11,5 и 2,9 % у контактных лиц. У 51 % реконвалесцентов имелись IgG-антитела. Результаты свидетельствуют о незавершенности инфекционного процесса и, косвенно, о возможной роли реконвалесцентов в передаче инфекции.
У половины больных на 4 – 5-й день болезни на туловище появляется сыпь (иногда похожая на сыпь при кори). Сыпь распространяется на верхние конечности, шею, лицо. Иногда беспокоит кожный зуд. В это же время развивается геморрагический синдром, появляются кровоизлияния на коже (у 62 % больных), в конъюнктиву, слизистую оболочку полости рта. В это время появляются носовые, маточные, желудочно-кишечные кровотечения. В конце 1-й, иногда на 2-й неделе признаки токсикоза достигают максимальной выраженности. Появляются симптомы обезвоживания, инфекционно-токсического шока. Иногда наблюдаются судороги, потеря сознания. В этот период больные нередко умирают.
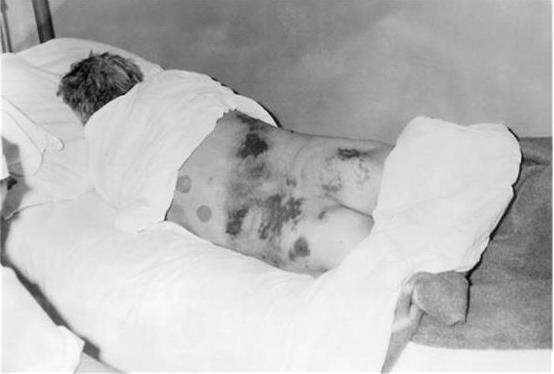
Рис. 17.
Клиническая картина периода разгара болезни соответствует проявлениям инфекционно-токсического шока: бледность кожи, цианоз, тахипноэ, резкая тахикардия, падение артериального давления, острое почечное повреждение. Развитие и прогрессирование синдрома диссеминированного сосудистого свертывания ухудшает прогноз. Типичны маточные, носовые, уретральные и желудочно-кишечные кровотечения (см. цв. вклейку, рис. 18).
Отмечаются локальные кровоизлияния в местах инъекций и небольших травм, положительные симптомы щипка и Кончаловского. В этом периоде болезни развивается тяжелая энцефалопатия вплоть до комы, у отдельных больных наблюдается кратковременное психомоторное возбуждение.
Исходы инфекции во время эпидемии в Киквите проанализированы у 105 женщин, 15 из которых (14 %) были беременными. В 10 случаях (66 %) беременность завершилась абортом. Летальность у беременных составила 95,5 % и превысила общую летальность (77 %) во время эпидемии (Mupapa K. [et al.], 1999).
Период выздоровления затягивается на 3 – 4 нед. В это время отмечаются облысение, периодические боли в животе, ухудшение аппетита и длительные психические расстройства. К поздним осложнениям относят поперечный миелит и увеит. Смертность – от 30 до 90 %. Летальный исход наступает обычно на 6 – 14-й дни болезни, причиной которого является инфекционно-токсический шок, геморрагический шок или полиорганная недостаточность. У выживших наблюдается длительная (до 5 мес.) астенизация, снижение умственной и физической работоспособности, постепенное купирование анемии.
Диагностика. Лихорадка Эбола клинически не отличается от лихорадки Марбург и часто диагностируется как другая ГЛ, тропическая малярия, брюшной тиф и паратифы, шигеллез, риккетсиоз, боррелиоз. Дифференциальная диагностика проводится с лептоспирозом, лихорадкой Цуцугамуши, чумой, Ку-лихорадкой, трипаносомозом, висцеральным лейшманиозом. При исследовании крови больных лихорадкой Эбола выявляется нейтрофильный лейкоцитоз, увеличение скорости оседания эритроцитов (СОЭ), анемия и тромбоцитопения.
Важным в диагностике является тщательно собранный эпидемиологический анамнез и анамнез путешествий, выявление контактов с летучими мышами, приматами в неблагополучных районах.
Подтверждением диагноза является изоляция вируса, обнаружение его антигена, РНК в ПЦР во время острой фазы болезни. В 2013 г. в РФ сертифицирован отечественный набор праймеров для определения РНК вируса в ПЦР в биологических жидкостях. Иммунофлюоресценция подтверждает присутствие вируса в клеточной культуре, материалом служат кровь, моча, мокрота и аутопсийные материалы больных.
Существенное значение имеет поиск антител в крови и оценка их в динамике с интервалом 5 – 7 дней в РСК или ИФА. Нарастание титров однозначно подтверждает лихорадку Эбола. Обнаружение иммуноглобулинов класса М позволяет верифицировать диагноз при однократном исследовании.
При исследовании крови отмечаются анемия, лейкопения, тромбоцитопения, анизоцитоз, пойкилоцитоз, базофильная зернистость эритроцитов.
Лечение. Больные подлежат немедленной изоляции и госпитализации в отделения интенсивной терапии и реанимации боксированного типа. Этиотропная терапия до настоящего времени не разработана. Попытки использования иммуноглобулинов от реконвалесцентов или гетерогенных гипериммунных сывороток не влияли на течение и исход заболевания. Все известные современные противовирусные средства также оказались неэффективными. Разрабатываемый в США с 2012 г. препарат МВ-003, представляющий собой моноклональные антитела к 3 основным гликопротеидам вируса, проходит стадию доклинических испытаний, но принципиально он способен улучшать исходы заболевания только при назначении в конце инкубационного периода или в самом начале болезни.
В США проходят регистрацию в Управлении по контролю качества пищевых продуктов и лекарственных средств США (FDA) 2 препарата, относящихся к нуклеотидным аналогам, потенциально эффективных и в инкубации, и в разгаре болезни: AVI7288 (геморрагическая лихорадка Марбург) и AVI7537 (геморрагическая лихорадка Эбола).
Патогенетическая терапия строится на следующих принципах:
– Всем больным проводится оксигенотерапия увлажненным кислородом через носовые катетеры.
– Оральная регидратация должна доминировать на начальном этапе болезни при отсутствии рвоты. Следует учитывать, что при геморрагических лихорадках Марбург и Эбола имеется как гипертоническая дегидратация за счет высокой лихорадки, повышенных потерь жидкости с перспирацией и потоотделением, так и изотоническая дегидратация за счет диарейного синдрома. В связи с этим недостаточно назначения воды, чая, соков и морсов. Основу должны составлять глюкозо-солевые растворы типа глюкосолана, регидрона и т. п., которые позволяют возместить не только потери воды, но и электролитов. Критериями эффективности оральной регидратации считаются купирование жажды, стабилизация центральной гемодинамики и общего состояния, восстановление диуреза.
– Оральная регидратация должна дополняться внутривенной инфузионной терапией, которая становится единственным методом детоксикации и регидратации при многократной рвоте и у больных с энцефалопатией. Рекомендуются сбалансированные полиионные кристаллоидные растворы (раствор Рингера, ацесоль, хлосоль или аналогичные) в суточной дозе 1,2 – 3,0 л и более в зависимости от степени дегидратации. Критериями эффективности считают восстановление диуреза, тургора кожи и центральной гемодинамики.
– При развитии инфекционно-токсического шока необходимо изменить тактику инфузионной терапии: кристаллоидные растворы следует чередовать с низко– или среднемолекулярными коллоидными растворами в соотношении 4: 1 – 6: 1. Целесообразно внутривенное введение глюкокортикостероидов в суточной дозе 90 – 180 мг в пересчете на преднизолон, предпочтение отдается гидрокортизону. В начальной стадии инфекционно-токсического шока с явлениями гиперкоагуляции показано непрерывное введение низкомолекулярного гепарина (фраксипарин) в суточной дозе 30 – 40 ЕД/кг, далее переходят на введение гепарина в дозах, обеспечивающих время свертывания крови в пределах 15 – 20 мин. На фоне гепаринотерапии проводят инфузии свежезамороженной плазмы, в которой содержится антитромбин 111, препятствующий образованию микросгустков крови. В качестве дезаггрегантов применяют курантил, трентал, компламин и раствор реополиглюкина.
Стабилизация гемодинамики проводится под контролем центрального венозного давления путем постоянной инфузии допамина в дозе 4 – 10 мкг/кг/мин, при неэффективности допамин сочетается с норадреналином в дозе 0,5 – 3,5 мкг/кг/мин или добутамином в дозе 5 – 20 мкг/кг/мин.
Важное значение в интенсивной терапии инфекционно-токсического шока при ГЛ являются своевременный перевод на искусственную вентиляцию легких (абсолютно показана при частоте дыхания выше 36 в минуту, парциальном давлении кислорода РаО2 ниже 70 %), коррекция кислотно-основного состояния крови, предупреждение дисфункции жизненно важных органов, интенсивная терапия полиорганной недостаточности, адекватная нутритивная поддержка и энергообеспечение.
При выраженном геморрагическом синдроме, который при ГЛ обусловлен не только прямым повреждением вирусом эндотелия капилляров, но и развитием синдрома диссеминированного внутрисосудистого свертывания вследствие инфекционно-токсического шока, следует дополнять вышеперечисленную интенсивную терапию следующими компонентами:
– повторным введением свежезамороженной плазмы с гепарином (из расчета 5000 ЕД гепарина на 1 л плазмы);
– введением 1 – 2 доз тромбоцитарной взвеси при критическом падении числа тромбоцитов в периферической крови;
– внутривенной инфузии ингибиторов протеаз ( апротинин по 200 000 ЕД каждые4чвсочетании с гепарином (до 250 ЕД/кг/сут).






