Микробиология бруцеллеза
Бруцеллез – своеобразное заболевание людей и животных, вызываемое бактериями рода Brucella. В России ежегодно регистрируется около 500 первичных заболеваний людей бруцеллезом.
Человек заражается бруцеллезом главным образом от домашних животных (овцы, козы, коровы, свиньи, северные олени – главный резервуар возбудителя в природе). Болезнь существует давно и была описана под названиями, определяемыми ее географическим распространением (мальтийская, неаполитанская, гибралтарская, средиземноморская лихорадка).
Возбудитель открыт в 1886 г. Д. Брюсом, который обнаружил его в препарате из селезенки солдата, умершего от мальтийской лихорадки, и назвал мальтийским микрококком – Micrococcus melitensis. Было установлено, что основным носителем его являются козы и овцы, а заражение происходит при употреблении сырого молока от них. В 1897 г. Б. Банг и Б. Стрибольт обнаружили возбудителя инфекционного аборта коров – Bacterium abortus bovis, а в 1914 г. Дж. Траум открыл возбудителя инфекционного аборта свиней – B. abortus suis. Проведенное в 1916 – 1918 гг. А. Ивенс сравнительное изучение свойств M. melitensis и B. abortus bovis показало, что они почти не отличаются друг от друга по многим свойствам. В связи с этим было предложено объединить их в одну группу, названную в честь Брюса – Brucella. В 1929 г. И. Хеддльсон включил в эту группу B. abortus suis и предложил род Brucella разделить на 3 вида: Brucella melitensis (Micrococcus melitensis), Brucella abortus (B. abortus bovis) и Brucella suis (B. abortus suis).
Заболевание людей и животных, вызываемое бруцеллами, было решено называть бруцеллезом. В последующем род Brucella пополнился еще тремя видами: B. ovis выделен от баранов, страдающих эпидидимитами (1953), B. neotomae – от кустарниковых крыс (1957) и B. canis – от гончих собак (1966). По классификации Берджи (2001), бруцеллы относятся к классу Alphaproteobacteria.
Бруцеллы обладают сходными морфологическими, тинкториальными и культуральными свойствами. Они представляют собой грамотрицательные мелкие кокковидные клетки диаметром 0,5 – 0,7 мкм и длиной 0,6 – 1,5 мкм (см. цв. вкл., рис. 96.1), располагаются беспорядочно, иногда парами, не имеют жгутиков, не образуют спор и капсул. Содержание Г + Ц в ДНК составляет 56 – 58 мол %. Бруцеллы являются аэробами или микроаэрофилами, в анаэробных условиях не растут. Температурный оптимум для роста 36 – 37 °C; рН 7,0 – 7,2; хорошо растут на обычных питательных средах, но лучше – с добавлением сыворотки или крови. Рекомендуемые среды: питательный агар с добавлением сыворотки (5 %) и глюкозы; агар, приготовленный на картофельном настое, с добавлением 5 % сыворотки; кровяной агар; мясо-пептонный бульон. Особенностью B. abortus является потребность ее в повышенном содержании CO2 (5 – 10 %) в атмосфере роста. Очень характерен для бруцелл медленный рост, особенно в первых генерациях: при высеве от человека и животных рост иногда появляется через 2 – 4 нед. Колонии бруцелл бесцветны, выпуклые, круглые – S-формы, или шероховатые – R-формы, нежные и прозрачные вначале, с возрастом мутнеют.
Колонии B. canis, B. ovis и 5-го биотипа B. suis всегда имеют R-форму. Рост бруцелл в бульонных средах сопровождается равномерным помутнением. Для роста бруцелл необходимы тиамин, биотин, ниацин. Бруцеллы ферментируют глюкозу и арабинозу с образованием кислоты без газа, не образуют индола, восстанавливают нитраты в нитриты. Образование сероводорода наиболее сильно выражено у B. suis.
В общей сложности у бруцелл с помощью иммуноэлектрофореза экстрактов, приготовленных из разрушенных ультразвуком клеток, обнаружено 10 – 14 антигенных фракций. Бруцеллы имеют общий родоспецифический антиген, различные другие соматические антигены, в том числе видоспецифические М (преобладает у B. melitensis), А (преобладает у B. abortus) и R (у шероховатых форм). Антигены М и А обнаруживаются также и у других видов (биоваров) бруцелл, но в разных соотношениях, что необходимо учитывать при их идентификации (табл. 26). Обнаружены антигены, общие с Francisella tularensis, Bordetella bronchiseptica и Y. enterocolitica (серотип 09). В связи с тем, что некоторые признаки у бруцелл варьируют, вид B. melitensis подразделяют на 3 биовара, вид B. abortus – на 9 и B. suis – на 5 биоваров. Для их дифференциации на виды и биотипы и идентификации используют комплекс признаков, включающий в себя, помимо морфологических и тинкториальных свойств, также потребность в CO2 для роста, способность расти на средах в присутствии некоторых красителей (основной фуксин, тионин, сафранин), выделять H2S, образовывать уреазу, фосфатазу, каталазу (активность этих ферментов наиболее сильно выражена у B. suis, они же не растут на среде с сафранином), чувствительность к тбилисскому бактериофагу, агглютинация моноспецифическими сыворотками (табл. 30). В случае необходимости используют дополнительные метаболические тесты: способность окислять некоторые аминокислоты (аланин, аспарагин, глутаминовую кислоту, орнитин, цитруллин, аргинин, лизин) и углеводы (арабинозу, галактозу, рибозу, D-глюкозу, L-эритритол, D-ксилозу).
Четвертый биовар B. suis, поскольку его основным носителем являются не свиньи, а северные олени, и с учетом других его особенностей целесообразно выделять в качестве самостоятельного вида Brucella rangiferis.
К пятому биовару B. suis относят культуры, выделенные от абортировавших коров и овец и имеющие стойкую R-форму бруцелл.
Отношение бруцелл к тбилисскому фагу: в обычном рабочем разведении фаг лизирует только B. abortus. Однако в дозе, равной десяти рабочим, фаг лизирует, хотя и слабо, штаммы B. suis и B. neotomae.
Резистентность бруцелл. Бруцеллы обладают относительно высокой устойчивостью во внешней среде. Они сохраняются во влажной почве и в воде до 2 – 3, а при температуре 11 – 13 °C – до 4,5 мес.; в непроточных водоемах – до 3 мес.; в молоке – до 273 дней; в масле – до 142 дней; в сыре – до 1 года; в брынзе – до 72 дней; в кислом молоке – до 30 дней; в кефире – до 11 дней. Однако они очень чувствительны к высокой температуре – при 70 °C погибают через 10 мин, а при кипячении – за несколько секунд. Пастеризация молока при 80 – 90 °C вызывает их гибель через 5 мин. Бруцеллы чувствительны также к различным химическим дезинфектантам.
Таблица 30
Дифференциация бруцелл на виды и биовары
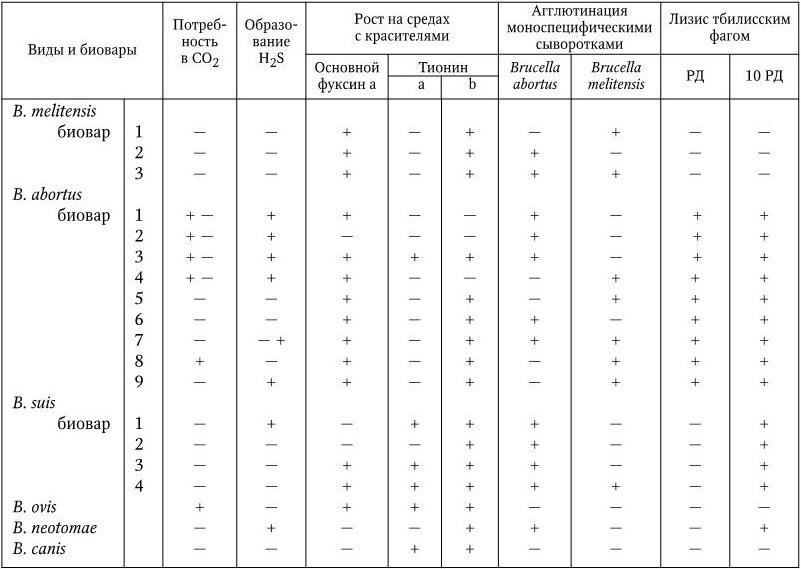
Примечание.а – концентрация в мкг/мл среды 1: 25 000; b – концентрация в мкг/мл среды 1: 50 000; РД – рабочая доза фага (стандартное тест-разведение).
Факторы патогенности. Бруцеллы не образуют экзотоксина. Их патогенность обусловлена эндотоксином и способностью подавлять фагоцитоз, предотвращать «окислительный взрыв». Конкретные факторы, подавляющие фагоцитоз, изучены недостаточно. Патогенность бруцелл связана также с гиалуронидазой и другими ферментами. Существенно важным является то, что бруцеллы обладают сильнейшим аллергенным свойством, которое во многом определяет патогенез и клинику бруцеллеза.
Особенности эпидемиологии. Основными носителями бруцелл являются овцы, козы (B. melitensis), крупный рогатый скот (B. abortus), свиньи (B. suis) и северные олени (B. rangiferis). Однако они могут переходить и на многие другие виды животных (яки, верблюды, буйволы, волки, лисицы, грызуны, ламы, сайгаки, бизоны, лошади, зайцы, ежи, куры и др.). Особенно большую эпидемиологическую опасность представляет переход Brucella melitensis на крупный рогатый скот, так как в этом случае она сохраняет свою высокую патогенность для человека. Из всех видов наиболее патогенным для человека в нашей стране является B. melitensis. Он служит причиной заболевания людей более чем в 95 – 97 % всех случаев бруцеллеза. B. abortus, как правило, вызывает латентную форму болезни, и только в 1 – 3 % отмечаются клинические проявления. Еще реже заболевание вызывает B. suis (менее 1 %). Патогенность бруцелл варьирует в зависимости не только от вида, но и от биовара. В частности, биовары 3, 6, 7, 9 B. abortus по вирулентности не уступают B. melitensis. Американские варианты B. suis являются также высоковирулентными, поэтому в разных странах этиологическая роль отдельных видов бруцелл проявляется по-разному. Например, в Мексике основную роль в эпидемиологии бруцеллеза играет B. melitensis, в США – B. suis, а в Канаде и некоторых европейских странах – B. abortus. Не исключено, что биовары 3, 6, 7, 9 B. abortus возникли в результате миграции на крупный рогатый скот Brucella melitensis и ее трансформации.
У животных бруцеллез протекает в виде общего заболевания, картина которого бывает различной. Для крупного и мелкого рогатого скота наиболее характерные проявления болезни – инфекционные аборты, особенно если они носят массовый характер. У свиней аборты отмечаются реже, болезнь протекает как хронический сепсис с поражением суставов, яичек и других органов. От больных животных возбудитель выделяется с молоком, мочой, испражнениями, гноем и особенно обильно – в период выкидыша с плодом, околоплодными оболочками и истечениями из родовых путей, которые представляют наиболее заразительный материал. Обильное размножение бруцелл в оболочках плода связывают с наличием в них многоатомного спирта – эритритола, который служит важным фактором роста для бруцелл всех видов, кроме B. ovis.
Человек заражается от животных (от больного человека крайне редко) главным образом контактным или контактно-бытовым путем (80 – 90 % всех заболеваний). Алиментарный способ заражения наблюдается в основном при употреблении непастеризованного молока от больных животных или молочных продуктов, приготовленных из него, а также воды. Контактным или контактно-бытовым способом могут заразиться все лица, постоянно или временно имеющие дело с животными или животным сырьем в силу своей профессии (пастухи, скотники, доярки, ветеринарные работники и другие лица). Бруцеллы при этом проникают в организм человека через кожу или, значительно чаще, через слизистые оболочки полости рта, носа, глаза (заносятся грязными руками).
Особенности патогенеза и клиники. Инкубационный период при бруцеллезе варьирует от 1 нед. до нескольких месяцев.
По лимфатическим путям возбудитель попадает в лимфатические узлы; размножаясь, образует «первичный бруцеллезный комплекс», локализация которого зависит от места входных ворот, но чаще всего это лимфатический аппарат ротовой полости, заглоточные, шейные, подчелюстные железы и лимфатический аппарат кишечника. Из лимфатических узлов возбудитель проникает в кровь и распространяется по всему организму, избирательно поражая ткани лимфо-гемопоэтической системы. Бактериемия и генерализация процесса приводят к сильной аллергизации организма. Бруцеллез протекает как хрониосепсис. Это обусловлено незавершенным характером фагоцитоза. Находясь и размножаясь внутри клеток, в том числе фагоцитов, бруцеллы оказываются не доступными ни для антител, ни для химиопрепаратов. Кроме того, они могут превращаться внутри клеток в L-формы и в таком виде длительно персистировать в организме, а возвращаясь в исходную форму, вызывать рецидив болезни.
Клиника бруцеллеза очень многообразна и сложна. Она зависит прежде всего от аллергизации и интоксикации организма и от того, какие органы и ткани вовлечены в инфекционный процесс. Чаще всего страдают лимфатическая, сосудистая, гепатолиенальная, нервная, и особенно опорно-двигательная системы. Бруцеллезу свойственно длительное течение (иногда до 10 мес.), в тяжелых случаях он может приводить к длительной потере трудоспособности и временной инвалидности, но все же болезнь, как правило, заканчивается полным выздоровлением.
Постинфекционный иммунитет длительный, прочный, но возможны повторные заболевания. Иммунитет перекрестный (против всех видов бруцелл) и обусловлен Т-лимфоцитами и макрофагами. У иммунных людей и животных фагоцитоз носит завершенный характер. Роль антител в иммунитете заключается в стимуляции фагоцитарной активности. Положительная аллергическая реакция свидетельствует не только о сенсибилизации организма, но и о наличии иммунитета. Прорыв иммунитета может произойти при инфицировании большими дозами возбудителя или при его высокой вирулентности.
Лабораторная диагностика бруцеллеза осуществляется с помощью биологической пробы, бактериологического метода, серологических реакций, аллергической пробы Бюрне и метода ДНК – ДНК гибридизации. Материалом для исследования служат кровь, костный мозг, конъюнктивальный секрет, моча, грудное молоко (у кормящих матерей), реже – испражнения, околосуставная жидкость. Поскольку основным местом пребывания возбудителя в организме являются клетки гемо– или лимфопоэтической систем, предпочтение следует отдавать выделению гемо– или миелокультуры. При бактериологическом исследовании необходимо обеспечить условия для роста B. abortus (потребность в CO2). Идентификацию выделенных культур бруцелл проводят на основании указанных в табл. 30 признаков. К биологической пробе (заражение морских свинок) прибегают в том случае, когда материал сильно загрязнен посторонней микрофлорой и получить непосредственно из него чистую культуру возбудителя трудно. Серологические реакции могут быть использованы либо для обнаружения антигенов возбудителя, либо для выявления антител к нему. Для обнаружения бруцеллезных антигенов, которые могут циркулировать в крови либо в свободном виде, либо в виде комплексов антиген + антитело (ЦИК – циркулирующие иммунные комплексы), используют следующие реакции: РПГА (особенно с использованием эритроцитарных диагностикумов с моноклональными антителами к родоспецифическому антигену бруцелл); реакцию агрегат-гемагглютинации (РАГА); эритроциты несут антитела к бруцеллезным антигенам; реакции коагглютинации, преципитации и ИФМ. Для обнаружения антител в сыворотке больного используют: реакцию агглютинации Райта, реакцию Кумбса (для выявления неполных антител), реакцию иммунофлуоресценции в непрямом варианте, РПГА, ИФМ, РСК, ОФР, а также ускоренные реакции на стекле: Хеддльсона, розбенгал, латекс-агглютинации, непрямую реакцию гемолиза (эритроциты, сенсибилизированные ЛПС бруцелл, в присутствии антител и комплемента лизируются).
Специфическая профилактика осуществляется с помощью живой вакцины, приготовленной из штамма B. abortus (живая бруцеллезная вакцина – ЖБВ), только в очагах козье-овечьего бруцеллеза. Вакцина применяется накожно, однократно. Ревакцинацию проводят только лицам, у которых проба Бюрне и серологические реакции отрицательны. Поскольку ЖБВ обладает сильным аллергенным действием, вместо нее предложена химическая бруцеллезная вакцина (ХБВ), приготовленная из антигенов клеточной стенки бруцелл. Она обладает высокой иммуногенностью, но менее аллергенна. Взвесь убитых бруцелл (убитая лечебная вакцина) или ХБВ могут быть использованы для лечения хронического бруцеллеза (стимулируют формирование постинфекционного иммунитета).






