Раковая МООМ
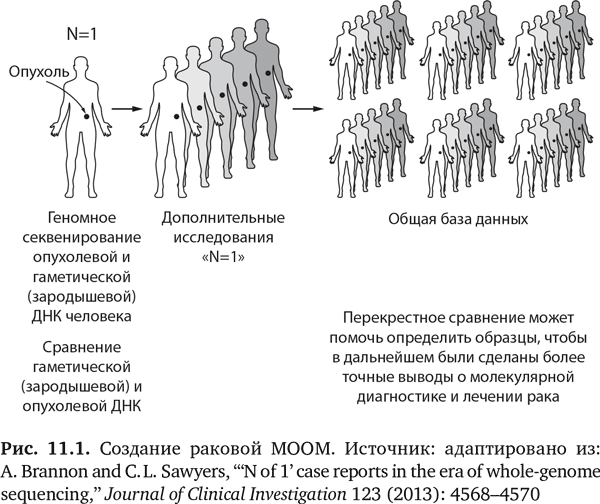
Еще в 2012 г. TechCrunch опубликовала статью «Облако вылечит рак» (The Cloud Will Cure Cancer)28. Это казалось непосильной задачей. Но всего год спустя образовалось то, что я бы классифицировал как первую раковую МООМ. Называлось это не так. Статья вышла под заголовком «Пациенты делятся ДНК для лечения болезней» (Patients Share DNA for Cures)29. Четыре различных института объединили усилия, каждому отводилась своя роль, отличная от других, и они дополняли друг друга. Это были Орегонский университет медицинских наук, который выступал как координирующее научное учреждение, Общество борьбы с лейкемией и лимфомой обеспечивало гранты и выступало в роли группы по защите прав пациентов, компания Illumina занималась секвенированием, а Intel – обработкой данных и разработкой информационного ресурса. Имея грант в размере $8,2 млн на три года работы, этот консорциум зарегистрировал 900 пациентов с лейкемией или лимфомой (известными как «жидкие» опухоли), их раковые клетки секвенировали; все эти данные, объединенные с клиническими данными, данными по лечению и результатам, должны сформировать новый информационный ресурс. Графически это представлено на рис. 11.1, цель которого – показать, как происходит секвенирование опухоли, вместе с зародышевой ДНК человека, и эти данные потом сравниваются с базой данной по 900 пациентам, страдающим раком. Идея в том, чтобы, когда придет 901-й пациент, его врач мог войти в базу данных и посмотреть, какое лечение лучше всего сработало в случаях пациентов с такими же или похожими мутациями, при этом информация фильтруется по возрасту, полу и другим потенциально релевантным характеристикам.
Теперь уже действуют еще несколько МООМ. Исследовательский фонд множественных миелом организовал подобное исследование, в котором участвовала 1000 пациентов, а на его поддержку было выделено $40 млн30. Американское общество онкологов-клиницистов поддерживает такие инициативы, а его директор Аллен Личтер сказал: «Эти случаи – настоящая сокровищница информации, если мы просто соединим их все вместе»31. Их проект под названием CancerLinQ заключается в сборе данных о лечении и его результатах по 100 000 пациенток с раком груди из 27 онкологических центров по всей стране31, 32а. Хотя пока там не содержится геномной информации, проект отражает «признание того факта, что большие данные необходимы для будущего медицины»31. Всего за несколько лет Flatiron Health смогла быстро собрать данные более чем из 200 раковых центров в США, по более чем 550 000 пациентам, с намерением анализировать и делиться данными для принятия правильных решений по лечению32b, 33. Хотя информационный ресурс не включает секвенирование опухолей или данные «омик», компания по производству программного обеспечения получила крупные инвестиции от Google Ventures и планирует включать их в будущем.
На самом деле раковая МООМ – это не то, что может еще больше увеличить добавленную стоимость медицины. Она необходима для того, чтобы надежды, возлагаемые на геномную медицину, стали реальностью. При секвенировании раковой ткани обнаруживаются тысячи мутаций. В идеале секвенируется и зародышевая ДНК каждого человека, что тоже выявляет миллионы вариантов в сравнении с эталонным геномом человека. Целенаправленный отбор всех этих вариантов, чтобы найти сигнал – мутации, ведущие к раку, – невозможен, если вы смотрите только на опухолевый геном, в котором будет много мутаций, не являющихся причиной рака. Таким образом, подобрать терапию на основании геномных данных невозможно. Все эти проблемы лучше всего решать с помощью информационного ресурса, в котором собраны все данные. В 2014 г. для решения этой сложной проблемы была запущена глобальная инициатива по краудсорсингу под названием DREAM Somatic Mutation Calling Challenge34, 35. Ее цель – используя облачную платформу Google, создать эффективный инструмент для определения мутаций. Но это всего лишь один компонент пакета. На самом деле платформа сильна лишь в той мере, в какой снабжена информацией о мутациях, видах лечения и результатах, поступающей от максимально возможного количества людей, с которыми она работает. И при всем восторге, который вызывают эти разнообразные маломасштабные МООМ, все-таки открытая медицина может быть значительно сильнее.
Представьте, что все пациенты с диагнозом «рак» становятся частью глобального информационного ресурса. ГИС каждого пациента, сканограммы, виды проводившегося лечения и результаты – все это вводится в эту МООМ. Там могут быть данные по сотням тысяч и даже миллионам людей с различной наследственностью и различными основными показателями, причем это детальная и важная информация по каждому человеку. Можно представить различные виды и подвиды рака, каждую мутацию и путь развития и их комбинации, ресурс должен автоматически обновляться и модернизироваться по мере введения данных по каждому человеку, его лечению и результатам лечения. Мы перешли от одного пациента к населению всего мира, ко всем людям, у которых может развиться рак, а развивая и поддерживая МООМ, мы теперь удвоили ставку в игре на демократизацию рака. Да, база данных МООМ может служить важнейшим преимуществом для улучшения результатов лечения пациентов. Жизнь нельзя растянуть навечно: мы все смертны. Но прецезионное лечение, построенное на таком подходе, может быть гораздо более эффективным в сохранении качества и продолжительности жизни.
Да, это фантазия, мечта, и маловероятно, что она когда-нибудь полностью осуществится. Для этого потребовалось бы снести все барьеры и границы, разделяющие страны и культуры, и нет никакого реального прецедента такого глобального кооперирования и гармонизации данных. (Если говорить о сломе барьеров, то мы определенно видели это в случае МООК, на которые записывались люди из всех стран на планете.) Мы даже не можем толком разобраться с многочисленными центрами в США, которые активно занимаются секвенированием опухолей у раковых больных. В статье в The New York Times под названием «Раковые центры собираются картировать гены пациентов» (Cancer Centers Racing to Map Patients' Genes) рассказывается: «Крупные научно-медицинские центры в Нью-Йорке и по всей стране тратят огромные средства на гонку вооружений для борьбы с раком»36. Свое мнение высказала Сьюзен Десмонд-Хеллман, которая возглавляла комиссию прецезионной медицины в Национальной академии наук: «При таких достижениях, как электронные медицинские карты и малозатратное секвенирование ДНК с высокой пропускной способностью, есть возможность воспользоваться рутинными случаями клинической практики для биомедицинских и клинических исследований. Тем не менее бо?льшая часть данных не собирается, не сводится воедино в одном месте и никак не соотносится с бурным ростом молекулярных данных»30. Но если мы действительно хотим выиграть войну против рака, то именно внедрение массовой открытой онлайн-медицины может стать победной тактикой и выигрышным билетом.
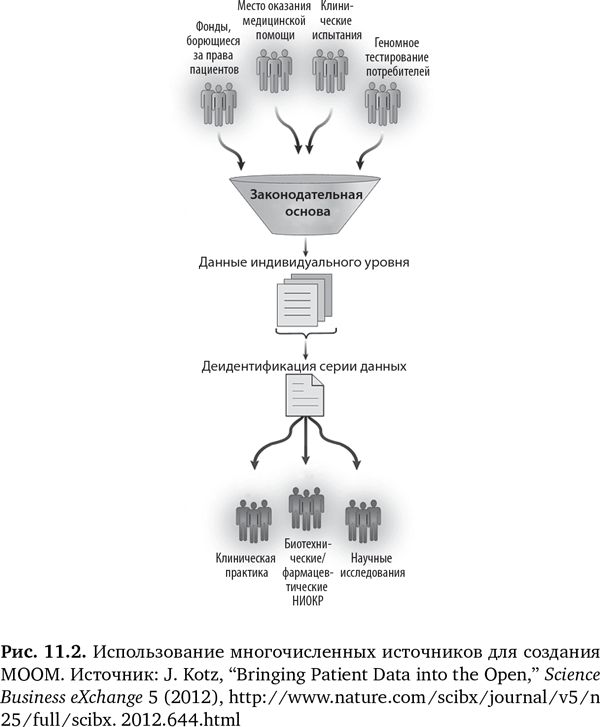
Много идей высказывается и о том, как создавать МООМ из многочисленных источников, как показано на рис. 11.2. Данные должны поступать не только от врачей, но и от самих пациентов, от компаний, проводящих тестирование и работающих непосредственно с потребителями (типа 23andMe), от фондов по защите прав пациентов, интернет-сообществ, объединяющих людей с одинаковыми проблемами со здоровьем (типа PatientsLike Me), и большого количества клинических испытаний. Часто приводят в пример эффективное сотрудничество между организацией, борющейся за права пациентов, и биотехнической компанией, в результате которого Vertex Pharmaceuticals разработала препарат калидеко. Фонд кистозного фиброза предоставил всю информацию по пациентам, что в конечном счете привело к успешному лечению на основании геномных данных; пять лет, потраченных на создание препарата, составляют почти треть времени, которое обычно требуется на разработку нового лекарственного препарата30. Как сказал Патрик Сун-Шионг, миллиардер, занимающийся биотехнологиями, и основатель Abraxis, «в прошлом единое целое не собиралось из разрозненных кусков науки, техники и цифровых технологий. Теперь это происходит. Мне нравится искать оптимальные структуры в науке и жизни. Именно этим я и занимаюсь. Только взаимосвязанная, мгновенно срабатывающая, управляемая система здравоохранения по типу „от молекулы до производителя“ может подключать науку и экономить деньги»37a, 37b.






