Состав белоксинтезирующей системы
Синтез белка осуществляется с помощью сложной белоксинтезирующей системы. В ее состав входят следующие компоненты.
1. Рибосомные субъединицы 30S и 50S, которые у прокариот и в митохондриях и хлоропластах эукариот образуют рибосому 70S; или субъединицы 40S и 60S, образующие у эукариот рибосому 80S.
2. Матричная РНК (мРНК).
3. Полный комплект двадцати аминоацил-тРНК, для образования которых необходимы соответствующие аминокислоты, аминоацил-тРНК-синтетазы, тРНК и АТФ. Аминоацил-тРНК (аа-тРНК) – это заряженная энергией и связанная с тРНК аминокислота, готовая для подвоза к рибосоме и включения в синтезирующийся на ней полипептид.
4. Белковые факторы инициации (у прокариот – IF-1, IF-2, IF-3).
5. Белковые факторы элонгации (у прокариот – EF-Tu, EF-Ts, EF-G).
6. Белковые факторы терминации (у прокариот – RF-1, RF-2, RF-3).
7. Некоторые другие белковые факторы (ассоциации, диссоциации субъединиц, высвобождения и пр.).
8. Гуанозинтрифосфат (ГТФ).
9. Неорганические катионы: двухвалентные – Mg2+ или Ca2+ – и одновалентные – K+ или HN4+ – в определенной концентрации.
Основным компонентом белоксинтезирующей системы является рибосома. Она объединяет все компоненты в единый комплекс. Рибосомы – «святая святых» клетки, так как именно на них совершается самое удивительное таинство живой материи – биологический синтез белка. Информация, содержащаяся в геноме, расшифровывается и материализуется в виде белков на рибосомах. Без них проявление жизнедеятельности невозможно.
Вирусы и плазмиды потому и являются облигатными внутриклеточными паразитами, что у них отсутствуют собственные рибосомы, и для реализации генетической информации (т. е. для проявления своей жизнедеятельности) они используют рибосомный аппарат клетки-хозяина.
Универсальности генетического кода соответствует универсальность механизма его расшифровки и реализации.
В природе существует только два класса рибосом – 70S и 80S. Они имеют сходную молекулярную структуру и механизм функционирования, хотя и различаются по размерам, составу и специфичности белков и белковых факторов. Схематический состав рибосом 70S и 80S показан на рис. 20.
Далее весь процесс биосинтеза белка будет рассматриваться на примере работы рибосом 70S.
Белковые факторы инициации (англ. initiation factors – IF) получили свое название потому, что они участвуют в организации активного комплекса (70S-комплекса) из субъединиц 30S и 50S, мРНК и инициаторной аминоацил-тРНК (у прокариот – формилметионил-тРНК), который «запускает» (инициирует) работу рибосом – трансляцию мРНК.
Белковые факторы элонгации (англ. elongation factors – EF) участвуют в удлинении (элонгации) синтезируемой полипептидной цепи (пептидила).
Белковые факторы терминации, или освобождения (англ. – release factors – RF) обеспечивают кодон-специфическое отделение полипептида от рибосомы и окончание синтеза белка.
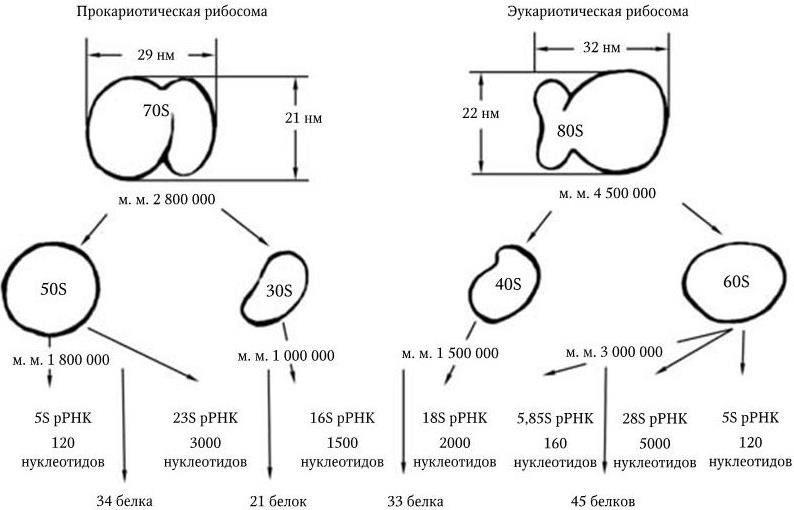
Рис. 20
Для осуществления трансляции необходимо участие ГТФ. Потребность белоксинтезирующей системы в ГТФ очень специфична: он не может быть заменен ни одним из других трифосфатов.
На биосинтез белка клетка затрачивает энергии больше, чем на синтез любого другого биополимера. Образование каждой новой пептидной связи требует расщепления четырех высокоэнергетических связей (АТФ и ГТФ): двух для того, чтобы нагрузить аминокислотой молекулу тРНК, и еще двух в ходе элонгации – одну при связывании аа-тРНК и другую при транслокации.
Рибосома выполняет следующие функции, необходимые для биосинтеза белка.
1. Функция динамического связывания и удержания всех компонентов белоксинтезирующей системы, благодаря чему создаются условия для встречи и взаимопрочитывания двух основных потоков информации, один из которых запрограммирован в мРНК, а другой – в антикодонах аа-тРНК; одновременно формируется биологическая машина, синтезирующая белок в строгом соответствии с последовательностью поступления в рибосому этой информации.
2. Каталитические функции, в частности образование пептидных связей между аминокислотами в синтезируемом полипептиде и гидролиз ГТФ.
3. Функция механического перемещения (транслокации): транслокация растущего пептида, связанного с тРНК, с одного участка рибосомы на другой и продвижение рибосомы вдоль мРНК. Выполнение этих функций обеспечивается наличием на рибосоме особых активных участков. Таких участков три (см. рис. 25). С одним из них связывается мРНК. Два других разных участка предназначены для связывания молекулы тРНК. В одном из них, получившем название пептидил-тРНК-связывающего участка, или Р-участка, прикрепляется тРНК, присоединенная к растущему концу полипептидной цепи – донорная тРНК. В другом – аминоацил-тРНК-связывающем участке, или А-участке, – связывается только что поступившая молекула тРНК, нагруженная аминокислотой – акцепторная тРНК. В обоих участках молекулы тРНК прочно прикрепляются лишь в том случае, если их антикодоны комплементарны кодонам мРНК и с ними спариваются. А– и Р-участки располагаются очень близко друг от друга, и поэтому связанные с ними молекулы тРНК связываются с двумя соседними кодонами в молекуле мРНК. Благодаря такому близкому расположению донорной тРНК, несущей пептидил, и акцепторной тРНК, несущей активированную аминокислоту, облегчается образование пептидных связей в синтезируемой полипептидной цепи. В процессе элонгации карбоксильный конец растущего пептидила отделяется в Р-участке от молекулы донорной тРНК и образует пептидную связь с аминокислотой, присоединенной к молекуле акцепторной аа-тРНК. Эта реакция катализируется не белковым ферментом, а особым фрагментом РНК большой субъединицы рибосомы (50S), который назвали рибозимом (по аналогии с «энзимом»).
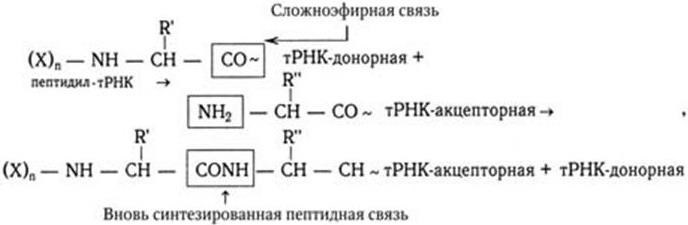
где (X)n – аминоацильные звенья пептидил-тРНК, R – радикалы.