9.3. Анализ результатов хирургического лечения рефлюксСИБР-ассоциированной бронхиальной астмы
Не менее 300 млн. населения планеты в настоящее время страдают от астмы, а еще 100 млн., согласно прогнозу специалистов, астма настигнет к 2025 г. (Маев И. В. и соавт., 2002) [1]. На астму приходится один из 250 летальных исходов во всем мире (Benjamin Stanley В., 1989) [2]. В России, как и в большинстве стран Европы, астма распространена среди 5 % взрослого населения и 7 % детей, т. е. в стране насчитывается около 7 млн. больных бронхиальной астмой (БА) (Чучалин А. Г., 1997) [3].
Еще в 1934 году J. Bray [цит. по Геллер и соавт, 1990)] указал на связь между патологией ЖКТ и бронхиальной астмой (БА), отмечая растяжение желудка после еды с возникновением вагусных рефлексов. В 1946 году С. Mendelson [цит. по [цит. по Геллер и соавт, 1990)] 4] наблюдал аспирацию желудочного содержимого, которое вызывало синдром, напоминающий астму. В ряде работ более позднего периода показана отчетливая связь между желудочно-пищеводным рефлюксом (ЖПР) и БА (Геллер Л. И. и соавт., 1990; Филимонов Л. Б. и соавт., 1990; Mainsfield LE, Stein M., 1989; Puchala M.) [5, 6, 7; 8]. По данным этих авторов, у больных с БА желудочно-пищеводный рефлюкс выявляется в 40–82 % случаев.
Рефлюксная теория возникновения бронхиальной астмы в настоящее время получила свое развитие. Накопление новых экспериментальных и клинических данных позволило по-новому интерпретировать патогенетическую связь БА и заболеваний дигестивного тракта.
Так, практически в 90 % случаев у больных БА выявляется дисбактериоз (Пархоменко Л. К. и соавт., 1994) [4]. Галимова Е. С. (2010) указывает, что в 57,8 % наблюдений у больных БА, имеющих сочетанное поражение органов желудочно-кишечного тракта (ЖКТ), обнаружены дисбиотические сдвиги различной степени выраженности, при этом дисбиоз I–II степени наблюдался у 69,2 %, дисбиоз III степени – у 30,8 % пациентов. Мы получили аналогичные данные (Мартынов В. Л., 2013) [10] обследовав пациентов с доказанной по результатам ирригоскопии недостаточностью илеоцекального клапана и сопутствующей бронхиальной астмой. Нарушение микробного пейзажа тонкой кишки выявлено у 33 пациентов (80,8 % обследованных): I степени – у 3 человек, II степени – у 19, III степени – у 9, IV степени – 2 человек. Наиболее выраженные изменения касались анаэробной микрофлоры: полное отсутствие или дефицит бифидумбактерий – у 26 пациентов, лактобактерий – у 17, избыточный рост кишечной палочки – у 16, другой условно-патогенной флоры (протей, клебсиелла, кандида) – у 12 пациентов.
В связи с этим положительный эффект оказывает энтеросорбция (Бутвин С. Н., 1989) [11], основными механизмами которой являются детоксикация клеточного содержимого, освобождение от эндотоксинов, сорбции пищевых аллергенов, гистамина и других биологически активных веществ, бактериальных антигенов, нормализация кишечной микрофлоры, иммунокоррегирующий эффект (сорбция циркулирующих иммунных комплексов, воздействие на лимфоидную ткань кишечника, блокирование иммуноглобулина Е).
Также улучшения состояния больных БА можно добиться при помощи разгрузочно-диетической терапии, механизмы действия которой связаны с подавлением аллергического воспаления, исключением пищевых аллергических продуктов с последующим проходом макромолекулярных остатков пищи через печень и лимфатическую систему ЖКТ в общий кровоток (Кокосов А. Н., 1982) [12]. Элиминация продуктов инфекционной сенсибилизации, происходящих из ЖКТ, путем гемосорбции, плазмафереза, сопровождается стимуляцией коры надпочечников с выбросом в кровь глюкокортикоидов, а также угнетением иммунопатологического компонента патогенеза БА (Чучалин А. Г., 1997) [3].
В настоящее время ни у кого не вызывает сомнения, что морфологической основой БА является аллергическое воспаление бронхов. В его развитии существенную роль играют нарушения функций местной системы иммунитета, представленной лимфоидной тканью, ассоциированной со слизистыми оболочками (MALT – mucosa-associated lymphoid tissue). Это – относительно автономный орган иммунной системы, причем эволюционно он формируется, прежде всего, в ЖКТ и раньше, чем другие органы, как центральные, так и периферические, не связанные с кишечником (Галимова Е. С. и соавт., 2010) [9].
Центральные органы иммунной системы в онтогенезе формируются из кишечной ткани, в частности, из глоточных карманов. Пейеровы бляшки тонкой кишки являются важнейшими поставщиками Т– и В-лимфоцитов для лимфоидных образований всех слизистых оболочек и эндокринных органов (Goodall R. J. R. Et all., 1981) [13]. В связи с этим понятен интерес исследователей к состоянию слизистой оболочки кишечника у больных БА и к особенностям течения БА у больных, имеющих различные воспалительные заболевания желудочно-кишечного тракта. По мнению Chernow B. (1979), имеются доказательства диффузного вовлечения MALT у больных БА, поскольку у них найдены субклинические воспалительные изменения слизистой ЖКТ.
С одной стороны, различные аллергены, попадая в кишечник имея своей мишенью, как и в бронхах, эпителий, могут вызывать развитие аллергического воспаления в эпителиальных тканях пищеварительной системы. Развитию патологического процесса в дыхательных путях могут способствовать и изменения иммунной системы (нарушение соотношения Т– и В-лимфоцитов, дефицит ряда компонентов комплемента, повышение уровня IgG, М, А и др.) выявленные некоторыми авторами у пациентов с Н. Pylori-ассоциированной патологией (Goodall R. J. R., 1981) [13]. Таким образом, несомненна связь между воспалительным процессом в слизистой бронхов и желудочно-кишечного тракта.
Подтверждением тому явилась работа Галимовой Е. С. (2010), которая показала, что у больных с БА в 67,8 % случаев диагностирована патология верхних отделов пищеварительного тракта. Из них поверхностный гастродуоденит – 21,1 %, атрофический гастрит – 8,9 %, эрозии двенадцатиперстной кишки (12-перстной кишки) – 4,5 %. Дуодено-гастральный рефлюкс и дискинезия желчевыводящих путей выявлены соответственно у 22,2 и 11,1 % пациентов с БА.
Нами анализированы жалобы гастроэтероколитического характера у 202 пациентов, страдающих БА (Мартынов В. Л., 2013) [10]. Они предъявляли жалобы на боли (63 %) и тяжесть в животе (61 %), тошноту (49 %), отрыжку воздухом (61 %), срыгивание пищей (45 %), изжогу и горечь во рту (74 %), диарею и послабление стула (43 %), непереносимость молока и другой пиши (41 %), неприятный запах изо рта (52 %), вздутие и урчание в животе (62 %). По нашим данным (Мартынов В. Л., 2013) [10], синдром хронического нарушения дуоденальной проходимости определялся у 64 % (n=228) пациентов с недостаточностью баугиниевой заслонки. Это обстоятельство мы объясняем восходящим воспалением проксимальных отделов ЖКТ (за счет СИБР), нарушением функции клапанных структур, обеспечивающих однонаправленное движение химуса и повышением полостного давления в 12-перстной кишке, панкреато-биллиарном тракте и желудке. Итогом каскада рефлюксов становитcя гастро-эзофагеальный рефлюкс (ГЭР) и его последствия.
Обозначенная патогенетическая связь между рефлюксной болезнью дигестивного тракта и ее внепищеварительными проявлениями, в частности, бронхиальной астмой, реализуется через ключевой механизм – синдром избыточного бактериального роста тонкой кишки (СИБР). Основными, в этой связи, представляются механизмы бактериальной транслокации (Жаркова М. С. И соавт., 2012) [15] в общий кровоток через стенку кишки со значительной токсической и аллергенной нагрузкой на иммунную систему. Предиктом бактериальной транслокации и аутоинтоксикации являются повышенная деконъюгация желчных кислот (Oren Zaidel, Henry C. Lin., 2003; Quera R, et all., 2005) [16, 17] и разобщение латеробазальных межклеточных эпителиальных связей (Кучерявй Ю. А., 2013) [18], которые сопровождают прямое цитотоксическое влияние толстокишечной флоры на эпителиоциты слизистой оболочки кишечника.
Приводим клиническое наблюдение пациентки, которой произведена хирургическая коррекция рефлюксов пищеварительного тракта с сопутствующей бронхиальной астмой.
Пациентка П., 1963 года рождения, поступила в хирургическое отделение ГБУЗ Но «ГКБ № 12 г. Нижнего Новгорода» в сентябре 2013 г. с жалобами на горечь во рту, изжогу, отрыжку кислым, периодические боли в правом подреберье после еды, периодические умеренные боли по всему животу, постоянную тошноту, однократную рвоту без последующего облегчения, общую слабость. Отмечает похудание в течение 2 лет на 10–15 кг, периоды запоров, сменяющиеся послаблением стула, продолжительностью до 2 месяцев. Также предъявляла жалобы на урчание и вздутие живота. Отмечала приступы удушья чаще в ночное время, что требовало применения бронхолитиков.
Считает себя больной в течение 5 лет, когда после выраженного стресса (смерть близкого родственника) стали беспокоить указанные жалобы. Интенсивность жалоб нарастала, неоднократно амбулаторно обследовалась: на ЭФГДС выявлены признаки гастроэзофагеальной рефлюксной болезни, зияние кардии и привратника, дуодено-гастральный рефлюкс. С ее слов, лечение в поликлинике по месту жительства было безрезультативным, при этом заболевание неуклонно прогрессировало. Бронхиальная астма наблюдается в течение 4 лет. Последние два года постоянно принимает базисную противовоспалительную терапию, купирует приступы удушья бронхолитическими средствами не реже 2-х раз в месяц.
Отмечается отягощенный аллергологический анамнез: непереносимость антибиотиков пенициллинового ряда, димедрола, йода, бисептола, азитромицина, хлорида кальция, поливалентную пищевую аллергию. 5 лет назад перенесла лапаротомию по поводу фибромиомы матки.
Находится в пессимистическом настроении, отмечает, что жизнь стала серой, «беспросветной», ничего в собственном восприятии и в окружающей обстановке не радует, домашние хлопоты и обычные нагрузки на работе в тягость, признается в мысли, что «медленно, постепенно умирает».
Объективный статус. Состояние средней степени тяжести. Сознание ясное, в собственной личности, месте и времени ориентируется. Активна. Телосложение астеническое. Кожа и видимые слизистые бледные, кожа сухая, отмечается повышенное шелушение эпидермиса, гипотрофичные придатки кожи: ломкие, тусклые волосы и ногти. Периферические лимфоузлы не увеличены. Гемодинамика: АД 130 / 90 мм. рт. ст., ЧСС – 78 уд. / мин., пульс удовлетворительных качеств. В легких дыхание усиленное везикулярное, определяются единичные свистящие хрипы, ЧД – 18 движений в мин. Язык суховат, густо обложен белым налетом. Живот обычной формы, участвует в акте дыхания, симметричный, мягкий во всех отделах, при поверхностной пальпации отмечается незначительная боль в параумбиликальной области, в правой подвздошной области живота, при глубокой пальпации умеренная боль по ходу ободочной кишки, положительный симптом Герца. Мочеиспускание без особенностей. Дефекация на момент осмотра до 3–4 раз в сутки, безболезненная, стул кашицеобразный, плохо смывается со стенок унитаза, без патологических примесей.
В клинических и биохимических анализах крови и мочи – без патологии. Индикан мочи положительный. В анализе кала – признаки мальдигестии и мальабсорбции. Кал на дисбактериоз – дисбактериоз 3 степени.
При ирригоскопии подтверждена недостаточность баугиниевой заслонки. По результатам контрастной рентгеноскопии желудка (рис. 47) – пищевод и кардия свободно проходимы. Желудок правильной формы, удлинен, контуры ровные, смещаем. Складки слизистой продольные, утолщены. Перистальтика средней глубины. Луковица и подкова 12-перстной кишки без особенностей. Пассаж бария по кишечнику свободен. В горизонтальном положении желудок под куполом диафрагмы. На КТ брюшной полости (рис. 48) выявлены признаки хронического нарушения дуоденальной проходимости: артериомезентериальная компрессия (АМК) нижнегоризонтальной части 12-перстной кишки – расстояние между аортой и верхней мезентериальной артерией на уровне нижнегоризонтальной части 12-перстной кишки 6 мм. При исследовании функции внешнего дыхания: ЖЕЛвд – 3,09 (81,1 %), ФЖЕЛ –2,63 (71,66 %), ОФВ1–2,15 (69,92 %), Инд. Тифно – 81,72 (100,91), ПОС – 5,47 (80,36 %), МОС25–4,59 (75,51 %), МОС50–2,77 (62,29 %), МОС75– 1,03 (50,27 %), СОС – 2,33 (64,5). Заключение – умеренно выраженные нарушения легочной вентиляции обструктивного типа, нарушение бронхиальной проходимости на уровне мелких бронхов. ЖЕЛ на нижней границе нормы. При консультации пульмонолога выставлен диагноз: Бронхиальная астма, средней степени тяжести, стадия нестойкой ремиссии.
Пациентке выставлен клинический диагноз: Хроническое нарушение дуоденальной проходимости. Недостаточность баугиниевой заслонки. Бронхиальная астма, среднетяжелое течение, фаза нестойкой ремиссии.
08.10.2013 г. в плановом порядке выполнена операция: дуодено-еюностомия с межкишечным анастомозом по Брауну с «заглушкой» на приводящую петлю и баугинопластика по методикам проф. Мартынова В. Л. Послеоперационный период протекал гладко, пациентка выписана из стационара на 10-е сутки после операции. Рекомендации носили общий характер, связанные с перенесенной операцией на органах брюшной полости.
В послеоперационном периоде (1 год после операции) отмечает полное исчезновение умеренных болей по всему животу, нормализовалась частота дефекации, стул стал оформленным, исчезло постоянное чувство тошноты, изжога и отрыжка не беспокоили. Приступов бронхиальной астмы за прошедший год не отмечала, бронхолитиками не пользовалась. Сохранились признаки пищевой аллергии на цитрусовые, которые проявляются крапивницей, бронхоспазмов не отмечала. Фон настроения позитивный, бытовая и профессиональная жизнь эмоционально окрашены. Отмечает «интерес к жизни».
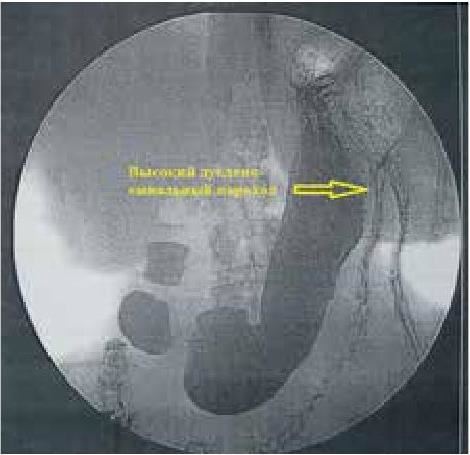
Рис. 47. Рентгеноскопия желудка. Определяется сглаженность слизистой оболочки, увеличенный «носкообразный» желудок. Пациентка П.
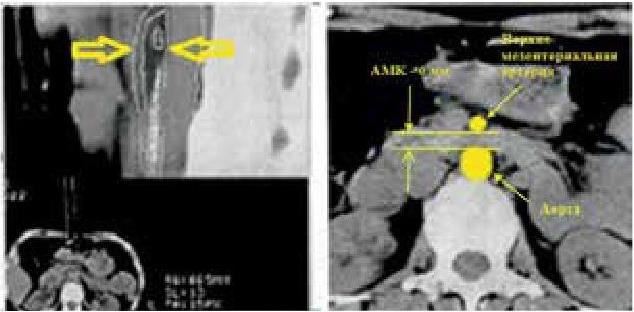
Рис. 48. Расстояние между аортой и верхней мезентериальной артерией на уровне нижне – горизонтальной части 12-перстной кишки (АМК) – 6 мм. Пациентка П.
В объективном статусе: пациентка прибавила в весе до 7 кг. При аускультации в легких дыхание усиленное везикулярное, хрипов нет, ЧДД – 16 движений в мин., язык незначительно обложен белым налетом, влажный. Живот обычной формы, участвует в акте дыхания, симметричный, мягкий, безболезненный во всех отделах.
В клинических и биохимических анализах крови и мочи без патологии. Индикан мочи отрицательный. Копрограмма – без патологических изменений (единичные лейкоциты). Кал на дисбактериоз – эубиоз.
На УЗИ органов брюшной полости без патологии. При ЭФГДС выявлен поверхностный гастродуоденит без признаков атрофии слизистой, кардия и привратник не изменены, свободно проходимы. Признаков дуодено-гастрального и гастро-эзофагеального рефлюксов не определяется. По результатам контрольной ирригоскопии – рельеф слизистой сохранен, заброса контраста в тонкую кишку не выявлено (рис. 49). При рентгеноскопии желудка (рис. 50) органической патологии не определяется. В динамике желудок уменьшился в размерах, определяется нормотония стенки желудка.
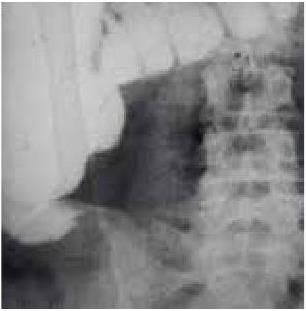
Рис. 49. Пациентка П. Контрольная ирригоскопия. Контраст в подвздошную кишку не поступает
Рис. 50. Пациентка П. Контрольная контрастная гастроскопия.
При рентгеноскопии 12-перстной кишки с зондом (рис. 51) признаков сдавления нижнегоризонтальной части 12-перстной кишки не определяется.
На контрольной функции внешнего дыхания ЖЕЛвд – 2,49 (68 %), ФЖЕЛ –2,38 (68 %), ОФВ1–1,87 (64 %), Инд. Тифно – 75,1 (93), ПОС – 4,56 (69 %), МОС25–3,68 (63 %), МОС50–2,38 (56 %), МОС75–0,93 (48 %). Заключение: легкое снижение жизненной емкости легких, легкое нарушение проходимости дыхательных путей. Диагноз пульмонолога консультанта: Бронхиальная астма смешанная, легкой степени, вне обострения.
Пациентке проведен водородный дыхательный тест с нагрузкой лактулозой (аппарат Gastro+ Gastrolyser) до хирургической коррекции рефлюксной болезни и через 1 год после операции. Результаты представлены на рис. 52.
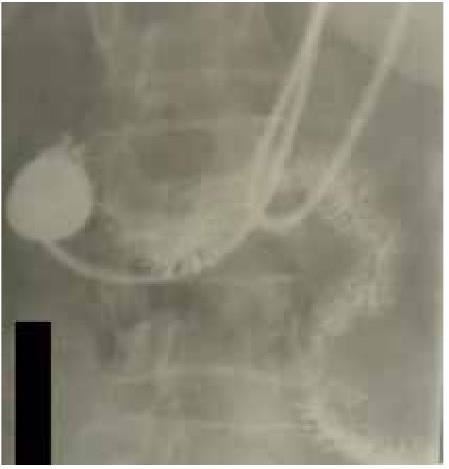
Рис. 51. Пациентка П. Рентгеноскопия 12-перстной кишки с зондом – признаков сдавления нижнегоризонтальной части 12-перстной кишки не определяется
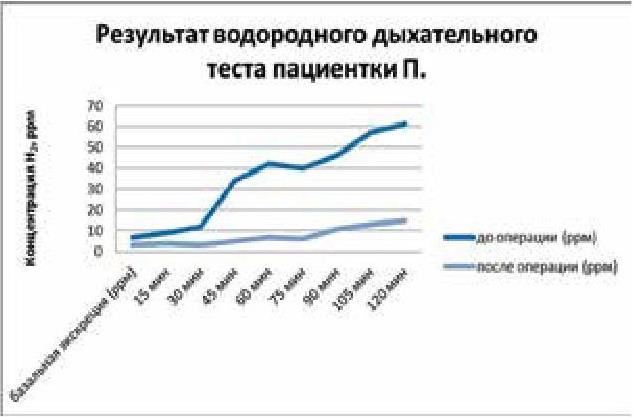
Рис. 52. Пациентка. Показатели водородного дыхательного теста с нагрузкой лактулозой.
Результаты водородного теста позволили диагностировать до операции синдром избыточного бактериального роста в тонкой кишке ассоциированный с недостаточностью баугиниевой заслонки (НБЗ), и его успешную коррекцию хирургическим способом.
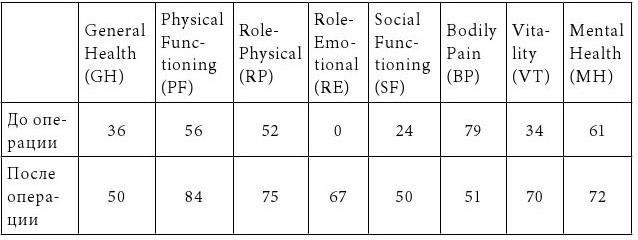
Динамика показателей качества жизни (определены с помощью шкалы MOS SF 36) у данной пациентки до хирургической коррекции рефлюксной болезни и через 1 год после операции представлена в таблице 9.
Данные теста MOS SF36 наглядно показывают значительное улучшение самочувствия пациентки, снижение негативного влияния переносимой болезни на социальное и личностное функционирование после проведенного хирургического лечения. Также снизились показатели тревожности пациентки.
Таблица 9
Данные качества жизни пациентки П.
Обсуждение.
Представленный клинический случай является примером триггерного влияния рефлюксов пищеварительного тракта и ассоциированного с ними СИБР на возникновение патологии дигестивного тракта и внепищеварительной патологии, в частности, бронхиальной астмы.
По нашим данным у 228 обследованных пациентов, страдающих БА, в подавляющем большинстве случаев клинические проявления гастроэнтероколитического характера типичны для недостаточности баугиниевой заслонки (НБЗ) и хронического нарушения дуоденальной проходимости (ХНДП).
Признаками ХНДП у таких пациентов при ЭФГДС явились: дуоденогастральный рефлюкс (69 %), зияние кардии (59 %), зияние привратника (73 %), рефлюкс – эзофагит (64 %).
Поэтажная манометрия методом открытого катетера выявила изолированную дуоденальную гипертензию в 28,9 %, дуоденальную гипертензию со «сбросом» в желудок – в 44,7 %, дуоденальную гипертензию со «сбросом» в желудок и в пищевод – в 10,5 %, гипертензию в желудке при нормотензии в 12перстной кишке – в 7,9 %, нормотензию в 12-перстной кишке и желудке – в 7,9 % случаев. Среднее давление в просвете 12-перстной кишке составило 192,4±31,2 мм водного столба (норма – 80–130 мм водного столба), в просвете желудка – 110,6±22,7 мм водного столба (норма – 60–80 мм водного столба).
Скриниг-тесты наличия СИБР у пациентов с недостаточностью баугиниевой заслонки с сопутствующей бронхиальной астмой были положительны у большинства обследуемых. Так, реакция мочи на индикан оказалась положительной у 144 (63 %) больных, водородный дыхательный тест с нагрузкой лактулозой дал положительный результат в 73 % пациентов (n=23).
Уровень средних молекул сыворотки крови был повышен у 173 (76 %) пациентов, в среднем это значение оказалось на 46 % выше нормальных показателей и составило 0,35±0,01 при норме – 0,24 (р<0,001). Эти данные свидетельствуют о наличие синдрома эндогенной интоксикации, развивающегося в рамках СИБР, у обследованных больных с БА и НБЗ, который выражен значительнее, чем у больных с НБЗ, не страдающих БА.
Таким образом, в этиопатогенезе бронхиальной астмы важными звеньями являются недостаточность баугиниевой заслонки с развитием СИБР и ассоциированные восходящие рефлюксы, как следствие хронического нарушения дуоденальной проходимости. Адекватная коррекция НБЗ с ликвидацией СИБР и ХНДП – баугинопластика и дуоденоеюностомия являются перспективным методом лечения бронхиальной астмы.
Список литературы:
1. Маев, И. В. Состояние органов пищеварения при хроническом обструктивном бронхите, бронхиальной астме и эмфиземе легких / И. В. Маев, Т. П. Воробьев, Г. А. Бусарова // Пульмонология. 2002; (№ 4): 85–92.
2. Benjamin Stanley В. Exstraesophageal manifestations of gastroesophageal reflux / Benjamin Stanley В, Kern Deschner // Am. J. Gastroenterol. 1989. – V. 84 (1). – P. 1–5.
3. Чучалин, А. Г. Бронхиальная астма / А. Г. Чучалин // Том 1, 2. Москва: «Агар», 1997.
4. Пархоменко, Л. К. Желудочно-пищеводный рефлюкс и бронхиальная астма / Л. К. Пархоменко, О. С. Радбин // Клин. Мед. – 1994. – № 6. – С. 47.
5. Геллер, Л. И. Желудочно-пищеводный рефлюкс и бронхиальная астма / Л. И. Геллер, Т. П. Гринская, Л. И. Николаева и др. // Тер. арх. – 1990. – № 2. – С. 69–71.
6. Филимонов, Л. Б. Гастроэзофагеальный рефлюкс у детей, страдающих бронхиальной астмой / Л. Б. Филионов, А. В. Можейко, Л. А. Дулькин и др. // Педиатрия. – 1990. – № 3. – С. 20–23.
7. Mainsfield, L. E. Gastroesophageal reflux and respiratory disorders: a review. / L. E. Mainsfield, М. Stein // Ann. Allergy. – 1989. – № 41 (3). – Р. 158–161.
8. Puchala, M. Respirache kamplicacia gastroezofagalneno refluxu / М. Puchala // Stud. Pneumol. Phtiseol. Cech. – 1988. – № 48 (9). – Р. 581–593.
9. Галимова, Е. С. О сочетании заболеваний желудочнокишечного тракта и бронхиальной астмы / Е. С. Галимова, Г. М. Нуртдинова, И. Кучер и др. // Известия высших учебных заведений. Поволжский регион. – 2010. – № 4 (14). – С. 48–52.
10. Мартынов, В. Л. Хирургическое лечение рефлюксной болезни: монография. Нижний Новгород, ООО «Центр оперативной печати», 2013; 535 с.
11. Бутвин, С. Н. Применение энтеросорбции в лечении больных хроническим обструктивным бронхитом / С. Н. Бутвин // Врачебное дело. – 1989. – № 4. – С. 80–82.
12. Кокосов, А. Н. Об изменении показателей иммунокомпетентной системы и гемодинамики у больных бронхиальной астмой под влиянием разгрузочно-диетической терапии / А. Н. Кокосов, С. Г. Осинин // Врачебное дело. – 1982. – № 1. – С. 15–18.
13. Goodall, R. J. R. Relationship between asthma and gastroesophageal reflux / R. J. R. Goodall Thorax. – 1981. – V. 36. – Р. 116–121.
14. Chernow, B. Pulmonary aspiration as a consequence of gastroesophageal reflux / В. Chernow, L. F. Johnson, W. R. Jauowitz et al. // Dig Dis Sci. – 1979. – V. 24. – Р. 839–844.
15. Жаркова, М. С. Влияние синдрома избыточного бактериального роста и бактериальной транслокации на течение заболевания у больных циррозом печени / М. С. Жаркова, М. В. Маевская, В. Т. Ивашкин // РЖГГК. – 2012. – Т. 22. – № 5. – С. 56–63.
16. Oren, Zaidel, Uninvited Guests: The Impact of Small Intestinal Bacterial Overgrowth on Nutritional Status / Oren Zaidel, Henry C. Lin. Practical Gastroenterology. – 2003. – Vol. XXVII. – № 7. – Р. 24–37.
17. Quera, R. Sobrecrecimiento bacteriano intestinal Rev. / R. Quera, Е. Quigley, А. Madrid // Med. Chil. – 2005. – Vol. 133. – Р. 1361–1370.
18. Кучерявый, Ю. А. Неалкогольный стеатогепатит и кишечная микрофлора: есть ли потенциал пребиотических препаратов в лечении? / Ю. А. Кучервый, Е. А. Маевская, М. Л. И др. // Медицинский совет. – 2013. – № 3. – С. 10–15.
Анализ полученных результатов подтверждает взаимосвязь между состоянием ЖКТ, рефлюксами, СИБР и развитием авитаминоза «С», БА, дерматозов, которые ранее отмечались как отдельные наблюдения, не связанные между собой в определенную систему.
В данной работе показана патология клапанной структуры пищеварительного тракта, которая объясняет развитие многих звеньев этиопатогенеза СИБР, авитаминоза «С», БА и дерматозов, связывая их в единую систему.






