Глава 2. СИБР – синдром избыточного бактериального роста в тонкой кишке
(В. Л. Мартынов, А. Г. Семенов, Н. В. Казарина, А. А. Тулупов, А. А. Чесноков)
Синдром избыточного бактериального роста (СИБР) (Small Intestinal Bacterial Overgrowth Syndrome) – это патологическое состояние, развивающееся вследствие бактериальной контаминации тонкой кишки различной микрофлорой и сопровождающееся функциональными нарушениями работы пищеварительного конвейера (Кучерявый Ю. А., 2010, 2014; Маев И. В., 2011).
При избыточном росте бактерий в тонкой кишке наблюдаются следующие изменения (Авдеев В., 2010; Плотникова Е. Ю., 2013; Маевская Е. А., 2013):
– избыточное заселение бактериальной микрофлорой тонкой кишки (в концентрации >105 микроорганизмов в 1 мл аспирата из тощей кишки) (Toskes P., 1993; Vanner S., 2008; Ардатская М. Д., 2011);
– качественное изменение бактериальной микрофлоры тонкой кишки (присутствие, так называемых, фекальных микроорганизмов – грамотрицательных колиформ, облигатных анаэробных бактерий) при более низких значениях – >103 КОЕ / мл, (Justensen T., 1984; Simon G. L., 1986);
– нарушение всасывания определенных пищевых веществ, особенно жиров и витаминов.
Актуальность проблемы СИБР. Реальная распространенность СИБР на сегодняшний день неизвестна (Маевская Е. А., 2013). Фактически это патологическое состояние плохо диагностируемо, ввиду неспецифичности его симптомов, которые часто относят к основному производящему СИБР заболеванию (Bures J., 2010). Фактически СИБР чрезвычайно распространен в присутствии одного или более предрасполагающих патологических состояний.
Существуют объективные причины, позволяющие объяснить широкую вариабельность данных о распространенности СИБР (Маевская Е. А., 2013):
– неспецифическая симптоматика за счет чего СИБР часто рассматривают в рамках основного заболевания, под «маской» которого он скрывается (например, СРК);
– пациенты с СИБР редко обращаются за медицинской помощью (например, после гастрэктомии), а если и обращаются, то СИБР у них часто не диагностируют;
– даже в условиях современной клиники не всегда возможно провести адекватную диагностику синдрома.
Ардатская М. Д., (2011) указывает на то, что частота выявления избыточного роста бактерий в тонкой кишке при различных заболеваниях (хронический гастрит, язвенная болезнь, хронический холецистит, патология гепатобилиарной системы, воспалительные и заболевания кишечника, синдром раздраженного кишечника), склеродермия, диабетическсая нейропатия, последствия хирургического вмешательства и пр.) составляет 40–99 %.
Бондаренко В. М. (2007) приводит сопоставимые данные о частоте выявления избыточного бактериального роста в тонкой кишке при заболеваниях ЖКТ (хронический гастрит, язвенная болезнь, хронический холецистит, воспалительные заболевания кишечника, синдром разраженного кишечника и др.) от 70 до 97 %.
Синдром избыточного бактериального роста в несколько раз чаще встречается у больных циррозом печени по сравнению со здоровыми людьми, особенно часто он выявляется при заболеваниях печени классов В и С по шкале Child – Pugh или спонтанном бактериальном перитоните в анамнезе (Yang C. Y., 1998). По данным Жарковой М. С. (2012) СИБР в кишечнике определялся у 69 % пациентов с циррозом печени, что несколько превышает цифры, приводимые в литературе. В зарубежных исследованиях указывается, что этот синдром выявляется у 49–60 % больных циррозом (Dae Won Jun, 2010; Gunnarsdottir S. A., 2003; Pande С., 2009; Yang C. Y., 1998). СИБР значительно чаще встречается у больных циррозом печени, имеющих латентную печеночную энцефалопатию (в 38,6 % по сравнению с 8,9 % в контроле; p=0,001), и частота его регистрации возрастает при увеличении класса цирроза по Child – Pugh (30,8 % – при А, 69,2 % – при В и С; p=0,054) (Bures J., 2010). Все авторы сообщают о корреляции между СИБР и тяжестью заболевания печени (Dae Won Jun, 2010; Pande С., 2009). Аналогичный вывод сделан и в исследовании Жарковой М. С. (2012). Дизрегуляция моторики проксимальных отделов пищеварительного тракта признана одной из главных причин возникновения СИБР и функиоцнальной диспепсии. Исследования показали высокую распространенность СИБР у больных с функциональной диспепсией, в частности у больных в лечении с ингибиторами протонной помпы (Lombardo L., 2010). СИБР был также обнаружен в 60 % пациентов с гастропарезом (George N. S., 2012).
Некоторые исследования указывают на 50 % распротраненность СИБР у пациентов с неалкогольным стеатогепатитом (НАСГ) (Wigg A. J., 2001; Sajjad A., 2005).
Кучерявый Ю. А. (2014) отметчает некоторую схожесть в симптоматике СРК и СИБР и довольно нередкое параллельное, на первый взгляд, существование двух патологий: у больных, попадающих под критерии СРК. Уже в 2000 г. в доступной печати стали появляться работы, в которых описывалось, что пациенты с СРК имеют положительные результаты ДТ, причем такие результаты могут быть связаны именно с наличием СИБР (Pimentel M., 2000, 2003). В этом, исследовании 76 % больных с СРК имели положительный результат дыхательного теста (ДТ), что оказалось существенно больше, чем в контрольной группе здоровых лиц. Согласно различным источникам, СИБР при СРК диагностируется с частотой от 30 до 85 % (Маевская Е. А., 2013; Черёмушкин С. В. 2000; Ford A. C., 2009; Mann N. S., 2009; Pimentel M., 2000, 2003; Scarpellini E., 2009; Singh V. V., 2004).
По данным Плотниковой Е. Ю. (2013) за 5 лет, ассоциация СРК и СИБР выявлена более чем у 60 % пациентов. По данным других авторов СИБР регистрируется у пациентов с СРК не менее чем в 50 % случаев (Lauritano E. C., 2005; Pimentel M., 2009; Saad R., 2007), достигая 78 % и более (Barrett J. S., 2008). Результаты метаанализа (Ford A. C., 2009), включающего 11 исследований, показали, что патологические дыхательные тесты значительно чаще регистрируются у больных с СРК, чем у здоровых лиц (OР=4,46; 95 % ДИ=1,69–11,80). Аналогичные результаты достигнуты и во втором метаанализе 11 исследований, опубликованном годом позже (Shah E. D., 2010) – патологические результаты тестов достоверно чаще встречались у пациентов с СРК: отношение шансов (ОШ) 4,46, 95 % доверительный интервал (ДИ) 1,69–11,80. При этом учет возраста и пола продемонстрировал еще более значимый результат (OШ 9,64, 95 % ДИ 4,26–21,82).
Таким образом, у больных с СРК имеется повышенный риск наличия СИБР, а данное сочетание не редкость и, по всей видимости, не случайность – синдромы имеют общие механизмы патогенеза.
Парфенов А. И. (2011) сообщает, что у 1 / 3 больных постинфекционным СРК выявлялся избыточный бактериальный рост в тонкой кишке, а клиническая картина отличалась рецидивирующей диареей. Нарушения состава фекальной микрофлоры имелись у большинства больных. Обычно в кале снижалась численность бифидумбактерий и лактобацилл, а также кишечной палочки с нормальной ферментативной активностью. Одновременно отмечался рост условно-патогенной микрофлоры с различными сочетаниями групп микроорганизмов. Чаще всего нарастало количество дрожжеподобных грибов, кокковой микрофлоры, клостридий, протея, клебсиелл. Но клиническая картина ПСРК не зависела от особенностей состава фекальной микрофлоры.
Мечетина Т. А. (2011) отмечает, что синдром избыточного бактериального роста в тонкой кишке после холецистэктомии встречается чаще по сравнению с больными желчнокаменной болезнью в 76 % и в 20 % случаев соответственно (р<0,05).
В настоящее время накоплено достаточно фактов, свидетельствующих о высокой частоте обнаружения СИБР при хроническом панкреатите. По данным литературы такое сочетание встречается от 30–40 % (Dominguez-Munoz J. E., 2007; Elfick D. A., 2005; Trespi E., 1999; Malik B. A., 2011) и даже до 92 % (Mancilla А. С., 2008) и зависит как от степени внешнесекреторной недостаточности поджелудочной железы, так и сочетания ее с билиарной недостаточностью, что наблюдается, например, при билиарнозависимом панкреатите (Gabrielli M., 2013).
Высокую распространенность СИБР (56 %) выявили у пациентов с муковисцидозом (Fridge J. L., 2007).
Среди пациентов, оперированных по поводу болезни Крона, СИБР выявлен у 30 %, тогда как среди больных, которым резекцию не производили, – всего у 18 % (Castiglione F., 2003). Tursi A. (2005) определил СИБР у 59 % пациентов с множественным дивертикулезом толстой кишки.
Глютеновая болезнь (целиакия) нечасто осложняется СИБР (9 % – 5 5 %) (Rubio-Tapia A., 2009; Tursi A, 2003; Ghoshal U. C., 2004; Krauss N., 2006). СИБР преимущественно возникает у пациентов, которые не соблюдают аглютеновую диету или имеющих сопутствующую лактозную непереносимостью (Krauss N., 2006; Ghoshal U. C., 2004; Rubio-Tapia A., 2009;).
При асимптомном течении СИБР у пациентов с ожирением выявлялся в 17 % (Sabat? J. M., 2008)
Классификация СИБР. Отечественными учеными выделены три степени выраженности СИБР в зависимости от характера и количества микрофлоры в тонкой кишке (Бондаренко В. М., 2007; Щербаков П. Л., 2009; Маев И. В., 2007):
I степень – при наличии увеличения аэробной нормальной кишечной микрофлоры (>105– 106 КОЕ / г);
II степень – увеличение аэробной нормальной кишечной микрофлоры и появление анаэробных бактерий (>106– 107 КОЕ / г);
III степень – преобладание анаэробной флоры (обсемененность на уровне 109 КОЕ / г и более).
В связи со сложностью верификации СИБР подходы к диагностике базируются на иных принципах (косвенных методах, весьма вариабельных по диагностической ценности), и вышеприведенная классификация по большому счету значения не имеет. Кроме того, отсутствуют какие-либо достоверные данные, позволяющие сопоставлять клинические симптомы (частота, выраженность) со степенью СИБР (Маевская Е. А., 2013).
На сегодняшний день, учитывая классификацию СИБР, основанную на микробиологических показателях, можно утверждать что, практикующему врачу данный синдром для понимания труднодоступен (Кучерявый Ю. А., 2014).
Чернин В. В. (2010) на основании собственных исследований разработал следующую классификацию дисбактериоза мукозной микрофлоры эзофагогастродуоденальной зоны:
1. По локализации:
a. Преимущественно ограниченный.
b. Распространенный (в пределах одной или нескольких зон ЖКТ).
2. По выраженности:
a. I степени (компенсированный).
b. II степени (субкомпенсированный).
c. III степени (декомпенсированный).
3. По течению:
a. Острый.
b. Рецидивирующий.
c. Длительно текущий.
Мечетина Т. А. (2011) выделила степени СИБР по критерию градиента выделения легкими Н2 при проведении нагрузочного водородного дыхательного теста:
– 1 степень: повышение на 20–50 ррм;
– 2 степень: повышение на 50–100 ррм;
– 3степень: повышение на 100 ррм и больше.
Учитывая то, что уровень водорода в выдыхаемом воздухе повышается при увеличении степени обсемененности тонкой кишки, автор соотносит выделенные степени со степенями дисбактериоза, определяемыми на основании микробиологического исследования.
Мы придерживаемся классификации описываемой Gabrielli M. (2013), который подразделяет СИБР на проксимальный и дистальный:
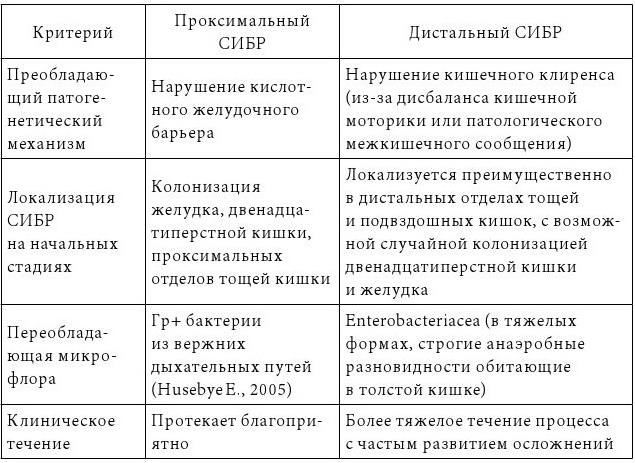
Особо стоит обратить внимание на тот факт, что при проградиентном долговременом течении синдрома изначально контаминирующая флора проксимального СИБРа заселяет и дистальные отделы ЖКТ, такми образом формируется тотальный СИБР.
Этиология СИБР. Большинство авторов сходятся в определении основных этиотропных патологичексих состояний, ведущих к развитию СИБР тонкой кишки (Ардатская М. Д., 2011; Авдеев В., 2010; Кучерявый Ю. А. 2010; Mcphee S. J., 2007; Pimentel M., 2009, Мечетина Т. А., 2011; Плотникова Е. Ю., 2013; Kopacova M., 2010). Мы попытались сгруппировать обозначенные состояния по производному патогенетическому эффекту, с расчетом на дальнейшее практическое применение в клинике.
Основные группы этиологических факторов мы видим следующие:
1) антероградная колонизация тонкой кишки из вышележащих отделов ЖКТ;
2) ретроградная колонизация тонкой кишки из нижележащих отделов ЖКТ;
3) мальнутриция (мальдигестия и мальабсорбция).
1) Причины антероградной колонизации тонкой кишки из вышележащих отделов ЖКТ:
а) Несостоятельность бактериальных «барьеров»: гипоахлоргидрия, состояние после гастрэктомии или резекции желудка (Шептулин А. А., 2008; Fried M., 1994; Gasbarrini A., 2007; Scarpellini E., 2007; Lewis S. J., 1996), недостаточность внешнесекреторной функции поджелудочной железы и желчевыводящих путей (Маев И. В., 2007, 2009; Парфенов А. И., 2007; Чернин В. В., 2010; Шульпекова Ю. О., 2003);
б) Нарушение моторики протоковой системы гепатико-гастро-панкреато-дуоденальной системы (гастростаз, дуоденостаз, ХНДП, функциональные заболевания органов верхнего этажа брюшной полости, нервно-мышечные заболевания, болезнь Гиршпрунга, болезнь Паркинсона, нейрофиброматоз (Husebye E., 2005; Kenny S. E., 1998);
в) Поступление бактерий из внекишечного резервуара (гнойный холангит, кариес).
2) Причины ретроградной колонизации тонкой кишки из нижележащих отделов ЖКТ:
а) Недостаточность илеоцекального клапана, первичная и вторичная (Мартынов В. Л., 2009; Oren Zaidel, 2003; Ардатская М. Д., 2001; Larry S. Miller, 2012; Gabrielli M., 2013);
б) Нарушение моторики тонкой кишки – дискинезии (стаз содержимого в тонкой и толстой кишках, хронические воспалительные заболевания кишечника, «функциональные» заболевания кишечника, хроническая интестинальная псевдообструкция тонкой кишки, прием препаратов угнетающих моторику кишечника);
в) Ненормальное сообщение между тонкой и толстой кишкой (кишечная непроходимость, оперативное отключение части кишки от пассажа содержимого; наличие свищей между тонкой и толстой кишкой, резекция илеоцекального перехода, ваготомия, резекция желудка, холецистэктомия, резекция тонкой кишки) (Oren Zaidel, 2003; Ардатская М. Д., 2001; Коротько Г. Ф., 2003; Парфенов А. И., 2007; Чернин В. В., 2010; Шептулин А. А., 2008; Husebye E., 2005)
г) Поступление бактерий из локального кишечного резервуара (дивертикулы тонкой кишки) (Tursi A., 2005; Husebye E., 2005; Пасечников В. Д., 2005).
3) Причины мальдигестии и мальабсорбции:
а) Ахлоргидрия (оперированный желудок, хронический атрофический гастрит, длительный прием ингибиторов протонной помпы);
б) Внешнесекреторная недостаточность поджелудочной железы (хронический панкреатит);
в) Патология желчевыводящих путей (желчнокаменная болезнь, хронический холецистит);
г) Энтеропатии (дисахаридазная недостаточность и прочие пищевые интолерантности);
д) Длительный пищевой дисбаланс, голодание (Чернин В. В., 2010; Маев И. В., 2007);
е) Местные и системные иммунные нарушения (лучевое, химическое воздействие (цитостатики), СПИД, стресс, дефицит IgA (Husebye E., 1995, 2005; Чернин В. В., 2010; Riordan S. M., 1997; Маев И. В., 2007; Berlitsos P. C., 1992; Pignata C., 1990);
ж) Антибиотикотерапия, НПВП терапия, ГКС терапия.
Lo W. K. (2013) в недавнем метаанализе 11 исследований (n=3134) показал невысокий относительный риск развития СИБР у пациентов, длительно принимающих ИПП, – 2,282 (95 % доверительный интервал – ДИ – 1,238–4,205). При этом в исследованиях, в которых в качестве диагностического метода использовали посев аспирата из тощей кишки, отмечен более высокий риск – 7,587 (95 % ДИ 1,805–31,894), чем при проведении дыхательных тестов, когда риск развития СИБР оказался значительно меньше (1,93; 95 % ДИ 0,69–5,42). Результаты исследования, проведенного в США (Ratuapli S. K., 2012) и включавшего 1191 пациента (70 % женщин; 48 % принимавших ИПП), в котором использована дыхательная диагностика, свидетельствуют об отсутствии риска развития СИБР у лиц, принимающих ИПП. Отсутствие связи приема ИПП с развитием СИБР было подтверждено в еще одном крупном исследовании (Choung R. S., 2011) (n=765), но в данной работе диагноз СИБР устанавливали на основании изучения аспиратов из тонкой кишки.
Проанализировав широкий спектр причин возникновения СИБР, можно выделить обширную группу заболеваний органического врожденного и приобретенного характера (Кучумова С. Ю., 2011; Ардатская М. Д., 2011; Кучерявый Ю. А., 2010), среди которых, по нашему мнению, несостоятельность илеоцекального перехода является ведущей.
Прямым доказательством возникновения СИБР при несостоятельности баугиниевой заслонки (НБЗ) является опыт Larry S. Miller (2012). В клиническом эксперименте автор моделировал недостаточность илеоцекального клапана, путем заведения 4-х просветного зонда за губы баугиниевой заслонки в направлении подвздошной кишки 19 здоровым волонтерам при проведении колоноскопии. Через 1 месяц после манипуляции с помощью водородного дыхательного теста у всех исследуемых выявлен синдром избыточного бактериального роста тонкой кишки. Таким образом, фактически разрушив баугиниевую заслонку, автор добился возникновения СИБР у волонтеров.
Bures J. (2010) указывает на повышенные риски рецидива СИБР связанные с пожилым возрастом (ОР=1,1) и аппендэктомией в анамнезе (ОР=5,9). По данным Elphick D. A. (2005) распространенность СИБР повышается с возрастом (приблизительно 50 % у людей старше 75 лет). Он связывает это с прогрессивным разрушением более чем одного из защитных механизмов. В частности, уменьшение секреции желудочного сока и нарушение кишечной моторики являются общим для пожилых людей.
По нашим данным (Мартынов В. Л., 2006, 2011, 2013) проведение классической аппендэктомии, а также проведение аппендэктомии с техническими трудностями и аппендэктомии в условиях осложненного течения острого аппендицита практически всегда приводит к несостоятельности баугиниевой заслонки. Факт интимной анатомической и функциональной близости клапанных структур илеоцекального перехода и аппендикса неоспорим. Аппендэктомия анатомически и функционально разрушает эти связи, и приводит к развитию вторичной приобретенной НБЗ. Формирующийся цекоилеальный рефлюкс способствует развитию и персистированию дистального СИБР. Однако, послеоперационное гистологическое исследование удаленных червеобразных отростков у пациентов оперированных по поводу НБЗ в 87 % случаев определяет признаки хронического аппендицита. В связи с этим, открытым остается вопрос о первичности хронического аппендицита по отношению к недостаточности илеоцекального клапана.
Диагностика СИБР. В настоящее время нет международных рекомендаций по диагностике СИБР, кроме того, нет единого мнения по выбору оптимального диагностического теста (Кучерявый Ю. А., 2010).
Можно думать о наличии синдрома контаминации тонкой кишки на основании данных анамнеза (операции, основное заболевание, антибиотикотерапия) и клинической картины. Далее при помощи методов инструментальной диагностики (рентгенологическое, эндоскопическое исследования, УЗИ и др.) подтверждают наличие нарушений органов и систем, способствующих развитию синдрома избыточного бактериального роста. Следующей задачей становиться подтверждение факта избыточного бактериального роста.
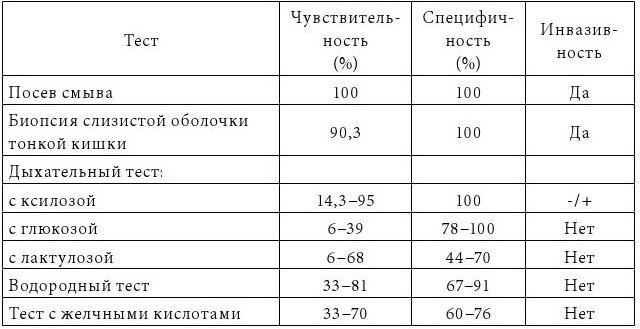
Quera R. (2005) приводит сгруппированные данные по информативности методов диагностики СИБР (табл. 1).
Таблица 1
Диагностическая ценность методов выявления СИБР
Методики определения дисбиоза кишечника можно разделить на 2 большие группы: прямые и непрямые методы:
К прямым (микробиологическим) методикам относятся:
1. Интестиноскопия с аспирацией содержимого тонкой кишки и дальнейшим бактериологическим исследованием;
2. Интраоперационный забор содержимого тонкой кишки;
3. Бактериологическое исследование кала.
«Золотым стандартом» диагностики СИБР считается интестиноскопия с аспирацией содержимого тонкой кишки и посевом аспирата на питательную среду (Кучерявый Ю. А., 2010; Авдеев В., 2010; Ардатская М. Д., 2011; Плотникова Е. Ю., 2013; Gabrielli, M., 2013; Маевская Е.а., 2013; Malik B. A., 2011).
Преимущества метода:
1. Позволяет высоко достоверно выявить исследуемый синдром;
2. Определяет степень тяжести СИБР;
3. Выявляет вид контаминирующих бактерий (внутрипросветная флора) и установливает их чувствительность к антибактериальным препаратам.
Недостатки метода:
1. Чрезмерная инвазивность, не идущая ни в какое сравнение со значимостью получаемых результатов;
2. Интестиноскопия требует проведения общей анестезии;
3. Необходимость в наличии двухбаллонного интестиноскопа;
4. Высокие требования к квалификации врача-эндоскописта;
5. Наличие мощной бактериологической службы с возможностью культивирования не только аэробов, но и анаэробов;
6. Тщательность выполнения алгоритма метода на всех этапах от забора материала до посева на среды и интерпретации полученных данных;
7. Длительный период ожидания результата – от 3–5 до 10 дней и более (в зависимости от получаемой культуры, скорости роста, возможности идентификации и проведения тестов по определению чувствительности к антибактериальным препаратам);
8. Недосягаемость дистальных отделов тонкой кишки и очагов бактериального роста при дивертикулитах, послеоперационных анатомических изменениях;
9. Высокий риск обсеменения оральной флорой интестиноскопа при заборе материала;
10. Высокая совокупная стоимость метода.
Все это объясняет возможность проведения интестиноскопии с аспирацией содержимого тонкой кишки только в крупных диагностических или научно-исследовательских центрах.
Посев кала, использующийся в нашей стране как метод оценки микробного биоценоза кишечника, в случае СИБР малоинформативен. Так, даже при максимальном приближении к правилам проведения микробиологических исследований метод может дать представление о микробном составе лишь 12–15 типируемых видов бактерий дистального отдела толстой кишки (Плотникова Е. Ю., 2013; Василенко В. В., 2000), по другим данным (Ардатская М. Д., 2001; Шептулин, А. А., 2008) до 25 видов бактерий (в зависимости от оснащенности лаборатории). Также недостатками метода считаются необходимость использования дорогостоящих питательных сред, длительность получения результатов, возможность исследования только внутрипросветной микрофлоры толстой кишки (Шептулин, А. А., 2008; Кучумова, С. Ю., 2011), что не дает представления о микробном составе тонкой кишки.
Нами предложен интраоперационный способ определения дистального синдрома избыточного бактериального роста в тонкой кишке пациентам, которым показана хирургическая операция. Чаще всего, этот способ используется при баугинопластике. Интраоперационно в рану выводится участок подвздошной кишки на 20 см проксимальнее илеоцекального угла, двумя мягкими кишечными жомами изолируется участок подвздошной кишки длинной 10 см. (рис. 1)
Производится пункция просвета изолированного участка подвздошной кишки, игла проводится косо относительно стенки кишки, в полость кишки вводится 10 мл стерильного физиологического раствора (рис. 2).
Для максимального насыщения введенного физиологического раствора присутствующей флорой выдерживается экспозиция 5 минут, не извлекая иглу (рис. 3).
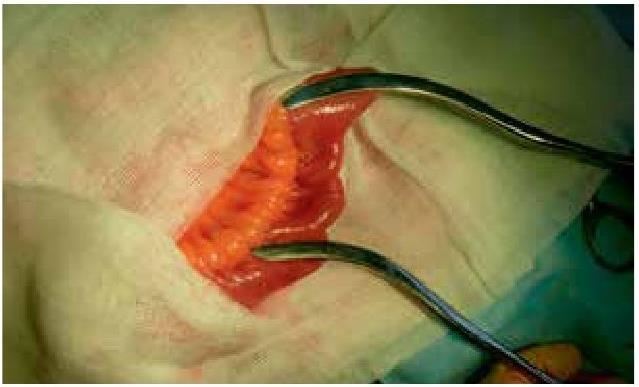
Рис. 1. Изолированный кишечными жомами участок подвздошной кишки
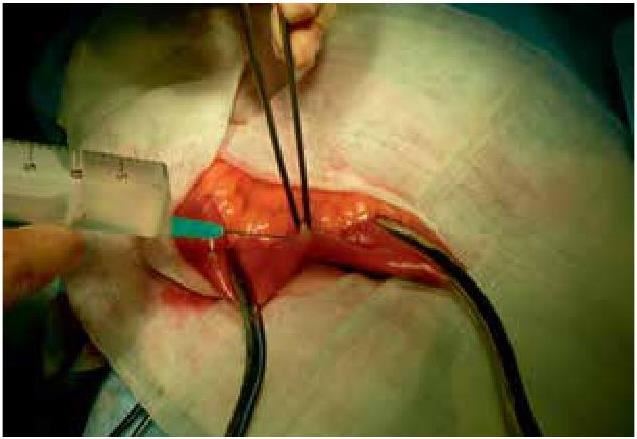
Рис. 2. Пункция полости подвздошной кишки
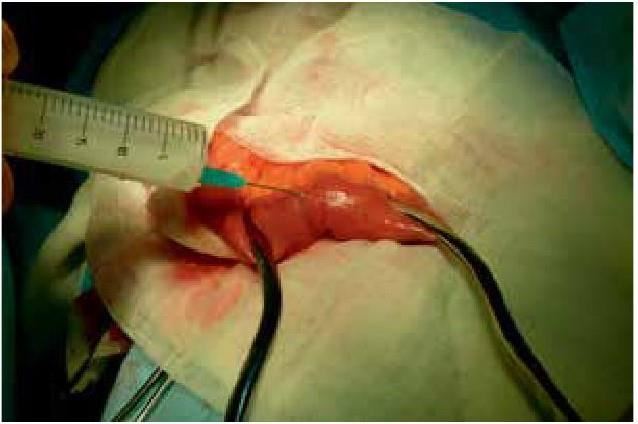
Рис. 3. Наполненная физиологическим раствором подвздошная кишка
После экспозиции содержимое изолированного участка подвздошной кишки аспирируется, при этом аспирация продолжается вплоть до прохождения иглы через слизистый слой кишки, игла извлекается (рис. 4).
Место пункции кишки перитонизируется. В дальнейшем аспират содержимого просвета подвздошной кишки направляется на бактериологическое исследование с обязательным определением чувствительности к антибиотикам контаминирующей флоры.
Предложенный метод используется и для определения проксимального СИБР в том случае, если выполняется симультанное оперативное вмешательство – по поводу нередко ассоциированных недостаточности баугиниевой заслонки и хронического нарушения дуоденальной проходимости (ХНДП). Срединный лапаротомный доступ позволяет выполнить пункцию и тощей и подвздошной кишок и достоверно определить дистальный и проксимальный СИБР тонкой кишки у пациента.
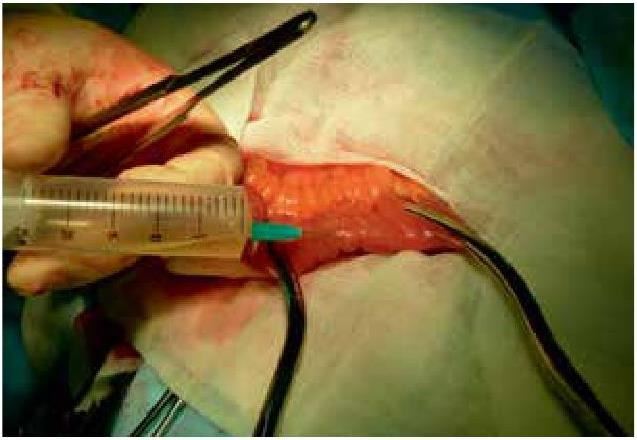
Рис. 4. Аспирация кишечного содержимого
Таким образом, разработанный способ интраоперационного забора материала для бактериологического анализа содержимого тонкой кишки позволяет выполнить «золотой стандарт» диагностики СИБР, при этом анализу подвергаются оба пула внутрикишечных микроорганизмов, а именно, просветная и мукозная флора.
К непрямым методам относятся тесты, основанные на изучении метаболитов микрофлоры (Воробьев А. А., 2004; Чернин В. В., 2008, Gasbarrini A., 2007, Khoshini R., 2008, Mendoza E., 2007, Rana S. V., 2008, Stotzer P. O., 2000):
a) молекулярно-генетические методы исследования микроорганизмов;
b) гистохимические;
c) морфологические;
d) комбинированные методы исследования биоматериала;
e) биохимические;
f) различные дыхательные тесты.
Молекулярно-генетический метод. Метод дает возможность получить информацию о видовом составе микробиоты кишечника. Метод основан на достраивании исследуемой ДНК или РНК микроба с помощью фермента термостабильной ДНКполимеразы (Ардатская М. Д., 2001). Метод применяется для контроля бактериальных групп и отдельных видов бактерий (до 18 штаммов). Отличается ПЦР-диагностика быстротой выполнения, видовой специфичностью, чувствительностью. Однако метод трудоемок, является дорогостоящим исследованием, требует индивидуального подбора олигонуклеотидов для каждой реакции, что ограничивает его широкое применение в практике.
Хромато-масс-спектрометрия. Этот метод основан на фиксации элюата, выделяющегося из хроматографической колонки. При этом хроматографическое разделение может быть проведено различными методами хроматографии. Методы позволяют определить родовой состав микрофлоры 35–40 возбудителей (Осипов Г. А., 1995), получить уникальную информацию о составе компонентов микробной клетки.
Хромато-спектрометрия является специфичной для диагностики анаэробных микроорганизмов. Метод позволяет оценить жизнеспособность микроорганизмов (Ардатская М. Д., 2000, 2001, 2006, 2009; Парфенов А. И., 2007). При помощи метода возможно определение малых концентраций клеток микроорганизмов. Так же достоинством метода является быстрота получения результатов. Однако для определения широкого спектра возбудителей необходимо проводить неоднократные исследования, что является недостатком метода. К прочим недостаткам можно отнести высокую стоимость исследования, необходимость использовать дорогостоящее оборудование, обучать методике медицинский персонал, в связи с чем метод не получил широкого применения.
Исследование короткоцепочечных жирных кислот. Метод основан на определении количественного и качественного состава короткоцепочечных жирных кислот (КЖК) фракции С2-С4, являющимися продуктами метаболизма микрофлоры кишечника, (к короткоцепочечным жирным кислотам (фракции С2-С4) относят уксусную, пропионовую, масляную кислоты) в кале и сыворотке крови (Ардатская М. Д., 2000, 2001, 2006, 2009; Плотникова Е. Ю., 2013). Анализ образцов проводится методом газожидкостного хроматографического анализа. Исследование КЖК позволяет подбирать индивидуальную терапию больному, оценивать ее эффективность, уточнить наличие ряда заболеваний ЖКТ (Ардатская М. Д., 2000, 2001, 2006, 2009). Метод позволяет использовать его в качестве скриннигового. Он обладает большой чувствительностью и специфичностью, воспроизводимостью результатов по сравнению с рутинным бактериологическим методом, обеспечивает высокую точность в оценке аэробных и анаэробных популяций микроорганизмов с указанием их родовой принадлежности. Недостатками метода являются необходимость обучения медперсонала, высокая стоимость, неудобство для обследуемых людей в транспортировке материала для исследования. Все это не позволяет методу получить более широкое распространение.
Методы, основанные на изучении концентрации индикана, продуцируемого индол-положительными микроорганизмами, фенола и паракрезола, являющихся метаболитами аэробных (в меньшей степени) и анаэробных (в большей степени) микроорганизмов (Ардатская М. Д., 2011; Плотникова Е. Ю., 2013), к сожалению, не получили должного распространения в клинической практике.
Известно, что под действием ферментов микроорганизмов незаменимая аминокислота триптофан превращается в индол, который в печени преобразуется в индикан и выделяется с мочой. Отсутствие индикана в моче безмикробных животных, а также снижение его количества при лечении антибиотиками свидетельствует о бактериальном генезе этого соединения. Наиболее высокая экскреция индикана с мочой определяется при диете, содержащей значительное количество мяса и яиц, и наименьшее – при потреблении растительной диеты. Размножающаяся в тонкой кишке флора элиминирует из химуса незаменимую аминокислоту триптофан, снижая всасывание и других аминокислот, вызывая их дефицит в крови, образует большое количество индола, который обладает выраженной гепатотоксичностью (Мартынов В. Л., 2013).
Резко повышенная экскреция индикана позволяет судить о размножении флоры, активно разлагающей триптофан, не только в дистальных, но и в проксимальных отделах кишечника. В норме в суточной моче из организма выделяется не более 100 мг индикана, что не обнаруживается обычными качественными пробами. Реакция бывает положительной только в том случае, если содержание индикана в моче превышает норму. Многие методы, в том числе и качественная реакция мочи на индикан, могут давать вполне удовлетворительные результаты, если дисбиоз достаточно выражен и касается многих групп микроорганизмов (Мартынов В. Л., 2013). Данная проба является скрининг-диагностикой синдрома избыточного бактериального роста в тонкой кишке.
Мы обследовали 185 пациентов с доказанной по результатам ирригоскопии недостаточностью илеоцекального клапана, качественная реакция мочи на индикан оказалась положительной у 173 (95 %) пациентов (Мартынов В. Л., 2006). При этом после хирургической коррекции в сроки более года качественная реакция мочи на индикан определена как положительная в 12 (14 %) из 86 случаев. До и после операции эта реакция определялась у 24 пациентов. У всех 24 до операции качественная реакция мочи на индикан оценена как положительная, после баугинопластики указанная реакция оказалась положительной лишь у 4 пациентов (p< 0,001).
Дыхательные тесты. Микробная флора продуцирует большое количество газов, что и используют для диагностики СИБР. Одним из альтернативных неинвазивных вариантов диагностики СИБР являются различные дыхательные пробы, основанные на измерении концентрации газов (углекислый газ, метан, водород, аммиак), продуцируемых микробиотой, в выдыхаемом воздухе. В норме эти вещества метаболизируются толстой кишкой. Если они появляются в воздухе раньше, чем химус достигнет толстой кишки, то это свидетельствует об избыточном росте тонкокишечной микрофлоры (Мечетина Т. А., 2011).
В 2008 г. был принят Римский консенсус по водородным тестам, в котором изложены рекомендации международных экспертов для клинической практики относительно показаний и методов проведения водородных дыхательных тестов при заболеваниях пищеварительного канала (Gasbarrini A., 2009).
По данным литературы, дыхательные тесты неинвазивны, могут использоваться в качестве экспресс-метода практическим врачом, не требуют специального обучения и не имеют высокой стоимости (Григорьев П. Я., 2000, 2004; Парфенов А. И., 2007; Шептулин А. А., 2008; Gasbarrini A., 2008; Rana S. V., 2008).
Используются дыхательные тесты с С12-холеглицерином, С14– гликохолевой кислотой, Д-ксилозой, глюкозой, лактулозой, С13-меченым углеродом (Григорьев П. Я., 2000, 2004; Парфенов А. И., 2007; Шептулин А. А., 2008; Rana S. V., 2008).
Одним из первых дыхательных тестов, используемых для диагностики СИБР, была проба с С14-гликохолевой кислотой (Rana S. V., 2008). Метод основан на способности бактерий деконъюгировать желчные кислоты до С14С02, который измеряется в выдыхаемом воздухе. Тест имеет низкую специфичность и чувствительность (Rana S. V., 2008), а также высокую стоимость (Cuoco L., 2006), в связи с чем его применение не получило распространения.
К углеродным дыхательным тестам относятся пробы с С12– холеглицерином, С13-меченым углеродом, CD-ксилозой. При этом в выдыхаемом воздухе измеряется углекислый газ, который выделяется бактериями кишечника при метаболизме меченых субстратов (Rana S. V., 2008) (обследуемому дают 1 г С14-меченной ксилозы, которая в норме выделяется почками (Rana S. V., 2008; Simren M., 2006). При наличии СИБР ксилоза метаболизируется до 14С02, который выводится легкими. По данным S. M. Riordan (1995) чувствительность и специфичность его низкие. Проведенные P. O. Stotzer (2000) исследования показывают, что чувствительность теста с D– ксилозой составляет 70 %.
Дыхательные тесты с углеводсодержащими субстратами (лактулоза, глюкоза, ксилоза) основаны на способности кишечных бактерий метаболизировать различные вещества с последующей регистрацией в выдыхаемом воздухе их метаболитов – водорода и / или метана (Кучерявый Ю. А., 2010). В норме все эти вещества должны метаболизироваться толстокишечными бактериями, появление же этих веществ раньше, чем они достигают толстой кишки, является маркёром наличия СИБР. Около 14–20 % H2, высвобождаемого в толстой кишке, экскретируется через легкие (Плотникова Е. Ю., 2013; Levitt M. D., 1970). Причем отмечается сильная положительная (линейная) зависимость между концентрацией выделяемого легкими водорода и концентрацией водорода в просвете кишечника. Таким образом, концентрация водорода в выдыхаемом воздухе может быть мерой его кишечной продукции.
Тесты с нагрузкой глюкозой, или / и лактулозой наиболее часто используемые пробы. После нагрузки субстратом в течение каждых 15 минут проводится измерение водорода в выдыхаемом воздухе. По данным разных авторов, положительной проба считается при повышении уровня водорода от 12 до 20 ррm по сравнению с базальным уровнем экскреции за 120 минут исследования (Мак Нелли П. Р., 1990; Шептулин А. А., 2008; Gasbarrini A., 2007; Rana S. V., 2008; Simren M., 2006; Gabrielli, M., 2013; Bures J., 2010).
Глюкоза полностью ассимилируется проксимальными отделами тонкой кишки и не доходит до дистальных. Таким образом, это подходящий субстрат для регистрации проксимального СИБР (Gabrielli M., 2013). Лактулоза является искусственным синтетическим дисахаридом, состоящим из фруктозы и галактозы. В организме человека не существует фермента, способного разложить ее на моносахариды. Лактулоза, являясь не всасываемым углеводом, достигает толстой кишки, что дает возможность для диагностики дистального СИБР (Cuoco L., 2006; Simren M., 2006; Gabrielli M., 2013).
Чувствительность и специфичность проб отличается. По данным различных авторов, для пробы с использованием лактулозы чувствительность составляет от 17 % до 85,7 %, а специфичность достигает 90,9 %. Авдеев В. (2010) отмечает специфичность и чувствительность дыхательного теста с глюкозой 78–83 и 62–93 % соответственно. Также проводились исследования по сравнению водородного дыхательного теста с лактулозой относительно «золотого стандарта» выявления СИБР – посева аспирата тощекишечного содержимого. По данным Е. Mendoza (2007) чувствительность водородного дыхательного теста с лактулозой составила 85,7 %, а специфичность 90,9 %.
Обобщая литературные данные по использованию водородного дыхательного теста с лактулозой, можно сделать вывод, что преимуществами метода являются: возможность обследования всей тонкой кишки на наличие СИБР; хорошая корреляция между скоростью продукции водорода в кишке и скоростью выведения его легкими (Кучерявый Ю. А., 2010; Zaidel O., 2003; Плотникова Е. Ю., 2013); быстрота и неинвазивность метода; низкая стоимость; четкое разграничение метаболической активности бактерий и их хозяина (Плотникова Е. Ю., 2013). Эти данные позволяют считать тест достаточно информативным и использовать его в качестве экспресс-диагностики практическим врачом. Также этот метод позволяет оценивать эффективность лечения СИБР.
С помощью водородного дыхательного теста также диагностируется время оро-цекального клиренса углеводов. Данное обстоятельство рассматривается некоторыми исследователями (Gabrielli M., 2013; Ledochowski M., 2008) как недостаток метода, наиболее ярко проявляющийся при проведении водородного дыхательного теста с нагрузкой лактулозой. В настоящее время основным диагностическим критерием признано присутствие 2-х пиков, первый обусловлен бактериальной активностью в тонкой кишке (СИБР), а второй – попаданием лактулозы в толстую кишку. Возникает сложность в верификации 1 пика, обусловленного ускоренной эвакуацией лактулозы в толстую кишку (ускоренный пассаж по тонкой кишке) или действительно обусловленного избыточной метаболической активностью бактерий в тонкой кишке. Gabrielli M. (2013) указывает на то, что это нестандартизированный критерий, снижающий диагностическую ценность метода (от 55 до 71 % водородного теста с глюкозой) (Gasbarrini A., 2009).
Кроме того, при помощи водородных дыхательных тестов можно диагностировать широкий спектр нарушений работы ЖКТ: мальабсорбция или мальдигестия некоторых углеводов; непереносимость лактулозы, сахарозы, лактозы (Плотникова Е. Ю., 2013).
Тем не менее, учитывая имеющуюся сильную положительную корреляцию между рецидивом СИБР, рецидивом гастроинтестинальных симптомов и патологичексими результатами водородных тестов, Gabrielli M. (2013) предлагает использовать водородные тесты в качестве теста – контроля эффективности антибиотикотерапии.
Дополнительные методы, используемые при синдроме избыточного бактериального роста, включают оценку функционального состояния тонкой кишки (в первую очередь моторной и пищеварительной) и верификацию нарушений процессов пищеварения и всасывания.
Патогенез СИБР. Дискутабельными остаются версии возникновения СИБР, представленные разными исследователями. Например, Ардатская М. Д. (2011) возникновение СИБР тонкой кишки объясняет попаданием в толстую кишку остатков недостаточно переваренной пищи (в связи с дефицитом панкреатических ферментов и ускоренной моторикой), что способствует развитию гниения и брожения и стимулирует пролиферацию в ней бактериальной флоры, за счет которой происходит расщепление нутриентов. Результатом этого является нарушение микробиоценоза толстой кишки с возможным последующим ретроградным проникновением бактерий в тонкую кишку через баугиниеву заслонку. Формированию цекоилеального рефлюкса способствует также повышение давления в полости толстой кишки из-за скопления в ней газов (сероводорода, углекислого газа, водорода и др.) – продуктов расщепления недостаточно гидролизованных нутриентов. Таким образоом, первичной признается мальдигестия, приводящая к рефлюкссу толстокишечного содержимого.
Мечетина Т. А. (2011) аналогично позиции Ардатской М. Д. (2011) представляет, что нарушение процессов пищеварения в тонкой кишке приводит к поступлению непереваренных нутриентов в толстую кишку. Это сопровождается размножением гнилостной и бродильной микрофлоры в толстой кишке, в результате чего возникает несостоятельность илеоцекального клапана, создающая условия для заброса толстокишечного содержимого в тонкую кишку и колонизации ее толстокишечной микрофлорой. В результате чего замыкается порочный круг.
В качестве критики предлагаемой Ардатской М. Д. схемы развития СИБР можно привести взгляд Витебского Я. Д. (1973) на клапанную деятельность илеоцекального запирательного аппарата. Расширяющийся в поперечном направлении илеоцекальный клапан при растяжении слепой кишки, приводит к растяжению уздечек, тем самым, сближаются губы баугиниевой заслонки и стенки илеоцекального соединения. Закрытие просвета будет тем гармоничнее, чем сильнее степень расширения кишки и натяжение уздечки. Совершенно аналогичен механизм закрытия просвета при антиперистальтике. Сокращающиеся уздечки также натягивают углы заслонки, замыкательный эффект усиливается сокращениями раздвинутых циркулярных мышц слепой кишки, огибающих терминальный отрезок тонкой. Таким образом, чем сильнее наполняется слепая кишка, тем сильнее при нормальном илеоцекальном запирательном аппарате уздечки затягивают и сближают губы баугиниевой заслонки, что и обеспечивает абсолютность клапана.
Данный факт был нами подтвержден экспериментально (Мартынов В. Л., 2006, 2009). Испытывая анатомические препараты при максимальном заполнении слепой кишки при нормальной баугиниевой заслонке, мы наблюдали диастатические разрывы слепой кишки, а заполнения подвздошной кишки не наступало. Поэтому нельзя согласиться с мнением, что при интактном состоянии илеоцекального сосустья может возникнуть цекоилеальный рефлюкс.
Авдеев В. (2010) придерживается взгляда, что синдром избыточного роста бактерий в тонкой кишке наряду с целиакией и внешнесекреторной недостаточностью поджелудочной железы относится к наиболее частым причинам мальабсорбции.
Маев И. В. (2007) сторонник взвешенной позиции и не выдвигает на первый план какой-то один патологичексий процесс. Он указывает что, в результате воздействия множества гетерогенных причин происходит обсеменение тонкой кишки условнопатогенными микробами, которые при помощи факторов адгезии прикрепляются к поверхности кишечного эпителия, пролиферируют, выделяют токсины, что сопровождается развитием синдрома бактериальной контаминации, характеризующегося целым рядом взаимосвязанных локальных и системных патологических процессов.
Особого внимания заслуживают рассуждения Кучерявого Ю. А. (2014). Он логично полагает, что дефицит нормальной флоры с высвобождением экологических ниш вряд ли будет существовать долго – это место могут занять представители условно-патогенной микрофлоры. Наличие патогенной или условно-патогенной флоры с развитием последующего воспаления слизистой оболочки желудочно-кишечного тракта у восприимчивого субъекта (вероятно, генетически предрасположенного) посредством активации местной иммунной защиты и развития кишечного дисбиоза способно увеличивать риск развития функциональных заболеваний ЖКТ. При этом отмечает, что избыточный бактериальный рост скорее будет предрасполагать к появлению или усугублению, в частности, симптомов СРК.
В связи с этим были предложены возможные пути взаимодействия измененной (нарушенной) микрофлоры и функции кишечника (Кучерявый Ю. А., 2014):
– кишечная микрофлора может взаимодействовать со слизистой кишечника через врожденные и адаптивные механизмы;
– сама измененная флора может приводить к повреждению кишечного эпителиального барьера, а следовательно, повышать его проницаемость для различных веществ;
– контакт с патогенной или условно-патогенной микрофлорой, ее персистирование могут приводить к развитию субклинического воспаления в слизистой оболочке кишечника с инициацией нейрогенной боли;
– возможно, увеличение ферментации панкреатических ферментов и компонентов пищи тонкокишечной микрофлорой с последующей интестинальной продукцией газа;
– отмечается нарушение всасывания желчных кислот под воздействием экспансии кишечной флоры в тонкой кишке.
Центральным остается вывод о том, что синдром избыточного бактериального роста, являясь следствием имеющихся патологических состояний, уже в свою очередь, усугубляет течение имеющейся патологии и выраженность нарушения процессов пищеварения и всасывания.
Подробнее рассмотрим представленные ниже пути взаимодействия кишечной флоры и функции дигестивного тракта через призму патогенетических механизмов.
Деконъюгация желчных кислот (ЖК) при СИБР. Важным патогенетическим звеном при СИБР, определяющим его клинические проявления, является преждевременная деконъюгация первичных желчных кислот (Cuoco L., 2006; Lin Н. С., 1996; Quera P. R., 2005; Мечетина Т. А., 2011; Авдеев В., 2010), осуществляемая тонкокишечной микрофлорой.
По данным L. Bala (2006) у больных с СИБР средний уровень деконъюгированных желчных кислот значительно выше по сравнению с лицами, у которых он отсутствовал – соответственно 500 мкмоль / л (в диапазоне 40–600) и 10 мкмоль / л (в диапазоне 0–300).
Деконъюгированные желчные кислоты обладают детергентными свойствами и способны повреждать эпителий слизистой оболочки тонкой кишки (Murphy G. M., 1998; Oren Zaidel, 2003). Вследствие этого снижаются синтез и сорбция ферментов на ее поверхности, что приводит к нарушению мембранного пищеварения (Quera P. R., 2005; Shindo K., 1996) и всасывания не только жиров и жирорастворимых витаминов А, D, Е, К, но также аминокислот и углеводов (Парфенов А. И., 2007; Шептулин А. А., 2008; Shindo K., 1996). Клинически эти нарушения проявляются креатореей, амилореей и стеатореей, нарастающем гиповитаминозе (Парфенов А. И., 2007, 2008; Murphy G. M., 1998; Oren Zaidel, 2003; Авдеев В., 2010). Кроме того, деконъюгированные желчные кислоты вместе с бактериальными токсинами нарушают водно-солевой обмен. Желчные кислоты индуцируют нарушение всасывания натрия (Ильченко А. А., 2006; Murphy G. M., 1998), увеличивают секрецию хлоридов и воды в просвет кишки (Ильченко А. А., 2006; Cuoco L., 2006), ускоряют перистальтику тонкой кишки, что усугубляет диарейный синдром (Авдеев В., 2010; Ардатская М. Д., 2011; Fan X., 2009; Gasbarrini A., 2007; Malik B. A., 2011; Nelis G. F., 1990; Nucera G., 2005).
Усугубление диареи приводит к потере вторичных жирных кислот, в результате чего развивается билиарная недостаточность и возможно развитие желчнокаменной болезни (Авдеев В., 2010). Оксалаты, содержащиеся в пище, в норме связываются в просвете кишки с кальцием и выводятся с калом. Если возникает потеря желчных кислот, в просвет кишки поступает большое количество свободных жирных кислот, связывающих кальций. Так как концентрация ионов кальция в просвете кишки уменьшается, увеличивается всасывание свободных оксалатов, что приводит к образованию оксалатных конкрементов (Авдеев В., 2010; Ардатская М. Д., 2011; Мечетина Т. А., 2011).
Следует также отметить, что деконъюгированные желчные кислоты быстро всасываются, что преждевременно выключает их из процессов пищеварения (Мечетина Т. А., 2011).
Избыточный рост бактерий может непосредственно вызывать повреждение эпителия тонкой кишки, так как метаболиты ряда микроорганизмов оказывают цитотоксическое действие – вызывают органические изменения слизистой кишки (дистрофия, воспаление, раковая метаплазия эпителиоцитов), вплоть до полного исчезновения микроворсинок и частичной атрофии ворсинок (Oren Zaidel, 2003).
Нарушение абсорбции и повреждение слизистой при синдроме избыточного бактериального роста также возникает при снижении поглощения аминокислот и пептидов (Ардатская М. Д., 2011; Malik B. A., 2011; Bures J., 2010). Воспаление собственной пластинки слизистой оболочки и атрофия ворсинок увеличивают проницаемость кишечной стенки и вызывают энтеропатию, связанную с потерей белка. Повышеное потребление белка бактериями неминуемо приводит к увеличению белкового дефицита (вплоть до формирования квашиоркора) и продукции избыточного количества токсичных субстанций – аммиака, D-лактата, бактериальных пептидогликанов и эндотоксинов (Malik B. A., 2011; Dibaise J. K., 2006).
Нарушения в обмене витаминов при СИБР. Нарушения состава кишечной флоры могут участвовать в усугублении мальнутриции еще одним путем – через снижение синтеза витаминов (Ардатская М. Д., 2011). Так, эшерихии и бифидобактерии участвуют в синтезе и всасывании витаминов К, группы В, фолиевой и никотиновой кислот. Лидером в отношении способности синтезировать витамины является кишечная палочка, которая участвует в продукции 9 витаминов: тиамина, рибофлавина, никотиновой и пантотеновой кислот, пиридоксина, биотина, фолиевой кислоты, цианкобаламина и витамина К.
Бифидобактерии синтезируют аскорбиновую кислоту. Бифидо– и лактобактерии способствуют всасыванию кальция и витамина D. Кислая среда в полости толстой кишки, характерная для нормального состава кишечной флоры, способствует усвоению железа.
Нарушение всасывания витаминов реализуется несколькими путями. Авдеев В. (2010) указывает, что бактериальные токсины, протеазы, другие метаболиты связывают витамин В12, что ведет к его дефициту и развитию макроцитарной В12-дефицитной анемии, вплоть до развития периферической полинейропатии. За счет стеатореи при избыточном бактериальном росте тонкой кишки нарушается всасывание в основном жирорастворимых (A, D и E) витаминов и железа (Ардатская М. Д., 2011; Bohm M., 2013; Gasbarrini A., 2007; Khoshini R., 2008; Malik B. A., 2011).
На формирование клинических симптомов оказывают влияние и нарушение процессов пищеварения и всасывания (Мечетина Т. А., 2011). Это обусловлено как внешнесекреторной недостаточностью печени и поджелудочной железы, так и тем фактом, что некоторые анаэробы сами или при помощи своих токсинов способны разрушать дисахаридазы щеточной каймы энтероцитов (Парфенов А. И, 2007; Ардатская М. Д., 2011), нарушая всасывание углеводов, а через подавление активности энтерокиназы уменьшать действие панкреатических протеаз (Oren Zaidel, 2003; Quera P. R., 2005; Ардатская М. Д., 2011).
Кроме того, нарушение микробиоты в тонкой кишке приводит к сдвигу рН в щелочную сторону, что также ведет к нарушению функций некоторых кишечных ферментов (дисахаридаз, пептидаз и др.) (Шепулин А. А., 2008; Cuoco L., 2006; Quera P R., 2005). Это приводит к тому, что углеводы не могут ассимилироваться в проксимальной части тонкой кишки, а подвергаются бактериальному гидролизу в ее дистальной части и становятся недоступны для хозяина. Расщепление углеводов бактериями сопровождается выделением водорода, углекислого газа и других газов, что клинически проявляется метеоризмом.
Продукты бактериального расщепления недостаточно гидролизованных нутриентов (индол, скатол, фенол, крезол, газы и т. д.) и эндотоксины бактерий усиливают перистальтику тонкой и толстой кишки, что приводит к ускорению пассажа химуса, уменьшению времени контакта панкреатических ферментов с нутриентами в сфере полостного и мембранного пищеварения. В результате, переваривание еще более ухудшается (Ардатская М. Д., 2011).
Надо отметить, что синдром мальнутриции (в основном нарушение всасывания) развивается все же при длительной персистенции нетипичной флоры в тонкой кишке (Ардатская М. Д., 2011). Например, при формировании анастомоза «бок в бок» его развитие наблюдается через 4–5 лет после оперативного вмешательства. Хотя гипопротеинемия может наблюдаться при синдроме избыточного бактериального роста, тяжелые нарушения переваривания и всасывания белка встречаются редко. Бактерии конкурируют с хозяином за белок (используя их в качестве источника азота), так же, как и за углеводы, продуцируя жирные кислоты и аммиак (Ардатская М. Д., 2011).
Аутоинтоксикация при СИБР. Синдром избыточной колонизации (контаминации) тонкой кишки обусловливает процессы гниения и брожения в тонкой кишке с развитием хронической аутоинтоксикации (Мартынов В. Л., 2006; Bauer T. M., 2002). Эндотоксины бактерий, особенно липополисахарид кишечной палочки, всасываясь в кровь, вызывают явления интоксикации и усугубляют воспалительно-деструктивные изменения паренхимы ПЖ, способствуют формированию неалкогольного стеатогепатита (Ардатская М. Д., 2011; Кучерявый Ю. А., 2014) и алкогольной болезни печени (Wei Zh.,2014).
Наши данные по аутоинтоксикации при НБЗ, ассоциированной с СИБР. Мы изучали процессы хронической аутоинтоксикации при синдроме избыточного бактериального роста тонкой кишки в условиях недостаточности баугиниевой заслонки (НБЗ) (Мартынов В. Л., 2013). В качестве показателя аутоинтоксикации организма был оценен уровень молекул средней массы по Н. И. Габриэляну. В норме этот показатель составляет 0,24±0,02 у. ед. Уровень средних молекул сыворотки крови выше нормы был зафиксирован у 82 из 100 пациентов с доказанной недостаточностью баугиниевой заслонки. Уровень средних молекул сыворотки крови после операции определен у 32 пациентов. Нормальные показатели отмечены у 12 (34 %) пациентов, повышенные – у 20 (66 %). До и после баугинопластики уровень средних молекул сыворотки крови определен у 20 пациентов. Нормальные показатели до и после операции выявлены в одном случае. После баугинопластики уровень средних молекул увеличился у трех пациентов, что связано с развитием спаечной болезни в области операции. Уровень средних молекул уменьшился по сравнению с дооперационным у 16 пациентов, при этом у 7 из них он достиг нормы. Полученные результаты статистически значимы.
Литературные данные свидетельствуют о развитии синдрома вегетососудистой дистонии при хронической аутоинтоксикации организма, потому в качестве косвенного показателя аутоинтоксикации мы использовали данные кардиоинтервалографии у пациентов с НБЗ (Мартынов В. Л., 2006). Синдром вегетативной дистонии по данным кардиоинтервалографии был выявлен у 118 из 128 пациентов (92 %). Клинически синдром вегетативной дисфункции проявлялся повышенной утомляемостью (92 %), головокружением (72 %), сердцебиением (65 %), головными болями (74 %), гипергидрозом (66 %), вазомоторной лябильностью (66 %). Вегетативный тонус большинства больных изменялся в сторону симпатикотонии (98 %). У 73 пациентов (57 %) отмечалось умеренное повышение симпатического тонуса, у 26 (20 %) – выраженное повышение симпатического тонуса и только у 3 пациентов (2 %) преобладала парасимпатическая активность.
Синдром вегетативной дистонии до и после баугинопластики оценен у 57 пациентов. По данным кардиоинтервалографии исчезновение признаков вегетативной дисфункции отмечено у 37 пациентов (65 %, p< 0,001), а у 10 пациентов (17 %) отмечено уменьшение его выраженности. Чувство сердцебиения исчезло у 46 (80 %), оно уменьшилось у 37 (65 %) больных; головокружение перестало беспокоить 43 (74 %), уменьшилось у 9 (16 %); потемнение в глазах не отмечают 43 (76 %), эта жалоба стала менее выражена у 9 (16 %) пациентов.
Аутоинтоксикация в развитии неалкогольного стеатогепатита. Некоторые авторы (Кучерявый Ю. А., 2013; Wu W. C., 2008) приходят к заключению, что ведущим фактором развития неалкогольного стеатогепатита (НАСГ) является СИБР. Так вторичный НАСГ, как правило, индуцируется внешними воздействиями, наиболее значимые из которых являются: синдром мальабсорбции и синдром избыточного бактериального роста (СИБР) в тонкой кишке (Ивашкин В. Т., 2000). В основе теории развития воспаления в печени лежит разобщение процессов окисления и фосфорилирования под воздействием избыточного поступления свободных жирныхкислот (СЖК) в гепатоцит посредством реализации «двух ударов» по гепатоциту. «Первый удар» сводится к избыточному поступлению свободных жирных кислот (СЖК) в печень, что приводит к развитию стеатоза, «второй удар» – оксидативный стресс, развивающийся в результате гиперактивации перекисного окисления липидов (ПОЛ) (Кучерявый Ю. А., 2013).
Основные патогенетические механизмы характерные для СИБР (нарушение кишечного барьера и повышение проницаемости стенки кишки для эндотоксинов и бактерий) признаны первичными в развитии эндотоксемии (Кучерявый Ю. А., 2013). Литературные данные указывают, что пациенты с НАСГ имеют повышенную проницаемость кишечной стенки, за счет повреждения плотных белковых контактов эпителиоцитов тонкой кишки, что создает необходимые условия для транслокации эндотоксина через кишечную стенку, попадание его в систему воротной вены и далее непосредственно в паренхиму печени.
Кучерявый Ю. А. (2013) схематизировал патогенетический каскад развития НАСГ при СИБР, приводим эту схему (таблица 2).
Также автор указывает что, частота трансформации НАСГ в цирроз печени в течение 10 лет достигает 7 %, а это повышает риск развития гепатоцеллюлярной карциномы (Adams L. A., 2010).
Таблица 2
Патогенетический каскад развития НАСГ при СИБР
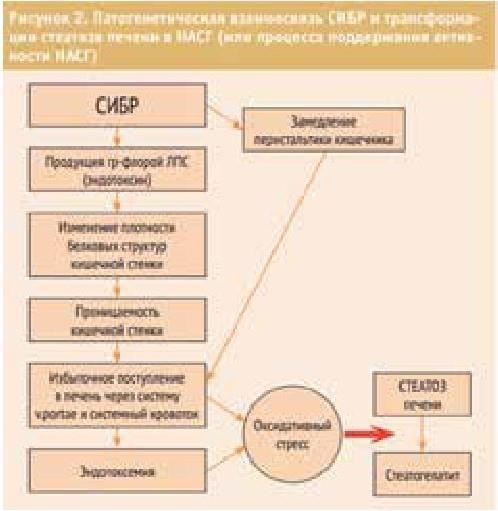
Аутоинтоксикация в развитии АБП.
Доказано, что у пациентов принимающих алкоголь увеличена проницаемость кишечной стенки к полиэтиленгликолю, лактулозе, маннитолу и 51CrEDTA (Bjarnason I., 1984; Keshavarzian A., 1994; Keshavarzian A., 1999; Parlesak A., 2000). Rao R. K. (2004) зарегистрировал высокий уровень эндотоксемии у пациентов с АБП. В экспериментах на животных концентрация пероксидазы лошади в крови была увеличена и коррелировала с алкоголь связанной эндотоксемией (Enomoto N., 2002; Forsyth C. B., 2009; Mathurin P., 2000; Keshavarzian A., 2001, 2009). Липополисахарид, введенный перорально, определялся в крови у мышей с острым опьянением в отличие от контроля (Lambert J. C., 2003).
Кроме того, выявлена корреляция между уровнем эндотоксемии, фактором некроза опузоли (TNF-?) и тяжестью АБП (Fujimoto M., 2000; Hanck C., 1998; Urbaschek R., 2001). Эндотоксины (ацетальдегид, бактериальная ДНК, пептидогликан, флагеллины) в портальном кровотоке активируют печеночные клетки Купера (Kupffer) через рецептор подобный белок viaToll4. Активация провоспалительного цитокинового пути привлекает большое количество нейтрофилов и моноцитов в ткань печени (Szabo G., 2010; Franc?s R., 2004). Отмечается взаимоотягощающий эффект различных эндотоксинов на печень. Так, бактериальная ДНК (TLR9) делает чувствительной печень к вызванному эндотоксином повреждению (Romics L., 2004), прием этанола увеличивал концентрацию пептидогликана, который способствовал большему повреждению печени (Gustot T., 2006; Purohit V., 2008).
Алкоголь приводит к расширению пула протеобактерий в ЖКТ, неторые исследователи (Harnisch J. P., 1989; Cericco M., 1996) описывали оппортунистические инфекции Corynebacterium (Actinobacteriaphylum) у людей с АБП. Матаболизм внутрипросветного алкоголя Escherichia coli реализует через алкогольдегидрогеназу (Salaspuro V., 1999) и через каталазный путь (Tillonen J., 1998), образующийся в результате ацетальдегид разрушает межклеточные белковые мостики слизистой оболочки. Таким образом, реализуя феномен бактериальной транслокации при СИБР.
Бактериальная транслокаци при СИБР. Рассмотрим следующий патогенетический механизм. Бактериальная транслокация – это пассаж микроорганизмов и их продуктов из кишечника в мезентериальные лимфатические узлы и в другие внекишечные среды (Wiest R., 2005; Wei Zh., 2014). Этот процесс может происходить и у здорового человека, не приводя к клинически значимым последствиям.
Бактериальная транслокация в развитие цирроза печени. Роль бактериальной транслокации при СИБР наглядно продемонстрирована у пациентов с циррозом печени (ЦП) отягощенным СИБР тонкой кишки. Создание доказательной экспериментальной модели (Lichtman S. N., 1990; Napolitano L. M., 1995; S?nchez E., 2005) и результаты более крупных доказательных исследований, проведенных на людях (Jun D. W., 2010; Pande C., 2009; Casafont Morencos F., 1996), свидетельствуют о взаимосвязи этих заболеваний. У больных ЦП в рамках портальной энтеропатии возникает отек слизистой кишечника, который ведет к ее гипоксии, в дальнейшем к воспалению, оксидативному стрессу, усилению перекисного окисления липидов в клетках реснитчатого эпителия и дезинтеграции слизистой. Морфологически можно наблюдать толстостенные расширенные капилляры, отек собственной пластинки, фибромускулярную пролиферацию и разобщение плотных межклеточных контактов, через которые, как считают исследователи, и возможна транслокация бактерий во внекишечные среды (Hashimoto N., 2002), что является существенным фактороом развития осложнений (Bellot P., 2013).
Пассаж микроорганизмов из кишечника в мезентериальные лимфатические узлы может усугублять гемодинамические нарушения у пациентов с ЦП (Heuman D. M., 2004). Это укладывается в рамки так называемого гипердинамического типа кровообращения, который характеризуется спланхнической и системной вазодилатацией (Ивашкин В. Т., 2009; Martell M., 2010) и реализуется портальной гипертензией (Bauer T. M., 2001). Полученные данные (Жаркова М. Д., 2012) позволяют предположить, что гемодинамические нарушения у больных циррозом начинаются задолго до инфицирования асцитической жидкости.
Развитие инфекционных осложнений у таких пациентов без сомнения отрицательно влияет на выживаемость больных (Martell M., 2010; Mathurin S., 2010). Летальность в группе обследуемых с ЦП инфекционными осложнениями выше (?30 %) по сравнению с пациентами без бактериальных инфекций (?12 %). Бактериальные инфекции, по результатам проведенных исследований (Chang C. S., 1998; Lata J., 2009; Pande C., 2009), оказались одним из независимых факторов, определяющих жизненный прогноз и продолжительность госпитализации у пациентов с ЦП и СИБР. Следует отметить, что возбудителя инфекции удается определить в 50–70 % случаев (Буеверов А. О., 2003; Fernandez J., 2002). Выявлено, что наличие синдрома избыточного бактериального роста в кишечнике, определяемого в начале заболевания, также отрицательно сказывается на выживаемости больных циррозом в течение двенадцати месяцев (Lata J., 2009).
У всех пациентов с инфицированием асцитической жидкости (n=5) в исследовании Жарковой М. С. (2012) наблюдалась бактериальная транслокация (р=0,017, критерий Фишера), также транслокация бактериальной ДНК в асцитическую жидкость происходит у 56,3 % больных ЦП. Жаркова М. Д. (2012) приходит к выводу что, синдром избыточного бактериального роста в кишечнике наблюдается у 69 % больных циррозом печени и коррелирует с тяжестью заболевания, портальной гипертензией – наличием асцита, более высокой степенью варикозного расширения вен пищевода. Гемодинамические нарушения (гипотония, тахикардия), инфекционные осложнения чаще развиваются у пациентов с положительным результатом водородного дыхательного теста. Синдром избыточного бактериального роста является прогностическим фактором низкой выживаемости при ЦП.
В работе Gutierrez I. M. (2012) СИБР рассматривается в качестве существенного фактора риска развития катетера-ссоциированных инфекций (КАИ). Так у детей с кишечной дисфункцией (мальнутрицией), возникшей в результате выраженных массивных воспалительных заболеваний кишечника либо в результате хирургических воздействий КАИ и СИБР являются наиболее распространенными осложениями определяющими прогноз болезни и жизни (Sondheimer J. M., 1998; Cole C. R., 2010). В результате различных гастроинтестинальных резекций происходит застой содержимого в дилятированной кишке с развитием избыточной бактериальной пролиферации в ее просвете и воспалением стенки. Необходимость парентеральной нутрициальной поддержки таких пациентов вызвана толерантностью к энтеральному питанию, наличие которой зависит от степени атрофии кишечных ворсинок и альтерации слизистой оболочки (Dibaise J. K., 2006; Riepe S. P., 1980). Наличие центрального венгозного катетера определяет риск развития КАИ в условиях СИБР (Gutierrez I. M., 2012).
Некоторые авторы (D’Antiga L., 1999; Cole C. R., 2010; Husebye E., 2005) полагают, что при повышении проницаемости кишечной стенки СИБР может быть потенциальным источником бактерий, способствующих КАИ. Эти предположения были реализованы в основном на экспериментальных моделях животных (Ziegler T. R., 2003; Berg R. D., 1979, 1992). Клиническое исследование проведенное Gutierrez I. M. (2012) подтвердило прочную ассоциацию между СИБР и парентеральным питанием у детей с энтеральной недостаточностью (adjusted OR = 5.1; adjusted 95 % CI 1.4–18.3, likelihood ratio test 6.68, P = 0.01). Однако, значительной корреляции между наличием флоры в дуоденум и риском развития КАИ не обнаружено.
Кроме того, высокая концентрация деконъюгированных желчных кислот является причиной стеатореи (Bala L., 2006), и мальабсорбции углеводов, поэтому дети с СИБР чаще нуждаются в ПП в условиях энтеральной недостаточности (Gutierrez I., 2012). В исследовании Kaufman S. S. (1997) дети с СИБР и энтеральной недостаточностью нуждались в парентеральном питании (ПП) в 2 раза дольше по сравнению с детьми без СИБР, при этом продолжительность применения ПП различалась в 3 раза. Косвенным подтверждением тому явилось улучшение тонкокишечной пищевой толерантности после эмпирической антибиотикотерапии, что привело к снижению частоты возникновения сепсиса (Bala L., 2006; Sigalet D., 2011)
Интересные данные приводит Габриелян Н. И. (2012). Изучая результаты микробиологического исследования резецированных клапанов сердца по поводу осложений инфекционного эндокардита (ИЭ), приходит к выводу, что первоисточником обнаруженных в клапанах микробов является аутофлора полости рта, зева и кишечника. Частота случаев роста микробов из клапанов составила 79,6 % (n = 234). Из 266 выделенных штаммов грамположительных микробов изолировано 218 (82 %) и грамотрицательных – 48 (18 %). Среди выделенной грамположительной микрофлоры лидировали три группы микроорганизмов: коагулазоотрицательные стафилококки (CNS) – с частотой 36,8 %, энтерококки – 14,7 %, стрептококки – 9,4 %. Среди энтерококков преобладали E.faecalis, реже изолировали E. faecium, Е. durans, Е. sakazaki. Гемокультура была положительной у 42 (18 %) пациентов из 234, совпадение роста микробов из клапанов и крови наблюдалось у 15 (35,7 %). У пациентов со сниженной резистентностью пищеварительного тракта при провоцирующих факторах (стресс, охлаждение, заболевания различных органов) и наличии дисбиозов открытых полостей тела может наблюдаться транслокация этих микробов в кровь и адгезия к ткани клапанов.
Аналогичные данные приводятся в национальном руководстве по кардиологии, где указывается, что около 85 % случаев ИЭ обусловлено стафилококками, стрептококками или энтерококками.
Барьерная функция желудка при СИБР. Важным фактором, ограничивающим обсеменение тонкой кишки, является кислотный барьер желудка (Мечетина Т. А., 2011). Соляная кислота – главный механизм защиты организма от СИБР (Gasbarrini A., 2007; Quera P. R., 2005). Количество бактерий в аспирате содержимого желудка коррелирует с интрагастральной рН: увеличение числа микробов начинает отмечаться при рН больше 3, а максимальное их количество достигает при рН 6–7,5 (Husebye E., 2005). В физиологических условиях 99 % бактерий, попавших в желудок, гибнут в течение 5 минут (Giannella R. A., 1972). Лишь определенные виды микроорганизмов являются кислотоустойчивыми (например, лактобактерии, хеликобактеры и др.), которые могут миновать желудок и колонизировать слизистую оболочку тонкой кишки.
Несмотря на то, что кислотный барьер желудка вполне достаточен, чтобы уничтожить большинство бактерий, динамические изменения уровня желудочной секреции, связанные с приемом пищи, создают возможность для прохождения микробов через этот барьер. Этот проход живых бактерий является физиологическим, и является источником для поддержания нормальной микрофлоры кишечника (Reback J. F., 2006).
Анализ литературы по этому вопросу показывает, что плотность бактерий в желудке увеличивается с уровнем рН, достигая плато приблизительно 1010 КОЕ / мл при рН равном 6–7,5. Подавление кислотопродуцирующей функции желудка сопровождается изменением микрофлоры тонкой кишки. По данным S. J. Lewis (1996) ежедневный прием 20 мг омепразола увеличивает у здоровых лиц количество бактерий в двенадцатиперстной кишке и ближайшей к ней части тощей кишки примерно на 2 порядка. Однако ни в одном из крупных контролируемых исследований такое нежелательное явление не отмечалось (Кучерявый Ю. А., 2010; Gutierrez I., 2012). Вопрос причастности ингибиторов портонной помпы (ИПП) к развитию СИБР остается сегодня дискуссионным. Теоретически ни один из имеющихся на фармакологическом рынке ингибиторов при пероральном приеме в средних дозах не способен полностью блокировать секрецию соляной кислоты. Оптимальным уровнем рН при приеме этих препаратов, позволяющим реализовать лечебный эффект, является рН>4. Однако не все ингибиторы, и не с первого приема, и не у всех лиц способны создать подобный уровень рН в теле желудка. Поэтому теоретические обоснования развития СИБР на фоне длительного применения ИПП в отсутствие данных контролируемых исследований о развитии СИБР при использовании этого класса лекарственных средств являются, по крайней мере, умозрительными.
Широкое распространение хеликобактериоза в мире, достигающее в развивающихся странах 90 %, дало основание считать H.pylori одной из главных причин приобретенной гипохлоргидрии (Feldman M., 1996; Kawaguchi H., 1996; Morihara M., 2001). Хеликобактерный гастрит распространяющийся на тело желудка, заканчивается атрофией слизистой оболочки и, как следствие, уменьшается секреция соляной кислоты, что, в конечном итоге, сопровождается снижением барьерной функции желудка.
Причинами ахлоргидрии могут быть хирургические вмешательства (гастрэктомия, ваготомия, повышающие концентрацию микробов в верхних отделах тонкой кишки в 100–1000 раз) (Allan J. D., 1967; Browning G. G., 1974; Greenlee F. I. B., 1971, 1977; Muscroft T. J., 1981), возраст старше 70 лет (Fried M., 1994; Murphy G. M., 1998; Saltzman J. R., 1994), аутоиммунные заболевания, сопровождающиеся выработкой антител к париетальным клеткам желудка (Dolby J. M., 1984; Marks I. N., 1992; McCloy R. F., 1995).
Исследования показывают, что разновидности бактерий, которые выявляются при этом, представляют, главным образом, флору верхних отделов дыхательных путей, ротоглотки, а также во многом схожи с культивируемыми из желудка. Установлено, что эта микрофлора может участвовать в метаболизме желчных кислот и изменять их ассимиляцию, а также белков и витамина В12 (Shindo K., 1996, 1995, 1993, 1998, 1998).
Нарушения моторики при СИБР. Нормальная кишечная перистальтика является одним из факторов защиты против избыточного бактериального обсеменения тонкой кишки (Esposito I., 2007; Quera P. R., 2005; Spencer N. J., 2001). В связи с этим появилось такое понятие как «кишечный клиренс» (Gasbarrini A., 2007) – способность тонкой кишки очищаться от патогенной микрофлоры (Husebye E., 2005; Spencer N. J., 2001).
В настоящее время считается, что моторные нарушения являются одной из важных составляющих патогенеза СИБР в тонкой кишке (Esposito I., 2007; Quera P. R., 2005).
Эффективность кишечного клиренса зависит от состояния мигрирующего моторного комплекса (ММК, англ. Migrating motor complex) – циклической, стереотипно повторяющейся сократительной активности желудка и тонкой кишки в межпищеварительный период. В норме сокращения и расслабления в двенадцатиперстной кишке происходят с периодичностью в среднем около 11 / мин, постепенно уменьшаясь к подвздошной кишке до 7 / мин. У здоровых людей регулярные сокращения с этой частотой продолжаются около 5 минут с промежутками от 20 мин до 1 часа (Husebye E., 1999; Vantrappen G., 1977). Общая продолжительность цикла мигрирующего моторного комплекса – около 90–120 минут. Сокращения, возникающие в рамках ММК, обеспечивают продвижение по тонкой кишке пищеварительных соков, остатков пищи, слизи, в том числе и бактерий.
Условиями для нормального кишечного клиренса являются сохраненная анатомическая целостность и функциональная активность кишечника (отсутствие хирургических вмешательств, врожденных аномалий, нормальная перистальтика и др.). Косвенным индикатором сохраненного кишечного клиренса является отсутствие в тонкой кишке грамотрицательной флоры. Снижение перистальтики тонкой кишки и / или изменение ее нормальной анатомии приводит в итоге к стазу содержимого, создает благоприятные условия для избыточного роста грамотрицательной флоры (Мечетина Т. А., 2011; Кучерявый Ю. А., 2010).
Хронические заболевания панкреато-билиарной системы, сопровождающиеся объемным снижением секреции желчи и панкреатического сока и приводящие как к несостоятельности дуоденального антибактериального барьера, так и к грубым нарушениям пищеварения в верхнем отделе пищеварительнотранспортного конвейера, в первую очередь жиров, являются триггером для избыточного роста микрофлоры в тонкой кишке (Кучерявый Ю. А., 2010).
Мечетина Т. А. (2011) указывает на потерю концентрационной функции желчного пузыря после холецистэктомии как на один из факторов, способствующих формированию СИБР в тонкой кишке. В физиологических условиях стерильность желчи обеспечивается антибактериальным эффектом желчных кислот (Малафеева Э. В., 1996). Бактерицидные свойства пузырной желчи по сравнению с печеночной, существенно выше, так как концентрация желчных кислот за счет его всасывательной функции увеличивается примерно в 10 раз. При нормально функционирующем желчном пузыре после еды желчь выбрасывается сразу большой порцией и транзиторная микрофлора, находящаяся в двенадцатиперстной кишке, в большинстве своем гибнет.
Желчные кислоты расщепляют эндотоксины, выделяемые грамотрицательной флорой тонкой кишки на нетоксичные фрагменты (Bertok L., 2004), а также воздействуют непосредственно на клеточные мембраны бактерий. Периоды заполнения и опорожнения желчного пузыря имеются в течение каждой из фаз ММК, однако максимум выделения желчи наблюдается, когда сокращения третьей фазы (максимальной активности) ММК достигают подвздошной кишки. Снижение бактерицидных свойств желчи неминуемо создает благоприятные условия для развития СИБР в тонкой кишке.
Антибактериальной активностью обладает и панкреатический сок, являющийся одним из важных компонентов врожденной защиты желудочно-кишечного тракта (Rubinstein E., 1985; Kruszewska D., 2004; Holowachuk S. A.,2004;. Minelli E. B., 1996)
Противоречивые данные в литературе приведены относительно патогенетической связи СИБР и хронических воспалительных заболеваний кишечника. Развитие хронических заболеваний кишечника рассматривается с позиций гипотезы о существовании микроботканевого комплекса кишечника – функционального блока, объединяющего эти три составляющие (Денисов Н. Л., 1997). Местной иммунной системе отводится основная регуляторная роль в обеспечении равновесного состояния в микроботканевом комплексе (Денисов Н. Л., 1990). При этом отмечается единство структуры слизистой оболочки и локальной иммунной защиты желудочно-кишечного тракта (Brandtzaeg P., 1995). В целом эффективная защита определяется сбалансированным ответом всех звеньев местного иммунитета, однако ведущим фактором, по мнению всех исследователей, является sIgA (Tsuji M., 2008; Wines B. D., 2006).
Недостаточность этого компонента влечет за собой колонизацию слизистых оболочек микробами (Nagura H., 1998), повышение потока аллергенов через эпителиальный барьер (Macdonald T. T., 2005) и, как следствие, повышение нагрузки на «вторую линию» иммунной защиты, с формированием хронического воспаления (Powrie F., 2004).
Многие авторы отмечают наличие СИБР и его участие в патогенезе при синдроме раздраженного кишечника (Leung Ki E. L., 2010; Lin H. C., 2005). Так, СИБР был найден приблизительно в 25 % пациентов страдающих болезнью Крона, особенно у больных переносших операцию (Castiglione F., 2003). Однако, Денисов Н. Л. (2011) в своей работе определил некоторую тенденцию взаимоотношения хронических воспалительных заболеваний (ХВЗ) кишечника и СРК. Так при анализе тонкокишечных аспиратов у пациентов с СРК выявлялось достоверно большее микробное число, чем у здоровых лиц, но меньшее, чем у больных язвенным колитом (1,47; 1,3 и 4,88 lg КОЕ / мл соответственно). Усиление пролиферации условно-патогенной микрофлоры происходило на фоне выраженной депрессии основных представителей нормального микробиоценоза кишечника и наблюдалось преимущественно у больных язвенным колитом.
Описанная тенденциозность «выстраивает» состояние здоровья, функциональную патологию кишечника и ХВЗ кишечника в линейный график развития воспаления. Иными словами, функциональная патология кишечника в условиях СИБР проявляется менее выраженными воспалительными проявлениями в стенке кишки, чем хронические воспалительные заболевания кишечника, что неоднократно доказано гистологически, инструментально и клинически, и однозначно отвечает на вопрос от неправомерности применения термина «функциональное заболевание кишечника». Очередным подтверждением сказанного является двух– трехкратное превышение нормы белка кальпротектина в фекалиях пациентов с недостаточностью баугиниевой заслонки. По нашим данным у 97 % (n=26) обследованных пациентов с доказанной по результатам ирригоскопии НБЗ кальпротектин составил в среднем 162,4 мкг / г, при норме 0–49 мкг / г.
Клиника СИБР. Мечетина Т. А. (2011) указывает на то, что клинические проявления СИБР в тонкой кишке обусловлены характером патологических процессов, развивающихся вследствие различных причин, и носят вторичный характер.
Плотникова Е. Ю. 2013 определяя симптомы СИБР (метеоризм, вздутие живота, абдоминальная боль или дискомфорт, диарея, утомляемость, слабость, похудание), отмечает что, они не характеризуются специфичностью, а отражают степень распространенности воспаления слизистой оболочки кишки, «наслаиваются» на проявления основного заболевания, являющегося причиной развития СИБР. Более тяжелые симптомы, включая мальабсорбцию (потеря веса, стеаторея, мальнутриция), дефицит нутриентов (анемия, тетания при гипокальциемии индуциорованной дефицитом витамина Д, В12 – дефицитная полиневропатия) и расстройство метаболизма костной ткани, повреждение печени указывают на осложнения СИБР (Saltzman J. R., 1994; Кучерявый Ю. А., 2010).
Клиническая картина СИБР неспецифична и полиморфна и позволяет только предполагать клинический диагноз. Можно выделить ряд наиболее часто встречаемых симптомов, которые условно можно разделить на абдоминальные (объективный метеоризм, особенно через небольшой промежуток после приема пищи, неустойчивый стул со склонностью к диарее, лиентерея и стеаторея) и общие (признаки дефицита жирорастворимых витаминов, цианокобаламина и фолиевой кислоты, железа; невротические расстройства) (Кучерявый Ю. А., 2010).
Патоморфоз синдрома избыточного бактериального роста нередко маскируется под соматические заболевания и во многом напоминает мальабсорбцию при СРК с диареей (Donaldson R. M. Jr., 1964; King T., 2004; Lin H. C., 2004; Saltzman J. R., 1994; Lupascu A., 2005). Метеоризм, абдоминальный дискомфорт и боли, расстройства стула в сторону послабления – вот немногое из того, что роднит эти два состояния, и то, о чем весьма часто сообщают сами пациенты (Кучерявый Ю. А., 2014). Если учесть, что в ряде случаев СИБР протекает вообще бессимптомно (Маев И. В., 2011; Bures J., 2010; Gabrielli M., 2013), а бактерии довольно значительно влияют на ферментативные, метаболические процессы и сорбцию, то рано или поздно могут появиться признаки мальабсорбции и альдигестии, напоминающие симптоматику СРК, за исключением постоянности связи боли и метеоризма со стулом.
Ассоциация СИБР и СРК способствует формированию синдрома мальабсорбции за счет сочетания двух важнейших факторов: ускоренный пассаж (уменьшение времени контакта химуса с эпителиоцитами тонкой кишки) и избыточная активность бактерий в тонкой кишке с инактивацией панкреатических ферментов (вторичная панкреатическая недостаточность). Нарушение моторной функции кишечника у больных с СРК может служить фоном или фактором риска развития / прогрессирования СИБР. Роль кишечной микрофлоры для организма человека очевидна: когда в силу разных причин она занимает новую экологическую нишу или число микроорганизмов в естественном биотопе превышает условно определенный нормальный барьер, могут появиться клинические симптомы, функциональные расстройства и, возможно, повышаться риск органических изменений различных органов, вплоть до развития осложнений.
Кучерявый Ю. А. (2014) выделил возможные сочетания СИБР и СРК и дал их клиническую характеристику (табл. 3).
Таблица 3
Клинические сочетания СИБР и синдрома раздраженного кишечника
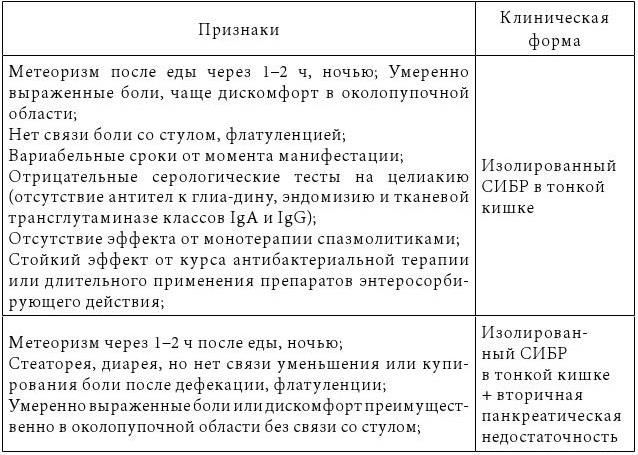


Кучерявый Ю. А. (2014) приходит к выводу, что связь между этими синдромами все же есть. Вероятнее всего, СИБР является самостоятельной единицей, часто сопутствующей СРК по причине некоторой общности патогенеза, однозначно усугубляющей течение этого заболевания
Лечение СИБР. Учитывая многофакторность патогенеза СИБР и широкий спектр заболеваний, при которых происходит его персистирование, подход к лечению больных должен быть не только комплексным, но и, по всей видимости, персонифицированным (Кучерявый Ю. А., 2010; Bures J., 2010).
Лечебно-профилактические мероприятия при синдроме бактериального роста в тонкой кишке включают широкий арсенал средств. Основными принципами лечения (Ардасткая М. Д., 2011; Авдеев В., 2010; Кучерявый Ю. А., 2010; Barrett J. S., 2008; Bures J., 2010; Мечетина Т. А., 2011) являются:
– лечение патологии, приведшей к развитию СИБР;
– восстановление нормального микробиоценоза кишечника;
– нормализацию кишечного пищеварения;
– деконтаминация условно патогенной флоры; – поддерживающая терапия основного заболевания и профилактика возникновения развития микробной контаминации тонкой кишки (в период ремиссии).
Несмотря на объективные сложности верификации СИБР, практическое звено здравоохранения серьезно продвинулось в лечении, опираясь на эмпирические подходы (Кучерявый Ю. А., 2014). Антибиотики, кишечные антисептики, препараты висмута, энтеросорбенты, пробиотики и пищевые волокна широко применяются на практике и апробируются в открытых исследованиях в связи с теоретическим обоснованием наличия СИБР и / или при выявлении определенных клинических синдромов, позволяющих врачу думать, что СИБР, вероятно, есть (Маевская Е. А., 2013).
Использование подхода к лечению с помощью антибактериальных средств остается дискутабельным, положительный эффект от их применения в 5 рандомизированных исследованиях (Lembo A., 2008; Pimentel M., 2003; Pimentel M., 2011; Sharara A., 2006; Whorwell P. J., 2006) поддерживает концепцию о роли измененной микрофлоры в патогенезе СРК.
В настоящее время эталоном в консервативной терапии СИБР тонкой кишки признан внутрикишечный антибиотик рифаксимин (Мечетина Т. А., 2011; Кучерявый Ю. А., 2014, Pimentel M., 2011; Drossman D. A., 2006; Маев И. В., 2013), который является полусинтетическим производным Рифампицина SV (Агафонова Н. А., 2009; Чучалин А. Г., 2007). В Европе рифаксимин используется при диарее путешественников (Corazza G. R., 2006) и печеночной энцефалопатии (Kerlin P., 1990). Стандартная схема применения рифаксимина составляет 7–14 дней, нередко требуются повторные курсы терапии.
Проводилось большое количество исследований по сравнению Рифаксимина с другими антибиотиками, такими как ципрофлоксацин, норфлоксацин, хлортетрациклин, метронидазол, защищенный амоксициллин и др. В них была показана большая эффективность (63,4–70 %) рифаксимина по критерию нормализации водородного дыхательного теста (DiStefano M., 2000; Lauritano E. C., 2009), достоверное снижение пиковой и общей экскреции водорода (Агафонова Н. А., 2009; Adachi J. A., 2006; Di Stefano M., 2000; Gasbarrini A., 2007; Peralta S., 2009; Scarpellini E., 2007). В одной из обзорных работ отмечено, что применение рифаксимина привело к купированию клинических проявлений СИБР у 33–92 % больных и редукции СИБР у 84 % пациентов с СРК (Drossman D. A., 2006). Также отмечается существенно лучшая переносимость рифаксимина (Dupont H. L., 2001) и меньшая частота (до 1 %) возникновения побочных эффектов (Baker D. E., 2005; Lakshmi C. P., 2009; Scarpignato C., 2006; Corazza G. R., 2006) по сравнению с системными и другими внутрикишечными антибиотиками. Отмечается факт отсутствия резистентности внутрикишечных бактерий к рифаксимину за счет его неселективного действия по сравнению с системными антибиотиками (Attar A., 1999). Du Pont H. L. (2014) напротив, указывает, что исследований резистентности микрофлоры к рифаксимину не проводилось, несмотря на имеющиеся теоретические предпосылки.
Аналогичный рифаксимину позитивный эффект мы наблюдали у пациентов с СИБР, которым выполнялись санирующие кишечник манипуляции (предоперационная подготовка кишечника, подготовка кишечника перед колоноскопией, УЗИ брюшной полости, после рентгеноконтрастных исследований кишечника и т. д.). Пиковое и фоновое выделение водорода нормализовались, а при неудовлетворительной подготовке (выявленной интраоперационно) выделение водорода соответствовало СИБР 1 степени (по Мечетиной Т. А., 2011), что было значительно меньше по сравнению с исходными данными (n=30, p=0,05). Также нами подтвержден факт восстановления первичного (до воздействия на кишечник) биоценоза кишечника в пределах количественного (по результатам ВДТ), качественного (по результатам бак. посева содержимого тонкой кишки) состава, а также заинтересованных отделов кишечника в сроки до 4-х недель, что согласуется с данными некоторых авторов (Ledochowski M., 2008). При этом достижение подобных результатов не требовало дорогостоящего фармакологического воздействия, с сопутствующими негативными эффектами. Таким образом, создав клиническую экспериментальную модель применения внутрикишечных антибиотиков, мы подтвердили эффективность и нестойкость консервативной антибиотикотерапии.
Косвенным подтверждением наших выводов служат рекоменации Кучерявого Ю. А. (2010), который считает оправданным применение коротких курсов энтеросорбентов с последующим назначением пребиотичексих препаратов.
Некоторые авторы указывают на дозозависимый эффект применения рифаксимина, то есть чем выше доза (выше 800 мг / сутки) тем более выражено санирующее кишечник действие. Так, Мечетина Т. А. (2011) приводит следующие данные. Через 1 месяц после лечения у больных, получавших рифаксимин в дозе 800 мг / сут, боли отсутствовали у 55 % больных, метеоризм – у 70 %, стул был нормальным у 75 %, а в группе больных получавших рифаксимин в дозе 1200 мг / сут, боли отсутствовали у 85 % больных, метеоризм – у 90 %, стул был нормальным у 95 % (р<0,05 по сравнению с исходными показателями и рифаксимином 800 мг / сут). Через 1 месяц после лечения у больных, получавших рифаксимин в дозе 800 мг / сут, нормальные показатели водородного дыхательного теста отмечены у 30 % больных, а у больных, получавших рифаксимин в дозе 1200 мг / сут – у 90 % больных (р<0,05 по сравнению с исходными и рифаксимином 800 мг / сут). Исследование эффективности проведенной терапии в сроки более 30 дней, к сожалению, не проводились.
Однако до сих пор отсутствует убедительная научная база, демонстрирующая высокую эффективность рифаксимина при СИБР, как это имеет место при диарее путешественников и печеночной энцефалопатии (Barbara G., 2004; Koo H. L., 2010). Большая часть исследований характеризуется коротким периодом и небольшим количеством наблюдений (Маев И. В., 2013; Bures J., 2010). Безусловным преимуществом подобных препаратов является отсутствие системных нежелательных явлений, а недостатком – высокая стоимость.
Кроме того, Bures J. (2010) отмечает достаточно высокую частоту рецидива СИБР после успешного лечения, достигающую 44 % спустя 9 мес. после эффективной терапии рифаксимином. Аналогичный процент рецидива был определен у пациентов с болезнью Паркинсона и СИБР через 6 месяцев после успешного лечения (Gabrielli M., 2011).
Интересен взгляд Плотниковой Е. Ю. (2013), которая в своем исследовании интерпретировала неудовлетворительные результаты проведенной терапии СИБР (сохраняющиеся болевой синдром и кишечная диспепсия при нормализации показателей дыхательного водородного теста) как проявление СРК.
Особняком в этом списке стоят данные Парфенова А. И. (2011), который подтверждает прогнозируемую эффективность терапии СИБР при постинфекционном СРК. По его данным лечение позволяет добиться стойкой ремиссии на протяжении не менее года у 76,3 % больных. Он приходит к выводу, что для ПСРК характерен еще один критерий – хороший терапевтический эффект антибактериальных, биологически активных препаратов (пре– и пробиотиков) и иммуномодуляторов.
Многие авторы (Кучерявый Ю. А., 2014; Lauritano E. C., 2008), в итоге, отдельно останавливаются на очевидном выводе – прогноз СИБР и риск его рецидива после успешной антибиотикотерапии зависит, прежде всего, от терапевтического воздействия на первичное фоновое заболевание, которое способствовало контаминации тонкой кишки. Gabrielli, M. (2013) справедливо указывает, что рецидив СИБР в случае сохранения предрасполагающих причин, часто приводит к хронизации процесса и сложной, а порой невозможной, консервативной коррекции.
Список литературы:
1. Adams, L. A. Nonalcoholic steatohepatitis: risk factors and diagnosis / L. A. Adams, A. E Feldstein. // Exp. Rev. Gastroenterol. Hepatol. – 2010. – № 4 (5). – P. 623–635.
2. Allan, J. D. Influence of gastric pH on gastric and j’ejunal flora / J. D Allan., M. M. Shiner // Gut. – 1967. – Vol. 8. – P. 574–581.
3. Bala, L. Malabsorption syndrome with and without small intestinal bacterial overgrowth: a study on upper-gut aspirate using IH NMR spectroscopy / L. Bala, U. C., Ghoshal // Magn Reson Med. – 2006. – Vol. 56. – № 4. – P. 738–744.
4. Barbara, G. Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome / G. Barbara, V. Stanghellini, R. de Giorgio // Gastroenterology. – 2004. – Vol. 126 (3). – P. 693–702.
5. Barrett, J. S. Probiotic effects on intestinal fermentation patterns in patients with irritable bowel syndrome / J. S. Barrett, K. E. Canale, R. B. Gearry // World J. Gastroenterol. – 2008. – Vol. 14, № 32. – P. 5020–5024.
6. Bauer, T. M. Small intestinal bacterial overgrowth in patients with cirrhosis: prevalence and relation with spontaneous bacterial peritonitis. / Bauer T. M., Steinbr?ckner B., F. E. Brinkmann, A. K. Ditzen, H. Schwacha, J. J. Aponte, K. Pelz, M. Kist, H. E. Blum // Am J Gastroenterol. – 2001. – Vol. 96. – P. 2962–2967.
7. Berlitsos, P. C. Association of gastric hypoacidity with opportunistic enteric infections in patients with AIDS / P. C. Berlitsos, J. K. Greenson, J. H. Yardley et al. // J. Infect. Dis. – 1992. – V. 166. – P. 277–284.
8. Bertok, L. Bile acids in physico-chemical host defence / L. Bertok // Pathophysiology. – 2004. – Vol. 11 (3). – P. 139–145.
9. Brandtzaeg, P. The human gastrointestinal secretory immune system in health and disease / P. Brandtzaeg, K. Valnes, H. Scott // Scand. J. Gastroenterology. – 1985. – Vol. 20. – Suppl. 114. – P. 17–38.
10. Browning, G. G. The effect of vagotomy and drainage on the small bowel flora / Browning G. G., Buchan K. A., Mackay C. //Gut. – 1974. – Vol.15. – P. 139–142.
11. Bures, J. Small intestinal bacterial overgrowth syndrome / J. Bures, J. Cyrany, D. Kohoutova D. et al. // World J. Gastroenterol. – 2010. – Vol. 28. – P. 2978–2990.
12. Castiglione, F. Antibiotic treatment of small bowel bacterial overgrowth in patients with Crohn’sdisease / F. Castiglione, A. Rispo, E. Di Girolamo E. et al. // Aliment Pharmacol Ther. – 2003. – Vol. 18. – P. 1107–1112.
13. Cuoco, L. Small intestine bacterial overgrowth in irritable bowel syndrome: a retrospective study with rifaximin / L. Cuoco, M. M. Salvagnini // Minerva Gastroenterol Dietol. – 2006. – Vol. 52 (l). – P. 89–95.
14. Dae, W. J. Association between small intestinal bacterial overgrowth and peripheral bacterial DNA in cirrhotic patients / W. J. Dae, T. K. Kyung, O. Y. Lee // Dig. Dis. Sci. – 2010. – Vol. 55. – P. 1465–1471.
15. Dolby, J. M. Bacterial colonization and nitrite concentration in the achlorhydric stomachs of patients with primary hypogammaglobulinaemia or classic pernicious anaemia / J. M. Dolby, A. D. B. Webster, S. P. Bordello // Scand J. Gastroenterol. – 1984. – Vol. 19. – P. 105–110.
16. Dominguez-Munoz, J. E. Pancreatic enzyme therapy for pancreatic exocrine insufficiency. / J. E. Dominguez-Munoz // Curr. Gastroenterol Rep. – 2007. – Vol. 9 (2). – P. l16–122.
17. Donaldson, R. M. Jr. Normal bacterial populations of the intestine and their relation to intestinal function / R. M. Jr. Donaldson // NEngl. J. Med. – 1964. – Vol. 270. – P. 1050–1056.
18. Drossman, D. A. The functional gastrointestinal disorders and the Rome III process / D. A. Drossman // Gastroenterology. – 2006. – Vol. 130 (5). – P. 1377–1390.
19. Elfick, D. A. Small bowel bacterial overgrowthin symptomatic older people: can it be diagnosed earlier? / D. A. Elfick., S. Chewt, S. E. Higham, N. Bird, A. Ahmad, S. D. Sanders // Gerontology. – 2005. – Vol. 51 – P. 396–401.
20. Esposito, I. Breath test for differential diagnosis between small intestinal bacterial overgrowth and irritable bowel disease: an observation on non-absorbable antibiotics / I. Esposito, A. de Leone, G. Di Gregorio // World J. Gastroenterol. – 2007. – Vol. 13 (45). – P. 6016–6021.
21. Feldman, M. Effects of aging and gastritis on gastric acid and pepsin secretion in humans: A prospective study / M. Feldman, B. Oyer, K. B. McArthur // Gastroenterology. – 1996. – Vol. 110. – P. 1043–1052.
22. Fernandez, J. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis / J. Fernandez, M. Navasa, Gomez J. // Hepatology. – 2002. – Vol. 35. – P. 140–148.
23. Ford, A. C. Small intestinal bacterial overgrowth in irritable bowel syndrome: systematic review and meta-analysis / A. C. Ford, B. M. Spiegel, N. J. Talley, P. Moayyedi // Clin. Gastroenterol. Hepatol. – 2009. – Vol. 7. – P. 1279–1286.
24. Fridge, J. L. Risk factors for small bowel bacterial overgrowth in cystic fibrosis / J. L. Fridge, C. Conrad, L. Gerson, R. O. Castillo, K. Cox // J Pediatr Gastroenterol Nutr. – 2007. – Vol. 44. – P. 212–218.
25. Fried, M. Duodenal bacterial overgrowth during treatment in outpatients with omeprazole / M. Fried, H. Siegrist, R. Frei // Gut. – 1994. – Vol. 35. – P. 23.
26. Gabrielli, M. Diagnosis of small intestinal bacterial оvergrowth in the clinical practice / M. Gabrielli, G. D. Angelo, T. D. I. Rienzo, E. Scarpellini, V. Ojetti // European Review for Medical and Pharmacological Sciences. – 2013. – V. 17. – Р. 30–35.
27. Gabrielli, M. Prevalence of small intestinal bacterial overgrowth in Parkinson’s disease / M. Gabrielli, P. Bonazzi, E. Scarpellini, A. E. Bendi, E. C. Lauritano et al. // Mov. Disord. – 2011. – Vol. 26. – P. 889–892.
28. Gasbarrini, A. 1st Rome H2-Breath Testing Consensus Conference Working Group. Methodology and indications of H2-breath testing in gastrointestinal diseases: the Rome Consensus Conference / A. Gasbarrini, G. R. Corazza, G. Gasbarrini et al // Aliment. Pharmacol. Ther. – 2009. – Vol. 29 (1). – P. 1–49.
29. Gasbarrini, A. Small intestinal bacterial overgrowth: diagnosis and treatment / A. Gasbarrini, E. C. Lauritano, M. Gabrielli // Dig. Dis. – 2007. – Vol. 25 (3). – P. 237–240.
30. George, N. S. Small intestinal bacterial overgrowth in gastroparesis / N. S. George, A. Sankineni, H. P. Parkman // Dig Dis Sci. – 2012. – [Epub ahead of print].
31. Giannella, R. A. Gastric acid barrier to ingested microorganisms in man: Studies in vivo and in vitro / R. A. Giannella, S. A. Broitman, N. Zamcheck // Gut. – 1972. – Vol. 13. – P. 251–256.
32. Greenlee, H. B. Bacterial flora of the jejunum following gpeptic ulcer surgery / H. B. Greenlee, R. Vivit, J. Paez // ArchSurg. – 1971. – Vol. 102. – P. 260–265.
33. Greenlee, H. B. The influence of gastric surgery on the intestinal flora. / H. B. Greenlee, S. M. Gelbart, De Orio A Jetal. // Am. J. Clin. Nutr. – 1977. – Vol. 30. – P. 1826–1833.
34. Gunnarsdottir, S. A. Small intestinal motility disturbances and bacterial overgrowth in patients with liver cirrhosis and portal hyperte nsion / S. A. Gunnarsdottir, R. Sadik, S. Shev // Am. J. Gastroenterol. – 2003. – Vol. 98. – P. 1362–1370.
35. Hashimoto, N. Effect of acute portal hypertension on gut mucosa / N. Hashimoto, H. Ohyanagi // Hepatogastroenterology. – 2002. – Vol. 49. – P. 1567–1570.
36. Heuman, D. M. Persistent ascites and low sodium identify patients with cirrhosis and low MELD score who are at high risk for early death / D. M. Heuman, S. G. Abou-assi, A. Habib // Hepatology. – 2004. – Vol. 40. – P. 802–810.
37. Holowachuk, S. A. Nonparallel secretion of antibacterial activity and protein in porcine pancreatic juice / S. A. Holowachuk, M. F. Bal’a, P. D. Gerard // Pancreas. – 2004. – Vol. 28 (2). – P. 232–238.
38. Husebye, E. Abnormal intestinal motor pattern sexplain enteric colonization with gram-negative bacilli in lateradiation enteropathy / E. Husebye, V. Skar, T. Hoverstad // Gastroenterology. – 1995. – Vol. 109. – P. 1078–1089.
39. Husebye, E. The pathogenesis of gastrointestinal bacterial overgrowth / E. Husebye // Chemotherapy. – 2005. – Vol. 51. – P. 1–22.
40. Husebye, E. The patterns of small bowel motility: physiology and implications in organic disease and functional disorders / E. Husebye // Neurogastroenterol. Motil. – 1999. – Vol. 11. – P. 141–161.
41. Justensen, T. The normal cultivable microflora in upper jejunal fluid in healthy adults / T. Justensen, O. Haagen Nielsen, E. Jacobson // Scand. J. Gastroneterol. – 1984. – Vol. 19. – P. 279–282.
42. Kawaguchi, H. Helicobacter pylori infection is the major risk factor for atrophic gastritis / H. Kawaguchi, K. Haruma, K. Komoto // Am. J. Gastroenterol. – 1996. – Vol. 91. – P. 959–962.
43. Kenny, S. E. Delayed maturation of the interstitial cells of cajal: a new diagnosis for transient neonatal pseudoobstruction. Report of two cases. / S. E. Kenny, J. M. Vanderwinden, R. J. Rintala // J. Pediatr. Surg. – 1998. – Vol. 33. – P. 94–98.
44. Khoshini, R. A systematic review of diagnostic tests for small intestinal bacterial overgrowth / R. Khoshini, C. Dai S., S. Lezcano // Dig. Dis. Sci. – 2008. – Vol. 53 (6). – P. 1443–1454.
45. King, T. Small intestinal bacterial overgrowthand irritable bowel syndrome / T. King // JAMA. – 2004. – Vol. 292. – P. 2213; author reply 2213–2214.
46. King, T. Small intestinal bacterial overgrowthandirritablebowel syndrome / T. King // JAMA. – 2004. Vol. 292. – P. 2213–2214.
47. Kopacova, M. Small intestinal bacterial overgrowth syndrome / M. Kopacova, J. Bures, J. Cyrany // World J. Gastroenterol. – 2010. – Vol. 16 (24). – Р. 2978–2990.
48. Krauss, N. Monitoring non responsive patients who have celiac disease / N. Krauss, D. Schuppan // Gastrointest. Endosc Clin N Am. – 2006. – Vol. 16. – P. 317–327.
49. Kruszewska, D. Effect of the antibacterial activity of pig pancreatic juice on human multiresistant bacteria / D. Kruszewska, A. Ljungh, S. O. Hynes // Pancreas. – 2004. – Vol. 28 (2). – P. 191–199.
50. Larry, S. Miller Ileocecal valve dysfunction in small intestinal bacterial overgrowth: A pilot study / Larry S. Miller, K. Anil Vegesna, Aiswerya Madanam Sampath, Shital Prabhu, Sesha Krishna Kotapati, Kian Makipour // WGJ. – 2012. – V. 18 – Р. 6801–6808.
51. Lata, J. Spontaneous bacterial peritonitis: a severe complication of liver cirrhosis / J. Lata, O. Stiburek, M. Kopacova // World J Gastroenterol. – 2009. – Vol. 15. – P. 5505–5510.
52. Lauritano, E. C. Rifaximin dose-finding study for the treatment of small intestinal bacterial overgrowth / E. C. Lauritano, M. Gabrielli, A Lupascu // Aliment. Pharmacol. Ther. – 2005. – Vol. 22. – P. 31–35.
53. Lauritano, E. Small intestinal bacterial overgrowthrecurrenceafter antibiotictherapy / E. Lauritano, M. Gabrielli, E. Scarpellini et al. // Am. J. Gastroenterol. – 2008. – Vol. 103. – P. 2031–2035.
54. Ledochowski, M. Hydrogen Breath tests. 1st Edition / M. Ledochowski, E. Ledochowski, A. Eisenmann. – Innsbruck: «Akademie», 2008. – 59 р.
55. Lembo, A. Rifaximin for the treatment of diarrhea associated irritable bowel syndrome: short term treatment leading to long term sustained response / A. Lembo, S. F. Zakko, N. L. Ferreira // Gastroenterology. – 2008. – Vol. 134 (4, suppl. 1). – P. 545.
56. Leung, K. E. L. Small intestine bacterial overgrowth / K. E. L. Leung, J. Roduit, J. Delarive // Rev. Med. Suisse. – 2010. – Vol. 6, № 233. – P. 186–188, 190–191.
57. Levitt, M. D. Use of respiratory hydrogen (H2) excretion to detect carbohydrate malabsorption / M. D. Levitt, R. M. Donaldson // J. Lab. Clin. Med. – 1970. – Vol. 75. – P. 937–945.
58. Levitt, M. D. Volume, composition, and source of intestinal gas / M. D. Levitt, J. H. Jr. Bond // Gastroenterology. – 1970. – Vol. 59. – P. 921–929.
59. Lewis, S. J. Altered bowel function and duodenal bacterial overgrowth in patiearrts «treated with omeprazole / S. J. Lewis, S. Franco, G. Young // Aliment Pharmacol Ther. – 1996. – Vol.10. – P. 557–561.
60. Lin, H. C. Bacterial concepts in irritable bowel syndrome / H. C. Lin, M. Pimentel // Rev. Gastroenterol. Disord. – 2005. – № 5, Suppl. 3. – P. 3–9.
61. Lin, H. C. Small intestinal bacterial overgrowth: a frame work for under standing irritable bowel syndrome / H. C. Lin // JAMA. – 2004. – Vol. 292. – P. 852–858.
62. Lin, Н. С. Jejunal brake: inhibition of intestinal transit by fat in the proxim SLL smallintestine / H. C. Lin, X. T. Zhao, L. Wang // Dig Dis Sci. – 1996. – Vol. 41. – P. 326–329.
63. Lombardo, L. Increased incidence of small intestinal bacterial overgrowth during proton pump inhibitor therapy / L. Lombardo, M. Foti, O. Ruggia, A. Chiecchio // Clin Gastroenterol Hepatol. – 2010. – Vol. 8. – P. 504–508.
64. Lupascu, A. Hydrogen glucose breathtest to detect small intestinal bacterial overgrowth: a prevalence case-control study in irritable bowel syndrome / A. Lupascu, M. Gabrielli, E. C. Lauritano, E. Scarpellini et al. // Aliment Pharmacol Ther. – 2005. – Vol. 22. – P. 1157–1160.
65. Macdonald, T. T. Immunity, inflammation, and allergy in the gut / T. T. Macdonald, G. Monteleone // Science. – 2005. – Vol. 307, N 5717. – P. 1920–1925.
66. Mancilla, А. С. Small intestine bacterial overgrowth in patients with chronic; pancreatitis / A. C. Mancilla, A. M. Madrid, H. C. Hurtado // Rev Med Chil – 2008. – Vol. l36 (8). – P. 976–980.
67. Mann, N. S. The prevalence of small intestinal bacterial overgrowth in irritable bowel syndrome / N. S. Mann, M. LimogesGonzales // Hepatogastroenterology. – 2009. – Vol. 56. – P. 718–721.
68. Marks, I. N. Acid secretion, 1932–92: Advances, adaptations, and paradoxces / I. N. Marks, J. A. Louw, G. O. Young // Scand J Gastroenterol. – 1992. – Vol. 193. – P. 7–13.
69. Martell, M. Physiopathology of splanchnic vasodilation in portal hypertension / M. Martell, M. Coll, N. Ezkurdia // World J. Hepatol. – 2010. – Vol. 2. – P. 208–220.
70. Mathurin, S. Infections in hospitalized patients with cirrhosis / S. Mathurin, A. Chapelet, V. Spanevello // Medicina (B Aires). – 2009. – Vol. 69. – P. 229–238.
71. Mc Cloy, R. F. Pathophysiological effects of long-term acid suppression in man / R. F. Mc Cloy, R. Arnold, K. D. Bardhan // Dig Dis Sci. – 1995. – Vol. 40. – P. 96–120.
72. Mcphee, S. J. Current medical diagnosis and treatment. – 4th ed. / S. J. Mcphee, M. A. Papadakis, L. M. Tierney – McGraw-Hill Medical Publishing Division, 2007. – 1931 p.
73. Mendoza, E. Diagnosis of small intestinal bacterial overgrowth in children: the use of lactulose in the breath hydrogen test as a screening test / E. Mendoza, C. Crismatt, R. Matos // Biomedica. – 2007. – Vol. 27 (3). – P. 325–332.
74. Minelli, E. B. Antimicrobial activity of human pancreatic juice and its interaction with antibiotics / E. B. Minelli, A. Benini, C. Bassi // Antimicrob Agents Chemother. – 1996. – Vol. 40 (9). – P. 2099–2105.
75. Morihara, M. Assessment of gastric acidity of Japanese subjects over the last 15 years / M. Morihara, N. Aoyagi, N. Kaniwa // Biol Pharm Bull. – 2001. – Vol. 24. – P. 313–315.
76. Murphy, G. M. Depressing acid, deconjugating bile / G. M. Murphy // Gut. – 1998. – Vol. 42. – P. 154–155.
77. Muscroft, T. J. The microflora of the postoperative stomach / T. J. Muscroft, S. A. Deane, D. Young // Br. J. Surg. – 1981. – Vol. 68. – P. 56–564.
78. Nagura, H. Mucosal immune system and mucosal inflammation / H. Nagura, H. Ohtani // Bioregulation and its disorders in the gastrointestinal tract. – Tokyo: Blackwell Science, 1998. – P. 95–104.
79. Oren Zaidel, Uninvited Guests: The Impact of Small Intestinal Bacterial Overgrowth on Nutritional Status / Oren Zaidel, Henry C. Lin. // Practical Gastroenterology. – 2003. – Vol. XXVII (7). – P. 24–37.
80. Pande, С. Small-intestinal bacterial overgrowth in cirrhosis is related to the severity of liver disease / C. Pande, A. Kumar, S. K. Sarin // Aliment. Pharmacol. Ther. – 2009. – Vol. 29. – P. 1273–1281.
81. Pignata, C. Jejunal bacterial overgrowth and intestinal permeability in child ren with immunodeficiency syndromes / C. Pignata, G. Budillon, G. Monaco tt al. // Gut. – 1990. – Vol. 31. – P. 879–882.
82. Pimentel, M. Eradication of small intestinal bacterial overgrowth reduces symptoms of irritable bowel syndrome / M. Pimentel, E. J. Chow, H. C. Lin // Am. J. Gastroenterol. – 2000. – Vol. 95 (12). – P. 3503–3506.
83. Pimentel, M. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. A doubleblind, randomized, placebo-controlled study / M. Pimentel, E. J. Chow, H. C. Lin // Am. J. Gastroenterol. – 2003. – Vol. 98 (2). – P. 412–419.
84. Pimentel, M. Review of rifaximin as treatment for SIBO and IBS / M. Pimentel // Expert Opin. Invest. Drugs. – 2009. – Vol. 18, № 3. – P. 349–358.
85. Pimentel, M. Rifaximin therapy for patients with irritable bowel syndrome without constipation / M. Pimentel, A. Lembo, W. D. Chey // N. Engl. J. Med. – 2011. – Vol. 364. – P. 22–32.
86. Powrie, F. Immune regulation in the intestine: a balancing act between effector and regulatory T cell responses / F. Powrie // Ann. N. Y. Acad. Sci. – 2004. – № 1029. – P. 132–141.
87. Quera, R. Sobrecrecimiento bacteriano intestinal / R. Quera, E. Quigley, A. Madrid // Rev. Med. Chil. – 2005. – Vol. 133. – P. 1361–1370.
88. Rana, S. V. Small intestinal bacterial overgrowth / S. V. Rana, S. B. Bhardwaj // Scand J Gastroenterol. – 2008. – Vol. 43 (9). – P. 1030–1037.
89. Reback, J. F. Studies of Intestinal Flora of White Rat / J. F. Reback // Scand J Gastroenterol. – 2006. – Vol. 43 (9). – P. 1030–1037.
90. Riordan, S. M. Bacteriologic аnalysis of мucosal вiopsy specimens for detecting Small-Intestinal Bacterial Overgrowth / S. M. Riordan, C. J. Mclver, V. M. Duncombe // Scand J Gastroenterol. – 1995. – Vol. 30 (7). – P. 681–685.
91. Riordan, S. M. Small intestinal bacterial overgrow thin the symptomatic elderly / S. M. Riordan, C. J. Mclver, D. Wakefield // Am J Gastroenterol. – 1997. – Vol. 92 (1). – P. 47–51.
92. Rubinstein, E. Antibacterial activity of the pancreatic fluid / E. Rubinstein, Z. Mark, J. Haspel // Gastroenterology. – 1985. – Vol. 88 (4). – P. 927–932.
93. Rubio-Tapia, A. Prevalenceof small intestine bacterial overgrowth diagnosed by quantitative culture of intestinal aspirate in celiac disease / A. Rubio-Tapia, S. H. Bartom, J. E. Rosenblatt, J. A. Murray // J Clin Gastroenterol. – 2009. – Vol. 43. – P. 157– 161.
94. Saad, R. Breath tests for gastrointestinal disease: the real deal or just a lot of hot air? / R. Saad, W. Chey // Gastroenterology. – 2007. – Vol. 133. – P. 1763–1766.
95. Saltzman, J. R. Bacterial overgrowth without clinical malabsorption in elderly hypochlorhydric subjects / J. R. Saltzman, K. V. Kowdley, M. C. Pedrosa // Gastroenterology. – 1994. – Vol. 106. – P. 615–623.
96. Saltzman, J. R. Nutritional consequences of intestinal bacterial overgrowth / J. R. Saltzman, R. M. Russell // Compr Ther. – 1994. – Vol. 20. – P. 523–530.
97. Saltzman, J. R. Bacterial overgrowth with out clinical malabsorption in elderly hypochlorhydric subjects / J. R. Saltzman, K. V. Kowdeley, M. C. Pedrosa, T. Sepe, B. Golner, G. Perrone, R. M. Russell // Gastroenterology. – 1994. – Vol. 106. – P. 615–623.
98. Scarpellini, E. High dosa gerifaximin for the treatment of small intestinal bacterial overgrowth / E. Scarpellini, M. Gabrielli, C. E Lauritano // Aliment Pharmacol Ther. – 2007. – Vol. 25 (7). – P. 781–786.
99. Scarpellini, E. Prevalence of small intestinal bacterial overgrowth in children with irritable bowel syndrome: a case-control study / E. Scarpellini, V. Giorgio, M. Gabrielli // J. Pediatr. – 2009. – Vol. 155. – P. 416–420.
100. Sharara, A. A randomized double-blind placebo controlled trial of rifaximin in patients with abdominal bloating and flatulence / A. Sharara, E. Aoun, H. Abdul-Baki // Am. J. Gastroenterol. – 2006. – Vol. 101 (2). – P. 326–333.
101. Shindo, K. Alteration of bile acid metabolism by cimetidine in healthy humans / K. Shindo, R. Yamazaki, K. Koide // J. Investig. Med. – 1996. – Vol. 44. – P. 462–469.
102. Shindo, K. Deconjugation ability of bacteria isolated from the jejunal fluid of patients with progressive systemic sclerosis and its gastric pH / K. Shindo, M. Machida, K. Koide // Hepatogastroenterology. – 1998. – Vol. 45. – P. 1643–1650.
103. Shindo, K. Effect of H2-receptor antagonists on bile acid metabolism / K. Shindo, M Fukumura // J. Investig Med. – 1995. – Vol. 43. – P. 170–177.
104. Shindo, K. Omeprazole induces altered bile acid metabolism / K. Shindo, M. Machida, M. Fukumura // Gut. – 1998. – Vol. 42. – P. 266–271.
105. Shindo, К. A syndrome of cirrhosis, chlorhydria, small intestinal bacterial overgrowth, and fat malabsorption / K. Shindo, M. Machida, K. Miyakawa // Am. J. Gastroenterol. – 1993. – Vol. 88. – P. 2084–2091.
106. Simon, G. L. The human intestinal microflora / G. L. Simon, S. L. Gorbach // Dig. Dis. Sci. – 1986. – Vol. 31. – P. 147–162.
107. Simren, M. Use and abuse of hydrogen breath tests / M. Simren, P. O. Stotzer // Gut. – 2006. – Vol. 55 (3). – P. 297–303.
108. Singh, V. V. Small bowel bacterial overgrowth: presentation, diagnosis, andtreatment / V. V. Singh, P. P. Toskes // Curr Treat Options Gastroenterol. – 2004. – Vol. 7. – P. 19–28.
109. Spencer, N. J. Simultaneous intracellular recordings from longitudinal and circular muscle during the peristaltic reflex in guinea-pig distal colon / N. J. Spencer, T. K. Smith // J Physiol. – 2001. – Vol. 533. – P. 787–799.
110. Stotzer, P. O. Comparison of the 1-gram (14) C–D-xylose breath test and the 50-gram hydrogen glucose breath test for diagnosis of small intestinal bacterial overgrowth / P. O. Stotzer, A. F. Kilander // Digestion. – 2000. – Vol. 61 (3). – P. 165–171.
111. Thompson, A. I. Genetics of ulcerative colitis / A. I. Thompson, C. W. Lees // Inflamm. Bowel. Dis. – 2011. – Vol. 17, N.3. – P. 831–848.
112. Toskes, P. Bacterial overgrowth of the gastrointestinal tract / P. Toskes // Adv. Int. Med. – 1993. – Vol. 38. – P. 387–407.
113. Tsuji, M. Dynamic interactions between bacteria and immune cells leading to intestinal IgA synthesis / M. Tsuji, K. Suzuki, K. Kinoshita, S. Fagarasan // Semin. Immunol. – 2008. – Vol. 20,N1 – P.59–66.
114. Tursi, A. Assessment of small intestinal bacterial overgrowth in uncomplicated acute diverticulitis of the colon / A. Tursi, G. Brandimarte, G. M. Giorgetti, W. Elisei // World J Gastroenterol. – 2005. – Vol. 11. – P. 2773–2776.
115. Tursi, A. High prevalence of small intestinal bacterial overgrowth in celiac patients with persistence of gastrointestinal symptoms after gluten with drawal / A. Tursi, G. Brandimarte, G. M. Giorgetti // Am. J. Gastroenterol. – 2003. – Vol. 98. – P. 839–843.
116. Vanner, S. The small intestinal bacterial overgrowth – Irritable bowel syndrome hypothesis: Implications for treatment / S. Vanner // Gut. – 2008. – Vol. 57, N 9. – P. 1315–1321.
117. Vantrappen, G. The interdigestive motor complex of normal subjects and patients with bacterial overgrowth of the small intestine / G. Vantrappen, J. Janssens, J. Hellemans // J Clin Invest. – 1977. – Vol. 59. – P. l158–1166.
118. Whorwell, P. J. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome / P. J. Whorwell, L. Altringer, J. Morel // Am. J. Gastroenterol. – 2006. – Vol. 101 (7). – P. 1581–1590.
119. Wiest, R. Bacterial translocation in cirrhosis / R. Wiest, G. Garcia-Tsao // Hepatology. – 2005. – Vol. 41. – P. 422–433.
120. Wines, B. D. IgA receptors in health and disease / B. D. Wines, P. M. Hogarth // Tissue Antigens. – 2006. – Vol. 68, № 2. – P. 103–114.
121. Xavier, R. J. Unravelling the pathogenesis of inflammatory bowel disease / R. J. Xavier, D. K. Podolsky // Nature. – 2007. – Vol. 448, N7152. – P. 427–434.
122. Yang, C. Y. Small intestinal bacterial overgrowth in patients with liver cirrhosis, diagnosed with glucose H2 or CH4 breath tests / C. Y. Yang, C. S. Chang, G. H. Chen // Scand. J. Gastroenterol. – 1998. – Vol. 33. – P. 867–871.
123. Авдеев, В. Диагностика и лечение синдрома избыточного роста бактерий в тонкой кишке / В. Авдеев // Врач. – 2010. – № 12. – С. 1–3.
124. Ардатская, М. Д. Дисбактериоз кишечника: современные аспекты изучения проблемы, принципы диагностики и лечения / М. Д. Ардатская, О. Н. Минушкин, А. В. Дубинин // Терапевтический архив. – 2001. – № 2. – С. 67–72.
125. Ардатская, М. Д. Дисбактериоз кишечника: эволюция взглядов. Современные принципы диагностики и фармакологической коррекции / М. Д. Ардатская, О. Н. Минушкин // Consilium Medicum. Гастроэнтерология. – 2006. – № 2. – С. 4–18.
126. Ардатская, М. Д. Летучие жирные кислоты и их диагностическое и прогностическое значение в гастроэнтерологической клинике / М. Д. Ардатская, О. Н. Минушкин, Н. И. Прихно // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2000. – Т.10. – № 5. – С. 63–70.
127. Ардатская, М. Д. Синдром избыточного бактериального роста и нарушение процессов пищеварения и всасывания / М. Д. Ардатская // Поликлиника. – 2009. – № 2. – С. 38–40.
128. Ардатская, М. Д. Синдром избыточного бактериального роста: учебное пособие / М. Д. Ардатская. – Москва: Форте принт, 2011. – 56 с.
129. Бондаренко, В. М. Дисбактериоз кишечника как клинико-лабораторный синдром: современное состояние проблемы. Руководство для врачей / В. М. Бондаренко, Т. В. Мацулевич – М.: ГЭОТАР-Медиа, 2007. – 304 с.
130. Бондаренко, В. М. Дисбактериозы кишечника у взрослых / В. М. Бондаренко, Н. М. Грачева, Т. В. Мацулевич – М.: КМК Scientific Press, 2003. – 224 с.
131. Бондаренко, В. М. Микроэкологические изменения кишечника и их коррекция с помощью лечебно-профилактических препаратов / В. М. Бондаренко, Н. М. Грачева, Т. В. Мацулевич, А. А. Воробьев // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2003. – Т.4 (20). – С. 66–76.
132. Буеверов, А. О. Бактериальная инфекция как осложнение цирроза печени / А. О. Буеверов // Рус. мед. журн. – 2003. – № 6. – С. 1264–1270.
133. Валуйских, Е. Ю. Клинико-генетические аспекты воспалительных заболеваний кишечника / Е. Ю. Валуйских, И. О. Светлова, С. А. Курилович // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2008. – Т. 18, № 6. – С. 68–74.
134. Василенко, В. В. Дисбактериоз – синдром раздраженного кишечника: эссе-анализ проблемы / В. В. Василенко // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2000. – № 6. – С. 10–13.
135. Витебский, Я. Д. Очерки хирургии илеоцекального отдела кишечника / Я. Д. Витебский. – М.: Медицина, 1973. – 111с.
136. Воробьев, А. А. Исследование пристеночной микрофлоры желудочно-кишечного тракта у человека в норме и при патологии / А. А. Воробьев, Ю. В. Несвижский, Е. М. Липницкий // Вестник РАМН. – 2004. – № 2. – С. 43–47.
137. Габриелян, Н. И. Микрофлора резецированных клапанов пациентов с инфекционным эндокардитом / Н. И. Габриелян, Е. М. Горская, М. Л. Семеновский, Т. С. Спирина, Л. Ю. Ромашкина, Т. Ф. Саид // Анналы хирургии. – 2012. – № 3. – С. 22–25.
138. Григорьев, П. Я. Нарушение нормального состава кишечного биоценоза и методы его коррекции / П. Я. Григорьев, Э. П. Яковенко // Русский медицинский журнал. – 2004. – Т. 6. – № 2. – С. 84.
139. Григорьев, П. Я. Нарушение нормального состава кишечной микрофлоры, клиническое значение и вопросы терапии. Методическое пособие. / П. Я. Григорьев, Э. П. Яковенко. – М., 2000. – 15 С.
140. Денисов, Н. Л. Клинико-иммунологические аспекты патогенеза, диагностики и лечения хронических воспалительных заболеваний кишечника (хронического энтерита и хронического колита): дисс. … канд. мед. наук: / Н. Л. Денисов. – Л., 1990. – 127 с.
141. Денисов, Н. Л. Микробо-тканевой комплекс кишечника человека / Н. Л. Денисов, С. А. Иноземцев // Материалы науч. конф. «Актуальные вопросы клиники, диагностики и лечения». – СПб, 1997. – С. 863–868.
142. Денисов, Н. Л. Синдром избыточного бактериального роста у больных с синдромом раздраженного кишечника и язвенным колитом / Н. Л. Денисов, К. В. Светов // Клинические перспективы гастроэнтерологии, гепатологии. – 2011. – № 3. – С. 22–26.
143. Жаркова, М. С. Влияние синдрома избыточного бактериального роста и бактериальной транслокации на течение заболевания у больных циррозом печени / М. С. Жаркова, М. В. Маевская, В. Т. Ивашкин // РЖГГК. – 2012. – Т.22. – № 5. – С. 56–63.
144. Ивашкин, В. Т. Неалкогольный стеатогепатит / В. Т. Ивашкин, Ю. О. Шульпекова // РМЖ. – 2000. – № 2. – С. 41–45.
145. Ивашкин, В. Т. Осложнения портальной гипертензии при циррозе печени / В. Т. Ивашкин // Рос. физиол. журн. им. И. М. Сеченова. – 2009. – Т. 95, № 10. – С. 1088.
146. Ильченко, А. А. Заболевания желчного пузыря и желчных путей / А. А. Ильченко. – М.: Анахарсис, 2006. – 448 С.
147. Кардиология. Национальное руководство / Под ред. Ю. Н. Беленкова, Р. Г. Оганова. – М.: ГЭОТАР-Медиа, 2008–1290 с.
148. Коротько, Г. Ф. Эвакуаторная деятельность гастродуоденального комплекса и ее энзимокоррекция при желчнокаменной болезнии после холецистэктомии / Г. Ф. Коротько, Е. Г. Пылева. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2003. – Т. XIII. – № 6. – С. 38–43.
149. Кучерявый, Ю. А. Неалкогольный стеатогепатит и кишечная микрофлора: есть ли потенциал пребиотических препаратов в лечении? / Ю. А. Кучерявый, Е. А. Маевская, М. Л. Ахтаева, Е. А. Краснякова // Медицинский совет. – 2013. – № 3. – С. 10–15.
150. Кучерявый, Ю. А. Взаимосвязь синдромов раздраженного кишечника и избыточного бактериального роста: есть ли она? / Ю. А. Кучерявый, С. В. Черёмушкин, Е. А. Маевская, Е. А. Сутугина // РЖГГК. – 2014. – № 2. – С. 5–14.
151. Кучерявый, Ю. А. Синдром избыточного бактериального роста / Ю. А. Кучерявый, Т. С. Оганесян // РЖГГК. – 2010. – № 5. – С. 63–68.
152. Маев И. В. Диагностика и лечение синдрома избыточного бактериального роста в тонкой кишке / И. В. Маев, Н. Ю. Ивашкина, Ю. А. Кучерявый, Т. С. Оганесян // Экспер. клин. гастроэнтерол. – 2011. – № 3. – С. 125–129.
153. Маев, И. В. Внешнесекреторная недостаточность поджелудочной железы у больных после оперативных вмешательств на желудке. / И. В. Маев, Е. А. Овлашенко, Ю. А. Кучерявый. // Consilium medicum. Гастроэнтерология. – 2009. – № 1. – С. 21–26.
154. Маев, И. В. Терапевтическая тактика при синдроме избыточного бактериального роста в тонкой кишке / И. В. Маев, А. А. Самсонов // Consilium medicum. – 2007. – № 7. – C. 44–50.
155. Маев, И. В. Эволюция представлений о синдроме раздраженного кишечника: Метод. рек. для врачей / И. В. Маев, Ю. А. Кучерявый, С. В. Черёмушкин. – М., 2013. – 80 с.
156. Маевская, Е. А. Синдром избыточного бактериального роста в тонкой кишке: от последних научных данных к рутинной практике / Е. А. Маевская, С. В. Черёмушкин, Н. А. Кривобородова, Ю. А. Кучерявый // Клин. перспективы гастроэнтерол. гепатол. – 2013. – № 5. – С. 30–41.
157. Мак Нелли, П. Р. Секреты гастроэнтерологии / П. Р. Мак Нелли. – М.: Бином, 1999. – 725 с.
158. Малафеева, Э. В. Микробиология и иммунология гнойной хирургической инфекции, вызванной неспорообразующими анаэробами / Э. В. Малафеева, А. Б. Граменицкий, Е. Н. Шевьева // Вестник РАМН. – 1996. – № 2. – С. 44–45.
159. Мартынов, В. Л. Игнорировать ли несостоятельность баугиниевой заслонки (НБЗ) при сопутствующих хроническом и катаральном изменениях червеобразного отростка? / В. Л. Мартынов, Д. Г. Колчин, Д. И. Булдаков, А. Г. Семенов, А. Х. Хайрдинов, Е. В. Клейментьев // Вестник хирургической гастроэнтерологии. – 2011. – № 3. – С. 67.
160. Мартынов, В. Л. Рефлюксы пищеварительного тракта и их хирургическая коррекция: дис. … докт. мед. наук: 14.00.27 / Мартынов Владимир Леонидович. – Саранск., 2006. – 261 с.
161. Мартынов, В. Л. Учебно-методическое пособие: Сфинктерно-клапанные аппараты и рефлюксы пищеварительной системы / В. Л. Мартынов, А. С. Мухин, В. Н. Рулев, Д. Г. Колчин, С. В. Храмов. – Нижний Новгород: Пламя, 2009. – 164 с.
162. Мартынов, В. Л. Хирургическое лечение рефлюксной болезни: Монография / В. Л. Мартынов. – Нижний Новгород, Изд-во ООО «Центр оперативной печати», 2013–535 с.
163. Мечетина, Т. А. Синдром избыточного бактериального роста в тонкой кишке после холецистэктомии: дис. … канд. мед. наук: 14.01.28 / Татьяна Анатольевна Мечетина. – Москва., 2011. – 134 с.
164. Осипов, Г. А. Хромато-масс-спектрометрическое исследование микроорганизмов и их сообществ: автореф. дис. … д-ра биол. наук: / Г. А. Осипов. – Москва, 1995. – 62 С.
165. Парфенов, А. И. Дисбактериоз кишечника: вопросы биологической терапии. / А. И. Парфенов, И. Н. Ручкина, Г. А. Осипов // Трудный пациент. – 2007. – № 5. – С. 32–34.
166. Парфенов, А. И. Постинфекционный синдром раздраженного кишечника [электронный ресурс] / А. И. Парфенов, И. Н. Ручкина // Лечащий врач. – 2011. – № 6. – режим доступа: http://www.lvrach.ru / 2010 / 07 / 15062900 / .
167. Парфенов, А. И. Энтерология / А. И. Парфенов. – М.: ООО «Медицинской информационное агентство», 2008. – 1100 с.
168. Пасечников, В. Д. Дивертикулы желудочно-кишечного тракта. / В. Д. Пасечников, С. З. Чуйков // Consilium Medicum. – 2005. – № 7 (2). – С. 24–29.
169. Плотникова, Е. Ю. Некоторые аспекты диагностики и лечения избыточной бактериальной контаминации тонкой кишки в клинической практике [электронный ресурс] / Е. Ю. Плотникова, М. В. Борщ, М. В. Краснова, Е. Н. Баранова // Лечащий врач. – 2013. – № 4. – режим доступа: http://www.lvrach.ru / 2013 / 02 / 15435625.
170. Черёмушкин, С. В. Эффективность использования пробиотиков при синдроме раздраженного кишечника: автореф. дис. … канд. мед. наук: / С. В. Черёмушкин. – М., 2000. – 20 с.
171. Чернин, В. В. Болезни пищевода, желудка и двенадцатиперстной кишки: Руководство для врачей / В. В. Чернин. – М.: ООО «Медицинской информационное агентство», 2010. – 528 С.
172. Чернин, В. В. Дисбактериоз мукозной микрофлоры гастродуоденальной зоны при воспалительно-язвенных поражениях, его диагностика и классификация / В. В. Чернин, В. М. Бондаренко, В. М. Червинец // Терапевтический архив. – 2008. – № 2. – С. 21–26.
173. Шептулин, А. А. Современные возможности применения рифаксимина в гастроэнтерологии. / А. А. Шептулин, Э. А. Торрес // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2008. – Т. 18. – № 5. – С. 17–22.
174. Шульпекова, Ю. О. Избыточный бактериальный рост в кишечнике: патогенетические особенности и лечебные подходы / Ю. О. Шульпекова // Русский медицинский журнал. – 2003. – Т. 11. – № 5. – С. 281–285.
175. Щербаков, П. Л. Применение энтеросорбентов в лечении дисбиоза кишечника / П. Л. Щербаков // Эксп. клин. гастроэнтерол. – 2009. – № 3. – С. 88–92.
176. Gabrielli, M. Diagnosis of small intestinal bacterial оvergrowth in the clinical practice / M. Gabrielli, G. D. Angelo, T. D. Rienzo, E. Scarpellini, V. Ojetti // European Review for Medical and Pharmacological Sciences. – 2013. – V.17. – Р. 30–35.
177. Агафонова, Н. А. Невсасывающиеся (кишечные) антибактериальные препараты в гастроэнтерологии: спектр применения рифаксимина. / Н. А. Агафонова // Consilium medicum. Гастроэнтерология. – 2009. – № 1. – С. 61–66.
178. Чучалин, А. Г. Федеральное руководство по использованию Лекарственных средств (формулярная система). ВыпускVIII. / А. Г. Чучалин, Ю. Б. Белоусов, В. В. Яснецов // М.: Эхо. – 2007. – 693 С.
179. DiStefano M. Rifaximin versus chlortetracycline in the shortterm treatment of small intestinal bacterial overgrowth. / M. DiStefano, S. Malservisi, G. Veneto // Aliment Pharmacol Ther. – 2000. – Vol. 14 (5). – P. 551–556.
180. Adachi, J. A. Rifaximin: a novel nonabsorbed rifamycin for gastrointestinal disorders / J. A. Adachi, H. L. DuPont // Clin Infect Dis. – 2006. – Vol. 42. – № 4. – P. 541–547.
181. Gasbarrini, A. Small intestinal bacterial overgrowth: diagnosis and treatment / A. Gasbarrini, E. C. Lauritano, M. Gabrielli // Dig. Dis. – 2007. – Vol. 25. (3). – P. 237–240.
182. Peralta S. Small intestine bacterial overgrowth and irritable bowel syndrome-related symptoms: experience with Rifaximin. / S. Peralta C. Cottone, T. Doveri et al. // World J. Gastroenterol. – 2009. – Vol. 5 (21). – P. 2628–2631.
183. Scarpellini, E. High dosage rifaximin for the treatment of small intestinal bacterial overgrowth / E. Scarpellini, M. Gabrielli, C. E. Lauritano // Aliment Pharmacol Ther. – 2007. – Vol. 25 (7). – P. 781–786.
184. Lauritano, E. C. Antibiotic therapy in small intestinal bacterial overgrowth: rifaximin versus metronidazole / E. C. Lauritano, M. Gabrielli, E. Scarpellini // Eur. Rev. Med. Pharmacol. Sci. – 2009. – Mar. Apr., 13 (2). – P. 111–116.
185. Dupont, H. L. Rifaximin versus ciprofloxacin for the treatment of traveler’s diarrhea: a randomized, double-blind clinical trial / H. L. Dupont, Z. D. Jiang, C. D. Ericsson // Clin. Infec.t Dis. – 2001. – Vol. 33 (ll). – P. 1807–1815.
186. Attar, A. Antibiotic efficacyin small intestinal bacterial overgrowth related chronic diarrhea: a crossover, randomized trial / A. Attar, B. Flourie, J. C. Rambaud / / Gastroenterology. – 1999. – Vol. 117. – № 4. – P.794–797.
187. Baker, D. E. Rifaximin: a nonabsorbed oral antibiotic / D. E. Baker // Rev Gastroenterol Disord. – 2005. – № 5. – P. 19–30.
188. Lakshmi, C. P. Frequency and factors associated with small intestinal bacterial overgrowth in patients with cirrhosis of the liver and extra hepatic portal venous obstruction / C. P. Lakshmi, U. C. Ghoshal, S. Kumar // Dig Dis Sci. – 2009. – May,8.
189. Scarpignato, C. Experimental and clinical pharmacology of rifaximin, a gastrointestinal selective antibiotic / C. Scarpignato, I. Pelosini // Digestion. – 2006. – Vol. 73. – P. 13–27.
190. Кучумова, С. Ю. Физиологическое значение кишечной микрофлоры / С. Ю. Кучумова, Е. А. Полуэктова, А. А. Шептулин, В. Т. Ивашкин // РЖГГК. – 2011. – Т. 21. – № 5. – С. 17–27.
191. Gabrielli, M. Diagnosis of small intestinal bacterial оvergrowth in the clinical practice / M. Gabrielli, G. D. Angelo, T. D. Rienzo, E. Scarpellini, V. Ojetti // European Review for Medical and Pharmacological Sciences. – 2013. – V. 17. – Р. 30–35.
192. Маевская, Е. А. Синдром избыточного бактериального роста в тонкой кишке: от последних научных данных к рутинной практике / Е. А. Маевская, С. В. Черемушкин, Н. А. Кривобородов, Ю. А. Кучерявый // Клиничексие перспективы гастроэнтерологии, гепатологии. – 2013. – № 5. – С. 29–40.
193. Sabat?, J. M. High prevalence of small intestinal bacterial overgrowth in patients with morbid obesity: a contributor to severe hepatic steatosis / J. M. Sabat?, P. Jou?t, F. Harnois et al. // Obes. Surg. – 2008. – Vol. 18. – P. 371–377.
194. Lo, W. K. Proton pump inhibitor use and the risk of small intestinal bacterial overgrowth: a meta-analysis / W. K. Lo, W. W. Chan // Clin. Gastroenterol. Hepatol. – 2013. – Vol. 11 (5). – P. 483–490.
195. Ratuapli, S. K. Proton pump inhibitor therapy use does not predispose to small intestinal bacterial overgrowth / S. K. Ratuapli, T. G. Ellington, M. T. O’Neill et al. // Am. J. Gastroenterol. – 2012. – Vol. 107 (5). – P. 730–735.
196. Choung, R. S. Clinical predictors of small intestinal bacterial overgrowth by duodenal aspirate culture / R. S. Choung, K. C. Ruff, A. Malhotra et al. // Aliment. Pharmacol. Ther. – 2011. – Vol. 33 (9). – P. 1059–1067.
197. Shah, E. D. Abnormal Breath Testing in IBS: A MetaAnalysis / E. D. Shah, R. J. Basseri, K. Chong, M. Pimentel // Dig. Dis. Sci. – 2010. – Vol. 55 (9). – P. 2441–2449.
198. Castiglione, F. Antibiotic treatment of small bowel bacterial overgrowth in patients with Crohn’s disease / F. Castiglione, A. Rispo, E. Di Girolamo et al. // Aliment. Pharmacol. Ther. – 2003. – Vol. 18. – P. 1107–1112.
199. Ghoshal, U. C. Partially responsive celiac disease resulting from small intestinal bacterial overgrowth and lactose intolerance / U. C. Ghoshal, U. Ghoshal, A. Misra, G. Choudhuri // BMC. Gastroenterol. – 2004. – Vol. 4. – P. 10.
200. Krauss, N. Monitoring nonresponsive patients who have celiac disease / N. Krauss, D. Schuppan // Gastrointest. Endosc. Clin. N. Am. – 2006. – Vol. 16. – P. 317–327.
201. Trespi, E. Intestinal bacterial overgrowth during chronic pancreatitis / E. Trespi, A. Ferrieri // Curr. Med. Res. Opin. – 1999. – Vol. 15. – P. 47–52.
202. Malik, B. A. Diagnosis and pharmacological management of small intestinal bacterial overgrowth in children with intestinal failure / B. A. Malik, Y. Y. Xie, E. Wine, H. Q. Huynh // Can. J. Gastroenterol. – 2011. – Vol. 25 (1). – P. 41–45.
203. Bauer, T. M. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia / T. M. Bauer, H. Schwacha, B. Steinbr?ckner.et al. // Am. J. Gastroenterol. – 2002. – Vol. 97. – P. 2364–370.
204. Chang, C. S. Small intestine dysmotility and bacterial overgrowth in cirrhotic patients with spontaneous bacterial peritonitis / C. S. Chang, G. H. Chen, H. C. Lien, H. Z. Yeh // Hepatology. – 1998. – Vol. 28. – P. 1187–1190.
205. Lata, J. Spontaneous bacterial peritonitis: a severe complication of liver cirrhosis / J. Lata, O. Stiburek, M. Kopacova // Wld. J. Gastroenterol. – 2009. – Vol. 15. – P. 5505–5510.
206. Pande, C. Smallintestinal bacterial overgrowth in cirrhosis is related to the severity of liver disease / C. Pande, A. Kumar, S. K. Sarin // Aliment. Pharmacol. Ther. – 2009. – Vol. 29. – P. 1273–1281.
207. S?nchez, E. Role of intestinal bacterial overgrowth and intestinal motility in bacterial translocation in experimental cirrhosis / E. S?nchez, F. Casafont, A. Guerra et al. // Rev. Esp. Enferm. Di g. –2005. – Vol. 97 (11). – P. 805–814.
208. Jun, D. W. Association between small intestinal bacterial overgrowth and peripheral bacterial DNA in cirrhotic patients / D. W. Jun, K. T. Kim, O. Y. Lee et al. // Dig. Dis. Sci. – 2010. – Vol. 55 (5). – P. 1465–1471.
209. Bellot, P. Pathological bacterial translocation in cirrhosis: pathophysiology, diagnosis and clinical implications / P. Bellot, R. Franc?s, J. Such // Liver Int. – 2013. – Vol. 33 (1). – P. 31–39.
210. Wu, W. C. Small intestinal bacteria overgrowth decreases small intestinal motility in the NASH rats / W. C. Wu, W. Zhao, S. Li // Wld. J. Gastroenterol. – 2008. – Vol. 14. – P. 313–317.
211. Wigg, A. J. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, andtumour necrosis factor alpha in the pathogenesis of nonalcoholic steatohepatitis / A. J. Wigg, I. C. Roberts-Thomson, R. B. Dymock et al. // Gut. – 2001. – Vol. 48. – P. 206–211.
212. Sajjad, A. Ciprofloxacin suppresses bacterial overgrowth, increases fasting insulin but does not correct low acylated ghrelin concentration in non-alcoholic steatohepatitis / A. Sajjad, M. Mottershead, W. K. Syn et al. // Aliment. Pharmacol. Ther. – 2005. – Vol. 22. – P. 291–299.
213. Fan, X. Review article: Small intestinal bacterial overgrowth, bile acid malabsorption and gluten intolerance as possible causes of chronic watery diarrhoea / X. Fan, J. H. Sellin // Aliment. Pharmacol. Ther. – 2009. – Vol. 29. – P. 1069–1077.
214. Gasbarrini, A. Small intestinal bacterial overgrowth: diagnosis and treatment / A. Gasbarrini, E. C. Lauritano, M. Gabrielli et al. // Dig. Dis. Sci. – 2007. – Vol. 25. – P. 237–240.
215. Malik, B. A. Diagnosis and pharmacological management of small intestinal bacterial overgrowth in children with intestinal failure / B. A. Malik, Y. Y. Xie, E. Wine, H. Q. Huynh // Can. J. Gastroenterol. – 2011. – Vol. 25 (1). – P. 41–45.
216. Nelis, G. F. Role of fructose-sorbitol malabsorption in the irritable bowel syndrome / G. F. Nelis, M. A. Vermeeren, W. Jansen // Gastroenterology. – 1990. – Vol. 99. – P. 1016–1020.
217. Nucera, G. Abnormal breath tests to lactose, fructose and sorbitol in irritable bowel syndrome may be explained by small intestinal bacterial overgrowth / G. Nucera, M. Gabrielli, A. Lupascu. et al. // Aliment. Pharmacol. Ther. – 2005. – Vol. 21. – P. 1391–1395.
218. Bohm, M. Diagnosis and management of small intestinal bacterial overgrowth / M. Bohm, R. M. Siwiec, J. M. Wo // Nutr. Clin. Pract. – 2013. – Vol. 28 (3). – P. 289–299.
219. Khoshini, R. A systematic review of diagnostic tests for small intestinal bacterial overgrowth / R. Khoshini, S. C. Dai, S. Lezcano, M. Pimentel // Dig. Dis. Sci. – 2008. – Vol. 53. – P. 1443–1454.
220. Bures, J. Small intestinal bacterial overgrowth syndrome / J. Bures, J. Cyrany, D. Kohoutova et al. // Wld. J. Gastroenterol. – 2010. – Vol. 28. – P. 2978–2990.
221. Dibaise, J. K. Enteric microbial flora, bacterial overgrowth, and short-bowel syndrome / J. K. Dibaise, R. J. Young, J. A. Vanderhoof // Clin. Gastroenterol. Hepatol. – 2006. – Vol. 4. – P. 11–20.
222. Bures, J. Small intestinal bacterial overgrowth syndrome / J. Bures, J. Cyrany, D. Kohoutova et al. // Wld. J. Gastroenterol. – 2010. – Vol. 28. – P. 2978–2990.
223. Barrett, J. S. Probiotic effects on intestinal fermentation patterns in patients with irritable bowel syndrome / J. S. Barrett, K. E. Canale, R. B. Gearry et al. // Wld. J. Gastroenterol. – 2008. – Vol. 14 (32). – P. 5020–5024.
224. Koo, H. L. Rifaximin: a unique gastrointestinal-selective antibiotic for enteric diseases / H. L. Koo, H. L. DuPont // Curr. Opin. Gastroenterol. – 2010. – Vol. 26 (1). – P. 17–25.
225. Gutierrez, I. M. Risk factors for small bowel bacterial overgrowth and diagnostic yield of duodenal aspirates in children with intestinal failure: a retrospective review / Ivan M. Gutierrez,, Kuang Horng Kang, Catherine E. Calvert et al. // J. Pediatr Surg. – 2012. – Vol. 47 (6). – P. 1150–1154.
226. Sondheimer, J. M. Infection and cholestasis in neonates with intestinal resection and long-term parenteral nutrition / J. M. Sondheimer, E. Asturias, M. Cadnapaphornchai // J. Pediatr. Gastroenterol. Nutr. 1998; 27:131–7. [Pub. Med: 9702641]
227. Cole, C. R. The rate of bloodstream infection is high in infants with short bowel syndrome: relationship with small bowel bacterial overgrowth, enteral feeding, and inflammatory and immune responses / C. R. Cole, J. C. Frem, B. Schmotzer et al. // J. Pediatr. 2010; 156:941–7. 7, e1. [PubMed: 20171649]
228. Kaufman, S. S. Influence of bacterial overgrowth and intestinal inflammation on duration of parenteral nutrition in children with short bowel syndrome / S. S. Kaufman, C. A. Loseke, J. V. Lupo et al. // J. Pediatr. 1997; 131:356–61. [PubMed: 9329409]
229. D’Antiga, L. Intestinal absorption and permeability in paediatric short-bowel syndrome: a pilot study / L. D’Antiga, A. Dhawan, M. Davenport et al. // J. Pediatr. Gastroenterol. Nutr. 1999; 29:588–93. [PubMed: 10554128]
230. Husebye, E. The pathogenesis of gastrointestinal bacterial overgrowth. / E. Husebye // Chemotherapy. 2005; 51 (Suppl 1):1–22. [PubMed: 15855746]
231. Ziegler, T. R. Trophic and cytoprotective nutrition for intestinal adaptation, mucosal repair, and barrier function / T. R. Ziegler, M. E. Evans, C. Fernandez-Estivariz et al. // Annu. Rev. Nutr. 2003; 23:229–61. [PubMed: 12626687]
232. Berg, R. D. Translocation of certain indigenous bacteria from the gastrointestinal tract to the mesenteric lymph nodes and other organs in a gnotobiotic mouse model / R. D. Berg, A. W. Garlington // Infect Immun. 1979; 23:403–11. [PubMed: 154474]
233. Berg, R. D. Bacterial translocation from the gastrointestinal tract / R. D. Berg // J. Med. 1992; 23:217–44. [PubMed: 1479301]
234. Dibaise, J. K. Enteric microbial flora, bacterial overgrowth, an.d shortbowel syndrome / J. K. Dibaise, R. J. Young,J. A. Vanderhoof // Clin Gastroenterol. Hepatol. – 2006; 4:11–20. [PubMed: 16431299]
235. Riepe, S. P. Effect of secreted Bacteroides proteases on human intestinal brush border hydrolases / S. P. Riepe, J. Goldstein, D. H. Alpers // J. Clin. Invest. 1980; 66:314–22. [PubMed: 6995483]
236. Bala, L. Malabsorption syndrome with and without small intestinal bacterial overgrowth: a study on upper-gut aspirate using 1H NMR spectroscopy / L. Bala, U. C. Ghoshal, U. Ghoshal et al. // Magn Reson Med. 2006; 56:738–44. [PubMed: 16972311]
237. Sigalet, D. Elements of successful intestinal rehabilitation / D. Sigalet, D. Boctor, M. Brindle et al. // J. Pediatr. Surg. 2011; 46:150–6. [PubMed: 21238657]
238. Spiegel, B. M. Bacterial overgrowth and irritable bowel syndrome: unifying hypothesis or a spurious consequence of proton pump inhibitors? / B. M. Spiegel, W. D. Chey, L. Chang // Am. J. Gastroenterol. 2008; 103:2972–6. [PubMed: 19086951
239. Wei, Zh. Alterations of the gut microbiome and metabolome in alcoholic liver disease / Wei Zhong, Zhanxiang Zhou // World. J. Gastrointest Pathophysiol. – 2014. – Vol. 5 (4). – P. 514–522.
240. Casafont Morencos, F. Small bowel bacterial overgrowth in patients with alcoholic cirrhosis / F. Casafont Morencos, G. de las Heras Casta?o, L. Mart?n // Dig. Dis. Sci. 1996; 41: 552–556 [PMID: 8617135
241. Gabbard, S. L. The impact of alcohol consumption and cholecystectomy on small intestinal bacterial overgrowth / S. L. Gabbard, B. E. Lacy, G. M. Levine, M. D. Crowell // Dig. Dis. Sci. 2014; 59: 638–644 [PMID: 24323179 DOI: 10.1007 / s10620-013-2960-y]
242. Yan, A. W. Enteric dysbiosis associated with a mouse model of alcoholic liver disease / A. W. Yan, D. E. Fouts, J. Brandl et al. // Hepatology. 2011; 53: 96–105 [PMID: 21254165 DOI: 10.1002 / hep.24018]
243. Bull-Otterson, L. Metagenomic analyses of alcohol induced pathogenic alterations in the intestinal microbiome and the effect of Lactobacillus rhamnosus GG treatment / L. Bull-Otterson, W. Feng, I. Kirpich // PLoS One. 2013; 8: e53028 [PMID: 23326376 DOI: 10.1371 / journal.pone.0053028]
244. Bode, J. C. Jejunal microflora in patients with chronic alcohol abuse / J. C. Bode, C. Bode, R. Heidelbach et al. // Hepatogastroenterology. 1984; 31: 30–34 [PMID: 6698486]
245. Baraona, E. Role of intestinal bacterial overgrowth in ethanol production and metabolism in rats / E. Baraona, R. Julkunen, L. Tannenbaum et al. // Gastroenterology. 1986; 90: 103–110 [PMID: 3940238]
246. V?kev?inen, S. Hypochlorhydria induced by a proton pump inhibitor leads to intragastric microbial production of acetaldehyde from ethanol / S. V?kev?inen, J. Tillonen, M. Salaspuro et al. // Aliment Pharmacol Ther. 2000; 14: 1511–1518 [PMID: 11069323]
247. Visap??, J. P. Microbes and mucosa in the regulation of intracolonic acetaldehyde concentration during ethanol challenge // J. P. Visap??, J. Tillonen, M. Salaspuro // Alcohol. 2002; 37: 322–326 [PMID: 12107032]
248. Lichtman, S. N. Hepatic inflammation in rats with experimental small intestinal bacterial overgrowth / S. N. Lichtman, R. B. Sartor, J. Keku, J. H. Schwab // Gastroenterology. 1990; 98: 414–423 [PMID: 2295397]
249. Napolitano, L. M. Chronic ethanol intake and burn injury: evidence for synergistic alteration in gut and immune integrity / L. M. Napolitano, M. J. Koruda, K. J. Zimmerman // J. Trauma. 1995; 38: 198–207 [PMID: 7869435]
250. Rao, R. K. Recent Advances in Alcoholic Liver Disease I. Role of intestinal permeability and endotoxemia in alcoholic liver disease / R. K. Rao, A. Seth, P. Sheth // Am. J. Physiol. Gastrointest. Liver Physiol. 2004; 286: G881-G884 [PMID: 15132946 DOI: 10.1152 / ajpgi.00006.2004]
251. Fujimoto, M. Plasma endotoxin and serum cytokine levels in patients with alcoholic hepatitis: relation to severity of liver disturbance / M. Fujimoto, M. Uemura, Y. Nakatani et al. // Alcohol Clin Exp Res2000; 24: 48S-54S [PMID: 10803780]
252. Hanck, C. Presence of plasma endotoxin is correlated with tumour necrosis factor receptor levels and disease activity in alcoholic cirrhosis / C. Hanck, S. Rossol, U. B?cker et al. // Alcohol Alcohol. 1998; 33: 606–608 [PMID: 9872348]
253. Urbaschek, R. Endotoxin, endotoxin-neutralizingcapacity, sCD14, sICAM-1, and cytokines in patients with various degrees of alcoholic liver disease / R. Urbaschek, R. S. McCuskey, V. Rudi et al. // Alcohol Clin Exp Res. 2001; 25: 261–268 [PMID: 11236841]
254. Szabo, G. Alcoholic liver disease and the gutliver axis / G. Szabo, S. Bala // World J Gastroenterol. 2010; 16: 1321–1329 [PMID: 20238398]
255. Franc?s, R. A sequential study of serum bacterial DNA in patients with advanced cirrhosis and ascites / R. Franc?s, S. Benlloch, P. Zapater et al. // Hepatology. 2004; 39: 484–491 [PMID: 14768002 DOI: 10.1002 / hep.20055]
256. Romics, L. Selective priming to Toll-like receptor 4 (TLR4), not TLR2, ligands by P. acnes involves up-regulation of MD-2 in mice / L. Romics, A. Dolganiuc, K. Kodys et al. // Hepatology. 2004; 40: 555–564 [PMID: 15349893 DOI: 10.1002 / hep.20350]
257. Gustot, T. Differential liver sensitization to toll-like receptor pathways in mice with alcoholic fatty liver / T. Gustot, A. Lemmers, C. Moreno et al. // Hepatology. 2006; 43: 989–1000 [PMID: 16628628 DOI: 10.1002 / hep.21138]
258. Purohit, V. Alcohol, intestinal bacterial growth, intestinal permeability to endotoxin, and medical consequences: summary of a symposium / V. Purohit, J. C. Bode, C. Bode // Alcohol. 2008; 42: 349–361 [PMID: 18504085 DOI: 10.1016 / j.alcohol.2008.03.131]
259. Bjarnason, I. The leaky gut of alcoholism: possible route of entry for toxic compounds / I. Bjarnason, T. J. Peters, R. J. Wise et al. // Lancet. 1984; 1: 179–182 [PMID: 6141332]
260. Keshavarzian, A. The differing effects of acute and chronic alcohol on gastric and intestinal permeability / A. Keshavarzian, J. Z. Fields, J. Vaeth et al. // Am J Gastroenterol. 1994; 89: 2205–2211 [PMID: 7977243]
261. Keshavarzian, A. Leaky gut in alcoholic cirrhosis: a possible mechanism for alcohol-induced liver damage / A. Keshavarzian, E. W. Holmes, M. Patel et al. // Am J Gastroenterol. 1999; 94: 200–207 [PMID: 9934756 DOI: 10.1111 / j.1572–0241.1999.00797.x]
262. Parlesak, A. Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease / A. Parlesak, C. Sch?fer, T. Sch?tz et al. // J Hepatol. 2000; 32: 742–747 [PMID: 10845660]
263. Enomoto, N. Thalidomide prevents alcoholic liver injury in rats through suppression of Kupffer cell sensitization and TNF-alpha production / N. Enomoto, Y. Takei, M. Hirose et al. // Gastroenterology. 2002; 123: 291–300 [PMID: 12105857]
264. Forsyth, C. B. Lactobacillus GG treatment ameliorates alcohol-induced intestinal oxidative stress, gut leakiness, and liver injury in a rat model of alcoholic steatohepatitis / C. B. Forsyth, A. Farhadi, S. M. Jakate et al. // Alcohol. 2009; 43: 163–172 [PMID: 19251117 DOI: 10.1016 / j.alcohol.2008.12.009]
265. Mathurin, P. Exacerbation of alcoholic liver injury by enteral endotoxin in rats / P. Mathurin, Q. G. Deng, A. Keshavarzian et al. // Hepatology. 2000; 32: 1008–1017 [PMID: 11050051 DOI: 10.1053 / jhep.2000.19621]
266. Keshavarzian, A. Preventing gut leakiness by oats supplementation ameliorates alcohol-induced liver damage in rats / A. Keshavarzian, S. Choudhary, E. W. Holmes et al. / J Pharmacol Exp Ther. 2001; 299: 442–448 [PMID: 11602653]
267. Keshavarzian, A. Evidence that chronic alcohol exposure promotes intestinal oxidative stress, intestinal hyperpermeability and endotoxemia prior to development of alcoholic steatohepatitis in rats / A. Keshavarzian, A. Farhadi, C. B. Forsyth et al. // J Hepatol. 2009; 50: 538–547 [PMID: 19155080 DOI: 10.1016 / j.jhep.2008.10.028
268. Lambert, J. C. Prevention of alterations in intestinal permeability is involved in zinc inhibition of acute ethanol-induced liver damage in mice / J. C. Lambert, Z. Zhou, L. Wang et al. // J Pharmacol Exp Ther2003; 305: 880–886 [PMID: 12626662 DOI: 10.1124 / jpet.102.047852]
269. Harnisch, J. P. Diphtheria among alcoholic urban adults. A decade of experience in Seattle / J. P. Harnisch, E. Tronca // Ann Intern Med. 1989; 111: 71–82 [PMID: 2472081]
270. Cericco, M. Corynebacterium xerosis endocarditis associated with alcoholic cirrhosis / M. Cericco, F. Iglicki, M. P. Guillaumont et al. // Gastroenterol Clin Biol. 1996; 20: 514 [PMID: 8761156]
271. Salaspuro, V. Ethanol oxidation and acetaldehyde production in vitro by human intestinal strains of Escherichia coli under aerobic, microaerobic, and anaerobic conditions / V. Salaspuro, S. Nyfors, R. Heine et al. // Scand J Gastroenterol. 1999; 34: 967–973 [PMID: 10563665]
272. Tillonen, J. Role of catalase in in vitro acetaldehyde formation by human colonic contents / J. Tillonen, P. Kaihovaara, H. JousimiesSomer et al. // Alcohol Clin Exp Res. 1998; 22: 1113–1119 [PMID: 9726283]
273. DuPont, H. L. Рифаксимин: неабсорбирующийся противомикробный препарат в терапии диареи путешественников / H. L. DuPont, C. D. Ericsson, J. J. Mathewson // Гастроnewsлайн. – 2014. – № 5. – С. 5–10.
274. Corazza, G. R. Treatment Of functional bowel disoders: is there room for antibiotics? / G. R. Corazza, M. Di Stefauo, C. Sparpignato // Digestion 2006; 73 (Suppl. 1): 38–46.
275. Kerlin, P. Glucose-H2 breath test for small intestinal bacterial overgrowth / P. Kerlin // Gastroenterology. 1990; 98: 253–4.






