Приложение 2. Запрограммированная гибель прокариот
Явление запрограммированной клеточной гибели обнаружено не только у многоклеточных организмов, но также и у одноклеточных эукариот и прокариот. Для последних оно равносильно запрограммированной смерти организма, то есть представляет собой феноптоз. В большинстве случаев стимулом, запускающим феноптоз у прокариот, является сигнал стресса (он может быть как внутренним, так и внешним).
Например, у многих бактерий существует белок RecA, который активируется при повреждении ДНК и гидролизует репрессор гена LexA [374] (см. список литературы к приложению 2). Это приводит к подавлению экспрессии генов, кодирующих (1) так называемые белки SOS-ответа, осуществляющие репарацию ДНК и (2) короткоживущий белок SulA. В свою очередь, SulA взаимодействует с фактором FtsZ (белком, формирующим кольцо деления) и тем самым блокирует клеточное деление. Неудивительно, что мутации в белке SulA приводят к многократному повышению устойчивости бактерий к повреждению их ДНК [261].
Ким Льюис отметил, что мутанты по SulA имеют огромное преимущество при выживании, но, тем не менее, в процессе эволюции оно не перевешивает долгосрочных негативных последствий, вызванных неспособностью популяции элиминировать клетки с поврежденной ДНК. Льюис также предположил, что вышеописанный каскад белковых взаимодействий запускает программу клеточной гибели [185]. Дальнейшие исследования подтвердили важную роль RecA в запрограммированной гибели бактерий. Оказалось, что вызванная стрессом (добавкой антибиотиков) активация этого белка является одним из важных звеньев апоптозоподобной гибели клеток кишечной палочки [81]. Если вызванный антибиотиками уровень повреждения ДНК был высок и запускаемые на начальном этапе RecA-обусловленного ответа белки репарации не могли с ним справиться, в клетке бактерии запускалась программа самоубийства. Примечательно, что помимо остановки клеточного деления, активация RecA приводит в итоге к таким характерным для апоптоза признакам, как конденсация хромосомы, фрагментация ДНК, деполяризация мембраны и экспонирование фосфатидилсерина c внешней стороны этой мембраны [81]. Последнее особенно интригующе, т. к. в случае апоптоза у многоклеточных эукариот считается, что экспонирование фосфатидилсерина является сигналом «съешь меня» для клеток иммунной системы. Роль этого феномена у прокариот пока совершенно неясна.
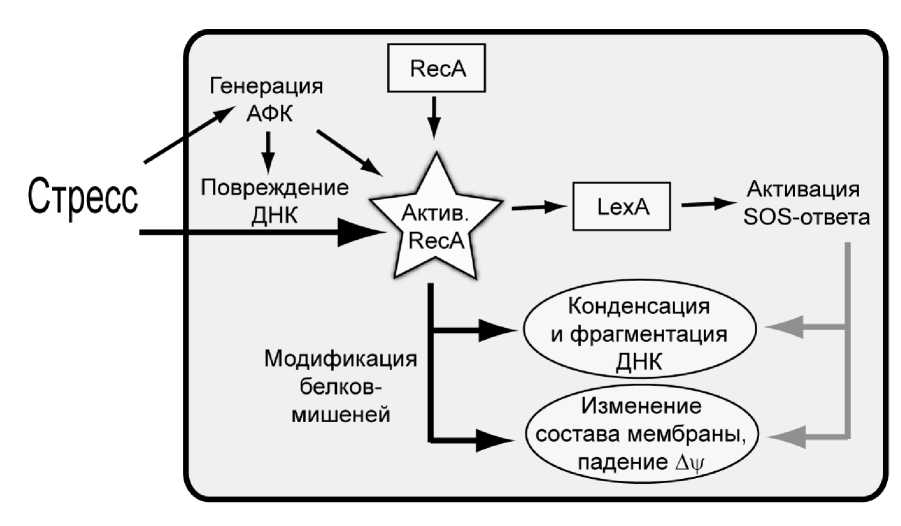
Рис. II-2.1
RecA-опосредованный сигнальный каскад — не единственная известная прокариотическая «система самоуничтожения». Помимо нее, у бактерий обнаружен целый набор механизмов самоубийства, функционирующих по принципу токсин-антитоксин (ТА-системы). Наиболее изученная из ТА-систем (обнаруженная в том числе и у кишечной палочки), способная убивать клетку при масштабных повреждениях ДНК в ответ на добавку антибиотиков и некоторые другие виды стресса, называется mazEF [127]. Токсином является белок mazF, представляющий собой сайт-специфическую эндорибонуклеазу, активность которой подавляется нестабильным в клетке белком mazE [401]. Помимо разнообразных стресс-сигналов, триггером системы mazEF является выделяемый кишечной палочкой в окружающую среду пептид «чувства кворума» NNWNN, называемый также внеклеточным фактором смерти EDF (Extracellular Death Factor) [162]. То есть, помимо функции самоуничтожения в ответ на стресс, эта система обеспечивает контроль плотности популяции бактерий, приводя к гибели клеток в случае возникновения «проблемы перенаселения».
Примечательно, что индуцированная антибиотиками активация системы mazEF приводила к снижению уровеня иРНК фактора RecA и к подавлению апоптозоподобной клеточной гибели, описанной выше [89]. Таким образом, «система самоуничтожения» в ответ на повреждения ДНК оказывается продублирована: RecA-опосредованный сигнальный каскад может являться «резервным» вариантом на случай отказа системы mazEF.
Работа описанных выше сигнальных каскадов приводит к гибели бактерии в ответ на повреждения ДНК еще до того, как эти повреждения сами по себе вызовут разбалансировку систем жизнеобеспечения клетки и смерть. Иными словами, клетка следует уже упоминавшемуся в этой книге самурайскому закону «лучше умереть, чем ошибиться». Эволюционный смысл этого явления, вероятно, заключается в элиминации организмов с серьезными повреждениями генома. Тем самым осуществляется «контроль качества» на уровне популяции. Близкой аналогией является феномен апоптоза (см. Приложение 1), одной из важнейших функций которого в организме является уничтожение потенциально опасных клеток, в первую очередь — с высоким уровнем повреждений ДНК (способных превратиться в раковые) или пораженных вирусом.
Не исключено, что антивирусная функция клеточной запрограммированной гибели играла важную роль в процессе эволюции еще до появления многоклеточных организмов. У многих прокариот обнаружены механизмы самоуничтожения, активирующиеся в ответ на заражение бактериофагом. Так, у некоторых штаммов кишечной палочки в хромосоме присутствует ген Lit, продукт которого при взаимодействии с вирусным белком gol фага Т4 приобретает токсичные свойства, блокирует фактор элонгации Tu и приводит к гибели клетки [3]. Примечательно, что сам ген Lit также является вирусным, т. к. принадлежит профагу e14, геном которого способен встраиваться в хромосому бактерии. Таким образом, клетка кишечной палочки становится, по образному выражению Кима Льюиса, «полем битвы между двумя видами паразитной ДНК» [185]. Так или иначе, но обусловленный геном Lit феноптоз является благоприятным признаком, т. к. препятствует распространению вирусов в популяции бактерий.
Тот факт, что у современных прокариотических организмов существует целый спектр разнообразных, достаточно сложных «механизмов самоубийства» на разные случаи жизни, однозначно указывает, что эти механизмы были отобраны эволюцией и в долгосрочной перспективе представляют их носителям определенные преимущества.
В случае растущей популяции бактерий, геном которых идентичен, появление и закрепление альтруистических признаков не удивительно, т. к. с эволюционной точки зрения значение имеет лишь сохранение и увеличение общего числа геномов, а не судьба отдельных его копий. Этот принцип очевиден на уровне многоклеточных организмов: естественный отбор идет на уровне совокупности генетически идентичных клеток, и жертвование отдельными клетками ради этой совокупности оправданно.
Несмотря на интуитивную понятность и простоту этой концепции, прямые экспериментальные доказательства эволюционных преимуществ наличия систем самоуничтожения у прокариот были получены лишь в недавнее время. Ю и соавторы [352] создали в E. coli искусственную систему самоуничтожения, включавшуюся в ответ на добавку антибиотика 6-аминопенициллановой кислоты (6-АПК), а также внедрили в бактерию индуцируемый ген цитоплазматической формы фермента бета-лактамазы, расщепляющего это токсичное для бактерии соединение. 6-АПК находился снаружи клеток, а фермент синтезировался внутри и мог попасть наружу и нейтрализовать яд только в случае гибели и разрушения клеток. Таким образом, исследователи получили модель, в которой можно было независимо контролировать уровень запрограммированной клеточной гибели (варьируя концентрацию 6-АПК) и уровень «пользы для популяции» от гибели клетки (варьируя индукцию экспрессии бета-лактамазы).
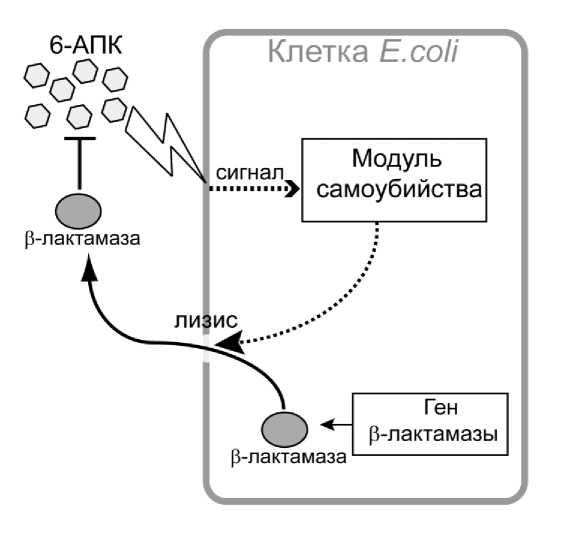
Рис. II-2.1
Дальнейшие эксперименты подтвердили, что при определенных концентрациях 6 АПК штаммы с искусственной программой смерти оказались более приспособленными и растут быстрее контрольных штаммов [352].
Наличие многочисленных примеров генетически запрограммированной клеточной смерти прокариот, сохранившихся в условиях жесткого естественного отбора, означает, что способность к феноптозу несет важные эволюционные преимущества. Для прокариот это способность контролировать численность популяции, сохранять ее «генетическую чистоту», элиминируя особей с поврежденным геномом, успешно сопротивляться разнообразным видам стресса, предотвращать распространение вирусов в популяции и др. Открытие у бактерий апоптозоподобного механизма клеточной гибели дает основания предполагать, что явление апоптоза многоклеточных также является эволюционным развитием древних программ самоуничтожения, проблемных для индивидуального организма, но благоприятных для эволюции вида.






