II.6.5 АФК, вызывающие старение, образуются в митохондриях
Вопрос о том, почему одни животные живут долго, а другие быстро умирают, т. е. о причинах длительности и краткости жизни, требует исследования.
Аристотель
«Длительность и краткость жизни» (350 г до нашей эры)
Митохондрии суть главный объект вмешательств, которые призваны увеличить продолжительность жизни.
Дж. Леманн и соавторы [180]
В клетке есть несколько мест, где образуются АФК. Это прежде всего митохондрии — органеллы, ответственные за поглощение почти всего кислорода, поступающего в организм через легкие. Митохондрии состоят из двух мембран (внешней и внутренней), межмембранного пространства и еще одного пространства, отделенного внутренней мембраной от межмембранного (рис. II.6.5.1).
В каждой клетке очень много отдельных митохондрий. Из-за складчатости внутренней митохондриальной мембраны её общая площадь у взрослого человека измеряется тысячами квадратных метров. И эта мембрана более чем на половину состоит из белков-ферментов, катализирующих дыхание клетки и сопряженный с ним синтез АТФ — энергетической валюты живых существ. Именно ферменты дыхания служат одним из главных катализаторов превращения О2 в анионрадикал супероксид, из которого получаются другие АФК. В принципе, основная функция дыхательных ферментов митохондрий — это превратить О2 в безобидную воду (см. Приложение 3). Но даже если небольшая часть поглощаемого митохондриями кислорода будет преобразована в супероксид, количества этого потенциально ядовитого вещества будет достаточно, чтобы натворить бед в нашем организме (о механизмах генерации АФК в клетке см. Приложение 4).
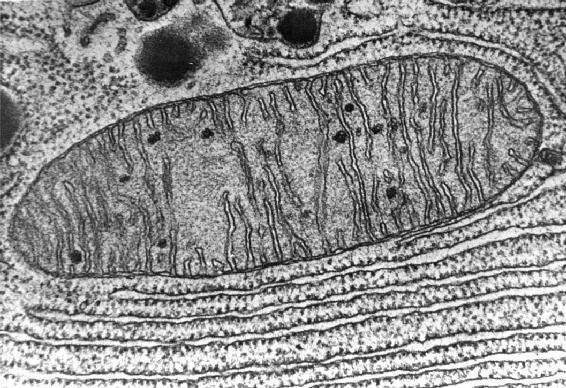
Рис. II.6.5.1
Итак, митохондрии — потенциально главный (или один из главных) генератор АФК в клетках млекопитающих. Выполнение этого условия необходимо (но еще не достаточно) для заключения, что именно митохондриальные АФК обусловливают медленное, нарастающее с годами, отравление организма, которое мы называем старением. В пользу такой возможности говорят следующие факты.
1) Продолжительность жизни различных видов обратно пропорциональна продукции АФК в митохондриях.
Митохондрии птиц образуют АФК медленней, чем митохондрии млекопитающих того же размера, имеющих гораздо меньшую продолжительность жизни [171,172]. Подобные соотношения наблюдаются также между летучей мышью (вес 8 г, живет до 34 лет) и землеройкой (вес 25 г, живет 1–2 года) [29,30]. В лабораториях Р.С. Сохала [167], Г. Бархи [11,12] и М. Бранда [171] было независимо показано, что продолжительность жизни теплокровных тем короче, чем выше скорость генерации АФК при обратном переносе электронов через комплекс I дыхательной цепи сердечных митохондрий. Такой корреляции не наблюдалось, если измеряли генерацию АФК при прямом переносе электронов через тот же участок цепи [171] (о механизмах переноса электронов по дыхательной цепи см. Приложение 3). Особенно обстоятельной оказалась работа группы из Кембриджа (Англия), где исследовали 12 видов различных млекопитающих (от мыши до бабуина и коровы) и птиц (от перепелки до голубя [336]) (рис. II.6.5.2). 11 видов легли на прямую, описывающую продолжительность жизни как обратную функцию от скорости генерации митохондриальных АФК. И только один вид оказался явным исключением из правила. Это был голый землекоп, живущий по крайней мере в 10 раз дольше мыши, но образовывавший АФК быстрее, чем мышь. Однако это тот случай, когда исключение лишь подтверждает правило. Дело в том, что голый землекоп был единственным нестареющим существом в исследованной выборке видов. Как уже отмечалось в предыдущем разделе, у землекопа программа старения, по-видимому, блокирована где-то после АФК, что и объясняет его выпадение из описанной корреляции: АФК образуются, но уже не в состоянии передать смертоносный сигнал дальше по цепочке событий, совокупность которых приводит к старению [442].
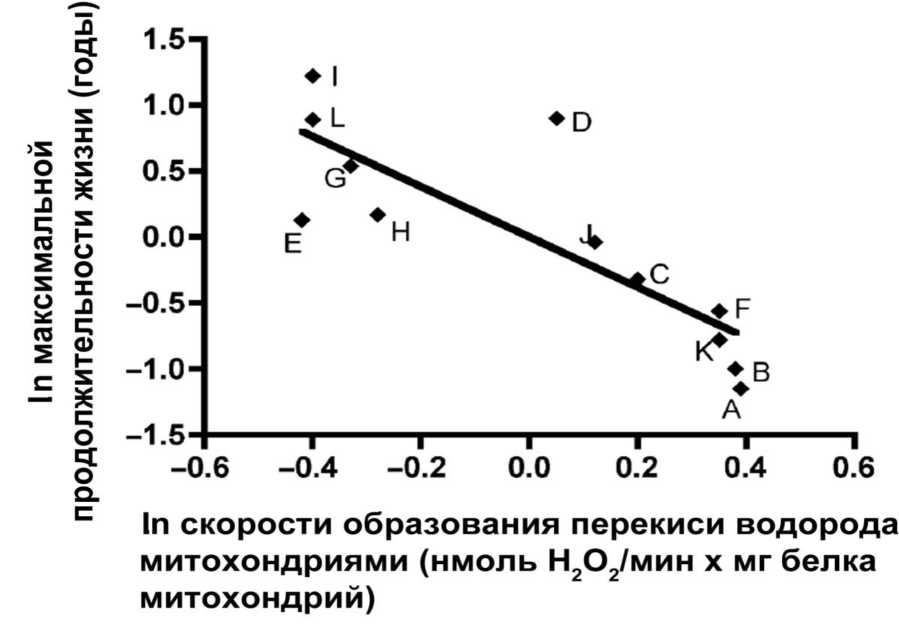
Рис. II.6.5.2
C этой точки зрения интересно сопоставление голого землекопа и летучей мыши. Оба имеют рекордную продолжительность жизни для столь мелких млекопитающих (более 30 лет), но у летучей мыши АФК образуются в митохондриях медленней, чем у короткоживущей обычной мыши M.musculus или землеройки, а у голого землекопа — быстрее. Создается впечатление, что программа старения у летучих мышей прервана до АФК, а не после АФК, как у голого землекопа[20].
Факты и соображения, изложенные выше, позволяют предполагать, что концентрация АФК в митохондриях должна с возрастом повышаться у стареющих организмов. Совсем недавно это было прямо подтверждено на дрозофиле М. Мерфи и сотрудниками [57], разработавшими элегантный метод измерения митохондриальных АФК in vivo с помощью проникающих катионов. Существенно, что на людях получены указания на увеличение с возрастом генерации АФК при обратном переносе электронов в мышечных митохондриях. Генерация H2O2 митохондриями скелетных мышц молодых людей (средний возраст 23,5 года) была почти втрое ниже, чем у пожилых (67,3 года), причем этот эффект блокировался ротеноном, ингибитором комплекса I [41]. Повышенная продукция АФК в митохондриях стареющих организмов происходит не только за счет дыхательной цепи. Так, количество моноаминоксидазы А, локализованной во внешней митохондриальной мембране, растет в сердце крыс в 7,5 раза за 24 месяца жизни. Этот фермент окисляет кислородом катехоламины, серотонин и некоторые другие амины с образованием Н2О2. Конечно, такой процесс лимитируется низкой концентрацией перечисленных субстратов окисления, но размах эффекта возраста так велик, что вряд ли оправданно сбрасывать его со счетов [219].
2) Антиоксидантная защита митохондрий значительно снижается при старении. Ключевую роль в этом эффекте играет падение уровня белка SIRT3 — фермента-деацетилазы, стимулирующего важнейшие антиоксидантные системы митохондрий — восстановление глютатиона и супероксиддисмутазу 2 [269,339,353,28].
и супероксиддисмутазы) и меньший уровень окисленности липидов. Максимальная продолжительность жизни белоногой мыши — более 8 лет против 3,5 лет лабораторной мыши [337,65,336,308]. Соотношение генерации АФК митохондриями и продолжительности жизни для белоногой мыши, как и для лабораторной, отлично ложится на прямую, коррелирующую эти параметры для других животных (рис. II.2.6.4).
3) Снижение уровня митохондриальных АФК замедляет старение. Такой эффект был достигнут тремя различными способами.
а) Каталаза, ключевой антиоксидантный фермент, расщепляющий Н2О2, был адресован в матрикс митохондрий, где он в норме отсутствует. Ген каталазы был лишен участка ДНК, кодирующего 11 аминокислотных остатка на N-конце белка. Эта часть белка — адрес, направляющий его в пероксисомы. Вместо пероксисомного адреса ген был дополнен участком ДНК, кодирующим полипептид из 25 аминокислот, который играет роль митохондриального адреса в ферменте орнитинтранскарбамилазе.
Модифицированный таким образом ген был введен в мышиный эмбрион. Оказалось, что мыши с такой мутацией живут дольше (данные группы П. Рабиновича [298]). В той же лаборатории было показано [179], что старение скелетных мышц резко замедляется присутствием каталазы внутри митохондрий. Исчезли такие нарастающие с возрастом эффекты, как повышение продукции перекиси водорода мышечными митохондриями, увеличение числа мутаций митохондриальной ДНК, рост карбонилирования белков (особенно белков митохондрий), снижение максимальной скорости митохондриального дыхания и сопряженного с ним синтеза АТФ.
Тормозилось уменьшение числа митохондрий в скелетных мышцах при старении животных [179]. Кроме того, ослаблялось неблагоприятное действие старения на миокард, снижались явления системного воспаления, уменьшалась частота возникновения опухолей негематопоэтического происхождения; при этом каталаза не влияла на развитие опухолей гематопоэтической системы и гломерулонефропатий [359,68]. На мышах с мутацией в корректорском центре митохондриальной ДНК-полимеразы («мутаторных мышах») адресная доставка каталазы в митохондрии сердца уменьшала число делеций митохондриальной ДНК, карбонилирование белков и количество активной формы фермента апоптоза — каспазы 3, повышенные у «мутаторных» мышей в отсутствие каталазы в органеллах [67]. Перечисленные эффекты были выражены гораздо слабее или вовсе отсутствовали, если каталаза была снабжена ядерным либо пероксисомным адресом [298].
б) Был нокаутирован ген белка p66shc, комплексующегося с митохондриальным цитохромом с и, по-видимому, разрешающего этому цитохрому переносить электрон прямо на О2, образуя О2-. Продолжительность жизни мышей выросла на 30 % (работы группы П. Дж. Пеличчи [224,361,236,104])[21].
в) В нашей лаборатории был синтезирован низкомолекулярный антиоксидант, адресованный в митохондрии (SkQ1, см. гл. II.7). Это вещество продлевало жизнь грибов, растений, ракообразных, насекомых, рыб и млекопитающих, а также замедляло развитие большой группы старческих заболеваний и признаков.
4) Увеличение уровня митохондриальных АФК ускоряет старение. В рамках нашего проекта по борьбе со старением (гл. II.7) один из его участников, президент Королевской академии наук Швеции Б. Кэннон и её сотрудники провели опыты на «мутаторных» мышах. Как уже отмечалось выше, такие мыши умирают гораздо быстрее со всеми признаками прогерии — преждевременного старения. Эти эффекты резко ослаблялись добавкой митохондриального антиоксиданта SkQ 1 в питьевую воду.
5) Старение сопровождается накоплением ошибок в митохондриальной ДНК [179] и уменьшением количества митохондриального фосфолипида кардиолипина [260,254]. У упомянутых в предыдущем абзаце прогерических мышей особенно много мутаций накапливается в митохондриальном гене цитохрома b [360], участвующем в генерации АФК митохондриями. В норме мутации митохондриальной ДНК возникают примерно на порядок быстрее, чем в ядерной, несмотря на наличие системы выбраковки поврежденных митохондрий (митоптоза), т. е. процесса, который должен способствовать очистке митохондриальной популяции клетки от органелл с поврежденной ДНК [323]. Одним из объяснений этому могло бы быть повреждение ДНК митохондрий за счет её окисления посредством АФК, образующихся во внутренней митохондриальной мембране, к которой эта ДНК прикреплена [323].
Другое «слабое место» митохондрий — кардиолипин. Этот необычный фосфолипид, содержащий не два, а четыре остатка жирных кислот, встречается только во внутренней мембране митохондрий, где он служит одним из наиболее массовых липидов. Большинство (а иногда и все четыре) жирных кислоты в молекуле кардиолипина — полиненасыщенные, т. е. с большим количеством двойных связей (во всех прочих фосфолипидах одна из двух жирных кислот обязательно насыщенная). Ненасыщенность жирных кислот придает кардиолипину необычайную чувствительность к АФК. С цитохромом b дыхательной цепи связан димер кардиолипина. Его восемь жирных кислот образуют что-то вроде колодца, стенки которого содержат 16 двойных связей, если жирные кислоты представлены линолевой кислотой (наиболее частый случай применительно к кардиолипину). Такая структура — идеальный «запал» для «поджига» внутренней мембраны митохондрии: АФК, атаковав подобную структуру, с высокой степенью вероятности запустят цепную реакцию перекисного окисления фосфолипидов в этой мембране. Источником таких АФК может быть цитохром b, активные центры которого находятся «в шаговой доступности» от димера кардиолипина [329]. Показано, что увеличение разности электрических потенциалов (??) на митохондриальной мембране тормозит перенос электронов с гема цитохрома Ьь на гем Ьн, что в свою очередь ведет к невозможности окислить свободнорадикальную форму убихинона (семихинон CoQ-) цитохромом Ьь. В результате CoQ-. накапливается, а затем окисляется кислородом с образованием O2-.. В тех же условиях O2-. генерируется также при обратном переносе электронов с участием комплекса I.
Образовавшись одним из этих двух способов, O2?· атакует кардиолипин, а продукт реакции — окисленный кардиолипин — уже не может удерживать цитохром с на поверхности внутренней мембраны митохондрий, и тот отщепляется от мембраны и переходит в межмембранное пространство митохондрий. Туда же освобождаются продукты окисления кардиолипина. В результате взаимодействия с этими продуктами цитохром с приобретает кардиолипин? пероксидазную активность, что в свою очередь ускоряет окисление новых порций кардиолипина и ведет к выходу из мембраны дополнительных количеств цитохрома с [140,141].
В межмембранном пространстве находится белок p66shc, уже упомянутый выше. Он также комплексуется с растворимым цитохромом с. Комплекс цитохрома с и p66shc начинает восстанавливать O2 до O2?·, что в свою очередь увеличивает продукцию O2?· митохондриями.
По данным, полученным в нашей группе М.Ю. Высоких [303], у прогерических мышей с мутантной митохондриальной ДНК? полимеразой уменьшается степень ненасыщенности жирнокислотных остатков кардиолипина (вероятно, как способ защиты от окислительного стресса) и этот эффект снимается антиоксидантом SkQ1, адресованным в митохондрии и, тем самым, ослабляющим окислительный стресс в органеллах мутанта.
В соответствии с логикой, изложенной выше, максимальная продолжительность жизни млекопитающих оказалась в обратной зависимости от количества двойных связей и способности к перекисному окислению фосфолипидов печеночных митохондрий [253].
Другой пример того же рода дало сравнение пчелиной матки («царицы») и рабочей пчелы (продолжительность жизни измеряются соответственно годами в первом случае и десятками дней — во втором [277]). У рабочих пчел оказалось гораздо больше полиненасыщенных жирных кислот, подверженных перекисному окислению, а у маток — насыщенных, устойчивых к этой опасности [116]. В грудном отделе рабочих пчел содержание цитохрома с в расчете на цитохромоксидазу было в 15 раз выше чем у матки, что могло бы способствовать у рабочих перекисному окислению кардиолипина и генерации O2?· этим цитохромом [62]. Наконец, количество белка-антиоксиданта, ювенильного гормона пчел вителлогенина было намного выше у маток [63].
6) Митохондриальные АФК вызывают апоптоз, тем самым способствуя уменьшению «клеточности» органов и тканей. На сегодня накоплен обширный экспериментальный материал о том, как АФК участвуют в запрограммированной смерти клетки. В этом смысле особенно важны митохондриальные АФК. Мутантные клеточные линии, лишенные митохондриальной ДНК, а значит и возможности образовывать АФК в дыхательной цепи, чрезвычайно устойчивы к апоптозу. Митохондриальный антиоксидант SkQ 1 блокирует апоптоз клеток в культуре, вызванный небольшой добавкой перекиси водорода. Сама добавленная перекись быстро разлагается клеточными ферментами, но затем, через 1–2 часа наступает мощный всплеск генерации эндогенных АФК, который как раз и снимается SkQ1. Здесь мы имеем дело с явлением, обнаруженным нашим сотрудником Д.Б. Зоровым, а именно образованием АФК под действием других АФК [403]. Показано также снятие некроза клеток in vitro посредством SkQ1 [328]. Кроме того, обнаружено предотвращение при помощи SkQ 1 возрастной активации апоптоза крысиных фибробластов [329].
Таким образом, есть веские основания полагать, что именно митохондриальные АФК вызывают уменьшение количества клеток в органах и тканях стареющих организмов.






