Приложение 4. Активные формы кислорода. Природа АФК и пути их образования в клетке
Почти весь кислород, поглощаемый живыми организмами, превращается в воду. Это происходит в результате реакции молекулы О2 с 4e- и 4H+. Однако небольшая доля поглощенного О2, обычно не превышающая 12 %, дает вместо воды анион супероксида (одноэлектронное восстановление О2 до радикала О2·-) или Н2О2 (двухэлектронное восстановление О2 до аниона пероксида O22-). Этот, казалось бы, незначительный в общем балансе дыхания процесс играет важнейшую роль в регуляции физиологических функций организма и даже его судьбе. Дело в том, что анион супероксида и Н2О2 могут превращаться в АФК, а именно в радикалы либо пергидроксила (НО2·), либо гидроксила (ОН·), а также в пероксинитрит (ONOO-), способный давать радикал ·ONOO, синглетный кислород (1O2) или все тот же ОН· (рис. П-4.1).
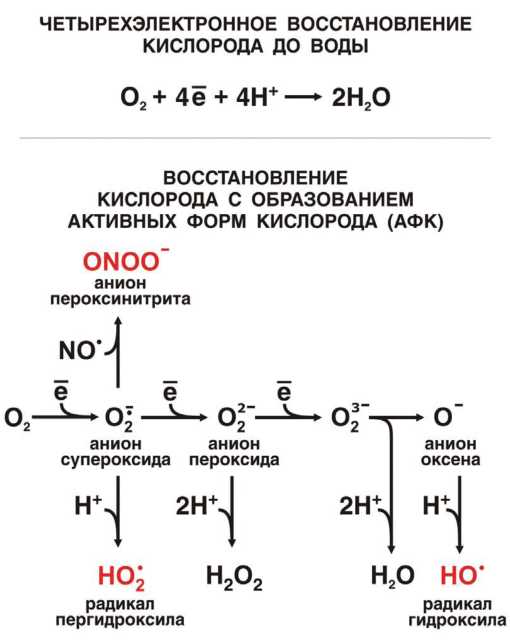
Рис. II-4.1
В свою очередь, АФК атакуют самые различные компоненты клетки, включая ДНК, РНК, белки и липиды. Некоторые из АФК настолько агрессивны как окислители, что даже небольшой их доли в общем потреблении кислорода хватает для проявления вредоносного действия, последствия которого могут оказаться трагическими для митохондрии, клетки и даже для организма в целом. Ведь если 1 % от тех 400 л О2, которые поглощает в день взрослый человек среднего веса, пойдут на образование не воды, а АФК, то это будет означать продукцию 4 л супероксида в день. Нетрудно представить себе последствия, если учесть, что такой продукт дальнейшего превращения супероксида как радикал гидроксила может соперничать по токсичности с «хлоркой», применяемой при дезинфекции. Первоначально считалось, что образование АФК — неизбежная «расплата» за аэробный образ жизни, поскольку мелкие, незаряженные и довольно гидрофобные молекулы О2, свободно проникающие через мембраны и даже накапливающиеся в них, чисто химически (неферментативно) могут окислять редокс-группы коферментов и белков, способные к одноэлектронному восстановлению кислорода. К таким группам относят полувосстановленные (семихинонные) формы убихинона, пластохинона, менахинона, флавинов, а также [Fe-Sj-кластеры негемовых железопротеидов с редокс-потенциалами, близкими к таковому пары супероксид/кислород. Однако многочисленные публикации последних лет убедительно свидетельствуют о том, что если даже АФК и служат побочными продуктами метаболизма, то, тем не менее, их образование и уборка тщательно контролируются организмом. В результате концентрация АФК в организме может варьировать на порядки за счет работы специальных регулирующих систем.
В случае наиболее мощных генераторов АФК, таких как комплексы I и III дыхательной цепи (а также комплекса II, дегидрогеназы дигидролипоата и цитохрома Р450), образование O2- выглядит как «преждевременная утечка» электронов, которые вместо переноса по дыхательной цепи (или применительно к цитохрому Р450 — участия в оксигенации субстрата) захватываются кислородом в процессе его одноэлектронного восстановления. Ввиду колоссальных объемов кислорода, поглощаемых дыхательной цепью, даже очень небольшая их «утечка» должна привести к образованию таких количеств АФК, которые значительно больше тех, что генерируются ферментами, специализированными на восстановлении О2 до O2- или Н2О2, т. е. моноаминооксидазой внешней митохондриальной мембраны, NADPH-оксидазой плазмалеммы, оксидазами пероксисом, ксантиноксидазой и некоторыми другими ферментными системами (таблица П-4.1).
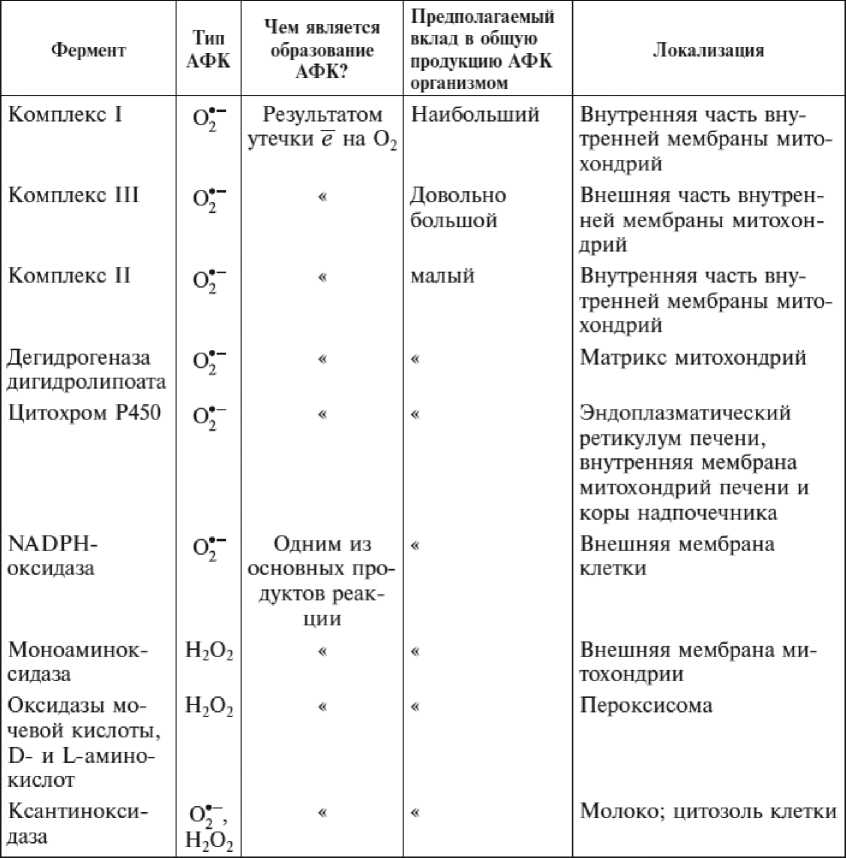
Таблица II-4.1.
Большему вкладу дыхательной цепи в общую генерацию АФК организмом соответствует и значительное количественное преобладание ферментов этой цепи над другими оксидазами и оксигеназами. Ферменты дыхательной цепи — один из основных компонентов внутренней мембраны митохондрий, общая площадь которой в организме человека равна примерно 14 тыс. м2. Прямые измерения распределения АФК в разных участках живой клетки показали, что, например, вспышка образования АФК при самоубийстве дрожжевой клетки первоначально происходит в ее митохондриях.
Как живые системы защищаются от АФК?
Традиционно в качестве защиты от АФК рассматривают прежде всего вещества-антиоксиданты, убирающие ядовитые формы кислорода. Результат взаимодействия АФК и антиоксидантов состоит в том, что АФК инактивируются, а антиоксиданты, как правило, выходят из строя, теряя свои защитные свойства. Антиоксидант гибнет, как бы прикрывая собой другие, более важные биомолекулы, такие, как ДНК, РНК, белки, фосфолипиды и т. п. Иногда возможна регенерация окисленного антиоксиданта в исходную активную форму. Антиоксиданты принято делить на водорастворимые, действующие в гидрофильных областях клетки (аскорбиновая кислота, SH-глутатион, цистеин и др.), и жирорастворимые, призванные защищать мембранные структуры (CoQ, пластохинон, витамины A, D, E и K). Например, CoQH2 может восстанавливать свободнорадикальные формы липидов, окисляясь в CoQ·-. Полученный CoQ·- регенерирует в исходный CoQH2, восстанавливаясь дыхательной цепью.
В последнее время все больше внимания уделяется биологическим механизмам защиты от АФК, снижающим продукцию активных форм кислорода в клетке, а не убирающим уже образовавшиеся АФК. Все аэробные организмы располагают глубокоэшелонированной системой защиты от АФК путем предотвращения самой их генерации. Простейшим приемом служит снижение внутриклеточной концентрации кислорода. Дело в том, что цитохромоксидаза и другие терминальные оксидазы, восстанавливающие О2 до Н2О, сохраняют максимальную активность вплоть до концентрации кислорода, составляющей всего несколько процентов от той, которая имеется в воде при нормальном атмосферном давлении. В то же время, скорость восстановления О2 до O2'- в митохондриях линейно зависит от концентрации O2. Вот почему снижение в 10–20 раз уровня O2 внутри клетки ведет к резкому торможению продукции O2- без существенного торможения цитохромоксидазной реакции, а значит, и без уменьшения скорости дыхания и сопряженного с ним синтеза АТФ. И действительно, измерения концентрации O2 в тканях животных показали, что эта величина примерно на порядок ниже, чем в воде, насыщенной воздухом, т. е. лежит в области В на рис. II-4.2.
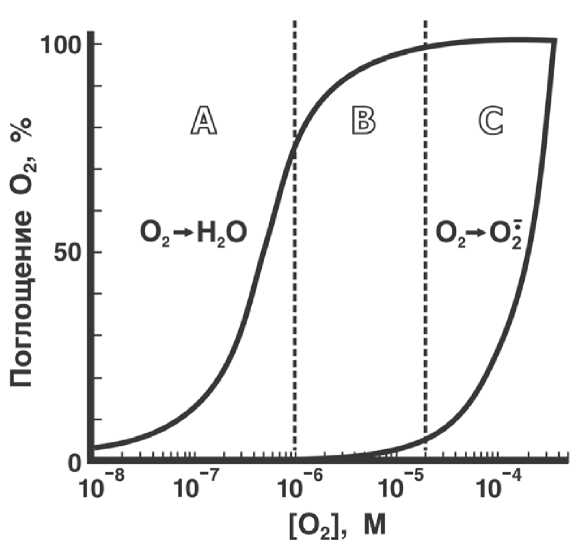
Рис. П-4.2.
Эта область выгодно отличается как от области А (где [О2] слишком мала для поддержания высокой скорости цитохромоксидазной реакции), так и от области С (где повышение [О2] приводит к развязыванию одноэлектронного восстановления кислорода без какого-либо выигрыша для цитохромоксидазы). В любой ткани, кроме легких, [О2] поддерживается на уровне существенно более низком, чем в равновесии с воздухом. Это происходит потому, что в покое скорость доставки О2 от легких к другим органам специально удерживается в области значений, весьма далеких от максимально возможных. Скорость доставки О2 резко возрастает при переходе от покоя к интенсивной работе. Улучшается вентиляция легких, усиливается работа сердца, растет скорость кровотока, расширяются кровеносные сосуды. Параллельно повышается потребление кислорода цитохромоксидазой из-за появления свободного АДФ. Но и в новых условиях соотношения скоростей потребления кислорода в тканях и его доставки оказываются отрегулированными таким образом, что [О2] в клетках не увеличивается выше 10 % от насыщения на воздухе. При этом организм отслеживает концентрацию АФК в крови с помощью особых сенсоров, которые вызывают сужение сосудов в ответ на рост [О2-].
Стратегия, описанная выше, невозможна для одноклеточных. Так, даже азотобактер, имеющий рекордную среди живых существ скорость дыхания, не в состоянии, как показал расчет, существенно понизить внутриклеточную [О2] из-за слишком короткой дистанции между цитозолем бактериальной клетки и внешней средой: поглощение О2 цитохромоксидазой тотчас компенсируется потоком О2 извне. Здесь на помощь приходит полисахаридная «шуба», окружающая клетку азотобактера. «Шуба» исключает конвекцию жидкости, омывающей непосредственно бактериальную стенку, что резко замедляет движение О2 из среды к бактерии. Проблема защиты от кислорода стоит для азотобактера особенно остро в средах, не содержащих солей аммония. В этом случае азотобактеру, чтобы выжить, приходится восстанавливать молекулярный азот до аммиака, чем занимается специальный фермент — нитрогеназа. Последняя чрезвычайно чувствительна к О2, даже следы которого ее быстро инактивируют. Неудивительно, что именно в условиях фиксации N2 азотобактер включает особую упрощенную дыхательную цепь, поглощающую кислород гораздо быстрее, чем делает это «каноническая» цепь, составленная из комплексов I, III и IV. Простая цепь, получившая название цепи дыхательной защиты, состоит всего из двух ферментов: 1) несопряженной NADH-дегидрогеназы II с ее единственным редокс-центром (FAD), которая восстанавливает CoQ посредством NADH, и 2) bd-хинолоксидазы, окисляющей полученный C0QH2 кислородом. Эта вторая реакция генерирует протонный потенциал с эффективностью №/е- = 1, т. е. вдвое меньшей, чем у комплекса IV. В итоге цепь дыхательной защиты транспортирует всего 2Н+ на каждую молекулу окисляемого NADH вместо 10Н+ в случае «канонической» цепи. Следовательно, азотобактеру в условиях дыхательной защиты приходится окислять в 5 раз больше NADH, чтобы получить столько же АТФ, сколько синтезирует обычная дыхательная цепь.
Иной путь защиты от кислорода избрала кишечная палочка. Как было показано в нашей лаборатории Е.О. Будрене, эти бактерии в ответ на появление в среде Н2О2 собираются в кластеры, каждый из которых состоит из тысяч отдельных клеток. Сигналом к движению бактерий навстречу друг другу служит градиент аттрактанта — аспарагиновой кислоты, которую они начинают выделять в среду при добавлении перекиси водорода. В результате на чашке с полужидким агаром образуется множество скоплений (кластеров) бактериальных клеток, каждый из которых состоит из большого количества отдельных бактерий. Кластеры могут образовывать правильные структуры различной формы, по-видимому, отражающие неравномерное распределение аспартата в агаре. Можно полагать, что внешние слои бактерий в кластере поглощают кислород, тем самым понижая его концентрацию в глубинных слоях кластера. В результате бактерии во внешних слоях жертвуют собой, прикрывая тех, кто оказался внутри кластера. В известном смысле аналогичная стратегия применяется в очень крупных мышечных клетках. Здесь митохондрии скапливаются непосредственно под внешней клеточной мембраной (сарколеммой). От этих скоплений вглубь клетки уходят длинные митохондриальные тяжи, связывающие субсарколемальные митохондрии с межфибриллярными, локализованными внутри мышечного волокна, т. е. между пучками актомиозиновых нитей. Предполагается, что кислород, поступающий в мышечную клетку, потребляется субсарколемальными митохондриями, дыхательная цепь которых образует протонный потенциал, который передается межфибриллярным митохондриям для синтеза АТФ.
Мягкое разобщение служит, по-видимому, одним из механизмов, снижающих продукцию АФК комплексами I и III. Как было показано в нашей лаборатории А. А. Старковым и соавторами, генерация перекиси водорода изолированными митохондриями сердца, окисляющими сукцинат, очень сильно зависит от величины разности электрических потенциалов (??) на митохондриальной мембране. В тех же опытах было установлено, что ингибитор комплекса I ротенон тормозит образование Н2О2 на 80 %, ингибитор комплекса III миксотиазол — на 15 %, а разобщитель-протонофор — на 95 %. Эти результаты позволили заключить, что 80 % Н2О2 образуется путем энергозависимого обратного переноса электронов комплексом I от сукцината (редокс-потенциал пары фумарат / сукцинат +0,03 В) к О2 (редокс-потенциал пары О2/ O2·- -0,3 В). Еще 15 % от общего количества перекиси водорода возникает в Q-цикле при реакции семихинонной формы убихинона (CoQ·-) с О2 в условиях дыхательного контроля, когда высокая ?? блокирует перенос электронов от гема Ьь к гему Ьн и тем самым предотвращает окисление CoQ·- посредством гема Ьь. Как тот, так и другой механизмы выключались, если несколько снижалась разобщителем, ингибитором сукцинатдегидрогеназы малонатом или включением процесса окислительного фосфорилирования добавкой АДФ. Есть основания полагать, что такого рода снижение ?? in vivo может быть вызвано небольшим («мягким») разобщением дыхания и фосфорилирования жирными кислотами. Такое разобщение может опосредоваться АТР/АДФ- антипортером, аспартат/глутамат-антипортером а также некоторыми другими митохондриальными переносчиками анионов, транспортирующими не только анионы своих специфических субстратов (нуклеотидов, аминокислот и т. д.), но также и анионы жирных кислот.
Инактивация аконитазы супероксидом может быть следующей линией обороны митохондрий от АФК. Показано, что супероксид вызывает окисление одного из четырех ионов негемового железа, имеющихся в аконитазе — ферменте, катализирующем одну из первых реакций цикла Кребса. Такое окисление ведет к потере этого иона и обратимо инактивирует фермент. Неактивная аконитаза реактивируется, связывая ион Fe2+. Выключение аконитазы супероксидом блокирует цикл Кребса в самом его начале. Поскольку именно цикл Кребса служит главным поставщиком электронов при дыхании, его блокада опустошает дыхательную цепь. Все ее электронные переносчики переходят в окисленную форму и уже не могут восстанавливать О2 ни до Н2О, ни до O2·?. В итоге тормозится генерация O2‘?, первичного предшественника митохондриальных АФК. Торможение аконитазы имеет еще одно следствие: в клетке накапливается цитрат — субстрат этого фермента. Цитрат — трехзарядный анион, образующий комплексы с Fe2+ и Fe3+. Комплекс цитратЗ — Fe2+ способен к самоокислению посредством О2, превращаясь в еще более прочный комплекс цитратЗ — Fe3+. Поэтому в аэробных условиях накопление цитрата должно способствовать уменьшению концентрации ионов Fe2+, которые служат наилучшим донором электронов для восстановления иона пероксида (О22-), завершающегося образованием радикала ОН· — наиболее опасной формы АФК (см. выше, рис. П4.1?). Таким образом, выключив аконитазу, митохондрия достигает, во?первых, уменьшения образования O2? и, стало быть, всех АФК, служащих производными супероксида, и, во-вторых, торможения генерации ОН·.