Приложение 6. Физические упражнения, митохондрии и старение
Старение, равно как и ряд нейродегенеративных заболеваний (в том числе, болезни Альцгеймера и Паркинсона), сопровождается хронической воспалительной реакцией, ростом уровня АФК в тканях и прогрессирующей дисфункцией митохондрий. Все это приводит к снижению уровня синтеза АТФ, повышению апоптозной активности и клеточной гибели. Одна из достаточно эффективных мер противодействия этим негативным явлениям — это регулярные физические тренировки на выносливость. Помимо очевидного благотворного влияния на физическую форму человека и здоровье в целом, такие тренировки снижают вероятность возникновения патологий сердца [32,6], болезни Альцгеймера [270,215] и целого ряда хронических заболеваний, в том числе и связанных с воспалительными реакциями [23,234]. В исследовании на небольшой выборке (28 человек) добровольцев было также показано, что у пожилых людей, регулярно выполнявших физические упражнения, ускоряется заживление ран [84]. Этот эффект был затем подтвержден в экспериментах на мышах: у пожилых (18 месяцев) животных, подвергавшихся физической нагрузке, раны заживали быстрее, а также наблюдалось снижение воспалительной реакции [151].
Прояснение молекулярного механизма, обусловливающего положительное влияние продолжительной физической нагрузки, является одной из активно развивающихся областей современной физиологии. Уже ясно, что центральную роль в этом механизме играет стимуляция биогенеза митохондрий [344] и митохондриальных функций в целом, а также повышение эффективности контроля уровня АФК [6,215].
Показано, что у мышей, подвергавшихся регулярной тренировке на выносливость (бег 45 мин — 2 часа в день, 5 дней в неделю, в течение 8 недель начиная с 3х-месячного возраста), возрастают уровень митохондриальных транскрипционных факторов, количество митохондриальной ДНК и продукция АТФ митохондриями мышц; повышается устойчивость к глюкозе и увеличивается общий уровень физической активности [55]. Было также установлено, что у взрослых (20 мес.) и старых (30 мес.) крыс регулярные физические упражнения (8 недель) приводили к снижению уровня повреждения ДНК, активации систем репарации, повышению устойчивости к окислительному стрессу, и снижению возраст-зависимого роста уровня 8-окси-2'-деоксигуанозина (8-OHdG) в мышцах [271].
Примечательно, что физическая нагрузка также стимулирует биогенез митохондрий мозга: у молодых (2 мес.) мышей, в течение 8 недель подвергавшихся физической нагрузке (1 час в день, 6 дней в неделю), в тканях мозга заметно увеличивалось количество митохондриальной ДНК, а также иРНК ряда белков-маркеров митохондриального биогенеза [344]. Возможно, именно это явление обусловливает благоприятный эффект физической нагрузки при развитии возраст-зависимых нейродегенеративных заболеваний [215].
Исследования последних лет выявили ряд деталей молекулярного механизма вышеописанного положительного действия физической нагрузки [120]. При сокращении мышц происходит выход кальция из саркоплазматического ретикулума; это влияет на активность кальций-зависимых ферментов, в частности — кальций/кальмодулин-зависимых киназ. В результате изменяется профиль фосфорилирования ряда транскрипционных факторов и их ко-активаторов, в том числе — белка PGC-1a, одного из основных регуляторов биогенеза и функций митохондрий [120].
Белок PGC-Іабьіл открыт в 1998 году как индуцируемый холодом ко-активатор ядерного рецептора PPAR-?, контролирующего развитие и метаболизм жировой ткани и мышц [268]. Основной функцией PPAR-?, как и любого ядерного рецептора, является регуляция транскрипции: связывая низкомолекулярные соединения, PPAR-? изменяет своё сродство к определенным участкам геномной ДНК [181].
Дальнейшие исследования показали, что к факторам, стимулирующим образование PGCl-а, относится не только холод, но также физическая нагрузка и голодание [147], и что помимо контроля термогенеза, PGCl-а вовлечен в регуляцию экспрессии множества генов, в том числе — ответственных за образование митохондрий [147,9], за метаболизм жиров и глюкозы [194], и за контроль суточных ритмов (гены «биологических часов») [196]. Этот белок взаимодействует с разнообразными транскрипционными факторами и участвует в регуляции функций митохондрий [378]; его экспрессия повышается при регулярных упражнениях на выносливость. PGC-1a, вероятно, регулирует как кратковременные, так и долговременные реакции организма на физическую нагрузку: его уровень достаточно быстро возрастает в работающих мышцах и падает при расслаблении, но регулярные упражнения на выносливость приводят к его устойчивому повышению [290].
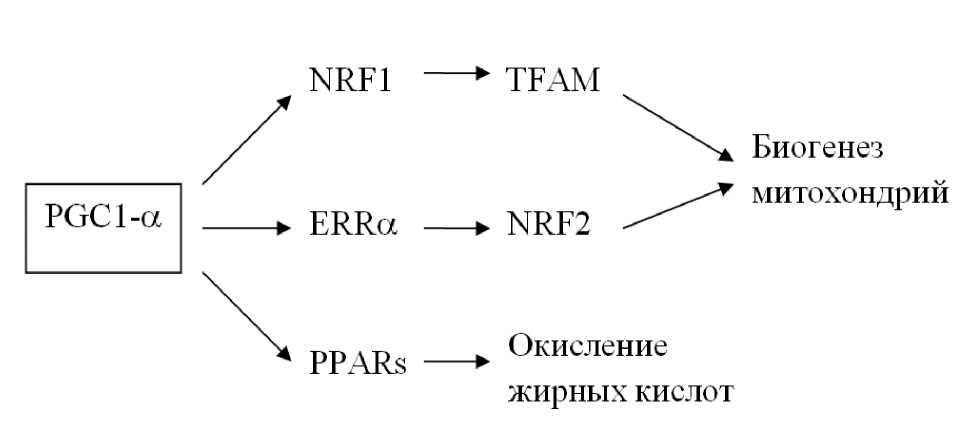
Рис. II-6.1.
Имеющиеся на сегодняшний день данные указывают, что PGC-1a является «узловым» регулятором биогенеза и функций митохондрий: несколько разнообразных сигналов индуцируют его экспрессию, а он, в свою очередь, способен активировать несколько регуляторных путей через взаимодействие с ядерными рецепторами (Рис. П-6.1) [379].
У мышей делеция гена PGC1-a не является летальной, но приводит к торможению постнатального развития сердца и медленных волокон скелетных мышц, а также снижению количества и функциональности митохондрий в них; выносливость животных при длительной физической нагрузке также была заметно снижена. С возрастом у мутантных мышей наблюдались ожирение и нарушение способности восстанавливать температуру тела после охлаждения [183]. Все это подтверждает важную роль PGC1-a в биогенезе и поддержке функциональности митохондрий.
Кроме того, при кратковременном голодании у таких мышей развивалась жировая инфильтрация печени (стеатоз). Примечательно, что, несмотря на ожирение, развитие инсулинорезистентности в ответ на богатую жирами диету у мутантных мышей было менее выражено, чем у контрольных мышей дикого типа [183]. Сходные результаты были получены в экспериментах на мышах при избирательном отключении гена PGC1-a в скелетных мышцах [397]; индукция синтеза PGC-1a в мышцах предотвращала развитие таких возраст-зависимых изменений, как саркопения, падение митохондриальных функций, снижение чувствительности к инсулину, ухудшение нейро-мышечной передачи и др. [381].
PGC-1a способен стимулировать биогенез митохондрий не только в ответ на физическую нагрузку. Так, эксперименты на тринадцатиполосном суслике Ictidomys tridecemlineatus показали, что PGC-1a играет важную роль в сохранении мышечной функции во время зимней спячки этого животного при полном отсутствии мышечной нагрузки [390].
Следует, однако, отметить, что PGCGa-путь — не единственный сигнальный каскад, связывающий физическую нагрузку и стимуляцию митохондриальных функций. У мышей с нокаутированным в скелетных мыщцах геном PGC-1a наблюдалось, несмотря на отсутствие этого фактора, индукция биогенеза митохондрий посредством упражнений на выносливость [288].
Поскольку центральным элементом механизма действия физической нагрузки как способа предотвращения патологических возрастных изменений являются митохондрии, неудивительно, что этот метод оказывается наиболее эффективен для защиты таких энергоемких и зависимых от митохондрий органов, как сердце, мышцы и мозг. Но еще более выраженное благотворное действие физические упражнения оказывают при ряде митохондриальных патологий.
Так, в опытах на мышах с митохондриальной миопатией, вызванной дефектом в цитохромоксидазе, упражнения на выносливость приводили к повышению уровня АТФ в тканях, а также к замедлению развития патологии и к увеличению продолжительности жизни [380].
Еще более значительный положительный эффект упражнений на выносливость наблюдался на «мутаторных» мышах с дефектом в домене ДНК-полимеразы ?, отвечающем за коррекцию ошибок при синтезе митохондриальной ДНК [292]. У этих мышей резко повышалось количество мутаций в митохондриальной ДНК, что приводило к дисфункции митохондрий, ускоренному старению и сокращению продолжительности жизни: уже на 6-ой месяц жизни у них наблюдались такие признаки старения, как поседение и облысение, снижение подвижности, потеря веса и общий физический упадок. Однако «мутаторные» мыши, которых начиная с трехмесячного возраста подвергали вынужденной физической нагрузке (45 минут 3 раза в неделю в течение 5ти месяцев), в возрасте 8ми месяцев были фенотипически неотличимы от контрольных мышей дикого типа. Упражнения также предотвратили раннюю смертность у «мутаторных» мышей и привели к значительному снижению количества точечных мутаций в митохондриальной ДНК. Кроме того, упражнения предотвращали возраст-зависимое снижение общего количества митохондриальной ДНК [292].
У человека упражнения на выносливость также оказывают благотворный эффект при ряде митохондриальных патологий. В нескольких исследованиях было показано, что физическая нагрузка может применяться для терапии митохондриальной миопатии [138,137]. Было также установлено, что регулярная физическая нагрузка коррелирует с более медленным укорочением теломер [174,247].






