2.2. Инфаркт миокарда
Витаминопрофилактика стрессорного инфаркта миокарда. Исследования последних лет конкретизировали знание патогенеза стрессорных кардиопатий, что позволило Ф. Меерсону сформулировать общий принцип метаболической защиты сердца, в основу которого было заложено подражание естественным антистрессорным и антиишемическим системам организма путем введения in vivo метаболитов этих систем или их синтетических аналогов, т. е. химических агентов, прицельно действующих на отдельные звенья патогенетической цепи стрессорных повреждений сердечной мышцы [98]. Ингибирование возбуждения центров головного мозга, детерминирующих стресс-реакцию, с помощью транквилизаторов, блокада индералом адренорецепторов сердца, через которые реализуется кардиотоксический эффект катехоламинов (спазм коронарных сосудов), блокада липидной триады (повреждение лизосомальных мембран и выход протеолитических ферментов, детергентное действие избытка жирных кислот и активация ПОЛ) ингибиторами ПОЛ, фосфолипаз и липаз, ингибирование лизосомальных ферментов (дезинтеграция инфраструктуры кардиомиоцитов) и блокада вхождения Са2+ в клетки верапамилом (избыток Са2+ вызывает необратимые контрактуры и некробиоз миофибрилл, нарушает сокращение и расслабление миокарда) – эти 5 групп факторов могут предупредить или ограничить стрессорные повреждения сердца [98].
Поскольку ИМ является закономерным исходом стрессорной альтерации сердца [98], необходимо было убедиться в эффективности подобной схемы его защиты в принятых условиях. Как известно, в результате ИМ сохранившийся миокард оказывается в состоянии гиперфункции. Последняя является причиной морфофункциональных сдвигов, составляющих существо долговременного этапа адаптации [96]. Именно поэтому представляет интерес наблюдение за динамикой стереометрических показателей, характеризующих объемные соотношения в системе кардиомиоцит – капилляр в левом желудочке сердца.
В табл. І-4 приведены значения тех стереометрических показателей неишемизированного миокарда левого желудочка, которые обнаружили изменения в результате ИМ и динамику в постинфарктном периоде. Приведенные данные объективно свидетельствуют о том, что перенесенный ИМ, вызванный временным сдавливанием левой коронарной артерии [256], вносит существенные изменения в объемные соотношения компонентов «интактного» миокарда. В первую очередь они касаются изменений микроциркуляторного русла. Не приходится сомневаться, что изменения эти являются следствием стрессорного повреждения. Дело в том, что ранее аналогичные изменения были описаны нами и при сильном эмоционально-болевом стрессе (ЭБС) [347]. Микроциркуляторные нарушения в миокарде, документируемые уменьшением диаметра капилляров, обусловлены, очевидно, снижением их кровенаполнения из-за контрактурного спазма артериол [98]. Примечательно, что у контрольных животных эти сдвиги сохраняются до 30 сут постинфарктного периода.
Таблица І-4.
Стереометрические показатели ишемизированного миокарда в постинфарктном периоде после применения верапамила, ионола, индерала, вольпроата, празозина, тиамина и никотинамида
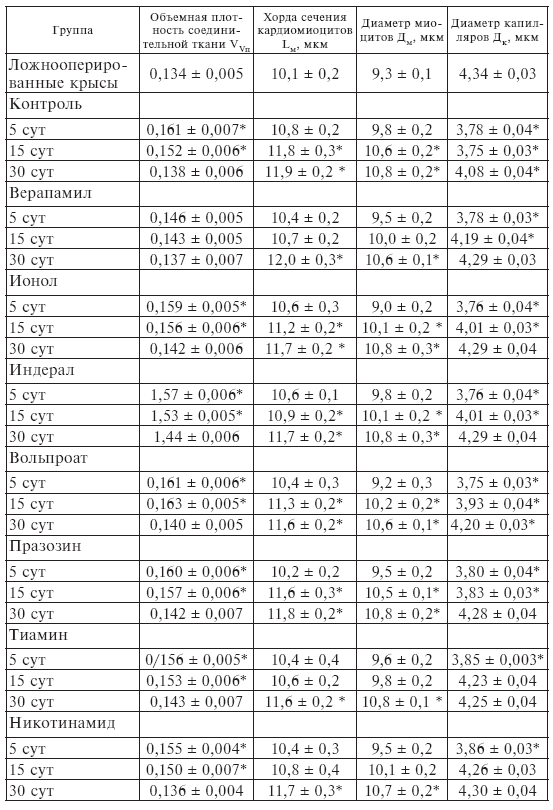
* p < 0,05 при сравнении с показателями ложнооперированных крыс.
Важными представляются и изменения объемной плотности интерстициальной соединительной ткани (физический смысл показателя сводится к тому, что относительный объем миокарда принимается равным 1, а доля в этом объеме интерстициальной соединительной ткани – некой дробной величине). Возрастание этой величины может объясняться двумя причинами: диффузным кардиосклерозом или отеком. Обратимость сдвигов указывает на вероятность второго процесса. Начиная с 15 сут у контрольных животных увеличиваются хорда сечения и минимальный диаметр кардиомиоцитов, что является следствием либо внутриклеточного отека, либо компенсаторной гипертрофии. Несовпадение динамики этих показателей с динамикой интерстициального отека указывает на вероятность гипертрофии.
Разобравшись с принципиальной динамикой стереометрических показателей в контроле, нетрудно дать оценку изменениям, привнесенным лекарственными препаратами. Основное благоприобретенное изменение, присущее всем препаратам, – нормализация диаметра капилляров не позднее 30 сут постинфарктного периода, а в случае применения верапамила – уже к 15-му дню. При применении верапамила полностью предотвращается интерстициальный отек миокарда (см. показатели объемной в табл. І-4) и значительно позднее, чем в контроле и при использовании других кардиопротекторов, появляются достоверные признаки компенсаторной рабочей гипертрофии неишемизированного миокарда. Очевидно, это связано с тем, что при существенном ограничении объема некроза сердечной мышцы соответственно уменьшается относительная перегрузка неинфарцированного миокарда.
Таким образом, верапамил (блокатор транспорта кальция вводили внутрь за 30 мин до ИМ в дозе 5 мг/кг), ионол (антиоксидант – 50 мг/кг внутрибрюшинно за 15 мин до ИМ), индерал (?-блокатор – 1 мг/кг аналогично), вольпраат (транквилизатор – 200 мг/кг внутрь за 30 мин до ИМ) и празозин (блокатор ?-рецепторов – 1 мг/кг внутрибрюшинно за 15 мин до ИМ) способны в значительной степени предотвращать стрессорные повреждения неишемизированной мышцы сердца за счет усиления васкуляризации сохранившегося миокарда в постинфарктном периоде.
Идентичность кардиопротекторного действия всех использованных фармакологических препаратов (судя по данным стереометрического анализа – табл. І-4) предполагает и общий механизм реализации защиты, который, в силу своей универсальности, должен срабатывать не только в сердце, но и в других органах. Действительно, кардиопротекторы (ГОМК, индерал, верапамил) способны существенно ограничивать и даже полностью предупреждать развитие язвенных поражений слизистой оболочки желудка, обусловленных адренергическим спазмом артериол при ЭБС [98].
Поскольку язвообразование в желудочно-кишечном тракте является классическим проявлением стресса, элементом знаменитой еще со времени Г. Селье морфологической стрессорной триады: язвы слизистой желудка, инволюция тимуса, гипертрофия надпочечников – можно полагать, что обнаруженные сдвиги свидетельствуют об антистрессорном механизме защиты (кардиопротекции) в принятых условиях.
Считается, что, несмотря на структурные отличия указанных выше кардиопротекторов, все они действуют на развитие одного и того же приспособительного процесса, только на разных его уровнях, например, участвуя в оформлении доминантного сигнала адаптации в мозговых центрах либо в ограничении или выключении детерминирующего функцию сигнала на периферии, т. е. в органах-мишенях [100]. Из минимальной схемы общей стрессреализующей системы ЭБС: кора мозга (возбуждение эмоциогенных центров) – гипоталамус (синтез рилизинг-факторов) – гипофиз (синтез АКТГ) – надпочечники (синтез стресс-гормонов) – орган-мишень (рецепция стресс-гормонов) видно, что блокировкой любого звена этой цепи с помощью прицельно действующих фармакологических средств можно остановить дальнейшее развертывание стресс-реакции и, следовательно, предотвратить ее негативные органоспецифические проявления в миокарде. Поскольку при стрессе в мозгу увеличивается количество тормозных медиаторов (ГАМК, глицин, дофамин, серотонин и т. п.), активируется мобилизация жирных кислот, блокирующих вход в клетки Са2+ через медленные каналы, а в сердце повышается концентрация аденозина и простагландинов, выключающих адренорецепторы, не исключено, что широко используемые в медицинской практике кардиопротекторы в значительной мере дублируют естественные механизмы саморегуляции, функционирующие в рамках эндогенных стресслимитирующих систем сердца и организма в целом [98].
Экспериментально установлено, что при многократном действии стрессорных раздражителей активация гипофизадреналовой системы, контролируемая гомеостатическими механизмами, с каждым разом становится все меньше [121, 271]. Следовательно, существует принципиальная возможность профилактики кардиогенных осложнений избыточного стресса за счет собственных защитных ресурсов организма путем стимуляции стресслимитирующих систем дозированным неспецифическим раздражением (тренингом). Ранее было показано, что мягкий стресс и гипоксия способны существенно уменьшить объем повреждения миокарда (некpоз) в зоне ишемии, вызываемый окклюзией левой коpонаpной артерии [103]. Поскольку внеинфарктный миокард, как и миокард зоны ишемии, становится объектом стрессорной альтерации, было интересно оценить возможность его защиты предварительной адаптацией к действию стресса, гипоксии и физической нагрузки.
Примененный нами метод изучения соотношений кардиомиоцит – капилляр дает возможность формализованной количественной оценки скорости диффузии кислорода через мембрану капилляров (V1), интерстициальное пространство (V2), сарколемму (V3), и саркоплазму (V4). Следует иметь в виду, что здесь оценивается не истинная скорость, а лишь сердечная компонента соответствующего механизма. Практически истинные значения скоростей транспорта кислорода были бы пропорциональны величине коэффициентов K при допущении, что внесердечные факторы, лимитирующие диффузию, остаются постоянными. Подобный формализованный эксперимент соответствует условиям опыта, в котором скорости диффузии кислорода определяются при очередной трансплантации сердец в один и тот же организм с абсолютно жестким поддержанием гомеостатических параметров, влияющих на диффузию кислорода.
Данные табл. І-5 подтверждают наличие нарушений транспорта кислорода в системе кардиомиоцит – капилляр внеинфарктной зоны. При этом скорости диффузии кислорода через суммарные мембраны капилляров и интерстиций остаются сниженными только в течение 5 сут после ИМ. Снижение V1 обусловлено уменьшением артериального притока в результате контрактурного спазма артериол. Уменьшение V2 может быть связано с преходящим интерстициальным отеком. V3 и V4 остаются сниженными в течение всего срока наблюдения. Приняв во внимание, что уже к 15 сут поступление артериальной крови и, следовательно, кислорода нормализуется, уменьшение V3 и V4 объясняется гипертрофией кардиомиоцитов. Очевидно, рост новообразующихся сосудов отстает от скорости гипертрофии клеток сердечной мышцы. Иными словами, пластическое обеспечение гипертрофированного миокарда в принятых условиях явно недостаточно.
Динамика исследованных стереометрических показателей миокарда у животных, адаптированных к стрессу и бегу, отличается от описанной лишь тем, что скорости диффузии кислорода через саркоплазму и сарколемму нормализуются не позднее 15 сут. Эти несомненно положительные изменения могут интерпретироваться следующим образом: V3 и V4 зависят от двух факторов – гипертрофии миоцитов и артериального притока.
Поскольку объем некроза у животных адаптированных, в частности, к стрессу, почти в 2 раза меньше, чем в контроле, – соответственно у них пропорционально менее выражена и гипертрофия сохранившегося миокарда. Поэтому рост капилляров уже к 15 сут создает адекватное пластическое обеспечение. В контроле это соотношение не нормализовалось и спустя 30 сут. Совершенно иная картина наблюдалась у животных с предоперационной барокамерной подготовкой. В этой группе лишь V2 через 5 сут достоверно снижался по сравнению с контролем.
Таблица І-5.
Значения переменного коэффициента K условной скорости диффузии кислорода (Vi= K? · T–1) через мембрану капилляров (V1), интерстициальное пространство (V2), мембрану кардиомиоцитов (V3) и саркоплазму (V4)
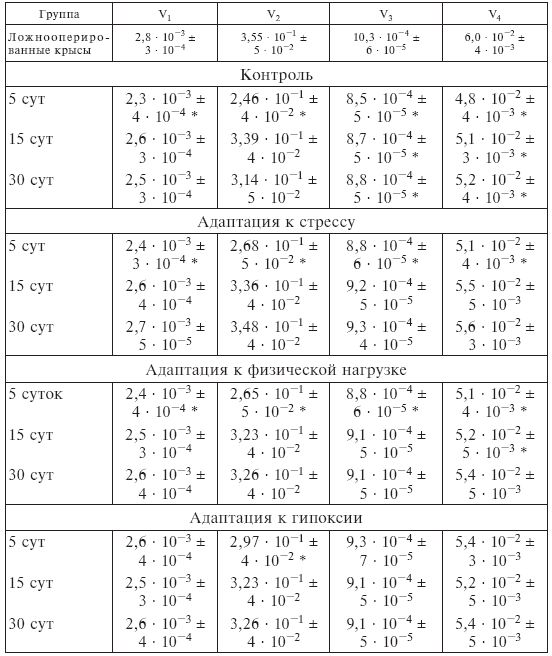
* p < 0,05 при сравнении с показателями ложнооперированных крыс.
Сосудистое русло животных, адаптированных к гипоксии, оказалось в наибольшей степени подготовленным к постстрессорным изменениям. Благодаря компенсаторному росту коронарных капилляров в процессе адаптации возможные патологические изменения в микроциркуляторном русле оказались практически нивелированными. Этим гарантируется адекватное пластическое обеспечение гиперфункционирующего внеинфарктного миокарда не позднее, чем к 5-му дню после ИМ.
Таким образом, представленные в табл. І-5 данные свидетельствуют, что предварительная адаптация к стрессу, физической нагрузке и гипоксии способствует ограничению альтерации внеинфарктного миокарда левого желудочка в результате стресса, сопутствующего наступлению циркуляторного некроза. Однако механизм защитного действия использованных вариантов тренинга различен. Адаптация к стрессу (иммобилизация животных на спине длительностью 15 мин – 1-й день, 30 мин – 2-й день, 45 мин – 3-й день и далее 5 раз по 1 ч через день) и физической нагрузке (принудительный бег в трет-бане по известной методике [2]) уменьшает повреждение за счет цитопротекторного действия, т. е. ограничения стрессреализующего механизма, а в случае адаптации к гипоксии (путем постепенного «подъема» животных в барокамере на высоту 5000 м над уровнем моря на 6 часов в день 5 раз в неделю на протяжении 6 недель) защита реализуется за счет заблаговременного усиленного роста коронарных коллатералей.
Выяснив, что защитное действие любых кардиопротекторов (в том числе неспецифического тренинга) при ИМ может реализоваться только двумя способами: через антистрессорные (цитопротекция) и собственно антиишемические (вазопролиферация) механизмы, было интересно использовать для этих целей витамины, известные как антистрессорными (витамин В1), так и сосудистыми (витамин РР) эффектами [13, 14]. Вероятность осложнений ИМ определяется величиной зоны некроза [116]. Размер некротического участка в миокарде детерминируется размерами зоны ишемии [103, 240], которые в решающей степени определяются чисто анатомическими факторами. Из этого следует, что лечебная коррекция здесь исходно затруднена [98]. А вот регуляция противоишемической устойчивости кардиомиоцитов, как показывает опыт (см. выше), представляется более доступной целью. Кроме того, исход ИМ в значительной мере определяется состоянием так называемого «неповрежденного» миокарда. Эти обстоятельства следует учитывать при оценке данных, характеризующих изменение размеров зон экспериментального ИМ (табл. І-6).
Таблица І-6.
Стереометрическая характеристика зон инфаркта миокарда у экспериментальных животных
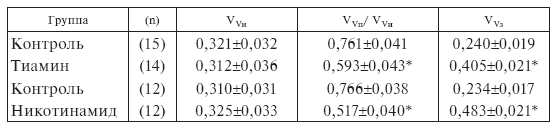
* Различия достоверны в сравнении с показателями контрольной группы – р < 0,05.
Отсутствие изменений удельного объема зоны ишемии (VVи) между контролем и опытом свидетельствует против активации коронарного кровообращения и усиленного развития артериальных коллатералей под влиянием тиамина и никотинамида. Наряду с этим оба препарата обнаруживают непосредственный цитопротекторный эффект, который документируется снижением доли зоны повреждения (некроза) в зоне ишемии (VVп /VVи) и адекватным повышением относительного объема зоны защиты (VVз), характеризующей размеры неинфарцированного миокарда в зоне ишемии. Совершенно очевидно, что ограничение исходного ИМ должно было привести и к уменьшению размеров рубца. Именно об этом свидетельствуют данные табл. І-4. На всем протяжении постинфарктного периода объемная доля зоны повреждения (ИМ и замещающего его рубца) оказывается меньшей, чем в контроле, что отражает кардиопротекторное действие Т (200 мг/кг подкожно за 2 ч до ИМ) и НА (50 мг/кг подкожно 12 раз с интервалом 48 ч). В табл. І-7 представлены также цифры, свидетельствующие о том, что у животных, получавших Т и НА перед моделированием ИМ, соотношение объемных плотностей коллагеновых волокон и продуцирующих их фибробластов увеличивается через 15 и 30 сут после операции, что свидетельствует о стимуляции фибробластической деятельности. При расчете коэффициентов корреляции между величинами относительного объема зоны повреждения и фибробластическим индексом была установлена жесткая обратная коррелятивная связь между ними (коэффициент колебался от –0,77 до –0,84). Из этого следует, что стимуляция созревания рубцовой ткани в инфарктной зоне достигается опосредованно, путем ограничения размеров самой зоны повреждения.
В результате защиты сердца Т и НА были отмечены положительные сдвиги в околоинфарктном миокарде (табл. І-4). В неповрежденном миокарде у контрольных животных наблюдается запустевание капилляров, что проявляется в уменьшении их диаметра. Подобная картина раньше была отмечена нами в миокарде животных, перенесших сильный стресс [169, 347]. Это явление следует объяснить снижением кровотока в результате контрактурного спазма артериол. То же самое имеет место и в «неповрежденном» миокарде под влиянием Т или НА. Разница в том, что у животных, получавших любой из витаминов, этот период короче.
Нарушения микроциркуляции в «неповрежденном» миокарде проявляются также и увеличением объемной плотности интерстициальной ткани (VVп). В основе этого явления лежит интерстициальный отек миокарда. Правда, ни Т, ни НА предотвратить его не могут. Возрастающие в постинфарктном периоде значения хорды сечения миоцитов (Lм) и меньшего их диаметра (Дм) могут объясняться либо внутриклеточным отеком, либо гипертрофией (см. выше). Методом интерферентометрии мы установили, что концентрация сухого вещества в кардиомиоцитах не уменьшается (что свидетельствовало бы об отеке), а остается практически постоянной, чем доказывается гипертрофия кардиомиоцитов. Причем процесс этот более выражен у контрольных животных, нежели у тех, которые получали Т или НА.
Таблица І-7.
Значения относительных объемов зоны повреждения (VVп), показатели фибробластической активности в рубце (ФИ), весовая доля жидкости в легочной ткани (?Р/Р) в течение постинфарктного периода
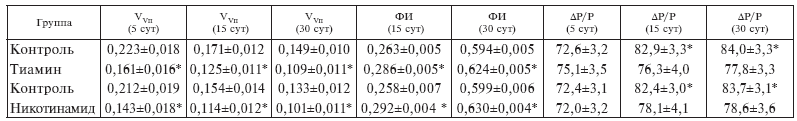
Примечания: 1) значения ?Р/Р даны в процентах; 2) * p < 0,05 при сравнении с контролем, а ?Р/Р – с показателем ложнооперированных крыс, который равен 73,1 ± 3,0.
В контроле достоверные признаки гипертрофии имеются уже к 15-му дню после ИМ, в то время как у крыс, получавших Т или НА, – только к тридцатому. По-видимому, больший объем ИМ у контрольных животных требует соответственно и большей гипертрофии миоцитов, при которой наступает нормализация относительной рабочей нагрузки на миокард.
Представленные выше данные показывают, что с помощью Т и НА нам удалось существенно ограничить размер инфарктного повреждения и оптимизировать некоторые морфофункциональные параметры неповрежденного миокарда. Эти сдвиги не могли положительно не сказаться на общей гемодинамике. В табл. І-7 показано, что у контрольных крыс отчетливо проявляется тенденция к накоплению жидкости в легочной ткани, что может являться признаком хронической левожелудочковой недостаточности. У животных, получавших витамин, этого не наблюдается, т. е. применявшееся у них лечение позволяет если не предотвратить, то по крайней мере отсрочить проявление такого грозного осложнения.
В связи с этим необходимо подчеркнуть, что несомненный эффект витаминотерапии в принятых условиях является следствием ограничения избыточной стрессорной реакции, которая имеет место во время развития острого ИМ [25]. Однотипные сдвиги были получены с помощью витаминов, влияющих на реализацию стресса прямо противоположным образом. Один из них (Т) действует как антистрессор [13], в то время как другой (НА) фактически является типичным стрессором [14]. Следовательно, механизмы действия обоих препаратов различны. При применении Т защита сердца достигается за счет оптимизации стресс-реакции, т. е. ограничения ее амплитуды [347], а в случае с НА мы, по существу, имеем дело с адаптацией к стрессу за счет создания относительно слабых повторяющихся фармакологических раздражений,
что и приводит к стимуляции стресслимитирующих систем [23].
Из табл. І-4 видно, что по кардиопротекторным свойствам Т не уступает самому эффективному из использованных нами фармакологических препаратов – блокатору медленного канала закачки внешнего Са2+ в клетку – верапамилу. Известно, что цитозольный Са2+ необходим для реализации действия стресс-гормонов на органы-мишени [156]. Ранее было показано, что метаболическая активность тиамина в тканях опосредуется антистрессорным гормоном инсулином [13]. Действие инсулина на клетку сопоставимо с эффектами атрактилозида – ингибитора выхода АТФ из митохондрий. Под влиянием атрактилозида органеллы становятся ареактивными к опосредуемым АДФ сигналам из цитозоля и работают только на себя. В результате вопреки катастрофическому уменьшению содержания адениловых нуклеотидов в цитозоле внутри митохондрий возрастает их сумма и отношение АТФ/АДФ или уровень ГТФ, что способствует тысячекратной активации синтеза белков митохондрий [71].
Инсулин активирует гликолиз [113] и сопряженную с гликолизом [98] работу внешней кальциевой помпы, откачивающей Са2+ из клетки [275]. Кроме того, он стимулирует внутриклеточный транспорт Са2+ в митохондрии [157], что в итоге приводит к снижению уровня цитозольного кальция и блокированию активности клетки. Под его воздействием с клеточной поверхности «снимаются» рецепторы, через которые осуществляется действие гормоновстимуляторов [71]. При дефиците Са2+ в цитозоле клетка становится ареактивной к адреналиновым, глюкагонным и глюкокортикоидным сигналам. Одновременно инсулин повышает вход глюкозы в клетку и стимулирует синтез из нее гликогена, липидов и аминокислот. Подобно атрактилозиду, инсулин, выключив функцию, активирует рост клеток, т. е. не только устраняет кардиотоксическое действие стресс-гормонов, но и осуществляет формирование «структурного следа адаптации» – компенсаторную гипертрофию неинфарцированного миокарда.
Кардиопротекторные свойства инсулина уже давно отмечены клиницистами, и начиная с 1950-х годов комбинация инсулина с глюкозой применяется для реанимации сердца после более или менее длительной остановки кровообращения, а также при сердечно-сосудистой недостаточности любого происхождения [82]. Четкий цитопротекторный эффект это средство оказывает на инфарцированный миокард [116]. Оно широко используется при лечении шоковых состояний, вызванных инфарктом миокарда [82]. Роль инсулина в развитии компенсаторной гипертрофии сердца [60, 62, 207] убедительно иллюстрируется хорошо известным в клинике отягчающим [60, 303, 332, 333], а нередко роковым влиянием инсулярной недостаточности на развитие основных заболеваний сердца: 70 % больных сахарным диабетом в США умирают от сердечной патологии [96]. Поэтому существует необходимость тщательного выявления и коррекции даже небольших нарушений функции инсулярного аппарата у сердечно-сосудистых больных [53, 60, 61, 302, 320, 329]. Способность Т активировать инсулинсинтетическую функцию поджелудочной железы [13] определяет его кардиопротекторные свойства и соответственно перспективы использования в кардиологической практике.
Из табл. І-6 видно, что НА более чем на треть (39 %) уменьшает объем зоны некроза и более чем в 2 раза (216 %) увеличивает объем зоны защиты инфарцированного миокарда у животных, подвергавшихся острой окклюзии коронарной артерии. Аналогичные результаты (39 и 211 %) ранее были получены нами после адаптации животных к иммобилизационному стрессу [103]. В обоих случаях антинекротическое действие реализуется одинаково по цитопротекторному, а не антиишемическому механизму, т. е. без изменения стереометрических параметров зоны ишемии, как это имело место после адаптации к гипоксии [103].
Адаптация к гипоксии ограничивает первичную ишемию за счет предшествующего роста коронарного русла [247]. Рост коронарного русла, по современным представлениям, определяется на молекулярном уровне специальными, генетически детерминированными факторами,
образующимися в увеличенном количестве при дефиците кислорода [98]. Этот антиишемический эффект адаптации сопровождался сравнительно небольшим повышением стабильности структур ишемизированной зоны к повреждению. Достигнутое в итоге значительное уменьшение размеров некроза было обусловлено, главным образом, антиишемическим (вазопролиферативным) эффектом [103].
При однократном введении большой дозы НА (200 мг/кг), вызывающем высокоамплитудную стрессорную реакцию [14], защитный кардиопротекторный эффект витамина не воспроизводится [24]. Для его реализации необходимо было существенно уменьшить дозу препарата (до 50 мг/кг), количество инъекций увеличить до 10–12 и выдерживать 48-часовой интервал между ними, т. е. перевести регуляторные системы организма в тренировочный режим адаптации к повторяющемуся мягкому фармакологическому раздражению.
Стресс по Г. Селье отражает только одну из сторон взаимоотношений организма со средой, а именно тот случай, когда сила постороннего влияния превышает нормальные физиологические границы. Из приведенных фактов следует, что существуют и неспецифические приспособительные реакции на слабые и умеренные раздражители. Согласно Л. Гаркави и др. [42], триада реакций «тренировка – активация – стресс» охватывает весь возможный диапазон раздражений, начиная с порога чувствительности и кончая предельными по силе воздействиями. «Реакция тренировки», как и стресс, последовательно проходит три стадии. Вначале организм как бы анализирует слабые воздействия, оценивает их. Защитные системы остаются при этом невредимыми, а возбудимость гипоталамуса и общая чувствительность организма уменьшаются (стадия ориентировки). Если интенсивность раздражения постепенно нарастает, деятельность нервной и эндокринной систем, а также обмен веществ постепенно перестраиваются. Стадию «перестройки» сменяет третья стадия – «тренированности», в которой заметно повышается активность защитных систем. В этом состоянии организм приобретает первичную резистентность к повреждающим агентам, причем не только тем, которыми его тренировали, но и многим другим.
Если же сила раздражителя заметно превышает «тренировочную», но при этом не достигает стрессового уровня, в ответ на него организм формирует неспецифическую «реакцию активации». В ее развитии тоже есть определенная последовательность. В стадии первичной активации в центральной нервной системе возникает умеренное возбуждение. Повышается возбудимость гипоталамуса, оживляется деятельность желез внутренней секреции, заметно ускоряется обмен веществ. Однако процессы эти хорошо уравновешены, а эндокринная система функционирует без патологии. Регулярное повторение такого среднего раздражения вызывает следующую фазу «стойкой активации». В это время организм успешно сопротивляется самым различным внешним и внутренним неблагоприятным воздействиям [20]. Поскольку речь идет о неспецифических реакциях организма, то совершенно очевидно, что спектр раздражителей, с помощью которых достигается защитный эффект, здесь, как и при стрессе, может быть достаточно широким и альтернативным. Полученные данные показывают, что НА является эффективным средством, обеспечивающим в терминах концепции Ф. Меерсона «совершенную адаптацию к стрессу», которая реализуется четким кардиопротекторным эффектом при окклюзионном ИМ.
В целом различия, обнаруженные в механизмах кардиопротекторного действия трех использованных адаптагенов (тиамина, никотинамида и гипоксии), весьма существенны, так как в перспективе создают возможность их рационального сочетания.






