3.3. Артериальная гипертензия
Повышение ангиопротекторного действия небилета витаминами В1и С при артериальной гипертензии. В этиологии артериальной гипертензии (АГ), фактором риска которой является инсулинозависимый сахарный диабет [339], увеличивающий чувствительность к стрессу [63], важную роль играют стрессорный адренергический спазм сосудов [98] и дисфункция их эндотелия, приводящая к нарушению продукции NO, что сопровождается вазоконстрикцией [92]. Поэтому патогенетически при АГ обосновано применение антистрессора небиволола (небилета), который представляет собой смесь D– и L-изомеров: первый устраняет адреноспазм через блокаду ?-адренорецепторов, а второй устраняет дефицит NO через стимуляцию его высвобождения из депо [201, 328].
Исходя из того, что тиамин является модулятором синтеза инсулина [13], снижающего образование кортикостероидов и катехоламинов в надпочечниках [355], а аскорбиновая кислота способна самостоятельно высвобождать оксид азота из NO-доноров [37], было интересно использовать сочетанное применение небилета и тиамина, а также небилета и аскорбиновой кислоты в лечении АГ. Целью исследования была сравнительная оценка влияния небилета и его сочетаний с витаминами В1 и С на уровень артериального давления (АД), центральную гемодинамику (ЦГД) и агрегацию тромбоцитов с последующей расшифровкой механизмов обнаруженных сдвигов.
В результате 7-дневного лечения больных АГ небилетом произошло снижение систолического АД (САД) на 15,8 % (р < 0,05), причем более выраженное антигипертензивное действие препарата реализовалось к концу 2-й недели от начала лечения – 20,5 % (р < 0,05). Диастолическое АД (ДАД) в эти же сроки снижалось соответственно на 11,0 % (р > 0,05) и 14,0 % (р < 0,1 > 0,05).
Гипотензивный эффект в конце монотерапии небилетом был хорошим у 6 больных (40 %), удовлетворительным у 5 (33 %), неудовлетворительным у 4 (27 %). Нормализация АД (до величины ниже 140/90 мм рт. ст.) была зафиксирована в среднем у 73 % пациентов.
При сочетанном применении небилета и аскорбиновой кислоты к концу первой недели лечения САД снижалось на 16,4 % (р < 0,05), к концу второй – на 24,0 % (р < 0,05), а ДАД – соответственно – на 15,0 % (р < 0,05) и 18,0 % (р < 0,05). Гипотензивный эффект в конце комбинированного лечения был отличным у 2 больных (13 %), хорошим – у 8 (53 %), удовлетворительным – у 4 (27 %) и неудовлетворительным – у 1(7 %). Нормализация АД (ниже 140/90 мм рт. ст.) была зафиксирована у 93 % пациентов.
Аналогичные результаты были получены при сочетанном применении небилета и тиамина (табл. І-12).
Из данных, представленных в табл. І-12, следует, что витамины В1 и С существенно увеличивают эффективность антигипертензивного действия небилета. Показательным в этом отношении является нормализующий эффект комбинированного лечения АГ на уровень ДАД, чего фактически не обеспечивает монотерапия небилетом.
Таблица І-12.
Изменение систолического АД (САД) и диастолического АД (ДАД) при лечении больных АГ небилетом (Н) в сочетании с аскорбиновой кислотой (АК) и тиамином (В1)
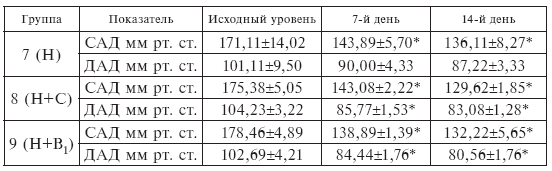
* Достоверное отличие между группами – р < 0,05.
Гипотензивный эффект во всех случаях был обусловлен снижением общего периферического сосудистого сопротивления и сопровождался позитивной динамикой основных параметров насосной функции сердца (снижение ЧСС, МРС, УРС – табл. І-13), а также оптимизацией реологических свойств крови (снижение скорости и степени агрегации тромбоцитов – табл. І-14).
Таким образом, комбинация небилета с витаминами В1 и С заметно улучшила результаты лечения больных с АГ.
При назначении небилета у здоровых лиц продемонстрировано снижение сосудистой резистентности (артериальных и венозных сосудов), что не было связано с ?-блокирующим эффектом препарата, о чем свидетельствует снижение кровотока [197] после введения этим лицам ингибитора NO-синтетазы (L-NMMA). В то же время вазодилятация, вызванная введением нитропруссида натрия (донор NO), не ингибировалась с помощью L-NMMA. Последнее доказывает, что небилет вызывает вазорелаксацию, воздействуя на систему L-аргинин – NO. Механизм активации NO-синтетазы небилетом пока неизвестен, однако он не связан с блокадой ?-адренорецепторов, 5-НТIA-рецепторов, в то же время не исключено его антиоксидантное действие на стабилизацию NO [197].
Таблица І-13.
Изменение центральной гемодинамики при лечении больных артериальной гипертензией небилетом (Н) в сочетании с аскорбиновой кислотой (АК) и тиамином (Т)
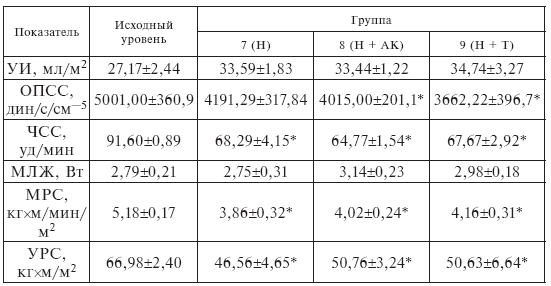
Таблица І-14.
Изменение агрегации тромбоцитов при лечении больных артериальной гипертензией небилетом (Н) в сочетании с аскорбиновой кислотой (АК) и тиамином (Т)
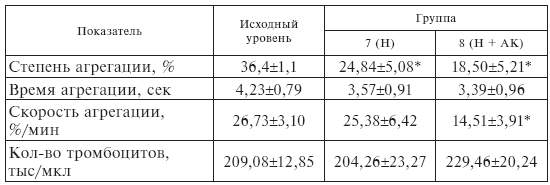
* Достоверные сдвиги – р < 0,05.
Главный фактор, инактивирующий NO, ограничивающий его миграцию и снижающий его концентрацию, – это супероксидный радикал О2 [183]. В кровеносной системе увеличение продукции О2 фагоцитирующими или эндотелиальными клетками (в период перехода от ишемии к реперфузии) провоцирует спазм. Предотвращение инактивации NO супероксидом объясняет способность супероксиддисмутазы улучшать микроциркуляцию при воспалительных процессах и нормализовать кровоток после тромбозов, вазоспазма и других нарушений кровообращения [64]. Поскольку одной из причин снижения продукции эндотелиального NO может быть усиленная генерация свободных радикалов [174], не исключено, что введение аскорбиновой кислоты, повышая мощность антиоксидантной защиты, также способно предупредить это явление. Прием антиоксидантов (витамин С) способствует восстановлению функции эндотелия и тормозит утолщение интимы сонной артерии [257], снижает деградацию NO перекисными радикалами у больных с гиперхолестеринемией [338], сахарным диабетом [337], курением [235], ишемической болезнью сердца [257] и артериальной гипертонией [321].
Кроме того, супероксид может влиять на эффективность вазодилятаторного действия NO. Двукратное повышение активных форм кислорода обнаружено в аорте кролика с интактным эндотелием при развитии толерантности к экзогенным донорам NO (нитратам) после наложения им пластыря с нитроглицерином [279]. Исходя из значения окислительного стресса в развитии толерантности к нитратам [176], обращают на себя внимание обнадеживающие результаты применения антиоксидантов для ее профилактики. В экспериментах аскорбиновая кислота полностью предупреждала развитие толерантности к нитратам на уровне эпикардиальных отделов коронарных артерий и в венозной системе [278]. При длительном применении нитратов она предупреждает развитие апрегуляции (повышение плотности рецепторов) активности тромбоцитов, проявляющейся повышением содержания внутриклеточного иона калия, стимулированного тромбином, и повышением микровязкости мембран тромбоцитов. А у больных с коронарной болезнью сердца, получавших трансдермальные пластыри с нитроглицерином, витамин С предотвращал повышение содержания в моче нитротирозина, вызываемого продукцией пероксинитрита, который является промежуточным продуктом метаболизма в организме оксида азота [108].
Являясь сильным восстановителем, аскорбиновая кислота in vitro дозозависимо усиливает выделение NO из состава NaNO2,, нитроглицерина и крови больных ИБС, что зафиксировано с помощью реакции нитрозилирования дезоксигемоглобина, которая сопровождается характерным изменением его спектра поглощения. Это означает, что витамин С может использоваться в клинике для усиления лечебного действия NO-доноров [37].
Известно, что продукты неферментативного гликозилирования белков крови, накапливающиеся при гипергликемии, связывают NO и препятствуют нормальному функционированию механизмов ауторегуляции кровотока [151]. Предполагается, что блокирование этих механизмов окисленными липопротеинами вносит вклад в развитие гемоциркуляторных нарушений при сахарном диабете [217]. В снижении эндотелийзависимой вазодилятации участвуют усиление образования супероксидных радикалов и чрезмерная активность протеинкиназы С, что, по-видимому, также связано с гипергликемией. Реакция периферических артерий у больных инсулинзависимым сахарным диабетом на введение метахолина восстанавливается на фоне инфузии витамина С, что подтверждает роль супероксидных радикалов в нарушении функции эндотелия [339]. Инсулин восстанавливает функцию эндотелия у больных сахарным диабетом [59], причем это может происходить не без участия аскорбиновой кислоты.
Существует гипотеза об определяющей роли витамина С в развитии диабетической ангиопатии [265]. По мнению авторов, инсулин участвует в механизмах, обеспечивающих поступление аскорбиновой кислоты в клетки некоторых тканей. При недостаточности инсулина развивается местный авитаминоз, который обусловливает появление сосудистой патологии. В свою очередь, АК, повышая освобождение оксида азота из тканевых депо, где он запасается в форме динитрозильных комплексов железа и нитрозотиолов [11], восстанавливая за счет устранения дисфункции эндотелия базальный синтез NO [174, 257], а также предотвращая его последующее разрушение супероксидными радикалами [337], очевидно, может активировать инсулиногенез в ?-клетках поджелудочной железы по NO-зависимому механизму. Показано, что субстрат (аргинин) и продукт (оксид азота) NO-синтетазной реакции являются мощными индукторами биосинтеза инсулина [197, 198]. Отюда не исключено, что ангиопротекторный механизм действия АК может обусловливать потенцирование NO-составляющей антигипертензивной активности небилета, который, как и инсулин, фактически является антистрессором: первый блокирует рецепцию катехоламинов [343], а второй – их новообразование [355].
При оценке влияния различных стрессоров на продукцию NO разные авторы обнаруживали как ее увеличение, так и снижение [90]. Увеличение генерации NO, как правило, имело место при кратковременном или умеренном раздражении, а уменьшение – при хроническом повреждающем стрессе. Поэтому не исключено, что фазовый характер отмеченных сдвигов NO-синтазы отражает соответствующую динамику развития стрессорной реакции, когда в фазу напряжения и резистентности биосинтез NO повышается, а в фазу истощения – снижается [90]. Поскольку развитие сердечно-сосудистых заболеваний, включая АГ, где стресс играет важную патогенетическую роль, сопровождается снижением мощности систем генерации NO [291], сочетанное применение активаторов NO-синтазы (небилет), а также средств, увеличивающих высвобождение депонированного NO и предохраняющих только что новообразованный и отмобилизованный оксид азота от разрушения супероксидными радикалами (аскорбиновая кислота), представляется целесообразным.
Общепринято, что сосудорасширяющее действие оксида азота связано с активацией растворимой гемсодержащей гуанилатциклазы за счет образования комплекса нитрозил – гем, который является истинным активатором фермента [139], и с накоплением цГМФ. В процессе расслабления сосуда под действием цГМФ ключевую роль играют цГМФ-зависимая протеинкиназа, а также ингибирование высвобождения Са2+, стимуляция обратного захвата клеточного кальция и гиперполяризация мембраны за счет открытия калиевых каналов [38]. Тождественные сдвиги в мышечной ткани вызывает инсулин в физиологических концентрациях. Он увеличивает в клетках-мишенях содержание цГМФ и активирует цГМФ– зависимые реакции [241], блокирует Са2+-насос [294] и стимулирует обратный захват кальция митохондриями [71], вызывает гиперполяризацию скелетных мышц [361] и увеличивает транспорт внеклеточного калия в миоциты [275].
Изменение трансмембранного потенциала под влиянием инсулина происходит очень быстро – уже через 1 с после нанесения гормона на мышечное волокно [361]. В связи с этим предполагается, что гиперполяризация мембран, индуцируемая инсулином, является первым звеном в цепи последовательных сигналов, следующих от гормон-рецепторных комплексов к эффекторным системам и ведущих к монополизации регуляторных механизмов, вследствие чего развивается ареактивность клеток к конринсулярным стрессорным гормонам. Интересны результаты сравнения инсулининдуцируемых сдвигов с действием блокатора ?-рецепторов адреналина – пропранолола. Оказалось, что по внешнему эффекту они практически неотличимы: инсулин полностью снимал чувствительность к адреналину, что может быть обусловлено снижением уровня цАМФ и стимуляцией входа кальция в митохондрии. Благодаря этому понижается уровень кальция в цитозоле, а его присутствие необходимо для реализации ионного эффекта при активации аденилатциклазы [71].
Исходя из того, что гормонообразование в инсулоцитах лимитируется синтезом дисульфидных связей [354], а NO является мощным катализатором образования дисульфидных мостиков [56], становятся понятными причины его инсулинотропности [64]. Сопоставляя эти факты с вышеизложенным, можно допустить, что инсулин, очевидно, способен «взять на себя» реализацию значительной доли спектра биологической активности оксида азота в том числе и в части обеспечения вазодилятации и стресслимитирующей функции NO.
Отсюда применение небилета, модулирующего генерацию NO, а через него и синтез инсулина, получает еще одно патогенетическое обоснование. То же самое относится и к аскорбиновой кислоте. В экспериментах на аллоксандиабетических крысах показано, что двухнедельное применение АК в больших дозах (1–1,5 г/кг) нормализует нарушения углеводного и липидного обмена, обусловленные дефицитом инсулина [313]. Защитное действие АК, очевидно, связано с реабилитацией инсулиногенеза через восстановление SH-групп в островках Лангерганса поджелудочной железы, заблокированных аллоксаном [81]. Инсулинотропная активность АК широко используется в терапии сосудистых нарушений, обусловленных инсулярной недостаточностью. Реакция периферических артерий у больных инсулинзависимым сахарным диабетом на введение метахолина восстанавливается на фоне инфузии витамина С, что подчеркивает, во-первых, роль супероксидных радикалов в нарушении функции эндотелия, а во-вторых, инсулиногенную составляющую в действии АК, поскольку инсулин также восстанавливает функцию эндотелия у этих больных [59].
В отличие от аскорбиновой кислоты тиамин не обладает выраженными антиоксидантными свойствами и не способен инициировать освобождение NO из депо [150]. Более того, есть данные, что он является антагонистом ацетилхолина – признанного эндогенного модулятора NO-синтазы [271]. В связи с этим потенцирование тиамином антигипертензивного действия небилета может быть обусловлено, прежде всего, бесспорной собственной инсулинотропной активностью витамина, т. е. реализуется через механизм гормонального опосредования [13].
Антиагрегационные свойства оксида азота лимитируются активацией растворимой гуанилатциклазы, новообразованием цГМФ и цГМФ-зависимым торможением накопления Са2+ в тромбоцитах [204]. Однако учитывая, что все циркулирующие клетки крови, в том числе тромбоциты, содержат рецепторы инсулина [91], легко допустить его участие и в дезагрегационном процессе, поскольку тромбоциты больных сахарным диабетом I типа характеризуются повышенной способностью к агрегации [139].
Считается, что антигипертензивные и антиагрегационные свойства оксида азота обусловлены в конечном итоге транзиторной цГМФ-зависимой «декальцификацией» миоцитов и тромбоцитов. Однако не исключено, что последняя в значительной степени может быть опосредована также прямым действием инсулина, способного снижать концентрацию Са2+ в цитозоле эффекторных клеток за счет повышения его захвата митохондриями [71], а также через увеличение обмена внутриклеточного Са2+ на внеклеточный Na+[85].
Роль гормонального опосредования становится более очевидной, если принять во внимание факты, противоречащие цГМФ-зависимому механизму антигипертензивного действия NO. Дело в том, что не все авторы разделяют мнение об цГМФ как медиаторе расслабления гладкомышечных клеток. Есть и такие, кто придерживается прямо противоположных взглядов на цГМФ как на фактор их сокращения. Первые указания на изменения в системе циклических нуклеотидов при спонтанной генетической гипертонии были получены в опытах на полосках гладкомышечных клеток сосудов, где было выявлено уменьшение содержания цАМФ в гомогенате аорты крыс SHR. В дальнейшем было показано, что у крыс SHR и у животных со стресс-формой генетической гипертензии наряду с уменьшением содержания цАМФ в гомогенате аорты наблюдается увеличение концентрации цГМФ [131]. На основании полученных данных была сформулирована гипотеза о ведущей роли нарушений системы циклических нуклеотидов (уменьшение соотношения цАМФ/цГМФ) в становлении нарушений контрактильности, реактивности и чувствительности клеток гладкой мускулатуры сосудов при артериальной гипертензии. При этом исходили из того, что в ряде случаев агенты, увеличивающие содержание цАМФ, приводят к расслаблению гладкой мускулатуры, а увеличивающие уровень цГМФ, – напротив, к ее сокращению [233].
Аналогичная гипотеза существует и в отношении сердечной мышцы, где цГМФ рассматривается как локальный медиатор возбуждения (сокращения), а цГМФ – расслабления (покоя) [249]. Ее экспериментальное подтверждение тоже не заставило ждать. Был обнаружен антагонизм в действии цГМФ и цАМФ на сердце, показано сокращающее действие цГМФ (дибутирильной формы, легко проникающей через мембрану) на мышцу подвздошной кишки [331] и препятствующее сокращению или расслабляющее действие цАМФ на мышечные препараты аорты или прямой кишки [242].
Не все ясно и в вопросе о влиянии цГМФ на функционирование Са2+-насоса в мышцах, поскольку одни авторы считают, что «накапливающийся цГМФ активирует цГМФ-зависимую протеинкиназу, а также Са2+-АТ-Фазу, участвующую в дефосфорилировании легких цепей миозина, что приводит к выходу Са2+ из мышечных клеток и в конечном счете к вазодилятации» [139]. Другие, наоборот, утверждают, что цГМФ блокирует Са2+-АТФазу: «в процессе расслабления сосуда под действием цГМФ ключевую роль играют цГМФ-зависимая протеинкиназа, а также ингибирование высвобождения кальция» [38].
На этом фоне «разнобоя» мнений предпочтительнее выглядит представление о том, что антигипертензивное действие NO in vivo в значительной степени может быть опосредовано инсулином, стимулирующим транспорт Са2+ в митохондрии [71], которые, являясь мощными депонентами цитозольного катиона, способны лимитировать процесс расслабления гладких мышц [86]. Благодаря антистрессорному действию инсулина [15] и способности этого гормона оптимизировать внутриклеточный гомеостаз Са2+ [275] его антигипертензивная активность может быть объяснена исходя из мембранной концепции патогенеза АГ. Известно, что в ее основе лежит представление о нарушении структуры и ионтранспортной функции клеточных мембран, проявляющееся снижением их способности (недостаточности) поддерживать в цитоплазме клеток нормальные величины градиента концентраций важнейших ионов (Na+, K+, Ca2+, Mg2+) по отношению к внеклеточной среде [130]. Ключевым по значимости следствием мембранного дефекта является кальциевая перегрузка клетки, которая для сохранения своей функции вынуждена работать в новом режиме клеточно-гормональных отношений, названном «перенастройкой», или ресетингом, клетки. Вследствие этого вся совокупность перенастроенных клеток, составляющих ткани, воздействует на системы нейрогормональной интеграции как бы изнутри – со стороны клеточной мишени, изменяя активность симпатической нервной системы, гипоталамо-гипофизарно-надпочечниковой системы и вызывая инволюцию инсулярного аппарата [130]. Поскольку развитие АГ характеризуется преобладанием стрессреализующих систем над стресслимитирующими, сочетанное применение модуляторов антистрессорных механизмов (небилет и АК, небилет и тиамин) для лечения гипертензии представляется оправданным и патогенетически обоснованным.






