5.4. Тиамин и генетический триггер лимфоцитов при стрессе
Наглядным примером тесной корреляции между дифференцировкой и делением лимфоцитов служит четкий инверсный ритм их суточной периодичности [77]. Наследуемый в соответствии с законом Г. Менделя о независимом распределении родительских признаков эндогенный ритм циркадных «волн митоза», или синхронного кариокинеза и дифференцировки, является очень устойчивым, однако циклическая природа роста и деления клеток позволяет им изменять степень синхронности с помощью внешних периодических сигналов, и этот триггерный тип поведения может объяснять в общих чертах суточные сдвиги митотической активности и синтеза ДНК, наблюдаемые в лимфоидном ростке крови.
В роли синхронизаторов биоритмов вообще и циркадного ритма митозов в частности могут выступать не только эффекторы дифференцировки – АКТГ, кортикостероиды, адреналин [232, 245, 302], но и эффекторы пролиферации – инсулин, тиреоидин, эстрогены [48, 349]. Биологический смысл реципрокной регуляции генома промоторами дифференцировки и пролиферации состоит не только в целесообразности дубляжа систем управления синхронизацией циркадных ритмов митоза, но и в ее гомеостатических функциях – стабилизации оптимального уровня деления клеток путем устранения апериодических возмущающих влияний противонаправленным действием на генетический триггер [22]. Факт осцилляций митотической активности тканей на разных этапах стресса был установлен еще Г. Селье, который указывал, что стадия тревоги характеризуется угнетением митотических делений, в стадии резистентности имеется обилие митотических фигур, а в стадии истощения их число снова уменьшается [153].
Поскольку фазовая пролиферация лимфоцитов крови крыс в динамике истощающего иммобилизационного стресса по Селье также является векторной функцией реципрокного плейотропного действия стрессреализующих и стресслимитирующих гормонов [104], было интересно оценить влияние на нее тиамина, который в отношении других эффекторных клеток-мишеней (гепатоциты, кардиомиоциты, кортикоциты) при аналогичном раздражении производил выраженный гомеостатический эффект [23].
Для анализа выделим следующие результаты, полученные при исследовании модели хронического стресса: во-первых, снижение пролиферативной активности лимфоцитов в первые 48 ч опыта (рис. II-15). Это соответствует данным литературы об иммуносупрессорном действии иммобилизационного стресса [86, 104]. Тиамин активирует включение меченого тимидина в ДНК на 1 ч и 48 ч опыта, что может быть оценено как проявление иммуномодуляции; во-вторых, повышение уровня 11-ОКС в крови в течение всего опыта, что, очевидно, является причиной иммуносупрессии (рис. II-19). Тиамин уменьшает амплитуду стероидогенной реакции, проявляет обычное свое антистрессорное действие, как и при любом другом виде стресса [23].
В-третьих, отчетливое дублирование колебаний пролиферативной активности лимфоцитов (рис. II-15) и осцилляций уровня ИРИ в крови крыс во все фазы иммобилизационного стресса (рис. II-22). Одинаковый синфазный ритм инсулиногенеза и синтеза ДНК в эффекторных клетках в динамике развития стрессорной реакции до и после нагрузок тиамином свидетельствует о том, что сдвиги пролиферации в обоих случаях – это инсулининдуцируемые изменения и что плейотропный эффект витамина В1 является гормональноопосредованным.
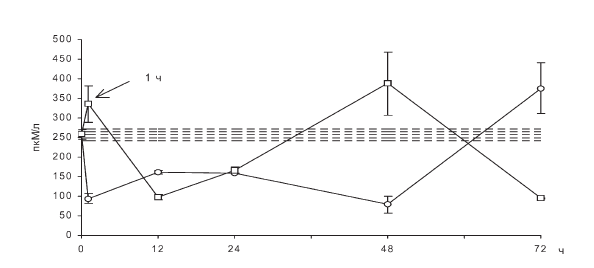
Рис. II-22. Содержание ИРИ (пкМ/л) в крови крыс в динамике хронического стресса до (?) и после () введения тиамина. По оси абсцисс – срок наблюдения, по оси ординат – единицы измерения. Заштрихованные участки – доверительные границы нормы. Достоверные сдвиги (р<0,05) обозначены звездочкой
Тиамин повышает инсулинсинтетическую функцию поджелудочной железы и оказывает выраженное инсулиноподобное действие на обмен веществ, в том числе и в отношении показателей, являющихся маркерными на действие инсулина [430]. Обусловленный тиамином сдвиг «влево» стрессорного ритма секреции инсулина (рис. II-22) и соответственно инсулинзависимого ритма пролиферативной активности лимфоцитов (рис. II-15), очевидно, связан с тем, что инсулинотропное действие витамина проявляется с наибольшей эффективностью, прежде всего на гипоинсулиновом фоне [23], в том числе на фоне «транзиторного диабета напряжения», который сопутствует стрессу [131].
Этот минимальный набор данных позволяет сформулировать рабочую гипотезу триггерного механизма, обсуждение которого целесообразно начать с уже детально изученного [215] клеточного цикла эукариот (фазы M, G0, G1, S и G2).
Во время прохождения клетками метаболического пути от М до М наблюдаются критические моменты, чрезвычайно важные для регуляции деления, – «точки ограничения R» [48]. Согласно [378], в момент R в клетках, находящихся в фазе G1, срабатывает специфический регуляторный механизм переключения из состояния покоя в состояние деления и обратно. Добавляя в среду различные гормоны, можно воздействовать на процесс деления клеток, который обеспечивается магистральным переключением всего типа обмена дифференцированных клеток на синтез биополимеров, необходимых для построения митотического аппарата. Последнее предполагает фундаментальную перестройку белкового спектра ферментов (за счет включения реципрокного механизма репрессии – дерепрессии синтеза ферментных ансамблей), определяющих новый тип обменной активности клетки, в том числе переключение энергии с одного русла на другое в интересах пролиферации [244]. Естественно, что подобное переключение возможно и в обратную сторону,т. е. в направлении дифференцировки клетки благодаря избирательному действию гормонов.
Приведенная на рис. II-23 схема перекрестной регуляции дифференцировки и пролиферации лимфоидных клеток крови крыс при стрессе фактически описывает генетический триггер, который в зависимости от природы и степени сродства управляющих сигналов может работать как рубильник-переключатель реципрокных оперонов, «перебрасывающий» жизнедеятельность системы из одного стационарного состояния в другое. Согласно [111], триггеры, т. е. системы, способные неопределенно долго находиться в любом из двух возможных устойчивых пограничных состояний, играют большую роль в механизмах биологической регуляции.
Настоящая модель учитывает представления о перекрестной регуляции дифференцировки и пролиферации по механизму обратной связи, который осуществляется при соединении эффектора с соответствующим репрессором функционального и митотического оперонов [111], кейлонную гипотезу [244], где важную роль в реализации механизма обратной связи, лимитирующего пролиферацию, играют циклические нуклеотиды (цАМФ) и стрессорные гормоны, а также данные о том, что инсулин и гидрокортизон являются соответственно индукторами пролиферации и дифференцировки клеток молочной железы [349] и могут разнонаправленно влиять на содержание цГМФ и цАМФ в лимфоцитах как in vivo, так и in vitro [86].
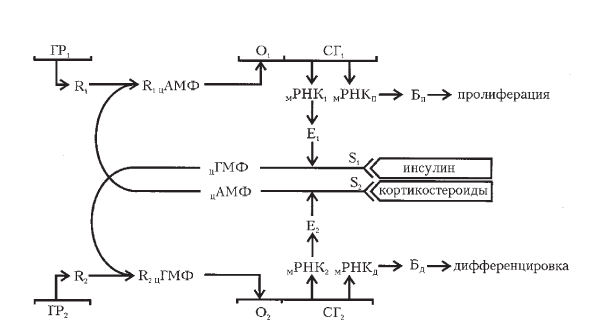
Рис. II-23. Гипотетическая схема функционирования генетического триггера лимфоцитов крови крыс при стрессе. ГR1 и ГR2 – генырегуляторы, R1 и R2 – репрессоры, R1цАМФ – комплекс R1+цАМФ, R2цГМФ – комплекс R2+цГМФ, О1 и О2 – операторы, СГ1 и СГ2 – структурные гены, Бп – белки пролиферации, Бд – белки дифференцировки, Е1 – аденилатциклаза, Е2 – гуанилатциклаза. Остальные пояснения в тексте
Стрессреализующие (адреналин – кортикостероиды) и стресслимитирующие (инсулин) гормоны, активируя мембранные или цитоплазматические рецепторы (S1 и S2), синергично с ферментами Е2 (аденилатциклаза) и Е1 (гуанилатциклаза) инициируют производство внутриклеточных посредников (циклические нуклеотиды). Далее в соответствии с концепцией оперона цАМФ – корепрессор синтеза Е1, соединяясь с репрессором R1, блокирует оператор структурного гена О1, препятствуя образованию мРНК1, мРНКП и митотических белков (РМ). А цГМФ – корепрессор синтеза Е2 вместе с R2 репрессирует синтез мРНК2, мРНКД и специфических функциональных белков (РД).
Динамика существенных переменных в этой симметричной модели триггера описывается следующей системой дифференциальных уравнений.
Изменение концентрации мРНК соответствует
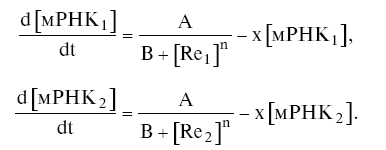
Член А / (В + [Re]n) представляет собой скорость синтеза мРНК на ДНК, которая пропорциональна вероятности застать оперон свободным. Последняя, в свою очередь, лимитируется концентрацией свободного репрессора Re1. А и В – постоянные, зависящие от констант скорости реакции А = В = k—1/k1. Поскольку неактивный репрессор находится в избытке, n – концентрация активного репрессора будет пропорциональна количеству корепрессора в другой половине системы, которое, в свою очередь, пропорционально количеству фермента в той же половине системы. Тогда для n = 2 (n > 1 – условие триггерности исследуемой модели) получим:
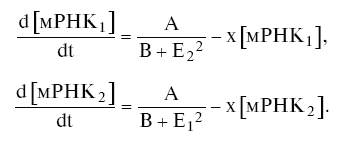
Изменение концентрации ферментов описывается уравнениями
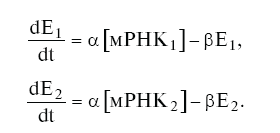
В любом из двух устойчивых состояний амплитуда триггера (отношение цАМФ / цГМФ) зависит в основном от интенсивности синтеза мРНК. Варьируя этот параметр, можно получить любое отношение специфических корепрессоров в стационаре. Для переключения триггера путем специфического (гормонального) сигнала необходимо хотя бы на очень короткий период изменить концентрацию соответствующего специфического вещества (корепрессора, фермента или мРНК) по меньшей мере во столько раз, какова амплитуда триггера. Далее система сама переходит в другой режим за счет механизма собственного подкрепления (реципрокное увеличение синтеза соответствующего корепрессора).
Представленная схема общего типа взаимодействия между указанными группами генов предельно упрощена, ее не следует понимать буквально, однако она решает поставленную задачу – позволяет рассмотреть динамическое поведение системы. Согласно схеме, гены связаны с различными клеточными функциями и со средой через специфические рецепторы, которые могут реагировать на гормональные сигналы и изменять внутриклеточное состояние. Связывание гормонального эффектора дифференцировки (стрессреализующие гормоны) с рецепторным аппаратом лимфоцитов вызовет увеличение в них уровня цАМФ и соответственно блокирование белков митоза, что может привести к новому стационарному состоянию с пониженной скоростью пролиферации и постепенному дрейфу системы в направлении дифференцировки. При этом в результате репрессии митотического оперона клеточного цикла и снижения уровня цГМФ, подавляющего вместе с R2 оперон дифференцировки, будет производиться все больше и больше цАМФ (и соответственно R1цАМФ), что в конце концов приведет к полному прекращению пролиферации и остановке клеточного цикла.
С другой стороны, связывание митогенных факторов роста (инсулин) с рецепторами клеточной мембраны через повышение в лимфоцитах уровня цГМФ будет с зеркальной точностью инициировать пролиферацию в ущерб дифференцировке.
О митогенной активности инсулина свидетельствуют следующие факты. На клетках печени показано, что действие инсулина можно воспроизвести с помощью бивалентных антител к его рецептору или их бивалентных фрагментов F(ab?)2-фрагментов, способных «сшивать» на поверхности клетки-мишени несколько рецепторов для этого гормона. Моновалентные Fab-фрагменты способны лишь блокировать связывание инсулина рецепторами, однако если восстановить бивалентность, добавив в среду инкубации еще антитела против Fab?-фрагментов, то снова обнаруживаются те же инсулиноподобные эффекты. Действие субоптимальных концентраций инсулина заметно увеличивается после добавления в среду антител к этому полипептиду [327]. Следовательно «сшивка» рецепторов имитирует и лимитирует эффект гормона.
Инкубация флуоресцентно меченого инсулина с лимфоцитами приводит к образованию на их поверхности «шапок» (cap) [399]. Такие же образования (caps) обнаружены при инкубации лимфоцитов с аналогично мечеными антителами к инсулиновым рецепторам. По данным Шлессингера, сразу после взаимодействия инсулина с клетками (в течение 1 с) в результате локальной агрегации образуются микрокластеры, невидимые под микроскопом, которые затем разрастаются до хорошо различимых флуоресцирующих пятен, содержащих сотни рецепторных молекул. В течение короткого времени от нескольких секунд до 10 мин процесс кластеризации охватывает всю клеточную поверхность и включает в себя движение гормонрецепторных комплексов на расстояние до нескольких микрон. Такая агрегация является обязательным условием для нормального протекания процессов интернализации [399].
Существенно, что инсулин сам способен регулировать экспрессию собственных рецепторов на поверхности лимфоцитов, лимитирующей пролиферацию [98].
Важность гормонального контроля пролиферации иммунокомпетентных клеток подчеркивает тот факт, что экспрессия инсулиновых рецепторов на лимфоцитах увеличивается при любой активации их клеточного цикла: в смешанной культуре [309], при использовании антигенов или поликлональных митогенов [433]. Методом проточной цитометрии установлено, что на разных фазах клеточного цикла стимулированные ФГА лимфоциты несут разное число рецепторов для инсулина – в фазе G0 – 35, в фазе G1a – 465, в фазе G1b – 5554 [433].
С помощью специфических антител против ФГА доказано, что этот лектин в отсутствие макрофагов «включает» только процесс выхода клеток из состояния покоя в цикл клеточного деления, что на языке символов может быть обозначено как (G0/G1) переход [132].
Считается, что in vivo инициирующим механизмом включения (G0/G1) перехода является физиологическая недостаточность данного типа клеток, при этом избыток одного из внешних факторов становится выше определенного критического уровня и инициирует цикл [42]. Сам по себе (G0/G1) переход обычно не приводит к пролиферации. Для ее запуска необходим дополнительный сигнал, включающий следующий и основной (G1/S) переход. Инициация S-фазы и включение механизма синтеза ДНК является результатом действия на клетку второго сигнала, который может быть представлен специфическими активирующими факторами или неспецифическими агентами, содержащимися в сыворотке крови [42].
Поскольку существуют веские экспериментальные доказательства включения (G0/G1) и (G1/S) переходов при импульсной активации гуанилатциклазы и (или) угнетении аденилатциклазы [236], становится очевидным, что роль первого и второго сигналов может выполнять один и тот же эффектор, например Кон-А, способный повышать уровень цГМФ в лимфоцитах. Данный лектин отличается настолько высоким сродством к рецептору инсулина, что Кон-А-сефарозу используют для выделения этих рецепторов [264], а его митогенная активность не зависит от присутствия макрофагов или их продуктов [434]. Последнее означает, что Кон-А «включает» оба перехода (G0/G1) и (G1/S), и его действие имитирует инсулиновый механизм активации пролиферации, так как осуществляется через «сшивание» инсулиновых рецепторов и активацию гуанилатциклазы [132]. Сукцинил-Кон-А, не обладающий митогенной активностью, предотвращает постмитотическую трансформацию фагоцитов в ранней фазе G1, что приводит к стабилизации фазы покоя.
Для деблокирования (G0/G1) перехода клеток в позднюю фазу G1 необходимо было отмыть их от сукцинил-Кон-А и добавить инсулин [358]. Отсюда не исключено, что в условиях организма этот гормон, в определенных концентрациях постоянно присутствующий в крови, может исполнять роль универсального митогена, имеющего двойную триггерную функцию в регуляции клеточного цикла лимфоцитов.
Регуляция пролиферации у эукариот осуществляется с помощью механизма строгого контроля, при котором определяющим фактором является равновесие двух антагонистов [276]. Они могут быть как внутриклеточными (цАМФ и цГМФ, катионы и анионы, различные реципрокные инициаторные белки для каждой фазы митотического цикла), так и внеклеточными (стрессорные гормоны и инсулин). На протяжении клеточного цикла концентрации цАМФ и цГМФ изменяются противонаправленно, что является основанием для утверждения о взаимном антагонизме этих циклических нуклеотидов. В большинстве случаев между концентрацией цАМФ и пролиферацией клеток была обнаружена обратная зависимость, а с содержанием цГМФ – прямая [204]. Монобутирильные производные цАМФ и цГМФ, которые хорошо проникают через клеточную мембрану, легко индуцируют отрицательную и положительную плейотропную реакцию в культуре фибробластов [393]. Экзогенный цГМФ даже в такой низкой концентрации, как 10—6 М, стимулирует не только пролиферацию, но и гидролиз цАМФ [364]. Из этого следует, что стрессорные гормоны и все физиологические факторы, способные повышать внутриклеточную концентрацию цАМФ (отрицательный сигнал) и (или) уменьшать концентрацию цГМФ (положительный сигнал), можно рассматривать как неспецифические ингибиторы пролиферации [204]. Естественно, что как активаторы пролиферации могут квалифицироваться все факторы, способные вызывать противоположные сдвиги, например инсулин, который устраняет контактное торможение и активирует клеточный цикл фибробластов через увеличение в них соотношения цГМФ/цАМФ с 0,18/22,0 до 2,00/17,0 [324].
К их числу, очевидно, принадлежит и тиамин, который усиливает положительное и снижает отрицательное плейотропное влияние внешних эффекторов, т. е. оптимизирует вклад инсулиногенной и стероидогенной составляющих иммобилизационного стресса в пролиферацию лимфоцитов, что может служить основанием для разработки соответствующего регламента тиаминопро-филактики и тиаминотерапии стрессорных иммунодефицитов.






