6.3. Ронколейкин (ИЛ-2) и витамины
Рекомбинантный ИЛ-2, синтезируемый на дрожжевой матрице, впервые появился в поле зрения клиницистов в 1995 г., а сейчас уже широко применяется в сепсисологии для иммунокоррекции ВИД. В возникновении ВИД важную роль играет гиперпродукция эндогенных глюкокортикостероидов в результате действия предшествующих сепсису различных видов стресса: операционного, травматического, болевого и др. В опытах на животных показано, что in vivo ИЛ-2 вызывает активацию гипофизад-реналовой системы [53]. Однако стрессогенное действие ИЛ-2 при его введении больным сепсисом клиницистами не учитывается, хотя это может быть важным как для выбора тактики иммунореабилитации, так и для оценки ее эффективности. Поскольку в медицинской литературе практически отсутствуют сведения о влиянии ИЛ-2 на уровень глюкокортикостероидов в крови больных сепсисом, прежде всего необходимо было восполнить существующий пробел.
Изучение иммунокорригирующего влияния ронколейкина при сепсисе проводили на 12 больных (6-я группа), еще 12 больным перед введением ронколейкина вводили комплекс витаминов группы В (7-я группа – накануне и за 2 ч до каждой инфузии ронколейкина внутривенно вводили 2 мл 6 % раствора витамина В1, а через 1 ч последовательно 2 мл 5 % раствора витамина В6 и 2 мл 0,01 % раствора витамина В12). Контролем служили 12 больных, которым проводилась интенсивная комплексная терапия сепсиса без применения ронколейкина и витаминов (5-я группа).
У 16 из 24 больных сепсисом, леченых ронколейкином, отмечены побочные реакции: незначительное (не более 0,5 °C по сравнению с исходным) повышение температуры тела во время введения препарата – у 12 (50 %), лихорадка с повышением температуры тела от 0,5 °C и выше – у 4 (16,7 %) больных. Пирогенные эффекты, сопряженные с повышением уровня стрессорных гормонов в крови [101], как правило, наблюдаются после введения корпускулярных или растворимых белков, являющихся аллоантигенами [86]. Существующий опыт использования в клинике дрожжевого рекомбинантного интерлейкина-2 показывает, что наряду с выраженной иммуностимуляцией многочасовое капельное введение ронколейкина часто вызывает у больных развитие лихорадочного состояния [13], которое может быть проявлением побочного стрессогенного действия препарата, снижающего эффективность иммунокорригирующего лечения.
У животных внутривенное введение ИЛ-2 сопровождается стрессогенной реакцией, которая проявляется повышением уровня АКТГ и глюкокортикостероидов в крови [53] и одновременно септическими проявлениями: лихорадкой, тахикардией, снижением системного АД, сердечного индекса, транзиторной почечной недостаточностью [77]. Были случаи, когда большие дозы ИЛ-2 при проведении противоопухолевой терапии вызвали усиление признаков сепсиса и тяжелые стрессобусловленные осложнения: инфаркт миокарда, канюлярный сепсис, почечную недостаточность, тромбоз легочных артерий и др. [33].
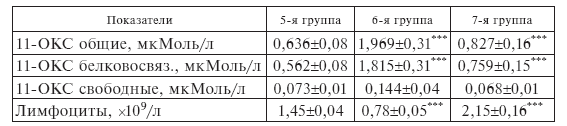
Экзогенный ИЛ-2 проявляет себя как стрессор и при сепсисе. Об этом свидетельствует двукратное повышение общих, белковосвязанных и свободных 11-ОКС, а также лимфопения, наблюдающиеся сразу после завершения первой инфузии ронколейкина (табл. II-4).
Таблица II-4.
Уровень 11-ОКС и лимфоцитов в крови больных сепсисом в конце 1-й 4-часовой инфузии ронколейкина
* р<0,05; ** р<0,02; *** р<0,001.
В работах [33] и [116] зафиксировано некоторое снижение абсолютных цифр лимфоцитоза у больных с хирургическим и ожоговым сепсисом даже на следующий день после разового применения ронколейкина, что косвенно указывает на проявление его стрессогенного действия и является основанием для продолжения цитокиновой терапии. Зеркальный характер сдвигов в системе «11-ОКС-лимфоциты» подчеркивает их взаимообусловленность, т. е. определяющую роль гормонов коры надпочечников в развитии лимфопенической реакции [31].
Аналогично, т. е. в противофазе, колеблется уровень кортикостероидов и лимфоцитов в крови крыс при циркадной ритмике [10]. По-видимому, ИЛ-2 является более сильным стрессором, чем Т-антиген (эритроциты барана – ЭР), так как первый вызывает инверсию циркадного ритма лимфоцитоза у мышей [200], а второй – нет [77]. Поскольку при введении глюкокортикостероидов интактным животным наблюдается смещение фаз суточной динамики уровня лимфоцитов [10], можно допустить, что парадоксальный лимфопенический эффект ронколейкина является результатом 4-часовой экспозиции стрессогенного действия препарата. Исходя из того, что экзогенные и эндогенные стресс-гормоны вносят помехи в действие активаторов иммунитета – ЭР и ИЛ-2 (в обоих случаях имеют место нарушения циркадного ритма лимфоцитоза [77, 200]), легко заключить, что для усиления иммуномодулирующих эффектов ронколейкина необходимо нивелировать стрессогенную составляющую его действия.
Неспецифический характер этих изменений подчеркивает основной компонент используемого нами комплекса витаминов – тиамин, который при введении септическим больным ронколейкина действует так же, как и при любом другом виде стресса – достоверно снижает амплитуду стероидогенной реакции (табл. II-4) [430] и тем самым нивелирует стрессорные сдвиги в системе крови [23].
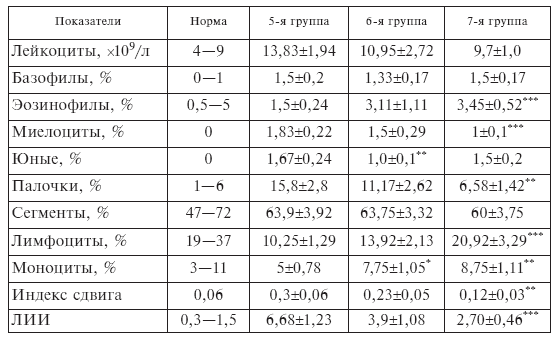
Клинический анализ крови (табл. II-5) показал, что у больных сепсисом исходно наблюдаются такие же изменения, как и при стрессе: лейкоцитоз со сдвигом формулы влево и лимфопения [153].
Таблица II-5.
Содержание нейтрофильных гранулоцитов в крови больных сепсисом через сутки после 1-й инфузии ронколейкина
*р<0,05; ** р<0,02; *** р<0,001.
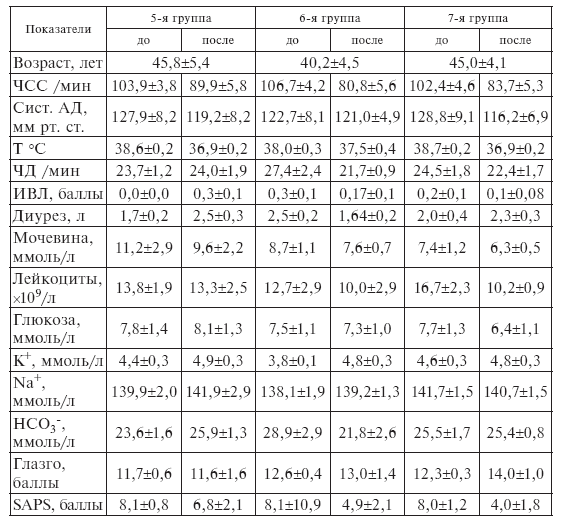
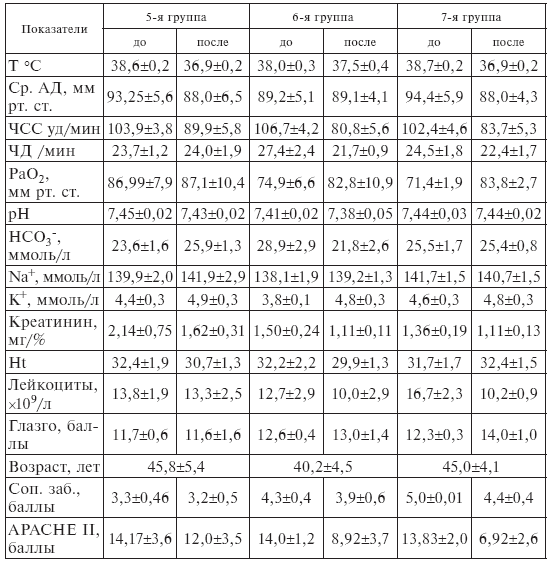
У больных 5, 6 и 7-й групп до лечения (контроль) наличие 2, 3 и 4 клинических признаков SIRS (системный ответ на агрессию) было выявлено соответственно в 100, 69 и 33 % случаев.
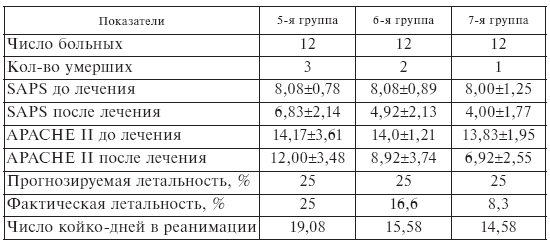
Оценка исходного состояния пациентов по системе APACHE-II и шкале SAPS показала, что в целом у всех больных до лечения средний балл в первом случае составил 14, а во втором – 8,0, что позволяло прогнозировать вероятную летальность на уровне 25 % (табл. II-6).
Факт повышения эффективности лечебного действия ронколейкина под влиянием комплекса антистрессорных витаминов документируется улучшением клинического состояния больных 3-й группы, которое проявлялось 2-кратным снижением среднего балла по шкалам SAPS и APACHE-II, ослаблением степени тяжести эндотоксикоза в виде нормализации температуры и гемодинамики, достоверного снижения лейкоцитоза, индекса сдвига лейкоцитарной формулы, увеличением относительного и абсолютного количества лимфоцитов, улучшением биохимических показателей крови. У больных 2-й группы, получавших только ронколейкин, клинический эффект был менее выражен, тогда как у пациентов 1-й группы (контроль) либо вообще не отмечалось положительной клинической динамики, либо она достигалась за более длительное время, хотя и в данной группе регистрировалось умеренное снижение среднего балла по обеим шкалам.
Таблица II-6.
Клинические показатели тяжести состояния больных до и после лечения
Цитокинотерапия на фоне комплекса витаминов группы В характеризовалась выраженным иммунокорригирующим действием. При сочетанном применении стресслимитирующих витаминов и ронколейкина устранение лимфопении у больных сепсисом в третьей группе происходило значительно быстрее, чем во второй, где указанный комплекс не применялся, о чем свидетельствует снижение общего количества инфузий иммуномодулятора.
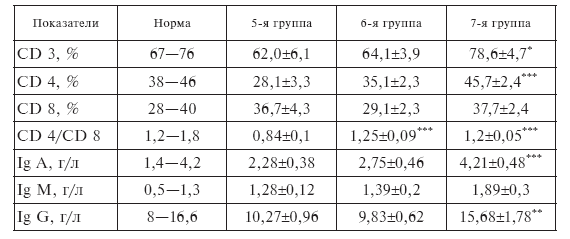
Из данных, представленных в табл. II-7, следует, что при сочетанном применении ронколейкина и комплекса антистрессорных витаминов коррекция клеточного и гуморального иммунитета была более выраженной.
Через сутки после первой инфузии ронколейкина общее количество Т-лимфоцитов (CD3) и Т-хелперов (CD4) по сравнению с исходным уровнем изменилось мало, а вот субпопуляция Т-супрессоров (CD8) сократилась почти на четверть. В результате структура кооперативных связей между элементами иммунореактивности в системе Т-клеточного иммунитета формально восстанавливается, однако это вряд ли можно рассматривать как признак иммунореабилитации. Оптимальное соотношение внутрипуловых субпопуляций, обеспечивающих эффективную реализацию специализированной функции иммунокомпетентных Т-клеток, отражает индекс CD4/CD8, который в норме равен 1,2–1,8. У больных сепсисом исходное снижение индекса CD4/CD8 до 0,8 определяется не только избытком Т-супрессоров, но и подавлением Т-хелпе-ров [130], о чем свидетельствует угнетение продукции эндогенного ИЛ-2 в принятых условиях [163]. Иммунореабилитация ВИД, в принципе, предполагает общее увеличение всего пула Т-клеток, когда же ничего подобного не происходит (табл. ІІ-7), а имеет место снижение одной из его субфракций (CD8), то речь здесь может идти в первую очередь об иммуносупрессии, т. е. о стрессогенном влиянии ронколейкина.
Если ронколейкин применять вместе со стресслимитирующими витаминами, то на первый план выдвигается иммунопротекторная составляющая его действия. В этом случае через сутки после первой инфузии цитокина наблюдается существенный рост общего содержания Т-лимфоцитов в крови больных сепсисом (7-я группа), главным образом за счет увеличения субпопуляции Т-хелперов и в меньшей степени Т-супрессоров (табл. II-7). Нивелирование снижения уровня Т-супрессоров, отмеченное у больных, получавших ронколейкин (6-я группа), очевидно, может быть еще одним проявлением антистрессорного действия витаминов, поскольку известно, что именно эта субпопуляция лимфоидных клеток (CD8) отличается наибольшей чувствительностью к кортикостероидам [86]. Таким образом, витамины фактически нормализуют нарушенное стрессом функционально важное соотношение CD4/CD8, которое у больных сепсисом после совместного применения комплекса антистрессорных витаминов группы В и ронколейкина достигает оптимального значения (табл. II-7), что объективно отражает факт иммуномодуляции.
Таблица II-7.
Содержание субфракций Т-лимфоцитов и иммуноглобулинов в крови больных сепсисом через сутки после 1-й инфузии ронколейкина
* р<0,05; ** р<0,02; *** р<0,001.
При тяжелом сепсисе [150] и стрессе [136] наблюдается феномен «исчезающих глобулинов» – резкое снижение иммуноглобулинов класса IgA, IgM и особенно IgG, что является поводом для применения соответствующей заместительной терапии антителами. Согласно [148], лечебный эффект IgG при сепсисе зависит от показателя формализованной оценки тяжести состояния по шкале SAPS: в диапазоне 20–25 баллов авторами зафиксировано снижение летальности на 33 %, а в группах больных с индексом тяжести менее 20 баллов заместительная терапия была неэффективной, очевидно, из-за отсутствия исходного дефицита антител. У наших больных при гораздо меньших значениях SAPS – 8 и APACHE – 14 (5-я группа) все фракции иммуноглобулинов крови находятся на уровне нижней границы нормы (табл. ІІ-7). На следующий день после первой инфузии ронколейкина (6-я группа) концентрация IgA, IgM и IgG заметно не изменялась. Введение ронколейкина на фоне действия комплекса антистрессорных витаминов группы В (7-я группа) в это же время достоверно повышало уровень IgG по сравнению с исходным.
Известно, что стрессорный всплеск стероидогенеза подавляет не только клеточный, но и гуморальный иммунитет, вызывая сбои в работе В-лимфоцитов, препятствующие их превращению в плазматические клетки, что, в конце концов, приводит к угнетению антителообразования. В опытах на животных показано, что концентрация IgG в крови обратно пропорциональна содержанию в ней эндогенных глюкокортикостероидов: при стрессе она снижается, при адреналэктомии – увеличивается
[86]. Следовательно, снижение уровня 11-ОКС у больных сепсисом (7-я группа), обеспечиваемое антистрессорными витаминами (табл. II-4), может быть необходимым условием для проявления иммуномодулирующего действия ронколейкина, которое распространяется и на В-клетки, а через них и на продукцию IgG. Поскольку синтез IgG зависит от Т-хелперов [28], которые контролируются инсулином [68], увеличение этой фракции антител в крови больных сепсисом, получавших ронколейкин вместе с комплексом витаминов группы В (7-я группа), очевидно, можно объяснить при помощи механизма инсулинового опосредования действия основного компонента комплекса – витамина В1 как в части ограничения амплитуды стероидогенной реакции [430], так и в части влияния на пролиферацию иммуноцитов [24], являющихся клетками-мишенями для данного гормона [98].
В связи с этим важно отметить, что стресслимитирующее действие витаминов существенно повышает терапевтический эффект ронколейкина у больных сепсисом.
Оценка динамики показателей SAPS и APACHE II свидетельствует о заметно большем снижении тяжести состояния пациентов после сочетанного применения ронколейкина и комплекса антистрессорных витаминов группы В, чем одного ронколейкина (табл. ІІ-8, ІІ-9).
Объективными критериями, подтверждающими этот факт, служат также уменьшение реальной летальности по сравнению с прогнозируемой, уменьшение сроков пребывания в палате интенсивной терапии, которые были всегда самыми значимыми в группе, где применялось сочетанное витаминно-цитокиновое лечение (табл. ІІ-6).
Иммуносупрессия, сопутствующая многим заболеваниям, физиологическим состояниям (старение, роды, недоношенность новорожденных) и действию на организм экстремальных факторов (травмы, ранения, ожоги, хирургические вмешательства и т. п.), сопряжена с недостатком ИЛ-2 в периферической крови и может быть компенсирована путем введения экзогенного лимфокина. Согласно [240], в динамике развития септического процесса по схеме SIRS – CARS – MOD применение провоспалительных цитокинов оправдано начиная со второй антивоспалительной стадии при несбалансированном течении CARS, которое приводит к выраженному иммунодефициту. Основным показанием к применению ИЛ-2 здесь является стойкое снижение общего количества лимфоцитов и их субфракций в крови больных на фоне клинических и лабораторных признаков сепсиса.
Таблица II-8.
Оценка тяжести состояния больных сепсисом до и после лечения по шкале SAPS
Вводимый in vivo ИЛ-2 увеличивает пул иммунокомпетентных клеток крови за счет интенсивной пролиферации предшественников цитотоксических Т-лимфоцитов, которые затем переходят в эффекторную форму, а также зрелых киллерных и хелперных Т-клеток [196]. Последние в свою очередь генерируют лимфокины, стимулирующие поликлональную активацию, пролиферацию и дифференцировку В-лимфоцитов в антителопродуценты. Таким образом, восстанавливаются системы клеточного и гуморального иммунитета и ликвидируется имеющийся транзиторный вторичный иммунодефицит (ВИД).
Таблица II-9.
Оценка тяжести состояния больных сепсисом до и после лечения по шкале APACHE II
Хотя мишенью экзогенного ИЛ-2 являются периферийные иммуноциты, и он фактически осуществляет «центробежную» активацию иммунитета в направлении, обратном естественному движению активационного сигнала [189], тем не менее, в конечном счете, приходит в движение вся иммунная система, в результате чего повышается антиинфекционная защита организма.
Для того чтобы понять, как действует экзогенный ИЛ-2 по принципу «от обратного», необходимо рассмотреть механизм прямой иммуномодуляции. При «центростремительной» активации иммунитета первичными эффекторными клетками являются макрофаги, которые захватывают Т-зависимые антигены и перерабатывают их в поверхностные Ia-антигенные маркеры, которые распознаются Т-лимфоцитами. При контакте с Ia-положительными гистосовместимыми макрофагами происходит активация Т-иммуноцитов (первый сигнал), которая сопровождается G0/G1-переходом в их клеточном цикле, а макрофаги приобретают способность продуцировать ИЛ-1.
Рецепторы к нему на поверхности клеток-мишеней появляются в середине G1-фазы. Соединение ИЛ-1 с рецептором (второй сигнал) «включает» в активированных Т-лимфоцитах синтез ДНК, т. е. служит триггером G1/S-перехода в их клеточном цикле [187]. Таким образом, ИЛ-1 реализует индуцированную антигеном пролиферацию Т-лимфоцитов и, по-видимому, опосредованно антигензависимую активацию В-лимфоцитов с превращением их в плазматические клетки.
Действие антигена или митогена на Т-клетку (первый сигнал) инициирует одновременно синтез ИЛ-2 и экспрессию рецепторов к нему (ИЛ-2Р) [80]. Продукция ИЛ-2 происходит в G1-фазе клеточного цикла и не зависит от пролиферации. В клетках, находящихся в фазе G0, ИЛ-2 не выявляется. Увеличение экспозиции G1-фазы с помощью блокатора G1/S-перехода – оксимочевины приводит к повышению генерации ИЛ-2, а облучение клеток-продуцентов в дозе 9,5 Гр угнетает их пролиферацию, но не изменяет скорости синтеза лимфокина [196].
Биологическая роль ИЛ-2 состоит в подкреплении действия ИЛ-1 по инициации пролиферации, так как при соединении ИЛ-2 и ИЛ-2Р фактически дублируется сигнал к включению G1/S-перехода в клеточном цикле Т-лимфоцитов. Добавление ИЛ-2 к активированным лимфоцитам усиливает синтез РНК и осуществляет перевод клетки из фазы G1a в фазу G1b, что продвигает ее в фазу S. Целесообразность такого дубляжа второго сигнала обусловлена тем, что после связывания ИЛ-1 и ИЛ-2 с рецепторами клеток-мишеней происходит быстрая, зависимая от лизосом деградация обоих факторов [196].
Биохимический механизм действия ИЛ-1 и ИЛ-2 одинаков: образование лимфокин-рецепторных комплексов в обоих случаях сопряжено с активацией внутриклеточной гуанилатциклазы и накоплением в лимфоцитах цГМФ [86], который является непосредственным медиатором пролиферации, ответственным за G1/S-переход в клеточном цикле [187], и включение митотического оперона в генетическом триггере лимфоцитов, лимитирующем наработку белков митоза и построение митотического аппарата [24].
Пролиферативный эффект ИЛ-2 лимитируется фазой клеточного цикла лимфоцитов, от которой зависит экспрессия ИЛ-2Р. На покоящихся клетках (фаза G1) высокоаффинных лимфокиновых рецепторов практически нет, их количество резко возрастает после антигенной или митогенной активации лимфоцитов. ИЛ-2Р появляются на Т-лимфоцитах периферической крови через 6 ч после стимуляции ФГА. Причем 90 % клеток, экспрессирующих ИЛ-2Р, являются хелперами/индукторами, 10 % – супрессорами/киллерами [80]. ИЛ-2Р выявляются также на активированных В-лимфоцитах [196].
Следует подчеркнуть, что ИЛ-2 стимулирует пролиферацию лимфоцитов только после их бласттрансформации митогеном или антигеном [360]. Отсюда ясно, что обратный (центробежный) ход процесса иммуногенеза, т. е. ответ на экзогенный ИЛ-2, будет определяться степенью экспрессии ИЛ-2Р, пропорциональной количеству уже активированных лимфоидных клеток.
Выпадение ИЛ-2 звена иммунного ответа при развитии стрессорных ВИД у ожоговых больных и у больных после обширных операций компенсируется введением экзогенного рИЛ-2 [116]. В то же время при СПИДе этот иммуномодулятор неэффективен из-за блокирования его рецепции на иммуноцитах, поскольку в крови таких больных содержится ингибитор продукции ИЛ-2 и экспрессии ИЛ-2Р [80].
Исходя из того, что у наших больных получен четкий иммунокорригирующий эффект на введение ронколейкина, можно предположить, что здесь имеет место стрессиндуцированный ВИД, который развивается за счет снижения синтеза эндогенного лимфокина без нарушения экспрессии его рецепторного аппарата на поверхности лимфоцитов. Известно, что стрессорные гормоны блокируют продукцию ИЛ-2, но не экспрессию ИЛ-2Р [80].
Данная констатация уже сама по себе предопределяет целесообразность применения в этих условиях антистрессорных средств. С другой стороны, сопутствующий стрессорный эффект самого ронколейкина безусловно требует коррекции, поскольку вызываемое им увеличение содержания 11-ОКС в крови больных, которое сохраняется на стабильно высоком уровне даже на следующий день после завершающей инфузии, вряд ли способствует максимальному проявлению иммуноактивности дрожжевого рекомбинантного лимфокина, а скорее всего ограничивает его регуляторный потенциал.
Действительно, применение комплекса антистрессорных витаминов группы В, уменьшающего амплитуду стероидогенной реакции организма больных на введение ронколейкина (снижение 11-ОКС в крови), существенно усиливает иммуномодулирующее действие препарата (повышение общего количества циркулирующих Т-лимфоцитов, в том числе Т-хелперов и Т-супрессоров, а также А-, М-, G-иммуноглобулинов).
Показано, что антистрессорное влияние основного компонента витаминного комплекса – тиамина опосредуется инсулином [23], который ограничивает гормонообразование в надпочечниках при стрессе за счет ингибирования ключевых ферментов стероидогенеза при переключении генетического триггера кортикоцитов из состояния секреции в состояние регенерации [24], а на уровне соматических клеток-мишеней был способен уравновешивать метаболические эффекты кортикостероидов за счет реципрокной регуляции синтеза и функционирования соответствующих ферментных ансамблей [430].
In vivo тиамин [83], как и инсулин [124], усиливает иммунный ответ на эритроциты барана (ЭБ). В продуктивную фазу иммунного ответа (на 8-й день иммунизации) тиамин резко повышает количество Т-лимфоцитов (Е-РОК) в тимусе, костном мозге, а также в селезенке и бляшкообразующих клеток (БОК) – в селезенке, причем у стрессированных животных (подвергавшихся затравке CCl4) иммуномодуляция была больше, чем у интактных [208].
Важно отметить, что in vitro инсулин дозозависимо увеличивает количество антителопродуцентов в суспензии клеток селезенки мышей, иммунизированных ЭБ [76]. Поскольку в условиях in vitro тиамин не влияет на пролиферативную активность лимфоцитов, его способность поддерживать высокую чувствительность лимфоидных клеток к антигенным стимулам in vivo прямо указывает на механизм инсулинового опосредования.
При моделировании in vivo стрессорного иммунодефицита показано, что в крови крыс колебания пролиферативной активности лимфоцитов во все фазы иммобилизационного стресса отчетливо дублируют осцилляции уровня иммунореактивного инсулина. Одинаковый синфазный ритм инсулиногенеза и синтеза ДНК (включение 3Н-тимидина) в эффекторных клетках в динамике развития стрессорной реакции до и после нагрузок тиамином свидетельствует о том, что сдвиги пролиферации в обоих случаях – это инсулининдуцируемые изменения и что пролиферативный эффект витамина В1 является гормональнообусловленным [24].
При инкубации in vitro суспензии клеток селезенки мышей, иммунизированных эритроцитами барана с инсулином, теофиллином (ингибитор фосфодиэстеразы) и NaF (активатор аденилатциклазы), новообразование БОК было достоверно ниже, чем при контакте спленоцитов только с инсулином. Инсулинотропный эффект носил дозозависимый характер и был связан с изменением оптимального соотношения цГМФ/цАМФ [76]. Согласно концепции триггерного механизма [24], воздействие на функциональное состояние аденилат– и гуанилатциклаз – есть эффективный способ регуляции процессов пролиферации и дифференцировки клеток иммунной системы.
Если говорить о тиамине как базовом компоненте исследуемого комплекса антистрессорных витаминов, то из вышеизложенного следует, что его действие в отношении проявления иммунотропных эффектов ронколейкина, по-видимому, реализуется по двум взаимосвязанным направлениям: 1) через инсулинозависимое снижение стрессорной нагрузки чужеродного белкового препарата на организм больного, которая усугубляет уже имеющийся ВИД, и 2) через инсулинозависимое увеличение внутриклеточной концентрации цГМФ, который является триггером G0/G1– и G1/S-переходов в клеточном цикле лимфоцитов. В результате тиаминовой коррекции увеличивается количество активированных лимфоцитов, экспрессирующих ИЛ-2Р, и оптимизируются условия для осуществления пролиферативного процесса в целом, что в сумме дает ощутимый прирост эффективности иммуномодулирующего действия ронколейкина при сепсисе.
Фактически данный комплекс антистрессорных витаминов решает триединую задачу по обеспечению антистрессорной профилактики, коррекции и устранения ВИД, т. е. реабилитации иммунитета. Во-первых, стресслимитирующие витамины предупреждают развитие дистресса, индуцирующего ВИД (тиамин, пиридоксин), во-вторых, нейтрализуют метаболические проявления уже возникшего стресса и ограничивают проявления ВИД (тиамин, кобаламин) и, в-третьих, способствуют устранению ВИД, т. е. восстановлению клеточного пула иммуноцитов (тиамин) через подключение действия эндогенных иммуномодуляторов (инсулина) и создание благоприятных условий для действия экзогенных (ронколейкина) [24].
Таким образом, применение комплекса антистрессорных витаминов группы В при сепсисе оправдано с позиций патогенетической коррекции ВИД и усиления иммуномодулирующего действия ронколейкина. Стресслимитирующие витамины фактически обеспечивают эндогенную реактивацию иммунной системы в условиях гиперкортицизма и являются пусковым фактором последующей ре-интеграции различных звеньев иммунитета под влиянием ронколейкина, что определяет целесообразность их совместного применения в комплексной терапии сепсиса.
В клинике Гродненского медицинского университета систематический учет септического контингента проводится с 1982 г. За это время обследовано свыше тысячи пациентов. Начиная с 1994 г. витамины В1+ В6+ В12 в комбинации с иммуностимулирующей терапией здесь стали базисным лечением септических больных. Данный подход позволил снизить летальность в группе больных, подвергавшихся гемосорбции, с 37,4 до 13,3 % и с 25 до 8,3 % в группе больных, получавших ронколейкин.






