6.2. Т-активин и витамины
Сепсис, т. е. генерализация инфекции, всегда имеет место на фоне несостоятельности гомеостаза. Летальность при сепсисе достигает значительных цифр и колеблется в широких пределах – от 20 до 40 % и прогрессивно нарастает при развитии септических осложнений, таких, как ПОН и септический шок, – от 40 до 70 % [2, 3, 7, 288]. Причиной этого может быть тот факт, что применяемые лечебные мероприятия не решают реабилитационной задачи, т. е. восстановления имеющегося дефекта гомеостаза, а иногда даже усугубляют его. Исходя из представлений о перекрестной адаптации и системных реакциях организма [19], а также концепции витаминно-гормональных взаимоотношений [18, 20], было интересно использовать имеющиеся теоретические и экспериментальные наработки по функциональной реабилитации гомеостаза [430] в целях снижения смертности при сепсисе.
Исходя уже из принципов интенсивного комплексного лечения сепсиса, которое сегодня включает: устранение нарушений в иммунной, эндокринной, сердечно-сосудистой, дыхательной системах, системе детоксикации, системе свертывания крови, микроциркуляции и т. д., необходимо признать, что эта патология должна квалифицироваться, как тотальная несостоятельность гомеостаза. Сепсис – это системное заболевание с множественными дефектами гомеостаза, и прежде всего в гуморальном звене его регуляции. Здесь на первый план выдвигаются взаимоотношения между гормональной и иммунной системами, которые в аспекте сепсиса в литературе фактически не анализируются и не учитываются в клинической практике, что, безусловно, снижает эффективность лечения.
Если принять, что постоянство внутренней среды организма является результатом интеграции функций [19], а развитие сепсиса, т. е. генерализация инфекционного процесса, всегда имеет место на фоне первичного или вторичного иммунодефицита [382], то показатели специфического иммунитета в данном случае, очевидно, могут служить адекватными критериями состоятельности гомеостаза в целом. Из рис. ІІ-29 видно, что традиционная интенсивная терапия сепсиса не устраняет исходный иммунодефицит. Более того, по имеющимся в литературе данным, некоторые лечебные мероприятия способны даже его усугубить [26, 168].
Почему это происходит, можно показать на примере гемосорбции. Гемосорбция (ГС), позволяющая элиминировать из крови вещества молекулярной массой от 500 до 5000 дальтон [94], так называемые средние молекулы, в том числе пептиды, с накоплением которых связывают развитие эндотоксикоза и иммуносупрессии [93], является на сегодняшний день одним из важнейших и наиболее патогенетически обоснованным методом в комплексной схеме интенсивного лечения сепсиса [6].
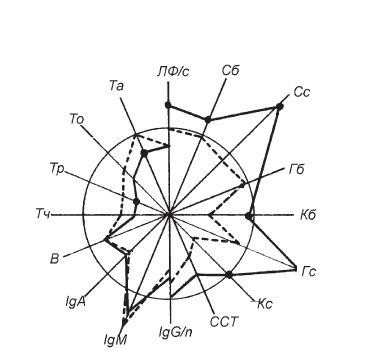
Рис. II-29. Иммунный и гормональный статус больных сепсисом (1-я группа) до (прерывистая линия) и после лечения (сплошная линия). В виде радиусов отложены иммунологические и гормональные показатели (в % к норме, представленной в виде окружности): ЛФ – лимфоциты (в 1 мкл крови); Та – активные Т-клетки; То – общие Т-клетки; Тр – теофиллинрезистентные; Тч – теофиллинчувствительные; В – В-лимфоциты; lgA, lgM, lgG – иммуноглобулины плазмы; С – суммарные 11-ОКС (б – белковосвязанные, с – свободные); Гб – гидрокортизон, связанный с белком; Кб – кортикостерон, связанный с белком; Гс – гидрокортизон свободный; Кс – кортикостерон свободный; ССТ – связывающая способность транскортина; n – число связывающих мест на транскортине. Достоверные сдвиги (р < 0,05) между прерывистой и сплошной линиями обозначены кружком
Тем не менее гемосорбция не только не компенсирует имеющуюся при сепсисе недостаточность Т– и В-звеньев иммунитета, но обусловливает некоторую тенденцию к ее углублению, в результате стимуляции стероидогенеза [167, 168]. Активация надпочечников фиксируется уже после первой процедуры и сохраняется на протяжении всего времени применения экстракорпоральной детоксикации, формируя состояние устойчивого гиперкортицизма (табл. II-2). Элиминация глюкокортикостероидов из крови активированными углями при проведении гемосорбции [167] приводит к суперкомпенсации потерь, за счет растормаживания гипофиза (устранение отрицательной обратной связи) и развития обычной стрессорной реакции.
Известно, что кортикостероиды ингибируют миграцию стволовых и B-клеток из костного мозга, кооперацию Т– и B-клеток, вызывают транзиторную лимфопению [286].
При стрессе изменяется не только спектр лимфоцитов, но и общая масса лимфоидной ткани в организме (атрофия тимуса, инволюция селезенки и т. д.), что является морфологической основой развития иммунодефицита. Функциональная взаимосвязь между гормональной и иммунной системами здесь настолько очевидна, что ее используют в диагностических целях при тестировании адаптации, т. е. для контроля фаз развития стрессорной реакции по изменению клеточного состава крови [271].
Таким образом, проблема иммунокоррекции при сепсисе – это в значительной мере проблема оптимизации стресса, которая в практическом плане связана с решением следующих основных вопросов: 1) снижение биосинтеза стероидов (определяет амплитуду функционального ответа надпочечников на раздражение); 2) снижение рецепции стероидов (определяет возможность проявления биологического действия гормонов); 3) активация катаболизма стероидов (определяет время существования эффективных концентраций гормонов); 4) снятие иммунодепрессантного действия стероидов (определяет реабилитацию иммунитета). Исходя из концепции витаминно-гормональных связей [18, 20] и имеющихся данных что:
1) витамин В1 является антистрессором, активирует инсулярный аппарат поджелудочной железы, нормализует углеводный обмен [18]; 2) витамин В6 блокирует стероидные рецепторы и, следовательно, биологическое действие гормонов [271, 375]; 3) витамин В12 активирует катаболизм стероидов и является метаболическим антагонистом стероидных гормонов, нормализует белковый и жировой обмен [205]; 4) Т-активин обладает реципрокным по отношению к глюкокортикостероидам иммуномодулирующим действием [191] – предполагалось, что эта комбинация (В1+В6+B12+Т-активин) может дать при сепсисе аддитивный антистрессорный иммунокорригирующий эффект.
Клинические испытания подтвердили это предположение. Исследования были проведены на 78 больных сепсисом, в лечении которых широко использовали детоксикационную гемосорбцию. В зависимости от характера лечения больные были разделены на 4 группы: 1 (32) – гемосорбция (ГС – 2–6 сеансов); 2 (15) – ГС (2–6 сеансов), накануне и за 2 ч до каждой ГС внутривенно 2 мл 6 % витамина В1, а через час последовательно 2 мл 5 % р-ра витамина В6 и 2 мл 0,01 % витамина В12, на ночь подкожно 0,01 % раствор Т-активина из расчета 40 мкг/м2 поверхности тела; 3 (17) – ГС (2–6 сеансов), витамины группы B (как больным 2-й группы) + УФО крови с помощью аппарата «Изольда МД 73М» (5—10 сеансов) по общепринятой методике; 4 (14) – к назначениям, аналогично больным 3-й группы, добавлен Т-активин подкожно из расчета 40 мкг/м2 поверхности тела.
Применение антистрессорных средств здесь регламентируется тем, что сама патология (сепсис) и лечение (мощная антибактериальная терапия, хирургическая санация очагов, использование различных травматических видов экстракорпоральной детоксикации) являются большой, а в сочетании, возможно, чрезмерной стрессорной нагрузкой на надпочечники (активация стероидогенеза), что в свою очередь приводит к тяжелой иммуносупрессии. Причинами снижения функциональной активности лимфоцитов периферической крови при стрессе являются: транзиторная лимфопения, вызывающая обеднение внутрисосудистого пула лимфоцитов благодаря избирательной эмиграции рециркулирующих клеток, а также прямое угнетение глюкокортикостероидами пролиферации отдельных субпопуляций лимфоцитов [305].
По данным [256], в механизме лимфопенического действия гидрокортизона и АКТГ большую роль играет уменьшение количества митозов и кариорексис лимфоцитов. Кроме того, гормоны коры надпочечников могут изменить реакцию макрофагов на Т-клеточные факторы посредством блокады активации лимфоцитов, угнетения синтеза лимфоцитов, а также влияния на взаимодействие этих медиаторов с клетками-мишенями [255].
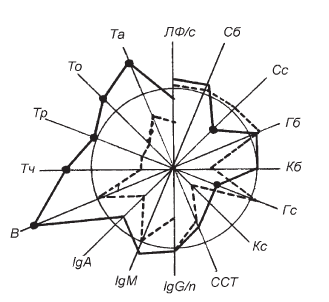
Рис. II-30. То же, что и на рис. ІІ-29, для 2-й группы
Как видно из рис. II-30, применение комплекса витаминов В с Т-активином при сепсисе вызывает выраженный антистрессорный эффект (снижение функционального ответа надпочечников на гемосорбцию) и устранение исходного иммунодефицита (достоверное повышение содержания в крови иммунокомпетентных клеток). Четкая синхронизация (зеркальность) сдвигов указывает на их взаимную обусловленность. Пролиферация лимфоцитов является важнейшим элементом развития нормальной иммунной реакции [25, 171]. В соответствии с современными теориями иммунитета этот процесс лежит в основе образования антигеноспецифического клона лимфоцитов и определяет интенсивность иммунной реакции [186, 188]. Поскольку иммунный ответ зависит от пролиферации Т– и В-лимфоцитов (в случае тимусзависимых антигенов пролиферация В-клеток осуществляется в кооперации с Т-клетками), то вполне возможно, что при сепсисе критической лимитирующей стадией может стать гормональнообусловленное нарушение способности прекомитированных антигеном клеток (осуществивших G0—G1-переход) включаться в митотическое деление.
Показано, что in vivo глюкокортикостероиды существенно ослабляют иммунный ответ сенсибилизированных лимфоцитов (после первого введения антигена) на последующие антигенные стимулы [230]. In vitro гормоны коры надпочечников угнетают бласттрансформацию сенсибилизированных Т-лимфоцитов в смешанной лимфоцитарной реакции и ответ на введение в культуру антигена [191]. Исходя из того, что процесс бласттрансформации есть не что иное, как рост клеток в фазе G1—S – G2, сопряженный с синтезом ДНК [132], можно заключить, что кортикостероиды способны изменять ответ Т-лимфоцитов на митогены (антигены) посредством блокирования триггерного по отношению к митозу перехода G1—S в клеточном цикле [256]. Изучение эффекта бласттрансформации лимфоцитов человека при воздействии на них ФГА показало, что добавление в систему преднизолона блокирует их трансформацию в бластные формы из-за специфического подавления синтеза ДНК [248].
Кортизолобусловленное ингибирование синтеза ДНК в лимфоидных клетках in vivo дозозависимо и проявляется уже через 150–390 мин после введения гормона [415, 416], что в принципе сопоставимо с экспозицией G1-фазы в клеточном цикле [42, 132]. Существенно, что именно в середине G1-фазы при активации лимфоцитов в смешанной культуре [419] либо при их активации антигенами или митогенами [308] на Т-клетках во множестве появляются рецепторы для инсулина, выполняющего, очевидно, функции триггера G1—S-перехода в условиях организма [132]. Следовательно, не исключено, что иммунодепрессантное действие глюкокортикостероидов реализуется через их реципрокные взаимоотношения с инсулином, на уровне рецепторного аппарата, генома и метаболизма лимфоцитов, как это известно в отношении гепатоцитов и клеток других органов-мишеней для обоих гормонов [18, 19]. В этой связи интересны следующие факты. Сепсис, как правило, сопровождается развитием инсулинорезистентности [113], частично за счет сопутствующего стрессорного гиперкортицизма [112], частично за счет связывания эндогенного инсулина накапливающимися в крови средними молекулами [177], что в обоих случаях нарушает специфическую рецепцию гормона и соответственно его биологическое действие.
Если уровень иммунокомпетентных клеток действительно отражает активность зависящей от инсулина пролиферации лимфоцитов, то отсутствие признаков иммунокоррекции после ГС (рис. II-29) прямо указывает на то, что данная процедура, несмотря на элиминацию средних молекул, проблему относительной недостаточности инсулина у больных сепсисом не решает. Наоборот, судя по направленности сдвигов, здесь скорее имеет место усиление инсулинорезистентности в результате выраженного стрессорного действия ГС (табл. II-2).
Следуя этой логике и представлениям о триггерной роли инсулина в «запуске» G1 – S-перехода клеточного цикла лимфоцитов [132], иммунокорригирующее действие витаминов группы В при сепсисе (т. е. достоверное увеличение пула иммунокомпетентных клеток – рис. II-30) можно объяснить следующим образом. Прежде всего, существенным моментом этого действия безусловно является сам совокупный антистрессорный эффект данного комплекса (см. выше), поскольку снижение уровня глюкокортикостероидов в крови устраняет инсулинорезистентность и соответственно отменяет «стероидный блок» пролиферации иммунокомпетентных клеток [191]. Однако не менее важное значение здесь, очевидно, имеет и аддитивный иммуномодуляторный эффект комплекса, где каждый его компонент вносит свой вклад в реализацию пролиферативного цикла.
В условиях антигенной стимуляции лимфоцитов (сепсис), т. е. «включенного» G0—G1-перехода, процесс активации транскрипции является центральным моментом действия активирующих факторов, так как синтез РНК и белка – суть G1-фазы клеточного цикла, в ходе которого клетка растет и готовится к делению на две [42]. Поэтому немаловажно и то, что стресслимитирующие витамины в составе соответствующих ферментов in vivo участвуют в формировании интрацеллюлярного пластического резерва для роста клеток в фазе G1, обеспечивая синтезы белков и нуклеиновых кислот необходимыми субстратами за счет катализирования межмолекулярных обменов простыми (трансаминирование – В6, трансметилирование – В12) и сложными (транскетолазные реакции – В1) фрагментами. Хотя актуальность дополнительного введения витаминов при сепсисе кажется очевидной, поскольку длительное антигенное раздражение в силу своего стрессорного характера [230] приводит к вторичной витаминной недостаточности [18], применение В-витаминов в принятых условиях решает регуляторную задачу реабилитации метаболического и соответственно иммунного гомеостаза. В этом отношении показательно активирующее влияние тиамина на инсулинсинтетическую функцию поджелудочной железы, которое воспроизводится как у интактных, так и гиповитаминозных животных [430].
Таблица II-2.
Содержание 11-оксикортикостероидов (в мкмоль/л) в крови больных сепсисом до и после гемосорбции (ГС)
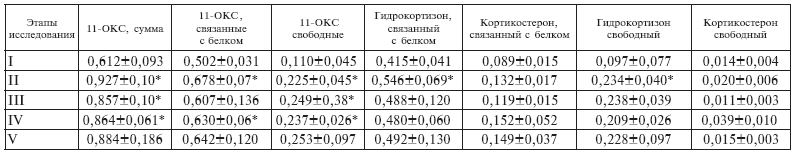
Примечание. I – до ГС; II – после ГС; III – через 6 часов; IV – через 24 часа; V – после всех ГС. * До
При стрессе тиамин не только снижает амплитуду пика глюкокортикостероидов в крови (рис. II-26), но и синхронизирует его с выходом пика инсулина (рис. II-27), что обеспечивает эффективную конкуренцию гормонов – антагонистов (т. е. отмену стероидного влияния) на уровне регуляции метаболических функций [23]. Повышение концентрации инсулина в крови [430] и маркерные эффекты его действия в органах-мишенях выявляются уже через 2 ч после введения тиамина интактным животным [18, 66]. Следовательно, экспозиционные характеристики инсулинотропного действия тиамина полностью укладываются во временные параметры G1-фазы клеточного цикла лимфоцитов, когда на их поверхности экспрессируются инсулиновые рецепторы, что создает реальные предпосылки лиганд-рецепторного взаимодействия, т. е. включения G1-перехода и соответственно пролиферации клеток лимфоидного ряда.
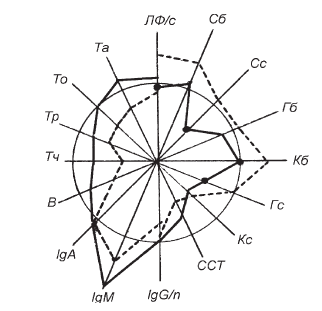
Рис. II-31. То же, что и на рис. ІІ-29, для 3-й группы
Насколько значим для роста каждой клетки в фазе G1 «интрацеллюлярный пластический резерв», очевидно, настолько же важен для количественного роста всей популяции эффекторных лимфоцитов резерв иммунокомпетентных клеток, который лимитирует процесс генерализации их деления. Предполагалось, что формирование этого клеточного резерва при сепсисе должен был обеспечить Т-активин, поскольку известно, что гормоны тимуса в присутствии антигена индуцируют двухэтапное созревание Т-клеток (Т0—Т1—Т2), т. е. превращение их в иммунокомпетентные лимфоциты [257]. Судя по амплитуде иммунокорригирующего действия (рис. II-30), такие ожидания не были беспочвенными. При этом вряд ли можно думать, что Т-активин способен активировать пролиферацию, поскольку для созревания лимфоцитов, т. е. для появления на их поверхности соответствующих антигенных маркеров, обеспечивающих иммунокомпетентность, не требуется деления клеток [191]. Более того, в большинстве случаев дифференцировка клеток связана с подавлением пролиферации. Филогенетически древние процессы дифференцировки сопровождаются появлением, углублением G1-фазы клеточного цикла и последующим переходом клеток в состояние покоя – G0 [42]. Кстати, длительное переживание Т2-клеток в фазе G0 in vivo может быть важным условием формирования клеточного резерва пролиферации [257].
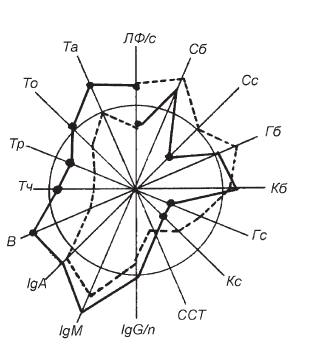
Рис. II-32. То же, что и на рис. ІІ-29, для 4-й группы
Если вместо Т-активина в схему лечения сепсиса ввести ультрафиолетовое облучение (УФО), действие которого в отношении лимфоцитов крови противоположно действию гормонов тимуса, то иммунокорригирующий эффект (прирост клеточного пула) В-витаминного комплекса, несмотря на сохранение его антистрессорного влияния (одинаковое снижение в крови уровня биологически активных свободных форм кортикостероидов), заметно сокращается (рис. II-31). УФО негативно влияет на жизнеспособность и функциональное состояние иммунокомпетентных клеток [172]. Например, у облученных макрофагов снижается функция презентации антигена и нарушается выработка интерлейкина-1 [322]. По-видимому, УФО-зависимая фотоальтерация клеточных мембран [151] нарушает дифференцировку лимфоцитов и соответственно сокращает клеточный резерв пролиферации. Изменения клеточных мембран, очевидно, носят малообратимый характер [151], поскольку дополнительное введение Т-активина хотя и повышает суммарный иммунокорригирующий эффект В-витаминов (рис. II-32), но не выводит его на уровень сдвигов, наблюдающихся без облучения (рис. II-30).
Следовательно, сочетание УФО и Т-активина в схеме лечения сепсиса вряд ли целесообразно. В то же время сочетание Т-активина с витаминами антистрессорного действия в принятых условиях себя полностью оправдало (рис. II-30).
Таблица II-3.
Уровень летальности больных в условиях проведения интенсивного комплексного лечения сепсиса
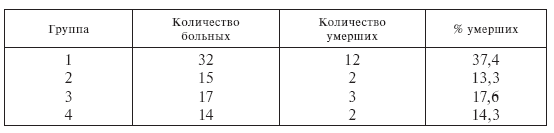
Сейчас хорошо известно, что биологическое действие гормонов тимуса резко усиливается на фоне гипокортицизма и зачастую достаточно даже кратковременного снижения уровня глюкокортикостероидов в крови для создания условий, обеспечивающих длительный, стимулирующий систему клеточного иммунитета эффект тимозина [191]. Полученные нами данные показывают, что вызванные совместным применением В-витаминов и Т-активина иммуномодуляция и нивелирование гормональнообусловленной иммуносупрессии (рис. II-29—ІІ-32) позволяют существенно (с 37,4 до 13,3 %) снизить уровень летальности у больных в условиях проведения интенсивного комплексного лечения сепсиса (табл. II-3).
Если выздоровление рассматривать как интегральный критерий реабилитации гомеостаза, то следует признать, что В-витамины в сочетании с иммуномодуляторами являются эффективным гомеостатическим (иммунокорригирующим) средством при сепсисе.






