5.5. Тиамин и ферментные маркеры генетического триггера гепатоцитов при стрессе
Триггеры, т. е. системы, способные неопределенно долго находиться в любом из двух возможных устойчивых состояний, играют большую роль в биохимической регуляции гомеостаза [192]. Функционирование триггерного механизма in situ можно оценить с помощью ферментных маркеров. Например, активность глюкозо-6-фосфатазы (Г-6-Фазы) печени у эмбрионов практически отсутствует, впервые она появляется в пренатальном периоде, затем резко возрастает в период рождения и остается на высоком уровне у взрослых животных, а активность гексокиназы, наоборот, максимальна у эмбрионов млекопитающих и снижается по мере онтогенетического развития [61]. При малигнизации ткани активность Г-6-Фазы падает, а активность гексокиназы (Гк) увеличивается пропорционально скорости роста опухоли [61]. Следовательно, первый фермент является маркером дифференцировки, а второй – маркером пролиферации. Сдвиги активности обоих ферментов лимитируются не их оборачиваемостью, а изменением массы ферментного белка, реализуемого через геном клетки [437] с помощью промоторов дифференцировки (адреналин, гидрокортизон [35]) и пролиферации (инсулин [4]). Предложенная Г. Вебером схема срочной и хронической адаптации данных ферментов [436] фактически описывает перекрестную регуляцию их синтеза и в этом смысле является аналогом генетического триггера Ф. Жакоба и Ж. Моно [111].
Известно, что активность Г-6-Фазы в печени у интактных мышей максимальна в темноте и минимальна в светлое время суток, когда функция надпочечников имеет соответственно максимальные и минимальные значения [212]. Поскольку в принятых условиях повышение уровня кортикостероидов в крови количественно соответствовало степени активации глюкозо-6-фосфатазы и включению [14С]-оротовой кислоты в общую РНК печени [18], можно допустить, что эта корреляция обеспечивается гормональной индукцией синтеза фермента. Согласно модели перекрестной регуляции генетических локусов, активация оперона дифференцировки автоматически блокирует оперон клеточного деления [245]. Действительно, по данным Ф. Халберга, время наибольшего количества митозов в эпидермисе уха и печени у мышей приходится на утренние часы, когда наблюдается анафаза суточного ритма кортикостероидов в крови, а наименьшего – на вечерние, что соответствует его акрофазе [303]. Существует представление, что в течение суток клетки беспрепятственно проходят все этапы подготовки к делению, но вследствие различного уровня энергетического обмена в организме в утренние и вечерние часы неодинаковое их количество вступает в митоз.
Ранее было замечено, что митотический индекс зависит от двигательной активности животных. Это наблюдение отражает известное правило – работа и деление клеток несовместимы [380]. Уровень энергетического обмена в свою очередь также зависит от двигательной активности, которая влияет на него через гормоны. По мнению В. Буллоу, последовательно развивавшего представление об определяющей роли глюкозы как энергетического фактора в делении клеток, стимулирующее или тормозящее действие гормонов на митозы связано с одной ключевой ферментативной реакцией, катализируемой гексокиназой, и осуществляется путем усиления или ослабления притока энергии в G2-периоде клеточного цикла, во время которого аккумулируется необходимая для митоза энергия [246].
Из приведенных данных следует, что Г-6-Фаза – это маркерный фермент дифференцировки, а гексокиназа – маркерный фермент пролиферации, функционирование которых генетически детерминировано реципрокным влиянием соответствующих промоторов (кортикостероидов или инсулина). В течение суток содержание гормоновиндукторов в крови, равно как и активность обоих ферментов в органах-мишенях, колеблется в противофазе друг к другу. Это полностью отвечает требованиям модели Ф. Жакоба и Ж. Моно [111] и, следовательно, может адекватно отражать ее функционирование in situ.
Исследования этой и других схем Ф. Жакоба и Ж. Моно, проведенные на аналоговой машине, показали, что для триггерной модели абсолютно исключен автокатализ и соответственно внутренняя колебательная неустойчивость. Переключение триггера из одного устойчивого состояния в другое всегда осуществляется внешним сигналом [155].
Описанный выше суточный ритм изменения активности гексокиназы и Г-6-Фазы отражает циркадные колебания гормонального фона крови [19], а функционирование данной ферментной системы в автоколебательном режиме невозможно даже по формальным соображениям. Дело в том, что в печени оба фермента могут взаимодействовать друг с другом, составляя типичный футильный (бесполезный энергозатратный) цикл, где угнетаются собственными продуктами:
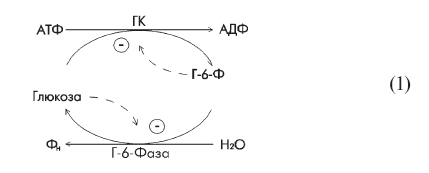
Автор теории футильных циклов Е. Сельков считает, что когда концентрации АТФ и АДФ в клетке стабилизированы и относительная концентрация глюкозы много больше, чем Г-6-Ф, т. е. если
[Глюкоза] / K iГ-6-Фаза >> [Г – 6 – Ф] / KiГК, (2)
где Кi Г-6-Фаза и КiГК – константы ингибирования ферментов своими продуктами, то
VГК >> VГ-6-Ф (3)
и в этом случае синтезируется Г-6-Ф со скоростью
V = VГК – VГ-6-Фаза > 0. (4)
Когда относительная концентрация глюкозы много меньше относительной концентрации Г-6-Ф, т. е. если
[Глюкоза] / K iГ-6-Фаза << [Г – 6 – Ф] / KiГК, (5)
то процесс идет в обратную сторону и Г-6-Ф распадается со скоростью
V = VГК– VГ-6-Фаза < 0. (6)
Анализ взаимодействия гексокиназы и Г-6-Фазы, проведенный Сельковым, показал, что при неизменной концентрации глюкозы в среде и фиксированном состоянии углеводного обмена цикл (1) не только не может автономно (т. е. сам без внешних воздействий) переходить от состояния (2) к состоянию (5) и обратно, но даже активно сопротивляется любым изменениям. Действительно, любой прирост концентрации Г-6-Ф в системе при фиксированной концентрации глюкозы приведет к увеличению VГ-6-Фазы и уменьшению VГК, что будет противодействовать первопричинному повышению концентрации Г-6-Ф [156].
Из схемы (1) видно, что как только цикл перестает обмениваться хотя бы одним из субстратов со средой или углеводным метаболизмом, он стабилизирует максимально бесполезное состояние, где скорости встречных реакций равны друг другу
VГК = VГ-6-Фаза
и где фактически будет выполняться только эквивалентная АТФазная реакция:
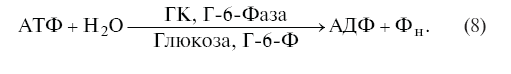
Однако такой вариант работы футильного цикла in vivo вряд ли возможен, хотя бы потому, что печень выполняет функции гомеостата глюкозы крови. Постоянное соответствие скорости поглощения и высвобождения глюкозы печенью степени гипергликемии или гипогликемии объясняют результирующим эффектом работы двух функционально сопряженных ферментов – гексокиназы и Г-6-Фазы [372]. Преобладание активности одного из ферментов, объединенных в субстратный цикл, абсолютно необходимо для печеночных клеток, поскольку именно оно определяет направление потока глюкозы и соответственно уровень гликемии. Постулированные Е. Сельковым переключения нетто-тока субстратов, а также вывод о том, что сигналы, вызывающие перемену его направления, генерируются вне футильного цикла [156], уже сами по себе поддерживают триггерную схему регуляции взаимодействия гексокиназы и Г-6-Фазы в гепатоцитах, которая реализуется с помощью гормонов на генетическом уровне.
Функционирование генетически детерминированного триггерного механизма в печени, являющейся органом-мишенью действия кортикостероидов и инсулина, удобно исследовать на моделях с более или менее длительным изменением функционирования глюкозо-глюкозо-6-фосфат субстратного цикла (переключения 2–5 по Е. Селькову), которое достигается воспроизведением гипер– или гипофункции соответствующих эндокринных желез.
Ранее было показано, что при гиперкортицизме (7-дневное введение гидрокортизона) активность Г-6-Фазы в печени крыс достоверно повышается, а при гипокортицизме (7-дневная адреналэктомия) – снижается [18]. Хроническое перераздражение секреторных элементов коры надпочечников, которое имеет место при развитии истощающего иммобилизационного стресса по Г. Селье, вызывает монотонную активацию Г-6-Фазы в гепатоцитах (рис. II-24).
На этом фоне резким контрастом выглядит снижение активности фермента к 12 ч опыта, когда по расчетам Г. Селье наступает фаза резистентности иммобилизационного стресса, сопровождающаяся существенным уменьшением концентрации 11-ОКС в крови (рис. II-19). Особенно отчетливо этот сдвиг воспроизводится у крыс, получавших тиамин, который, обладая инсулиноподобным действием, способен самостоятельно уменьшать амплитуду стероидогенной реакции надпочечников при стрессе [18].
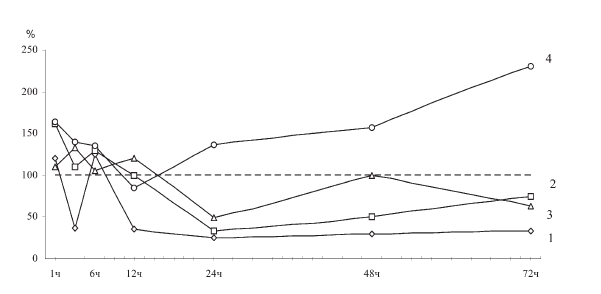
Рис. II-24. Содержание глюкозы (1), глюкозо-6-фосфата (2), активность гексокиназы (3) и глюкозо-6-фосфатазы (4) в печени крыс в различные сроки иммобилизационного стресса
Учитывая четко установленный механизм двойственного гормонального контроля синтеза ферментного белка, специфически расщепляющего Г-6-Ф [437] при анализе собственных данных, легко предположить, что изменение активности Г-6-Фазы в печени всегда зависит от несбалансированного усиления потока «плюс» (инсулиновой) или «минус» (кортикостероидной) информации к репрессору [61] соответствующего генетического локуса. С этих позиций труднее объяснить обнаруженные сдвиги на уровне гексокиназы, которая в отличие от глюкозо-6-фосфатазы не является гормониндуцибельным ферментом [122]. Действительно, при суточной экспозиции иммобилизации по Г. Селье активность ГК в печени стрессировавшихся крыс падает вдвое, а у животных, подвергавшихся аналогичному воздействию, но на фоне тиамина, она в такой же степени увеличивается (рис. II-25).
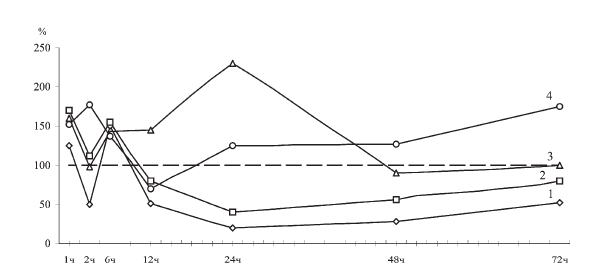
Рис. II-25. Влияние тиамина на содержание глюкозы (1), глюкозо-6-фосфата (2), активность гексокиназы (3) и глюкозо-6-фосфатазы (4) в печени крыс в различные сроки иммобилизационного стресса
Хотя считается, что ГК не контролируется инсулином [122], ее ингибирование и стимуляция в принятых условиях опыта фактически накладываются на однонаправленные колебания инсулинового фона: в конце фазы резистентности истощающего стресса (24 ч иммобилизации), когда отмечается повторный и уже критический всплеск стероидогенеза (рис. II-19), очевидно, имеет место развитие функционального стероидного диабета [329], а активирующее инсулиногенез действие тиамина особенно сильно проявляется как раз при гипофункции ?-клеток поджелудочной железы [18]. Воспроизведение стимулирующего влияния тиамина на уровне независящей от него ГК также заставляет искать какие-то альтернативные варианты гормонального опосредования данного эффекта. В качестве исходных предпосылок здесь могут быть приняты во внимание следующие: 1) генетическая детерминированность сдвигов ГК (в оптимальных условиях определения активности фермента обнаруженные эффекты обусловлены изменением массы ферментного белка); 2) ГК – это маркер пролиферации [61]. В совокупности эти предпосылки выстраиваются в схему генетического триггера, где инсулин играет роль промотора пролиферации камбиальных элементов [4], а у дифференцированных клеток активирует аутосинтетические гены, обеспечивающие восстановительные биосинтезы (белков, липидов, углеводов) и внутриклеточную регенерацию. В обоих случаях инсулин «толкает» маятник генетического триггера клетки из одного устойчивого состояния в другое (работа – репарация) через снижение внутриклеточного уровня цАМФ, который, согласно
Б. Гудвину [35], блокирует оперон пролиферации (аутосинтетические гены). Гормональнообусловленное подавление активности аденилатциклазы и падение содержания цАМФ показаны для всех органов-мишеней [350], в том числе и для печени [27], где эффекты инсулина особенно ярко проявляются на фоне противоположного действия стрессорных гормонов [323].
В основе уникальной способности инсулина тормозить различные эффекты множества контринсулярных гормонов, очевидно, лежит механизм его разнонаправленного влияния на тканевую концентрацию цАМФ и цГМФ [18, 25, 171]. Считается, что реципрокные взаимоотношения цАМФ и цГМФ на клеточном уровне обеспечивают динамический контроль, т. е. «включение» и «выключение» внутриклеточных систем, претерпевающих при своем функционировании противоположно направленные сдвиги [294].
В порядке проверки предположения, что торможение тиамином избыточного гормонообразования в надпочечниках [18], опосредованное антистрессорными эффектами инсулина [218], может сопровождаться переключением генетического триггера в гепатоцитах [33], было проведено исследование динамики соответствующих маркеров на высоте мощного болевого раздражения крыс по Г. Селье [153]. Для этого в стандартных условиях моделирования стресса (подкожное введение 1 мл скипидара) и предварительной нагрузки тиамином (400 мг/кг на 24 ч) через каждые 15 мин от начала раздражения животных в крови измеряли содержание иммунореактивного инсулина, в ткани надпочечников – концентрацию кортикостероидов, а в печени – уровень цАМФ.
Из рис. II-26 видно, что при данном виде стресса гормонообразование в надпочечниках достигает наивысшего уровня уже через 15 мин от начала опыта, а содержание инсулина в крови – только к 30-й минуте (рис. II-27).
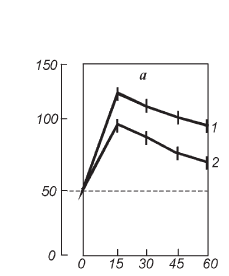
Рис. II-26. Содержание 11-ОКС (а – мкМ/кг) в надпочечниках крыс в динамике острого стресса до (1) и после (2) введения тиамина. Здесь и на рис. II-27, II-28 по осям абсцисс – срок наблюдения, по осям ординат – единицы измерения. Достоверные сдвиги (р<0,05) обозначены звездочкой
На фоне предварительного введения тиамина максимумы стероидогенной и инсулиногенной реакций совпадают по времени. Тиамин не только способствует более раннему увеличению концентрации инсулина в крови, но, что особенно важно, поддерживает повышенный уровень инсулинемии даже через 45 и 60 мин от начала опыта. Результатом этого является нормализация содержания цАМФ, устойчиво повышенного в печени стрессированных крыс (рис. II-28).
Исходя из того, что цАМФ – это мессенджер генетического триггера в эффекторных клетках [35], уменьшение его уровня в принятых условиях может говорить о выключении активности гетеросинтетических генов (оперон дифференцировки), контролируемых стрессорными гормонами [246], и реципрокном включении аутосинтетических генов (оперон пролиферации), контролируемых инсулином [4]. Об этом свидетельствуют факты ингибирования под влиянием тиамина Г-6-Фазы, являющейся маркером дифференцировки [436], и стимуляции гексокиназы (рис. II-25) – маркера пролиферации [430].
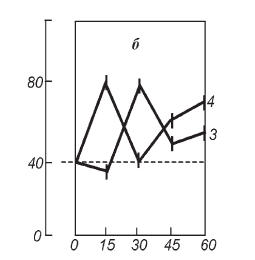
Рис. II-27. Содержание ИРИ (б – МЕ/л · 10—3) в крови крыс в динамике острого стресса до (3) и после (4) введения тиамина
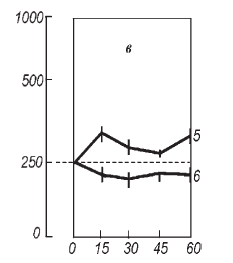
Рис. II-28. Содержание цАМФ (в – пкМ/г) в печени крыс в динамике острого стресса до (5) и после (6) введения тиамина
Поскольку такое действие тиамина проявляется не только при гипокортицизме [18], но и на фоне активации стрессреализующих систем, это означает, что он включает достаточно мощный конкурентный по отношению к стрессорным гормонам механизм инсулиновой регуляции метаболического гомеостаза, на основании которого можно строить новую стратегию витаминокоррекции стресса в клинике.






