2.3. Механизмы кардиотропности тиамина
Антистрессорные механизмы кардиопротекторного действия витамина В1. Применение тиамина или его коферментной формы – кокарбоксилазы в клинике для профилактики и лечения заболеваний сердца традиционно опирается на постулат о коферментном механизме
действия вводимых витаминных препаратов [119]. Между тем открытие тканевых факторов, лимитирующих проявление специфической активности вводимых витаминов (наличие тканевого депо легкодоступных коферментов и отсутствие свободных апоферментов), позволяет радикально пересмотреть прежние представления о принципах современной витаминотерапии и витаминопрофилактики [13, 14, 19]. Этот вопрос актуален и для кардиологии, где кокарбоксилаза до сих пор считается эффективным кардиотропным средством. Поэтому целью работы было выяснение реального механизма корригирующего действия тиамина при экспериментальной патологии сердца, на основе которого можно было бы строить рациональную стратегию использования витамина B1 в кардиологической практике.
По существующим представлениям стресс и ишемия играют главную роль в возникновении основных заболеваний сердца [98, 166, 250], генез которых хорошо описывается моделью с «зацикливанием» возбуждения в системе порочных кругов, в которую оказываются вовлечены гипоталамус, надпочечники, ретикулярная формация среднего мозга и сосудосуживающие центры продолговатого мозга, что порождает непрерывные тонические нисходящие влияния на сердечно-сосудистый аппарат, приводящие к острой ишемии миокарда и сердечной недостаточности [124].
Адекватность такой схемы стрессорной альтерации сердца демонстрируется данными табл. І-8, из которой следует, что асинхронное раздражение крыс электрическим током [205] приводит к нарушению капиллярного кровообращения в сердечной мышце. Об ишемизации миокарда свидетельствуют снижение объемной и поверхностной плотности капилляров, уменьшение их диаметра и соответственно повышение относительной поверхностной плотности капилляров. Функциональным следствием этих сдвигов является достоверное снижение скорости диффузии кислорода через капиллярную стенку (табл. І-9). В совокупности приведенные данные, даже при неизменных скоростях диффузии кислорода через интерстициальное пространство между капилляром и кардиомиоцитом, сарколемму и цитоплазму мышечной клетки (табл. І-9), документируют кислородный дефицит в миокарде в результате ЭБС.
Таблица І-8.
Стереометрические показатели миокарда левого желудочка у экспериментальных животных (M±m)

* Различия достоверны (р < 0,05) с контрольной группой.
Таблица І-9.
Скорость диффузии кислорода через мембрану капилляров (V1), интерстициальное пространство между капилляром и кардиомиоцитом (V2), сарколемму (V3) и цитоплазму мышечной клетки (V4) в миокарде экспериментальных животных (М ± m) в условных единицах

* Различия достоверны (р < 0,05) с контрольной группой.
При воспроизведении ЭБС у крыс по методу О. Десидерато [205] подкожное введение 200 мг/кг тиамина за 2 ч до раздражения оказывает отчетливое противострессорное действие (рис. І-21, І-22) и одновременно нормализует вызванные стрессом нарушения капиллярного кровообращения в миокарде (табл. І-8 и І-9). В соответствии с вышеизложенным взаимообусловленность этих эффектов представляется достаточно очевидной.
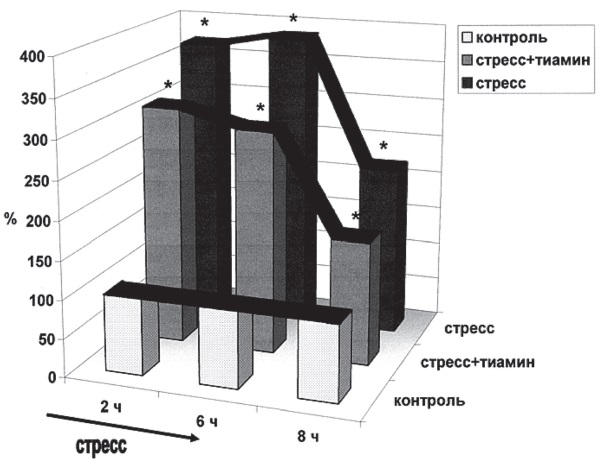
Рис. І-21. Содержание свободных 11-ОКС (%) в плазме крови крыс при эмоционально-болевом стрессе: белые столбики – контроль, черные столбики – ЭБС, серые столбики – тиамин + ЭБС. По оси абсцисс – время (стрелкой обозначена экспозиция стресса)
Для экстраполяции полученных данных в кардиологическую практику, где применение тиамина в виде его коферментной формы – кокарбоксилазы имеет давнюю историю и большой позитивный опыт, необходимо было оценить эффективность кардиопротекторного действия витамина на моделях, имеющих четкий клинический эквивалент. Таким требованиям вполне отвечает модель экспериментального инфаркта миокарда у крыс, вызванного временным сдавливанием левой коронарной артерии [256].
Варианты защитного действия любого кардиопротектора могут быть следующими. Прежде всего возможны активация коронарного кровообращения и усиленное развитие артериальных коллатералей [229].
Этот механизм способствует уменьшению зоны повреждения миокарда, даже если непосредственная устойчивость кардиомиоцитов к ишемии не изменяется. Подобный эффект документируется снижением удельного объема зоны ишемии (VVи). Другой защитный механизм может быть связан с собственно цитопротекторным действием, реализующимся через повышение устойчивости кардиомиоцитов к ишемии (VVп/VVи) и соответственно через адекватное повышение относительного объема зоны защиты (VV3).
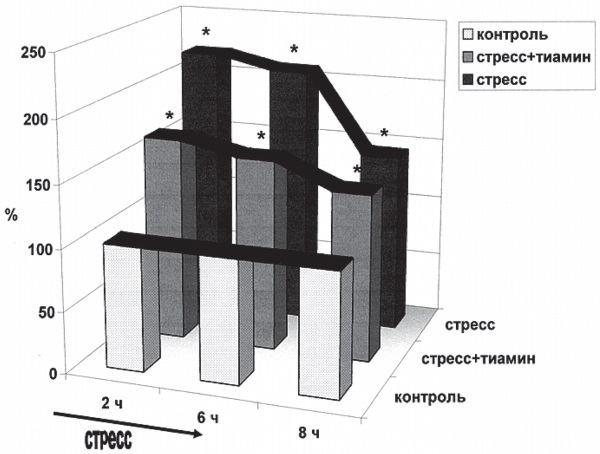
Рис. І-22. Содержание общих 11-ОКС (%) в плазме крови крыс при эмоционально-болевом стрессе. Обозначения те же, что и на рис. І-21
Полученные данные показывают, что тиамин в принятых условиях опыта является эффективным кардиопротектором, защитное действие которого осуществляется за счет второго механизма. Об этом свидетельствуют достоверные изменения Vп/Vи (0,593±0,043 против 0,761±0,041; p < 0,05) и VV3 (0,405±0,021 против 0,240±0,019; p < 0,05) при статистически несущественных отличиях VVи (0,312± 0,076 против 0,321±0,072; р > 0,5) во всех группах опытов (цифры слева) по сравнению с соответствующими контролями (цифры справа).
Таким образом, при отсутствии специфической кардиотропности у тиамина из-за наличия в органе буферного депо кофермента, емкость которого примерно втрое выше потребности тиаминзависимых ферментов (рис. І-23), фактически исключается возможность реализации специфического действия введенного витамина in vivo. Поэтому объяснять многочисленные факты несомненной терапевтической эффективности кокарбоксилазы у кардиологических больных нужно как-то иначе, например за счет механизма расцикливания порочных кругов при реализации антистрессорного действия витамина.
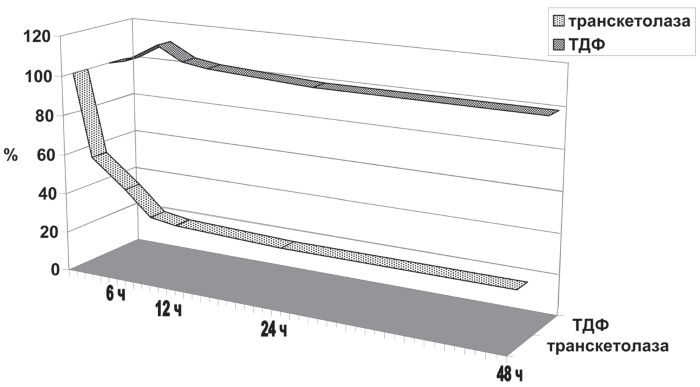
Рис. І-23. Содержание ТДФ (светлая кривая) и активность транскетолазы (темная кривая) в цитоплазматической фракции сердца крыс (6 мг белка в 1 мл 0,15 М KCl, содержащем 0,5 М дитиотреитол) через различные промежутки времени после начала диализа (1 мл/500 мл 0,1 М К-фосфатного буфера, содержащего 0,5 мМ дитиотреитол). Исходный уровень ТДФ, принятый за 100 %, составлял 8,1 мкг на 1 г ткани, активность транскетолазы 25,4 мкмоль С-7-Ф в час на 1 г ткани
Для понимания механизма кардиопротекторного действия тиамина принципиальной является проблема дифференциации специфических (коферментных) и неспецифических (опосредованных) эффектов экзогенного витамина. Существует ряд общих ограничений для проявления специфического действия витамина B1: 1 – отсутствие дефицита тиамина в исследуемой ткани; 2 – отсутствие апоформ витаминзависимых ферментов; 3 – наличие тканевого депо ТДФ [13]. Все эти ограничения действуют в принятых условиях опыта. При развитии компенсаторной гипертрофии сердца (КГС) и инфаркта миокарда обеспеченность сердца тиамином не уменьшается, а увеличивается. В опытах с моделированием КГС (стеноз аорты) или инфаркта миокарда (перевязка коронарных артерий) показано, что тканевое содержание тиамина и его фосфорных эфиров резко увеличивается не только в неповрежденных участках сердечной мышцы [145], но и в предынфарктной зоне и наиболее сильно (в 1,5–2 раза) непосредственно в зоне инфаркта [162]. Синхронно увеличивается и активность транскетолазы (ТК), достигая максимальных значений именно в этой зоне [67]. При развитии КГС темпы накопления ТДФ в сердце значительно опережают темпы нарастания мышечной массы органа [145]. Поэтому рассчитывать на проявление специфического (коферментного) действия дополнительно введенного витамина в этих условиях, очевидно, не приходится. Здесь важно не только то, что исходно ТК уже активирована, но и особенности образования холоформы ТК. Дело в том, что в тканях, содержащих депо ТДФ, нет свободного апофермента ТК. Включение кофермента в белок ТК происходит уже на рибосомах, с которых «сходит» готовый холофермент [22]. Связанный в составе ТК кофермент в дальнейшем ею прочно удерживается: время полужизни белковой и простетической частей фермента равны [47]. Это препятствует появлению в системе свободной апотранскетолазы на посттрансляционных этапах. Факт отсутствия свободной апотранскетолазы практически исключает саму постановку вопроса о коферментном действии вводимого витамина на уровне транскетолазы, поскольку здесь исходно устранена возможность акцепции новообразованного ТДФ предсуществующим апоферментом, в чем, собственно, и состоит его смысл.
В условиях насыщения тканей эндогенным коферментом это ограничение справедливо и для остальных витаминзависимых ферментов. Поскольку ТДФ не является индуктором синтеза специфического ферментного белка (это исключено наличием мощного тканевого депо кофермента), реализация биологического действия вводимого витамина с этого уровня невозможна и по формальным причинам. В отношении ТК известно, что ее период полужизни составляет 140–160 ч, а в сутки обновляется примерно 6–8 % молекул ферментного белка
[48]. Следовательно, в принятых условиях экспозиции действия тиамина (8 ч) при моделировании ЭБС внутриклеточный пул ТК мог обновиться не более чем на 2 %. Даже если не учитывать эквивалентную скорость естественной деградации ферментного белка, то все равно очевидно, что этот сдвиг не может быть основой каких-либо биологических эффектов. Кроме того, логически трудно себе представить, как коферментное действие вводимого тиамина на уровне витаминзависимых ферментов в сердце может реализоваться здесь же изменением микроциркуляции, т. е. через сосудистые реакции, управляемые дистанционно с помощью нервной или гуморальной регуляции. Поэтому объяснение кардиопротекторных эффектов тиамина следует искать не в специфическом механизме действия вводимого витамина на метаболизм сердечной мышцы [119], вероятность которого в силу указанных выше ограничений близка к нулю, а в возможности влияния его на универсальные экстракардиальные механизмы регуляции физиологических процессов. Для этого вполне пригодны существующие традиционные варианты интерпретации стрессорной кардиопатии, например схема, разработанная К. Судаковым. В опытах на кроликах с предварительным вживлением нихромовых электродов в область базальных ядер гипоталамуса им было показано, что при длительной непрерывной стимуляции отрицательных эмоциогенных центров развивается острый эмоциональный стресс с характерным нарушением деятельности сердечно-сосудистого аппарата [67]. Если электрораздражение гипоталамуса производить у адреналэктомированных животных, то гипертензивный эффект, приводящий к острой ишемии миокарда и сердечной недостаточности, обычно вызвать не удается, и, напротив, он легко воспроизводится, когда такое раздражение подкрепляется микроинъекциями гидрокортизона и адреналина в область ретикулярной формации среднего мозга [153]. Отсюда ясен механизм формирования своеобразного порочного круга, когда первично возникающие в условиях острого эмоционального стресса возбуждения лимбико-ретикулярных структур мозга вторично устойчиво поддерживаются обратным действием на них гормонов надпочечников.
Проникая через гематоэнцефалический барьер и взаимодействуя с ?-адренергическим субстратом ретикулярной формации среднего мозга, они оказывают на него вторичное тонизирующее действие. Вследствие этого усиливаются тонические влияния на сосудосуживающие центры продолговатого мозга, что обусловливает стойкое преобладание прессорных эффектов на периферические артериальные сосуды с нарушением кислородного обеспечения сердечной мышцы [153].
Опыты с адреналэктомией показывают, что любая попытка корректировки ситуации, очевидно, возможна лишь через разрыв этого порочного круга. В последней связи можно полагать, что нормализация тиамином нарушенного капиллярного кровообращения в сердечной мышце при ЭБС (табл. І-9) является результатом противострессорного действия витамина (рис. І-21), которое предотвращает развитие контрактурного спазма гладких мышц артериол миокарда, имеющего место при стрессе [98].
Оптимизация ЭБС тиамином не определяется его аналгезирующими свойствами (синаптоанестезией), так как противострессорное действие витамина отчетливо выявляется при различных вариантах моделирования стресс-реакции, в том числе и без применения болевых раздражений, например при введении АКТГ [13].
Поскольку в принятых условиях тиамин действует лишь как антистрессор, его кардиопротекторные эффекты не являются специфичными и могут быть воспроизведены при любом способе оптимизации стресса.
Развитие стрессорной кардиопатии зависит от функционального соотношения стрессреализующих и стресслимитирующих систем организма [98, 214, 220, 237]. Одним из важных эндогенных стресслимитирующих факторов является инсулин, который не только уравновешивает многочисленные метаболические эффекты стресс-гормонов, но и тормозит их образование в надпочечниках [177]. Введение инсулина с глюкозой вызывает четкий противоишемический эффект на инфарцированном миокарде [116]. Тиамин активирует инсулинсинтетическую функцию поджелудочной железы, повышает уровень иммунореактивного инсулина в крови при стрессе и оказывает выраженное инсулиноподобное действие на обмен веществ, в том числе и в отношении процессов, являющихся маркерными на действие инсулина [13]. Поэтому есть все основания связывать кардиопротекторное действие тиамина с антистрессорными эффектами инсулина. Это полностью отвечает концепции витаминно-гормональных связей [13, 14].






