Заключение
Начиная с 1986 г. поступление в реанимационное отделение областной больницы г. Гродно больных с сепсисом неуклонно возрастает. Еще 18–20 лет назад (до чернобыльских событий) эта величина составляла 4–5 больных в год, то сейчас во много раз больше больных поступает в отделение за месяц, т. е. налицо рост иммунодефицита у населения. Причиной может быть не только лучевая нагрузка на гемопоэтическую ткань (расчеты показывают, что после аварии на Чернобыльской АЭС пожизненная костномозговая тканевая доза на душу населения в Беларуси составляет 8,8 мЗв, в северной Украине – 2,8, Центральном районе России – 1,0 мЗв, т. е. в 3–8 раз больше, чем в сопредельных странах) [88], но и стрессорная нагрузка на лимфоидную ткань в результате повышения агрессивности среды обитания (манифестация экологического, экономического, социального кризиса).
Цена стресса (дистресса по Г. Селье) для организма и механизмов его резистентности достаточно велика и может выражаться, прежде всего, в снижении устойчивости к инфекциям, что часто является причиной развития сепсиса. Патогенетически оба состояния имеют много общего и определяются сложным и тесным взаимодействием двух факторов: дефектной реактивностью организма (повышенной стрессчувствительностью) и нарушенным иммунным гомеостазом (наличием иммунодефицита). Стрессчувствительные иммунодефицитные особи представляют собой оптимальную «питательную среду» для генерализации инфекции.
Схожесть фазовой динамики стресса и сепсиса подчеркивает фундаментальную патогенетическую общность обоих состояний. Критерии стресса по Г. Селье (гиперфункция коры надпочечников, инволюция тимуса, лейкоцитоз и лимфопения) одновременно являются маркерами стрессорного иммунодефицита. Пути преодоления и профилактики септических последствий стресса принципиально ясны: это применение различных антистрессорных средств, а также способов воздействия на клетки-мишени, которые страдают от стрессобусловленной аутоагрессии. Применение средств, обладающих антистрессорным действием, здесь регламентируется тем, что сама патология (сепсис) и лечение (мощная антибактериальная терапия, хирургическая санация очагов, использование различных видов экстракорпоральной детоксикации) являются большой, а в сочетании, возможно, чрезмерной стрессорной нагрузкой на надпочечники (активация стероидогенеза), что в свою очередь приводит к тяжелой иммуносупрессии.
Предложенная Г. Селье [153] модель иммобилизационного стресса стала общепринятым способом воспроизведения гормональнообусловленной иммуносупрессии [31, 84]. Многочасовая фиксация животных на спине вызывает лимфопению [47], миграцию Т-лимфоцитов в костный мозг [54], инволюцию тимуса и селезенки [26], снижение реакции бластной трансформации лимфоцитов на различные митогены [86] и угнетение противоопухолевого иммунитета [104]. Поскольку маркерные признаки иммунодепрессии проявляются только при длительной экспозиции раздражения (стадия истощения), при средней (стадия резистентности) они отсутствуют, а при короткой (стадия тревоги) может наблюдаться даже стимуляция иммунологических процессов за счет подавления активности стрессчувствительных Т-супрессоров [104], было интересно исследовать динамику уровня лимфоцитов в крови и их способность образовывать бласты во все фазы иммобилизационного стресса до и после введения тиамина, обладающего выраженным антистрессорным [23] и иммуностимулирующим действием [83].
Результаты исследования влияния хронического иммобилизационного стресса по Г. Селье на способность лимфоцитов периферической крови к пролиферации в ответ на митогенные стимулы показали, что в стадии истощения (48 ч иммобилизации) синтез ДНК при культивировании лимфоцитов с митогенами снижается, что может свидетельствовать о развитии иммунодефицита. Однако в отличие от того, что описано в литературе, такое же снижение включения 3Н-тимидина в ДНК зафиксировано и в самом начале стадии тревоги (1 ч), где предполагалась стимуляция иммуногенеза, а к концу стадии истощения (72 ч) иммунодефицит не только не усугубляется, но исчезает совсем. Поскольку при иммобилизации животных митогензависимые колебания реакции бласттрансформации лимфоцитов (РБТЛ) дублируют динамику фоновой (спонтанной) пролиферации, можно предположить, что ФГА-, ЛПС– и РКW-лимитируемые сдвиги обусловлены не собственно механизмом иммуномодуляции (межклеточной кооперацией), а изменением в каждую фазу стресса количества митогенчувствительных иммунокомпетентных клеток крови, т. е. уровнем лимфопении.
В течение 48 ч иммобилизации животных в циркулирующей крови происходит уменьшение общего количества лимфоцитов, которое к 72 ч опыта нормализуется. Адреналэктомия в принятых условиях опыта устраняет лимфопению, что подчеркивает стероидозависимость лимфоцитарной реакции. Однако несовпадение динамики РБТЛ с динамикой 11-ОКС свидетельствует о том, что циркуляторные эффекты гормонов коры надпочечников, очевидно, скорректированы влиянием стероидозависимых факторов с противоположным действием. Не исключено, что одним из них является мощный антистрессор – инсулин, биосинтез которого в инсулоцитах in vivo активируется кортикостероидами [5].
Характерно, что максимальное снижение общего содержания лимфоцитов крови и активности РБТЛ наблюдаются в самом начале иммобилизационного стресса (1 ч – стадия тревоги), когда имеет место катехоламиновый блок ?-рецепторов поджелудочной железы, приводящий к так называемому «диабету напряжения» [131], и в его заключительной фазе (48 ч – стадия истощения) с развитием типичного «стероидного диабета» из-за функционального перераздражения инсулярного аппарата. На возможность инсулиновой корректировки стероидозависимой лимфопении и РБТЛ указывают данные по тиамину, который повышает уровень лимфоцитов в крови и их способность к пролиферации in vitro именно в те сроки иммобилизационного стресса (1 ч и 48 ч), где предполагается функциональный дефицит инсулина. Дело в том, что тиамин активирует инсулинсинтетическую функцию поджелудочной железы, повышает уровень иммунореактивного инсулина в крови при стрессе и оказывает выраженное инсулиноподобное действие на обмен веществ, в том числе и в отношении процессов, являющихся маркерными на действие инсулина. Показано, что инсулинотропные эффекты тиамина наиболее четко проявляются на гипоинсулиновом фоне [430].
При анализе механизмов инсулиноподобного (иммуномодулирующего) действия тиамина, прежде всего, следует учитывать его антикатехоламиновый (1 ч) и антистероидный (48 ч) эффекты [188]. Известно, что инсулин при парентеральном введении вызывает резкое снижение уровня катехоламинов сначала в венозной, а затем и артериальной крови [439].
Действительно, через 72 ч иммобилизации животных масса тимуса у них уменьшается в три раза, что может свидетельствовать о развитии вторичного иммунодефицита. Но на этом аналогии с данными литературы заканчиваются, поскольку через 72 ч непрерывного раздражения, на фоне инволюции тимуса, которую вызывает истощающий иммобилизационный стресс, функциональные признаки иммунодефицита исчезают, лимфопения прекращается, а пролиферативный ответ лимфоцитов на поликлональные митогены полностью восстанавливается.
Биологический смысл этого парадоксального явления пока неясен. Можно лишь полагать, что данный факт отражает некую фазовость общего иммуннострессорного процесса, проявляющуюся даже в условиях непрерывного 72-часового раздражения, когда функции донора Т-клеток начинают выполнять другие иммунокомпетентные органы, например костный мозг, который в терминальную стадию стресса возвращает в кровоток накопленные им накануне лимфоциты, отмобилизованные тимусом. Что касается гормональной составляющей, то здесь, по-видимому, уместны следующие допущения. Уменьшение лимфопении и восстановление активности РБТЛ в заключительной фазе истощающего стресса, очевидно, обусловлено антистрессорным действием инсулина, концентрация которого в крови животных в этот период повышается. Инсулинозависимость и одновременно фазовость процесса подтверждают данные по тиамину, который способствует более раннему выхождению пика инсулина в крови при стрессе, соответственно сдвигая влево во временной шкале опыта его тропные эффекты в отношении циркулирующих лимфоидных клеток.
Одинаковый синфазный ритм инсулиногенеза и синтеза ДНК в эффекторных клетках в динамике развития стрессорной реакции до и после нагрузок тиамином свидетельствует о том, что сдвиги пролиферации в обоих случаях – это инсулининдуцируемые изменения и что плейотропный эффект витамина В1 является гормональноопосредованным.
Тиамин повышает инсулиносинтетическую функцию поджелудочной железы и оказывает выраженное инсулиноподобное действие на обмен веществ, в том числе и в отношении показателей, являющихся маркерными на действие инсулина [430]. Обусловленный тиамином сдвиг «влево» стрессорного ритма секреции инсулина и соответственно инсулинзависимого ритма пролиферативной активности лимфоцитов (рис. ІІ-15), очевидно, связан с тем, что инсулинотропное действие витамина проявляется с наибольшей эффективностью, прежде всего на гипоинсулиновом фоне [23], в том числе на фоне «транзиторного диабета напряжения», который сопутствует стрессу [131].
Этот минимальный набор данных позволяет сформулировать рабочую гипотезу триггерного механизма: стрессреализующие (кортикостероиды) и стресслимитирующие (инсулин) гормоны, активируя мембранные или цитоплазматические рецепторы (S1 и S2), синергично с ферментами Е2 (аденилатциклаза) и Е1 (гуанилатциклаза) инициируют производство внутриклеточных посредников (циклические нуклеотиды). Далее в соответствии с концепцией оперона цАМФ – корепрессор синтеза Е1, соединяясь с репрессором R1, блокирует оператор структурного гена О1, препятствуя образованию мРНК1, мРНКП и митотических белков (РМ). А цГМФ – корепрессор синтеза Е2 вместе с R2 репрессирует синтез мРНК2, мРНКД и специфических функциональных белков (РД).
Данная схема перекрестной регуляции дифференцировки и пролиферации лимфоидных клеток крови крыс при стрессе фактически описывает генетический триггер, который в зависимости от природы и степени сродства управляющих сигналов может работать как рубильник-переключатель реципрокных оперонов, «перебрасывающий» жизнедеятельность системы из одного стационарного состояния в другое. Согласно [111], триггеры, т. е. системы, способные неопределенно долго находиться в любом из двух возможных устойчивых пограничных состояний, играют большую роль в механизмах биологической регуляции.
Настоящая модель учитывает представления о перекрестной регуляции дифференцировки и пролиферации по механизму обратной связи, который осуществляется при соединении эффектора с соответствующим репрессором функционального и митотического оперонов [111], кейлонную гипотезу [244], где важную роль в реализации механизма обратной связи, лимитирующего пролиферацию, играют циклические нуклеотиды (цАМФ) и стрессорные гормоны, а также данные о том, что инсулин и гидрокортизон являются соответственно индукторами пролиферации и дифференцировки клеток молочной железы [349] и могут разнонаправленно влиять на содержание цГМФ и цАМФ в лимфоцитах как in vivo, так и in vitro [86].
Схема общего типа взаимодействия между указанными группами генов предельно упрощена, ее не следует понимать буквально, однако она решает поставленную задачу – позволяет рассмотреть динамическое поведение системы. Согласно схеме, гены связаны с различными клеточными функциями и со средой через специфические рецепторы, которые могут реагировать на гормональные сигналы и изменять внутриклеточное состояние. Связывание гормонального эффектора дифференцировки (стресслимитирующие гормоны) с рецепторным аппаратом лимфоцитов вызовет увеличение в них уровня цАМФ и соответственно блокирование белков митоза, что может привести к новому стационарному состоянию с пониженной скоростью пролиферации и постепенному дрейфу системы в направлении дифференцировки. При этом в результате репрессии митотического оперона клеточного цикла и снижения уровня цГМФ, подавляющего вместе с R2 оперон дифференцировки, будет производиться все больше и больше цАМФ (и соответственно R1цАМФ), что, в конце концов, приведет к полному прекращению пролиферации и остановке клеточного цикла. С другой стороны, связывание митогенных факторов роста (инсулин) с рецепторами клеточной мембраны через повышение в лимфоцитах уровня цГМФ будет с зеркальной точностью инициировать пролиферацию в ущерб дифференцировке.
Хроническое перераздражение секреторных элементов коры надпочечников, которое имеет место при развитии истощающего иммобилизационного стресса по Г. Селье, вызывает монотонную активацию Г-6-Фазы в гепатоцитах. На этом фоне резким контрастом выглядит снижение активности фермента к 12 ч опыта, когда по расчетам Г. Селье наступает фаза резистентности иммобилизационного стресса, сопровождающаяся существенным уменьшением концентрации 11-ОКС в крови. Особенно отчетливо этот сдвиг воспроизводится у крыс, получавших тиамин, который, обладая инсулиноподобным действием, способен самостоятельно уменьшать амплитуду стероидогенной реакции надпочечников при стрессе [18].
Учитывая четко установленный механизм двойственного гормонального контроля синтеза ферментного белка, специфически расщепляющего Г-6-Ф [437] при анализе собственных данных, легко предположить, что изменение активности Г-6-Фазы в печени всегда зависит от несбалансированного усиления потока «плюс» (инсулиновой) или «минус» (кортикостероидной) информации к репрессору [61] соответствующего генетического локуса. Воспроизведение стимулирующего влияния тиамина на уровне независящей от него гексокиназы (ГК) также заставляет искать какие-то альтернативные варианты гормонального опосредования данного эффекта. В качестве исходных предпосылок здесь могут быть приняты во внимание следующие: 1) генетическая детерминированность сдвигов ГК (в оптимальных условиях определения активности фермента обнаруженные эффекты обусловлены изменением массы ферментного белка); 2) ГК – это маркер пролиферации [61]. В совокупности эти предпосылки выстраиваются в схему генетического триггера, где инсулин играет роль промотора пролиферации камбиальных элементов [4], а у дифференцированных клеток активирует аутосинтетические гены, обеспечивающие восстановительные биосинтезы (белков, липидов, углеводов) и внутриклеточную регенерацию. В обоих случаях инсулин «толкает» маятник генетического триггера клетки из одного устойчивого состояния в другое (работа – репарация) через снижение внутриклеточного уровня цАМФ, который, согласно [34], блокирует оперон пролиферации (аутосинтетические гены). Гормональнообусловленное подавление активности аденилатциклазы и падение содержания цАМФ показаны для всех органов-мишеней [350], в том числе и для печени [233], где эффекты инсулина особенно ярко проявляются на фоне противоположного действия стрессорных гормонов [323].
При мощном болевом раздражении крыс по Г. Селье (подкожное введение скипидара) гормонообразование в надпочечниках достигает наивысшего уровня уже через 15 мин от начала опыта, а содержание инсулина в крови – только к 30-й минуте. На фоне предварительного введения тиамина содержание 11-ОКС в надпочечниках отчетливо снижается, а максимумы стероидогенной и инсулиногенной реакций совпадают по времени. Тиамин не только способствует более раннему увеличению концентрации инсулина в крови, но, что особенно важно, поддерживает повышенный уровень инсулинемии даже через 45 и 60 мин от начала опыта. Результатом этого является инсулинозависимая нормализация содержания цАМФ, до этого устойчиво повышенного в печени стрессированных крыс. Поскольку такое действие тиамина проявляется на фоне активации стрессреализующих систем, это означает, что он включает достаточно мощный и конкурентный по отношению к стрессорным гормонам механизм инсулиновой регуляции метаболического гомеостаза, на основании которого можно строить новую стратегию витаминокоррекции стресса в клинике.
Традиционная интенсивная терапия сепсиса (радикальная санация очагов, антибактериальная терапия, экстракорпоральная детоксикация) не устраняет исходный иммунодефицит. Более того, по имеющимся в литературе данным, указанные лечебные мероприятия способны даже его усугубить [26, 168].
Почему это происходит, можно показать на примере гемосорбции. Гемосорбция, позволяющая элиминировать из крови вещества молекулярной массой от 500 до 5000 дальтон [88], так называемые средние молекулы, в том числе пептиды, с накоплением которых связывают развитие эндотоксикоза и иммуносупрессии [93], является на сегодняшний день одним из важнейших и наиболее патогенетически обоснованных методов в комплексной схеме интенсивного лечения сепсиса [6]. Тем не менее гемосорбция не только не компенсирует имеющуюся при сепсисе недостаточность Т– и В-звеньев иммунитета, но обусловливает некоторую тенденцию к ее углублению в результате стимуляции стероидогенеза. Активация надпочечников фиксируется уже после первой процедуры и сохраняется на протяжении всего времени применения экстракорпоральной детоксикации, формируя состояние устойчивого гиперкортицизма. Элиминация глюкокортикостероидов из крови активированными углями при проведении гемосорбции [167] приводит к суперкомпенсации потерь за счет растормаживания гипофиза (устранение отрицательной обратной связи) и развития обычной стрессорной реакции. Таким образом, проблема иммунокоррекции при сепсисе – это в значительной мере проблема оптимизации стресса. Клинические испытания подтвердили это предположение. Применение антистрессорных средств здесь регламентируется тем, что сама патология (сепсис) и лечение (мощная антибактериальная терапия, хирургическая санация очагов, использование различных травматических видов экстракорпоральной детоксикации) являются большой, а в сочетании, возможно, чрезмерной стрессорной нагрузкой на надпочечники (активация стероидогенеза), что в свою очередь приводит к тяжелой иммуносупрессии. Причинами снижения функциональной активности лимфоцитов периферической крови при стрессе являются транзиторная лимфопения, вызывающая обеднение внутрисосудистого пула лимфоцитов благодаря избирательной эмиграции рециркулирующих клеток, а также прямое угнетение глюкокортикостероидами пролиферации отдельных субпопуляций лимфоцитов [305].
Применение комплекса витаминов В с Т-активином при сепсисе вызывает выраженный антистрессорный эффект (снижение функционального ответа надпочечников на гемосорбцию) и устранение исходного иммунодефицита (достоверное повышение содержания в крови иммунокомпетентных клеток). Четкая синхронизация (зеркальность) сдвигов указывает на их взаимную обусловленность.
Если вместо Т-активина в схему лечения сепсиса ввести ультрафиолетовое облучение (УФО), действие которого в отношении лимфоцитов крови противоположно действию гормонов тимуса, то иммунокорригирующий эффект (прирост клеточного пула) В-витаминов, несмотря на сохранение его антистрессорного влияния (одинаковое снижение в крови уровня биологически активных свободных форм кортикостероидов), заметно сокращается. По-видимому, УФО-зависимая фотоальтерация клеточных мембран [151] нарушает дифференцировку лимфоцитов и соответственно сокращает клеточный резерв пролиферации. Изменения клеточных мембран, очевидно, носят малообратимый характер, поскольку дополнительное введение Т-активина хотя и повышает иммунокорригирующий эффект В-витаминов, но не выводит его на уровень сдвигов, наблюдающихся без облучения.
Следовательно, сочетание УФО и Т-активина в схеме лечения сепсиса вряд ли целесообразно. В то же время сочетание Т-активина с витаминами антистрессорного действия в принятых условиях себя полностью оправдало.
Сейчас хорошо известно, что биологическое действие гормонов тимуса резко усиливается на фоне гипокортицизма, и зачастую достаточно даже кратковременного снижения уровня глюкокортикостероидов в крови для создания условий, обеспечивающих длительный стимулирующий систему клеточного иммунитета эффект тимозина [191]. Полученные нами данные показывают, что вызванные совместным применением В-витаминов с Т-активином иммуномодуляция и нивелирование гормональнообусловленной иммуносупрессии позволяют снизить уровень летальности у больных в условиях проведения интенсивного комплексного лечения сепсиса с 37,4 до 13,3 %. Если выздоровление рассматривать как интегральный критерий реабилитации гомеостаза, то следует признать, что антистрессорные витамины в сочетании с иммуномодуляторами являются эффективным гомеостатическим (иммунокорригирующим) средством при сепсисе.
Существующий опыт использования в онкологической клинике [13] дрожжевого рекомбинантного интерлейкина-2, показывает, что наряду с выраженной иммуностимуляцией многочасовое капельное введение ронколейкина часто вызывает у больных развитие лихорадочного состояния, которое может быть проявлением побочного стрессогенного действия препарата, снижающего эффективность иммунокорригирующего лечения.
Экзогенный ИЛ-2 проявляет себя как стрессор и при сепсисе. Об этом свидетельствует двукратное повышение общих, белковосвязанных и свободных 11-ОКС, а также лимфопения наблюдающиеся сразу после завершения первой инфузии ронколейкина. Зеркальный характер сдвигов в системе «11-ОКС – лимфоциты» подчеркивает их взаимообусловленность, т. е. лимитирующую роль гормонов коры надпочечников в оформлении лимфопенической реакции. Исходя из того, что парадоксальный лимфопенический эффект ронколейкина является результатом 4-часовой активации стероидогенеза под влиянием препарата, можно заключить, что для усиления иммуномодулирующих эффектов цитокина необходимо нивелировать стрессогенную составляющую его действия.
Неспецифический харарактер этих изменений подчеркивают антистрессорные витамины, которые в принятых условиях, т. е. при нагрузке септических больных ронколейкином, действуют так же, как и при других видах стресса – достоверно снижают амплитуду стероидогенной реакции и одновременно нивелируют стрессорные сдвиги в системе крови.
Клинический анализ крови показал, что у больных сепсисом исходно наблюдаются такие же изменения, как и при стрессе: лейкоцитоз со сдвигом формулы влево и лимфопения. У больных 5, 6 и 7-й групп до лечения (контроль) наличие 2, 3 и 4 клинических признаков SIRS (системный ответ на агрессию) было выявлено соответственно в 100, 69 и 33 % случаев. Оценка исходного состояния пациентов по системе APACHE-II и шкале SAPS (стрессорный статус) показала, что в целом у всех больных до лечения средний балл в первом случае составил 14, а во втором – 8,0, что позволяло прогнозировать вероятную летальность на уровне 25 %. Факт повышения эффективности лечебного действия ронколейкина под влиянием В-витаминов документируется улучшением клинического состояния больных 7-й группы, которое проявлялось 2-кратным снижением среднего балла по шкалам SAPS и APACHE-II, ослаблением степени тяжести эндотоксикоза в виде обрыва лихорадки, нормализацией гемодинамики, достоверного снижения лейкоцитоза, лейкоцитарного индекса интоксикации, увеличением относительного и абсолютного количества лимфоцитов, улучшением биохимических показателей крови. У больных, получавших ронколейкин, клинический эффект обнаруживался заметно реже, тогда как у пациентов контрольной группы либо вообще не отмечалось существенной клинической динамики, либо она была отрицательной, хотя и в этом случае регистрировалось умеренное снижение среднего балла по обеим шкалам.
Цитокинотерапия на фоне В-витаминов характеризовалась выраженным иммунокорригирующим действием. При сочетанном применении стресслимитирующих витаминов и ронколейкина коррекция клеточного (сдвиги на уровне иммунокомпетентных клеток) и гуморального иммунитета (сдвиги на уровне иммуноглобулинов) была более выраженной.
Через сутки после первой инфузии ронколейкина общее количество Т-лимфоцитов (CD3) и Т-хелперов (CD4) по сравнению с исходным уровнем изменилось мало, а вот субпопуляция Т-супрессоров (CD8) сократилась почти на четверть. В результате структура кооперативных связей между элементами иммунореактивности в системе Т-клеточного иммунитета формально восстанавливается, однако это вряд ли можно рассматривать как признак иммунореабилитации. Оптимальное соотношение внутрипуловых субпопуляций, обеспечивающих эффективную реализацию специализированной функции иммунокомпетентных Т-клеток, отражает индекс (CD4/CD8), который в норме равен 1,2–1,8. У больных сепсисом исходное снижение индекса (CD4)/(CD8) до 0,8 определяется не только избытком Т-супрессоров, но и подавлением Т-хелперов. Иммунореабилитация ВИД, в принципе, предполагает общее увеличение всего пула Т-клеток, когда же ничего подобного не происходит, а имеет место снижение одной из его субфракций (CD8), то речь здесь может идти в первую очередь об иммуносупрессии, т. е. о стрессогенном влиянии ронколейкина.
Если ронколейкин применять вместе со стресслимитирующими витаминами, то на первый план выдвигается иммунопротекторная составляющая его действия. В этом случае через сутки после первой инфузии цитокина наблюдается существенный рост общего содержания Т-лимфоцитов в крови больных сепсисом, главным образом за счет увеличения субпопуляции Т-хелперов и в меньшей степени Т-супрессоров. Нивелирование снижения уровня Т-супрессоров, отмеченное у больных, получавших ронколейкин, очевидно, может быть еще одним проявлением антистрессорного действия витаминов, поскольку известно, что именно эта субпопуляция лимфоидных клеток (CD8) отличается наибольшей чувствительностью к кортикостероидам [183]. Таким образом, витамины фактически нормализуют нарушенное стрессом функционально важное соотношение CD4/CD8, которое у больных сепсисом после совместного применения витаминов группы В и ронколейкина достигает оптимального значения, что объективно отражает факт иммуномодуляции.
При тяжелом сепсисе (SAPS больше 20 баллов) наблюдается феномен «исчезающих глобулинов» – резкое снижение иммуноглобулинов класса IgA, IgM и особенно IgG, что является поводом для применения соответствующей заместительной терапии антителами [171]. У наших больных при гораздо меньших значениях SAPS – 8 и APACHE – 14 все фракции иммуноглобулинов крови находятся на уровне нижней границы нормы. На следующий день после первой инфузии ронколейкина концентрация IgA, IgM и IgG заметно не изменялась. Введение ронколейкина на фоне действия антистрессорных витаминов в это же время достоверно повышало уровень IgG по сравнению с исходным.
Известно, что стрессорный всплеск стероидогенеза подавляет не только клеточный, но и гуморальный иммунитет, вызывая сбои в работе В-лимфоцитов, препятствующие их превращению в плазматические клетки, что, в конце концов, приводит к угнетению антителообразования. Следовательно, снижение уровня 11-ОКС у больных сепсисом, обеспечиваемое антистрессорными витаминами, может быть необходимым условием для проявления иммуномодулирующего действия ронколейкина, которое распространяется и на В-клетки, а через них и на продукцию IgG. Поскольку синтез IgG зависит от Т-хелперов [186], которые контролируются инсулином [68], увеличение этой фракции антител в крови больных сепсисом, получавших ронколейкин вместе с В-витаминами, очевидно, можно замкнуть на механизм инсулинового опосредования действия основного компонента комплекса – витамина В1 как в части ограничения амплитуды стероидогенной реакции, так и в части влияния на пролиферацию иммуноцитов, являющихся клетками-мишенями для данного гормона.
В последней связи важно отметить, что стресслимитирующее действие витаминов существенно повышает терапевтический эффект ронколейкина у больных сепсисом. Результат оценки формализованных показателей SAPS и APACHE II свидетельствует о заметно большем снижении тяжести состояния пациентов после сочетанного применения ронколейкина и антистрессорных витаминов, чем одного ронколейкина. Объективными критериями, подтверждающими этот факт, служат также уменьшение реальной летальности по сравнению с прогнозируемой, уменьшение сроков пребывания в палате интенсивной терапии, которые были всегда самыми значимыми в группе, где применялось сочетанное витаминно-цитокиновое лечение.
Таким образом, применение В-витаминов при сепсисе оправдано с позиций патогенетической коррекции ВИД и усиления иммуномодулирующего действия ронколейкина. Стресслимитирующие витамины фактически обеспечивают эндогенную реактивацию иммунной системы в условиях гиперкортицизма и являются пусковым фактором последующей реинтеграции различных звеньев иммунитета под влиянием ронколейкина, что определяет целесообразность их совместного применения в комплексной терапии сепсиса.
Подводя итог вышеизложенному, необходимо отметить, что сформировавшиеся в начале ХХ в. классические представления о сепсисе в последнее время кардинально изменились. Согласно [239], септический процесс характеризуется фазовым течением: SIRS (синдром системной воспалительной реакции) – CARS (синдром компенсаторного антивоспалительного ответа) – MOD (мультиорганная дисфункция). В настоящее время под SIRS подразумевают системный ответ не только на инфекцию, но и на разнобразные экстремальные воздействия и на агрессию – травму, ожоги, повторные оперативные вмешательства, радиационные повреждения, шоки и т. п. При этом ключевую роль в динамике процесса SIRS/MOD играет не генерализованное размножение бактериальной микрофлоры, а реакция организма на повреждение, клинически проявляющаяся симптомами SIRS. Следовательно, сепсис является не столько результатом микробной атаки макроорганизма, сколько следствием стрессобусловленных нарушений в иммунном звене гомеостаза, проходящих в своем развитии от состояния его избыточной активации («фаза гипервоспаления») к состоянию иммунодефицита («фаза иммунопаралича»).
Летальность при сепсисе достигает значительных цифр и колеблется в широких пределах от 20 до 40 % и прогрессивно нарастает при развитии септических осложнений, таких, как ПОН и септический шок, – от 40 до 70 % [2, 229]. Причиной этого может быть тот факт, что применяемые лечебные мероприятия не решают реабилитационной задачи, т. е. восстановления имеющегося дефекта гомеостаза. По статистическим данным США, в 1990-х годах число смертельных исходов сепсиса по стране составляло порядка 600 000 случаев в год [7]. В целом по Европе ежегодно регистрируется до 500 000 случаев сепсиса – один на тысячу госпитализированных [239]. В клинике Гродненского медицинского университета учет данной категории пациентов проводится с 1982 г. Позитивный опыт использования здесь антистрессорных витаминов в комбинации с иммуномодуляторами при сепсисе выявляет не только пути коррекции нарушений иммунной составляющей гомеостаза при сепсисе, но и способы их профилактики. Данный подход позволил снизить летальность в группе больных, подвергавшихся гемосорбции, с 37,4 до 13,3 % и с 25 до 8,3 % в группе больных, получавших ронколейкин (рис. II-33).
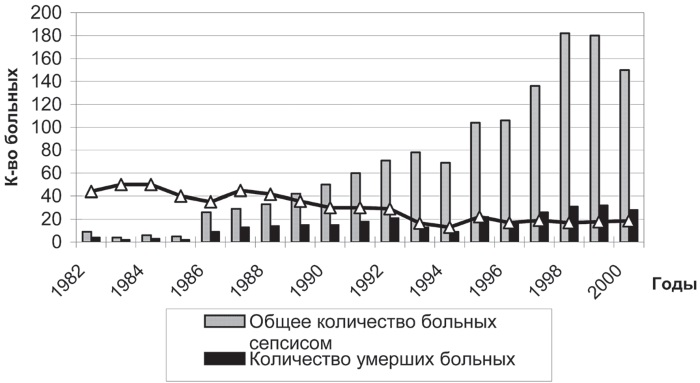
Рис. II-33. Динамика уровня летальности больных сепсисом в 1982–2000 гг. по данным реанимационного отделения областной клинической больницы г. Гродно
Результаты выполненных экспериментально-клинических исследований позволяют предложить для внедрения в медицинскую практику метод повышения эффективности комплексного лечения сепсиса с помощью комбинации витаминов В1, В6, В12 и иммуномодуляторов (Т-активин, ронколейкин).
Показанием к совместному применению витаминов, обладающих антистрессорным действием, и Т-активина является использование стрессогенных процедур интенсивной терапии сепсиса, которые усиливают вторичный иммунодефицит и снижают эффективность иммунокорригирующей терапии. Для получения максимального эффекта Т-активин необходимо применять после введения В-витаминов, обладающих антистрессорным действием. Накануне (за 24 ч) и за 2 ч до каждой процедуры (гемосорбция, УФОК, плазмаферез и т. д.) следует вводить вначале витамин В1 (2 мл 6 % р-ра), затем через 1 ч последовательно витамин В6 (2 мл 5 % р-ра) и витамин В12 (2 мл 0,01 % р-ра), а на ночь подкожно 0,01 % р-р Т-активина из расчета 40 мкг/м2 поверхности тела.
Показанием к совместному применению антистрессорных витаминов и ронколейкина является стрессогенная активность самого цитокина, которая заметно снижает его иммунокомпетентность. При использовании ронколейкина витамины группы В следует вводить внутривенно накануне (за 24 ч) и за 2 ч до каждой инфузии ронколейкина – вначале 2 мл 6 % р-ра витамина В1, а через 1 ч последовательно 2 мл 5 % р-ра витамина В6 и 2 мл 0,01 % р-ра витамина В12.
Введение в традиционную схему комплексного лечения сепсиса В-витаминов в сочетании с иммуномодуляторами решает реабилитационную задачу по восстановлению иммунного гомеостаза за счет снижения тяжелой гормональнообусловленной иммуносупрессии, вызванной стрессорным действием самой патологии и используемыми методами ее коррекции (мощная антибактериальная терапия, хирургическая санация очагов, применение травматичных видов экстракорпоральной детоксикации, ультрафиолетового облучения крови и т. д.), что приводит к повышению эффективности лечебных мероприятий и снижению летальности больных.
Фактически речь идет о реализации предсказательной силы концепции витаминно-гормональных связей [430] через оптимизацию комплексного лечения сепсиса, т. е. о новых показаниях к применению витаминов в лечебной практике (сепсисологии), что является вкладом в создание некоферментной витаминологии как отдельной научно-практической дисциплины в медицине [23]. Позитивный опыт использования витаминов, обладающих антистрессорным действием, при сепсисе указывает не только на пути коррекции стрессобусловленного иммунодефицита, но и способы его профилактики. Учитывая экспансию стрессорной патологии и опасность ее для здоровья населения Беларуси, проблема оптимизации стресса должна решаться централизованно, через создание и реализацию государственных оздоровленческих программ, где научно обоснованная витаминопрофилактика стресса будет играть ключевую роль.






