5.3. Тиамин и стрессорная лимфопения
Механизмы регуляции функций иммунной системы связаны с рядом ключевых концепций эндокринологии. Так, катаболическая активность стрессорных гормонов в отношении лимфоидных органов – это, по-существу, механизм иммуносупрессии, а пролиферативная активность инсулина в отношении иммунокомпетентных клеток определяет механизм иммуномодуляции. На поверхности и внутри Т(В) – лимфоцитов, а также макрофагов обнаружены высокоаффинные рецепторы для стресслимитирующих (инсулин) и стрессреализующих (катехоламины, кортикостероиды) гормонов, а вторичные гормональные мессенджеры (цГМФ и цАМФ) одновременно являются положительными и отрицательными медиаторами их пролиферации.
Адекватность «эндокринологического подхода» к иммунологическим проблемам особенно ярко проявляется при анализе взаимоотношений стресса и иммунитета, которые Г. Н. Крыжановский рассматривал в неразрывной связи, как общебиологические категории, реализующиеся в ряде своих существенных проявлений сочетанно и друг через друга [90]. Исходя из этого, некоторые авторы оценивают иммунологические проявления стресса как патологию нейроэндокринной регуляции иммуногенеза [47].
В серии работ [47, 54] реакцию системы крови крыс на 6-часовой иммобилизационный стресс исследовали через 6, 9, 12, 24, 48 и 72 ч от начала опыта, т. е. фактически в период отдыха животных, где выявленные изменения клеточного состава довольно сложно интерпретировать как гормональнообусловленные, поскольку время возникновения наблюдаемых сдвигов в большинстве случаев синхронизируется не с максимумом гормональных перестроек, а с периодом послестрессовой нормализации уровня гормонов [86]. Особенно трудно в принятых условиях выявить катехоламиновую составляющую, поскольку повышение тонуса симпатической нервной системы и выделение адреналина из хромаффинной ткани всегда имеет место в самом начале развития стрессорной реакции [131].
В иммунологических экспериментах на мышах [84] животным после 3-кратного ежедневного 8-часового обездвиживания давали 3 дня отдохнуть, затем их забивали и исследовали способность Т-лимфоцитов селезенки к продукции ИЛ-2мРНК. В то же время известно, что при часовой фиксации кроликов в положении лежа на спине уровень 11-оксикортикостероидов в их крови увеличивается вдвое, а через 1 ч после прекращения раздражения падает до исходного [201]. Поэтому наблюдаемые разными авторами колебания гуморального и клеточного иммунитета, особенно в отдаленные сроки после воздействия, могут быть связаны не с предшествующим стрессорным эпизодом, а с физиологической (циркадной) ритмикой функционирования эндокринных желез [22] и органов иммунной системы [77].
Часто используемые в качестве аргументов поддержки тезиса о стрессзависимости сдвигов ссылки на известное катаболическое действие экзогенных кортикостероидов в отношении лимфоидной ткани здесь вряд ли уместны, поскольку индуцируемая в опытах in vitro и in vivo иммуносупрессия, как правило, лимитируется их эффективной концентрацией, т. е. проявляется при внесении гормонов в культуры клеток или при тестировании способности к ответу на митогены клеток, взятых после введения гормонов в организм, и зависит от дозы и времени аппликации по отношению к митогенной стимуляции [422].
Отсюда ясно, что для дифференцированной оценки влияния стресса на те или иные иммунологические показатели забой животных следует производить во время раздражения, а для учета фазового характера стрессорной реакции (0—12 ч иммобилизации крыс – стадия тревоги, 12–24—48 ч – стадия резистентности, 48–72 ч – стадия истощения [22]) наблюдаемые сдвиги требуют четкой «привязки» к ее временным координатам. Гормональную составляющую в стрессзависимой динамике иммуногенеза, очевидно, можно оценить только при сопоставлении соответствующих сдвигов во временной шкале опыта.
У людей и животных при психоэмоциональном, болевом, травматическом, операционном и других видах стресса подавление пролиферативной активности лимфоидных клеток и их ответа на митогены прямо зависит от выраженности и длительности раздражения [54, 86, 363], поэтому снижение реакции бласттрансформации лимфоцитов (РБТЛ) у больных рассматривается как плохой прогностический признак, свидетельствующий о глубоком иммунодефиците с перспективой развития септического состояния [347].
Результаты исследования влияния хронического иммобилизационного стресса на способность лимфоцитов периферической крови к пролиферации в ответ на митогенные стимулы приведены на рис. II-15—II-18.
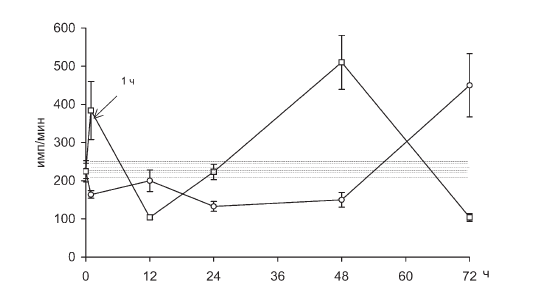
Рис. II-15. Спонтанная пролиферация Т-лимфоцитов в крови крыс в динамике хронического стресса до (?) и после () введения тиамина. Здесь и на рис. II-16, II-17, II-18 по осям абсцисс – срок наблюдения; по осям ординат – количество импульсов в 1 мин, заштрихованные участки – доверительные границы нормы
Действительно, в стадии истощения (48 ч иммобилизации) синтез ДНК при культивировании лимфоцитов с митогенами снижается, что может свидетельствовать о развитии иммунодефицита. Однако в отличие от того, что описано в литературе, такое же снижение включения 3Н-тимидина в ДНК зафиксировано и в самом начале стадии тревоги (1 ч), где предполагалась стимуляция иммуногенеза [183], а к концу стадии истощения (72 ч) иммунодефицит не только не усугубляется, но исчезает совсем. Исходя из того, что при иммобилизации животных митогензависимые колебания РБТЛ дублируют динамику фоновой (спонтанной) пролиферации, можно предположить, что ФГА-, ЛПС– и РКW-лимитируемые сдвиги обусловлены не собственно механизмом иммуномодуляции (межклеточной кооперацией), а изменением в каждую фазу стресса количества митогенчувствительных иммунокомпетентных клеток крови, т. е. фактически определяются соответствующими сдвигами лимфопении.
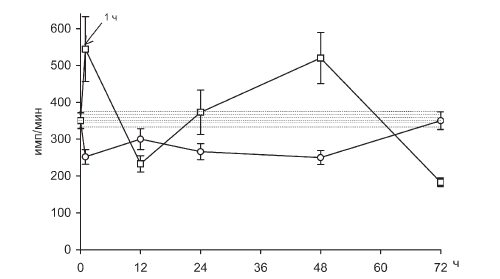
Рис. II-16. ЛПС-реактивность Т-лимфоцитов в крови крыс в динамике хронического стресса до (?) и после () введения тиамина
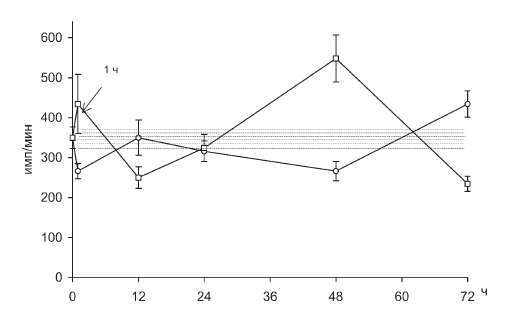
Рис. II-17. PKW-реактивность Т-лимфоцитов в крови крыс в динамике иммобилизационного стресса до (?) и после () введения тиамина
Известно, что антигенная стимуляция иммуногенеза является функцией содержания лимфоцитов в крови. У ночных животных в утреннее и дневное время из центральных органов в периферическую циркуляцию идет интенсивная эмиграция лимфоцитов с высоким уровнем внутриклеточного метаболизма. В вечернее и ночное время интенсивность этих процессов значительно снижается. Соответственно и введение Т-зависимого антигена (эритроцитов барана) мышам утром и днем обусловливает более высокий уровень гуморального иммунного ответа, чем вечером и ночью [77].
В течение 48 ч иммобилизации животных в циркулирующей крови происходит уменьшение общего количества лимфоцитов (рис. II-21), которое к 72 ч опыта нормализуется.
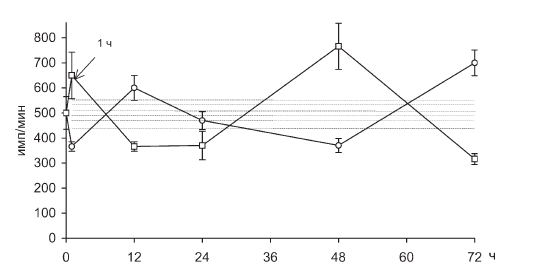
Рис. II-18. ФГА-реактивность Т-лимфоцитов в крови крыс в динамике хронического стресса до (?) и после () введения тиамина
Повышение содержания нейтрофильных гранулоцитов отмечается в первые 12 ч иммобилизации, что соответствует данным литературы [31]. Адреналэктомия в принятых условиях опыта устраняет лимфопению, но не лейкоцитоз (рис. II-20), что подчеркивает стероидозависимость именно лимфоцитарной реакции. Однако несовпадение динамики РБТЛ с динамикой 11-ОКС (рис. II-15, II-16 и рис. II-18, II-19) свидетельствует о том, что циркуляторные эффекты гормонов коры надпочечников, очевидно, скорректированы влиянием стероидозависимых факторов с противоположным действием. Не исключено, что одним из них является мощный антистрессор – инсулин, биосинтез которого в инсулоцитах in vivo активируется кортикостероидами [83].
Характерно, что максимальное снижение общего содержания лимфоцитов крови (рис. II-21) и активности РБТЛ (рис. II-15, II-16, II-17, II-18) наблюдается в самом начале иммобилизационного стресса (1 ч – стадия тревоги), когда имеет место катехоламиновый блок ?-рецепторов поджелудочной железы, приводящий к так называемому «диабету напряжения» [49, 131], и в его заключительной фазе (48 ч – стадия истощения) с развитием типичного «стероидного диабета» из-за функционального перераздражения инсулярного аппарата [5].
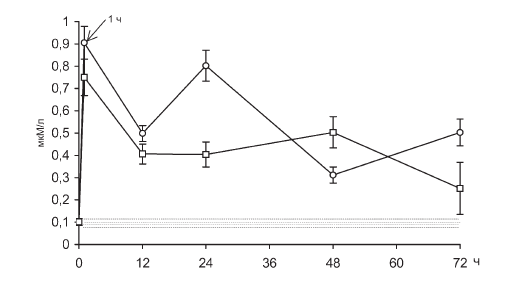
Рис. II-19. Стероидогенная реакция надпочечников в динамике хронического стресса до (?) и после () введения тиамина. По оси абсцисс – срок наблюдения; по оси ординат – содержание 11-ОКС в крови, мкМ/л.
Заштрихованные участки – доверительные границы нормы
На возможность инсулиновой корректировки стероидозависимой лимфопении и РБТЛ указывают данные по тиамину, который повышает уровень лимфоцитов в крови (рис. II-21) и их способность к пролиферации (рис. II-15, II-16, II-17, II-18) in vitro именно в те сроки иммобилизационного стресса (1 ч и 48 ч), где предполагается функциональный дефицит инсулина. Дело в том, что тиамин активирует инсулинсинтетическую функцию поджелудочной железы, повышает уровень иммунореактивного инсулина в крови при стрессе и оказывает выраженное инсулиноподобное действие на обмен веществ, в том числе и в отношении процессов, являющихся маркерными на действие инсулина [23]. Показано, что инсулинотропные эффекты тиамина наиболее четко проявляются на гипоинсулиновом фоне [18].
При анализе механизмов инсулиноподобного (иммуномодулирующего) действия тиамина, прежде всего, следует учитывать его антикатехоламиновый (1 ч) и антистероидный (48 ч) эффекты. Известно, что катехоламины усиливают миграцию Т-лимфоцитов в костный мозг [31, 54].
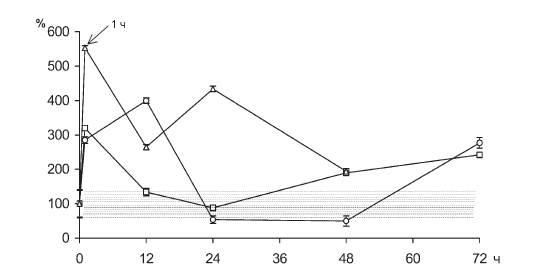
Рис. II-20. Содержание лейкоцитов в крови крыс в динамике хронического стресса до (?) и после () введения тиамина или после адреналэктомии (D). По оси абсцисс – срок наблюдения; по оси ординат – число нейтрофилов, в % от нормы
Миграционная способность лимфоцитов каким-то образом зависит от степени заполненности ?-рецепторов на их поверхности катехоламинами [265]. На фоне блокирования ?-рецепторов обзиданом введение адреналина уже не вызывает увеличения количества лимфоцитов в костном мозгу по сравнению с исходным его содержанием [54]. Поскольку число лимфоцитов в крови отражает только баланс между приходящими и уходящими из нее клетками, совершенно очевидно, что ?-блокаторы будут нивелировать лимфопению.
Это относится и к тиамину, который усиливает действие обзидана, создавая условия, при которых адреноблокатор выигрывает конкуренцию за ?-рецепторы эффекторных клеток у катехоламинов [23]. Как и другие соединения, содержащие четвертичный атом азота, он обладает ганглиоблокирующими свойствами и является антагонистом ацетилхолина [223]. Этот антагонизм проявляется уже при относительно небольшой концентрации витамина В1 в перфузате (10—5 М) и возрастает при ее увеличении. Установлено, что в механизме антагонизма тиамина с ацетилхолином имеют место конкуренция за места связывания, угнетение синтеза медиатора и усиление его распада за счет активации холинэстеразы, причем решающую роль здесь играет тиаминовый блок н-хо-линорецепторов [361].
В то же время, как и любой ганглиоблокатор, он выключает не только парасимпатические, но и симпатические узлы, вызывая синаптоанестезию [107], угнетение каротидных клубочков и хромаффинной ткани надпочечников, что приводит к уменьшению секреции катехоламинов и ослаблению их тропности в отношении эффекторных клеток-мишеней [100]. При внутривенном введении большие дозы тиамина оказывают выраженное депрессивное влияние на разных уровнях нервной системы: подавление возбудимости чувствительных нервных окончаний, блокирование проведения нервных импульсов через нервно-мышечные синапсы и ганглии, угнетение вазомоторных и других центров в центральной нервной системе, депрессию в ретикулярной формации [267]. Эти данные в значительной мере объясняют факт пермиссивного влияния тиамина в отношении проявления эффектов ?-блокаторов, но не исчерпывают всех вариантов, поскольку его антикатехоламиновое действие может быть опосредовано и инсулином, который при парентеральном введении вызывает резкое снижение уровня катехоламинов сначала в венозной, а затем и артериальной крови [439].
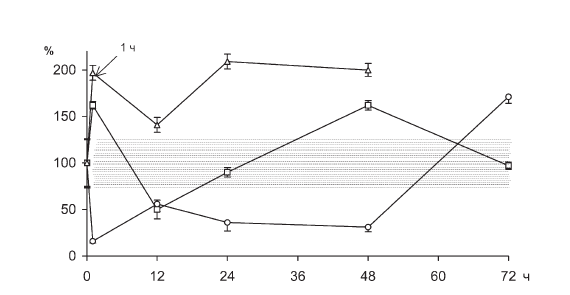
Рис. II-21. Содержание лимфоцитов в крови крыс в динамике хронического стресса до (?) и после () введения тиамина или после адреналэктомии (?). По оси абсцисс – срок наблюдения, по оси ординат – число лимфоцитов, в % от нормы
Согласно [54], стресс-реакция сопровождается фазовым изменением иммунореактивности. Начальный период характеризуется массовым перераспределением иммунокомпетентных клеток, снижением клеточного и гуморального иммунитета. Продолжительность и степень иммунодепрессии зависят от силы и длительности действия стрессора. После завершения стрессорного эпизода реституция показателей происходит в следующем порядке: раньше всего нормализуется количество циркулирующих лимфоцитов, затем восстанавливается реактивность на поликлональные митогены и, наконец, – ответ на антигенную стимуляцию. Считается, что при хроническом стрессе с нарастающей эффективностью раздражения период восстановления становится малозаметным или отсутствует вовсе и организм плавно переходит в состояние вторичной иммунологической недостаточности со стероидозависимой инволюцией лимфоидных органов [153].
Действительно, как видно из рис. II-10, через 72 ч иммобилизации животных масса тимуса у них уменьшается в три раза, что может свидетельствовать о развитии вторичного иммунодефицита. Но на этом аналогии с данными литературы заканчиваются, поскольку через 72 ч непрерывного раздражения, на фоне инволюции тимуса, которую вызывает истощающий иммобилизационный стресс, функциональные признаки иммунодефицита исчезают, лимфопения прекращается (рис. II-21), а пролиферативный ответ лимфоцитов на поликлональные митогены полностью восстанавливается (рис. II-15, II-16, II-17, II-18).
Биологический смысл этого парадоксального явления пока неясен. Можно лишь полагать, что данный факт отражает некую фазовость общего иммуннострессорного процесса, проявляющуюся даже в условиях непрерывного 72-часового раздражения, когда функции донора Т-клеток начинают выполнять другие иммунокомпетентные органы, например костный мозг, который в терминальную стадию стресса возвращает в кровоток накопленные им накануне лимфоциты, отмобилизованные тимусом[31]. Что касается гормональной составляющей, то здесь, по-видимому, уместны следующие допущения. Уменьшение лимфопении и восстановление активности РБТЛ в заключительной фазе истощающего стресса, очевидно, обусловлено антистрессорным действием инсулина, концентрация которого в крови животных в этот период повышается [131]. Инсулинозависимость и одновременно фазовость процесса подтверждают данные по тиамину, который способствует более раннему выхождению пика инсулина в крови при стрессе [18], соответственно сдвигая влево во временной шкале опыта его тропные эффекты в отношении циркулирующих лимфоидных клеток (рис. II-15, II-16, II-17, II-18 и II-21).
Само собой разумеется, что гормональная обусловленность иммуномодулирующего действия тиамина, которая логически вытекает из вышеприведенных материалов, должна быть подтверждена прямым изучением динамики уровня иммунореактивного инсулина в крови крыс в аналогичном опыте. Для объяснения фазового характера единого иммуннострессорного процесса, имеющего место при длительной иммобилизации животных, требуется расшифровка триггерного механизма регуляции иммуногенеза стресслимитирующими (инсулин) и стрессреализующими (катехоламины, кортикостероиды) гормонами.






