5.2. Тиамин и инволюция тимуса при стрессе
Знаменитая триада морфологических проявлений стресса Г. Селье: увеличение веса надпочечников – инволюция тимуса – лимфопения не только свидетельствует о тесной интеграции гормонального и иммунного гомеостатов в реализации «Общего адаптационного синдрома» [153] при развитии реакции напряжения, но и может служить своеобразной тест-системой для оценки иммунопротекторного действия различных антистрессорных препаратов. Введенное Г. Селье в научный обиход понятие «инволюция тимико-лимфатического аппарата» учитывает особую чувствительность тимуса и лимфоцитов периферической крови к повышенному содержанию гормонов надпочечников [154]. Согласно наиболее распространенной гипотезе, снижение массы и клеточное опустошение тимуса при стрессе связано с увеличением секреции корой надпочечников стероидных гормонов, вызывающих распад лимфоцитов и угнетение метаболических процессов в клетках тимуса с последующим длительным нарушением процессов пролиферации [280, 398, 400, 401].
Констатирующая часть гипотезы фактологически безупречна, поскольку при воспроизведении апробированной Г. Селье модели иммобилизационного стресса (фиксация крыс в положении на спине) к 72-му часу опыта тимус животных действительно теряет 2/3 своей массы (рис. II-10), что сопровождается столь же экстенсивным уменьшением содержания клеток в органе [57].
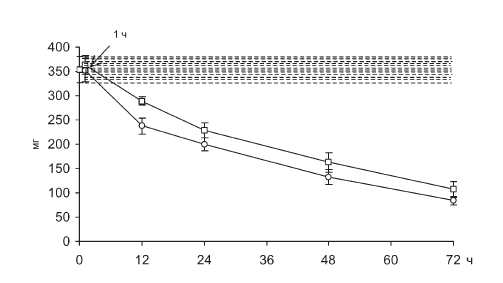
Рис. II-10. Инволюция вилочковой железы в динамике хронического стресса до (?) и после () введения тиамина. По оси абсцисс – срок наблюдения; по оси ординат – масса тимуса, мг
Роль стероидных гормонов коры надпочечников здесь очевидна, поскольку у гипофизэктомированных и адреналэктомированных крыс тимолитический эффект иммобилизационного стресса не воспроизводится [31, 41]. Тезис о гормональнообусловленном нарушении пролиферации в органе на первый взгляд тоже выглядит вполне правдоподобно: на гистологических препаратах тимуса при стрессе, вызванном иммобилизацией, пикнотичные и лизированные клетки выявляются уже через 3–6 ч опыта [54]. Кроме того, известно, что глюкокортикостероиды служат «исполнителями» так называемой «индуцированной активации клеточной смерти лимфоцитов» – AICD (activation-induced cell death), которая является вариантом апоптоза лимфоцитов, закономерной гибели однажды активированных клеток [429].
Синтетическую активность клетки отражает параметр ? – характерное для нее отношение односпиральных к двухспиральным нуклеиновым кислотам [67]. Параметр ? был достаточно информативен при исследовании синтетической активности разнодифференцированных клеток тимуса лейкозных мышей [199]. Двухспиральные молекулы нуклеиновых кислот (ДНК), обладающие большей, чем односпиральные, устойчивостью к повреждающим факторам и предназначенные для хранения информации, неактивны в синтетическом отношении. Процесс реализации информации в виде синтеза тех или иных эффекторных белков в клетке всегда сопряжен с появлением активных в синтетическом отношении односпиральных нуклеиновых кислот, которые могут быть представлены как «расплетенными» односпиральными участками ДНК, доля которых составляет 5 % от односпиральных молекул нуклеиновых кислот, так и молекулами РНК.
Таким образом, в полностью неактивной в синтетическом отношении клетке нуклеиновые кислоты представлены в основном двухспиральными нуклеиновыми кислотами (ДНК) и характеризуются низким значением параметра ?. Активация синтетических процессов в клетке неизбежно приводит к повышению величины параметра ? либо за счет появления «расплетенных» участков ядерной ДНК при активации генома клетки, либо за счет накопления различных форм РНК, либо за счет обоих этих факторов, которые приводят к «включению» белок-синтезирующего конвейера [67]. Этот вывод подтверждается результатами работ [30], в которых было показано, что величина параметра ? была пропорциональна количеству рибосом, входящих в состав синтезирующих белки полисом. Распад полисом на моносомы без изменения общего количества рибосом приводит к резкому уменьшению величины параметра ?.
Используя информативность параметра ? как критерия синтетической активности клеток, можно было легко проверить предположение о стрессиндуцированном блоке пролиферации тимоцитов. Для этого, учитывая гетерогенность клеточного пула тимуса (20 % составляют пролиферирующие Р-клетки диаметром 8—14 мкм и 80 % – непролиферирующие Q-клетки диаметром 4–8 мкм [54]), мы изучили профиль распределения тимоцитов по величине с одновременной регистрацией уровня синтетической активности в них по соотношению РНК/ДНК (параметр ?) у крыс во временной динамике иммобилизационного стресса.
Из рис. II-11 видно, что в пуле непролиферирующих Q-клеток тимуса (диаметр менее 8 мкм) соотношение односпиральных и двухспиральных нуклеиновых кислот не изменяется во все сроки опыта, в то же время пул пролиферирующих Р-клеток (диаметром более 8 мкм) отвечает на раздражение (иммобилизация) не понижением, а повышением параметра ? в терминальной фазе стресса. Следовательно, говорить о стрессиндуцированном блоке пролиферации тимоцитов в принятых условиях опыта не приходится. Определение степени деградации ДНП (в лимфоидных тканях большая часть массы ДНК связана с белками в виде дезоксирибонуклеопротеида и лишь небольшая ее часть находится в свободной солерастворимой форме), проведенное ранее [55], показало, что целостность ДНП тимоцитов на протяжении исследованного промежутка времени иммобилизации крыс сохраняется.
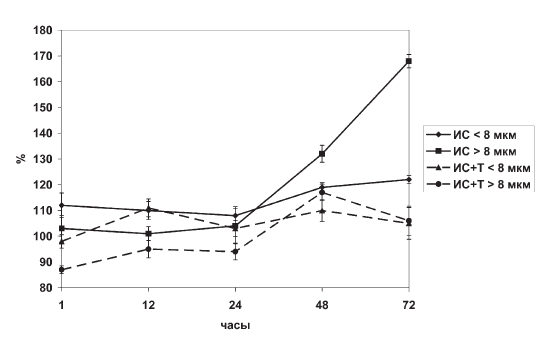
Рис. II-11. Соотношение РНК/ДНК (параметр ?) разных размерных классов на мазках-отпечатках тимуса в динамике иммобилизационного стресса до и после введения тиамина
Эти данные свидетельствуют о минимальном вкладе распада тимоцитов в опустошение тимуса при стрессе. Кстати, небольшое число пикнотичных и лизированных клеток всегда обнаруживается в тимусе интактных животных, что, очевидно, является результатом естественной убыли тимоцитов за счет их функционального изнашивания. Существуют различные мнения о гистогенезе клеток в тимусе. Предположение о дифференциации клеток в направлении: большой лимфоцит – средний – малый не подтверждается экспериментальными данными. Согласно другой точке зрения, в тимусе имеются по крайней мере два независимо дифференцирующихся, т. е. невзаимодействующих по принципу обратной связи, суб-класса Т-лимфоцитов с различными фенотипами: Thy-1+, TL+ и Thy-1+, TL? [54].
Клетки первого фенотипа интенсивно обновляются и составляют, главным образом, популяцию Р-клеток, жизненный цикл которых завершается в самом тимусе – они не попадают в кровоток и не выявляются в периферических лимфоидных органах. Являются ли они предшественниками клеток второго фенотипа, неизвестно. Предполагается, что гистогенез тимоцитов осуществляется по следующей схеме: Р-клетка (фенотип ее неизвестен) пролиферирует и дифференцируется в клетки Q1 (Thy-1+, TL?, диаметр 5–7 мкм), которые выходят в циркуляцию. Часть Q1-клеток остается в тимусе и трансформируется в Р2-клетки фенотипа Thy-1+, TL+, которые, завершая цикл, дифференцируются в Thy-1+, TL? Т-клетки [54].
Увеличение параметра ?, характеризующего синтетическую активность тимоцитов в терминальной фазе иммобилизационного стресса (рис. II-11), связано не с манифестацией пролиферации, а с изменением качественного состава клеточной популяции тимуса. Если в норме (контроль), в фазу тревоги (1—12 ч опыта) и фазу резистентности (24 ч опыта) иммобилизационного стресса тимус крыс на 80 % представлен Q-популяцией малых (4–8 мкм) лимфоцитов, то в начале фазы истощения (48 ч опыта) и ее конце (72 ч опыта) 80 % клеточного состава органа приходится на долю Р-популяции больших (8– 14 мкм) лимфоцитов (табл. II-1, рис. II-12).
Таблица II-1.
Относительное количество лимфоцитов разных размерных классов на мазках-отпечатках тимуса в зависимости от времени иммобилизации животных, не получавших тиамин и получавших тиамин
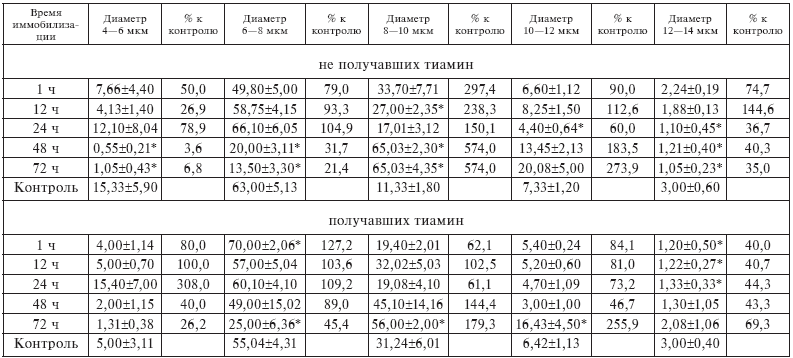
* Статистически достоверные различия с контрольными животными в группе.
Поскольку в контроле и опыте в мазках тимуса подсчитывали 100 произвольно выбранных клеток, находящихся в поле зрения, кардинальное изменение внутрипулового соотношения в пользу больших тимоцитов в терминальную фазу стресса, когда масса тимуса уменьшается на 2/3 (рис. II-10), однозначно свидетельствует о радикальном и пропорциональном сокращении доли малых.
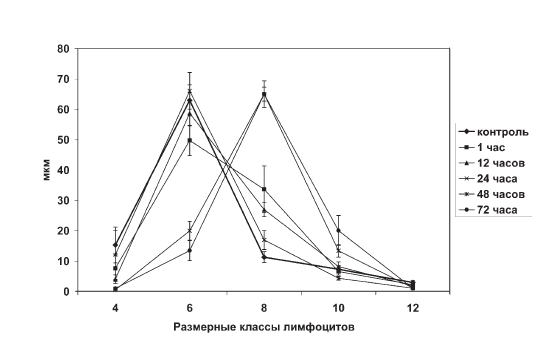
Рис. II-12. Профиль распределения тимоцитов в мазках тимуса крыс по размерным классам в динамике иммобилизационного стресса до введения тиамина
Если стрессобусловленное изменение количества больших и малых тимоцитов представить в координатах – «клетки / время», то со всей очевидностью выясняется факт, что внутрипуловые сдвиги количества первых являются зеркальным отражением динамики вторых (рис. II-13).
Следовательно, в принятых условиях, т. е. при иммобилизационном стрессе, имеет место не изменение пролиферации, а клеточное опустошение органа за счет малых тимоцитов.
Пролиферативную активность тимоцитов, т. е. количество клеток (Nt), производимых в единицу времени, можно рассчитать по формуле [55]:
Nt = N0Imt / Tm,
где N0 – количество клеток в органе, Im – митотический индекс, Tm – среднее время митоза, t – время.
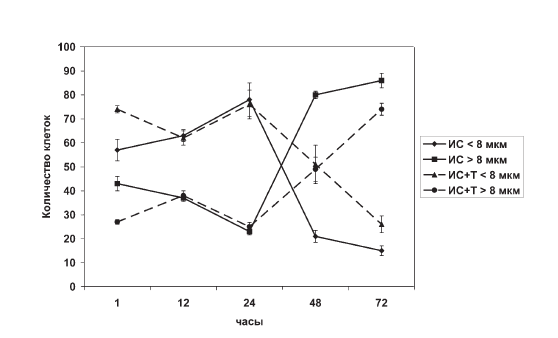
Рис. II-13. Профили содержания больших (> 8 мкм) и малых (< 8 мкм) тимоцитов в мазках тимуса крыс в динамике иммобилизационного стресса до и после введения тиамина
Суточная продукция клеток в тимусе крыс и мышей составляет 30–35 % от исходного количества – рекордный показатель для организма млекопитающих. На основании морфологического исследования и оценки интенсивности пролиферации теоретически рассчитано, что из тимуса крыс Wistar за сутки эмигрирует около 3 · 108 клеток [55]. Отсюда следует, что в норме основная масса новообразованных лимфоцитов эмигрирует из тимуса. Как известно, постоянство числа клеток в тимусе поддерживается двумя процессами – пролиферацией и иммиграцией клеток (притоком), с одной стороны, а также лизисом и эмиграцией (оттоком) – с другой.
Гистологическими методами было показано, что лимфоциты из коркового слоя тимуса вначале переходят в мозговой слой [394], где они линейно ориентируются вдоль сосудов [280], а затем поступают в кровоток [284]. Миграции способствует и анатомическое расположение сосудов в тимусе – артерии находятся в корковом слое, а вены – в мозговом [108]. Прямым подтверждением миграции лимфоцитов в кровоток является тот факт, что в венах тимуса морских свинок содержится большее количество клеток, чем в притекающей в орган крови, и эта разница увеличивается после введения животным глюкокортикостероидов [283].
Согласно расчетам, выполненным по кинетическим параметрам клеток тимуса крыс Wistar (митотический индекс – 8—10‰, время генерации пролиферирующих клеток – 8—10 ч, время обновления – 72 ч, средняя продолжительность митоза – 25–26 мин и др.), в первые 9—12 ч иммобилизации эмиграция тимоцитов увеличивается на 50–80 %. Количество клеток в тимусе в течение суток уменьшается на 35–40 % [55]. Из рис. ІІ-12 видно, что в процессе клеточного опустошения тимуса в фазу тревоги (1—12 ч) и фазу резистентности (24 ч) иммобилизационного стресса существенного изменения профиля распределения остающихся в органе клеток по величине не происходит. Это означает, что в первые сутки иммобилизации тимус покидают клетки всех степеней зрелости. Поскольку тимус на 90–95 % представлен клетками, иммунологические функции которых несовершенны, и только 5—10 % популяции составляют зрелые, дифференцированные, иммунологически компетентные клетки, можно заключить, что в кровоток поступают клетки, не завершившие «нормальной» дифференциации в органе [55].
В фазу истощения иммобилизационного стресса (48–72 ч) «подвижный» клеточный ресурс тимуса полностью отмобилизован и в органе остается только популяция «оседлых» тимоцитов, неспособная выходить в кровяное русло (рис. II-12).
Что касается регуляции процесса опустошения тимуса, то известна его зависимость от гормонов гипофизад-реналовой системы. По данным [31], адреналэктомия и гипофизэктомия полностью предотвращают убыль тимоцитов при воздействии стрессоров. Сопоставляя динамику содержания малых лимфоцитов в тимусе (рис. II-13) и динамику содержания 11-ОКС в крови крыс (рис. II-4), следует отметить идентичность (однонаправленность) сдвигов обоих показателей во все фазы иммобилизационного стресса. Факт дублирования стрессобусловленных ритмов изменения клеточного состава тимуса и секреции глюкокортикостероидов надпочечниками, указывающий на их взаимообусловленность (соподчиненность), прямо свидетельствует о гормональном контроле эмиграции лимфоцитов из тимуса. Следовательно, коррекция гормонального фона должна лежать в основе тимуссберегающих технологий профилактики стрессорных иммунодефицитов, поскольку не исключено, что все антистрессорные факторы могут оказывать органопротекторное действие на тимус при развитии реакции напряжения. Правомерность такого заключения можно проиллюстрировать на примере тиамина, который способен уменьшать амплитуду стероидогенной реакции надпочечников при иммобилизационном стрессе (рис. II-4). Антистрессорные эффекты тиамина аппроксимируются снижением скорости падения массы тимуса, т. е. величины клеточного опустошения органа (рис. II-10). На фоне введения тиамина даже в терминальной фазе стресса (48–72 ч иммобилизации) тимус крыс в какой-то мере сохраняет свой мобилизуемый клеточный ресурс.
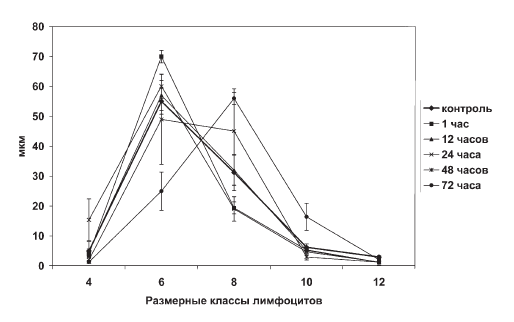
Рис. II-14. Профиль распределения тимоцитов в мазках тимуса крыс по размерным классам в динамике иммобилизационного стресса после введения тиамина
Об этом свидетельствует нивелирование сдвигов параметра ?, отражающего, как указывалось выше, соотношение пролиферирующих и непролиферирующих клеток в тимусе (рис. II-11), данные гистограмм распределения тимоцитов по величине, которые в отличие от контроля на стресс (рис. II-12) приближаются к норме (рис. II-14), а также динамика содержания в тимусе больших (8– 14 мкм) и малых (4–8 мкм) лимфоцитов во все фазы иммобилизационного стресса, которая четко отражает факт стабилизирующего влияния тиамина (рис. II-13).


![Еда, меняющая жизнь [Откройте тайную силу овощей, фруктов, трав и специй]](https://img-lib.med-tutorial.ru/964172336/cover.jpg)