5.1. Тиамин и стрессорная гипертрофия надпочечников
Феномен прижизненных флуктуаций размеров клеток и их ядер известен давно. Еще в 30-х годах ХХ в. В. Якоби выявил некую кратную функцию колебаний их объема. Подвергая вариационно-статистическому анализу большие массивы данных кариометрических исследований, он установил, что кривые распределения размеров ядер во многих случаях имеют несколько максимумов, абсолютные величины которых относятся друг к другу в пропорции 1:2:4:8 и т. д. На этом основании В. Якоби сделал вывод, что рост ядер, а следовательно, и клеток происходит путем многократного удвоения их объема [319, 320]. Так был сформулирован достаточно общий «закон ритмического роста клеток» или «закон ритмического удвоения объема ядер», отражающий, как оказалось позже, полиплоидизацию соматических клеток в процессе развития организма [321].
Однако вскоре выяснилось, что существуют и отклонения от этого закона, выражающиеся в иных пропорциях роста клеток, при которых вершины вариационных кривых занимают промежуточное положение между кратными максимумами, постулируемыми схемой Якоби [9, 79]. Поскольку подобные сдвиги кариограмм были зафиксированы при действии ультрафиолетовых лучей [442] и некоторых гормонов, Е. Вермель связал их с изменением функционального состояния клеток-мишеней.
Полемизируя с Е. Вермелем, В. Якоби пытался вначале объяснить обнаруженные оппонентами отклонения от ожидаемых величин объемов ядер наличием изменчивости ядер внутри одного класса [320], а позже тем, что изменения функционального состояния клеток все равно ведут к развитию полиплоидных клеточных элементов [321].
В свою очередь Г. Хертвиг предложил совершенно иной вариант объяснения, который заключается в том, что, по его мнению, в зависимости от функционального состояния клетки ее ядро может впитывать жидкость из цитоплазмы до тех пор, пока уже не объем, а поверхность ядра удвоится. Исходя из элементарных геометрических расчетов он показал, что при удвоении поверхности ядра его объем увеличится не в 2, а в 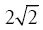
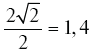
Эта идея нашла свое выражение и дальнейшее развитие в концепции о так называемом набухании и сморщивании ядер клеток при усилении и ослаблении их органоспецифической функции – выработка секретов и гормонов, нервная деятельность, мышечное сокращение и т. п. Согласно А. Беннингхофу, при усилении функциональной активности клеток белки их кариоплазмы подвергаются усиленному окислению и распаду, вследствие чего общее количество частиц в ядре возрастает, осмотическое давление повышается и объем ядра увеличивается на 30–40 % за счет насыщения кариоплазмы водой. Напротив, при угнетении жизнедеятельности клеток размеры частиц ядерных коллоидов увеличиваются, осмотическое давление внутри ядра падает, и ядро несколько уменьшается за счет отдачи воды в цитоплазму [224].
Если описанные флуктуации размеров ядра специализированной клетки носят функциональный характер и зависят от объема выполняемой ею работы, это означает, что они должны быть прямо связаны с функциональным циклом клетки (активность – покой), который определяется генетически детерминированными суточным и сезонным ритмами, а также частотой падающей на нее рабочей нагрузки. Действительно, уже давно известно, что у крыс и мышей ночью в период бодрствования ядра клеток печени [250], почек [335], коры надпочечников [385] и других тканей гораздо крупнее, чем днем, когда животные спят. Отмечены сезонные колебания величин ядер кортикоцитов у крыс [385] и морских свинок [263].
Исходя из того, что синхронизация суточных и сезонных биоритмов осуществляется стрессорными гормонами [17], которые выполняют роль своеобразного метронома биологических функций, можно было ожидать, что объем ядер клеток органов-мишеней должен ежечасно и сиюминутно лимитироваться напряженностью гормонального фона.
По данным Е. Тонуцци, активация гипофизадреналовой системы при моделировании стресса (голод, охлаждение, введение дифтерийного токсина и др.) приводит к резкому увеличению размера клеток пучковой зоны коры надпочечников и укрупнению их ядер. Угнетение этой системы путем экстирпации гипофиза дает противоположный эффект. У гипофизэктомированных животных аналогичные стрессорные раздражения уже не активируют адреналовые железы и соответственно не вызывают увеличения кортикоцитов и их ядер [423].
Сейчас твердо установлено, что острая стрессорная гипертрофия пучковой зоны коры надпочечников осуществляется за счет гипертрофии клеток, которая сопровождается ростом размера их ядер [424]. Увеличение объема ядер в большей степени коррелирует с нарастанием стероидогенеза, чем гипертрофия клеток, и поэтому используется в качестве морфологического маркера для оценки функционального состояния надпочечников [377]. У крыс при перегревании ядра кортикоцитов начинают увеличиваться уже через час после начала опыта, достигая максимума через 12 ч [337]. После однократной инъекции АКТГ гипертрофия ядер развивается через 6–9 ч [206].
Повышение функциональной активности коры надпочечников, как и других медленно обновляющихся органов, в которых отсутствует полиплоидия [190], приводит к увеличению среднего объема ядер кортикоцитов и к сдвигу вариационных кривых вправо [263, 385]. Согласно [71], распределение объема ядер по классам в пучковой зоне молодых и взрослых крыс на кариограммах представлено всегда одновершинными кривыми. Это свидетельствует о том, что все ядра клеток пучковой зоны являются диплоидными и что гипертрофия ядер с возрастом не сопровождается увеличением их плоидности. Одновершинный характер кривых распределения размера ядер в различных зонах коры надпочечников крыс и мышей описан многими авторами [314, 344]. Что касается полиплоидных кортикоцитов, то они обнаружены у коз [367] и белоногих хомячков [261].
В ряде работ, где проводилось прямое измерение уровня ДНК, была доказана диплоидность ядер кортикоцитов, причем введение АКТГ приводило к увеличению их размеров, но не изменяло характера плоидности [317, 389]. Развитие полиплоидных клеточных элементов в результате изменения их функционального состояния, что предполагал В. Якоби [321], здесь маловероятно, поскольку полиплоидия – это кратное увеличение полных наборов хромосом сверх диплоидного набора, а в принятых условиях обнаружена обратная зависимость между образованием стероидов и синтезом ДНК в надпочечниках крысы после стимуляции АКТГ [232]. Считается, что повышение внутриклеточной концентрации цАМФ под влиянием кортикотропина влечет за собой подавление синтеза ДНК и интенсификацию синтеза кортикостероидов [383].
Цитологические измерения в наших опытах производились в левом надпочечнике (правый использовался для электронномикроскопических исследований). В 10 часов утра сразу после декапитации крыс и извлечения надпочечников левый из них разрезали пополам, фрагменты маркировали и фиксировали в 10 % формалине. После спиртовой проводки, обезвоживания и заливки материала в парафин изготавливали гистологические срезы, которые окрашивали гематоксилином и эозином.
Кариометрия проводилась с помощью телевизионной измерительной системы для исследования биологических объектов, разработанной и изготовленной в НИИ физико-химических проблем при Белгосуниверситете, и компьютерной программы АСТА-5, основанной на принципе преобразования оптического изображения объекта с микроскопа в видеосигнал, который с помощью устройства ввода изображения оцифровывается и вводится в память ЭВМ для последующего выделения из него информации о геометрических параметрах объекта (периметр, диаметр, площадь, объем). В каждом наблюдении на дисплее обводились курсором 100 ядер кортикоцитов при увеличении объектива 20. Результаты компьютерной обработки исходной телеметрии ядер суммированы на рис. II-1, II-2, II-3.
Для изучения распределения спонгиоцитов с разным диаметром ядер нами условно выделено 5 групп клеток с 1 мкМ интервалом в размерах ядер. Таким образом к 1-й группе отнесены клетки с диаметром ядер до 4 мкМ включительно; ко 2-й – от 4 до 5 мкМ; к 3-й – от 5 до 6 мкМ; к 4-й – от 6 до 7 мкМ; к 5-й – клетки с ядром, превышающим 7 мкМ.
Итак, что же получилось? При моделировании иммобилизационного стресса по Г. Селье на высоте раздражения (экспозиция 24 ч) были выявлены типичные кариометрические признаки диплоидности кортикоцитов: одновершинность вариационных кривых объема ядер клеток пучковой и сетчатой зон коры надпочечников крыс и их сдвиг вправо относительно аналогичных кривых, построенных для контрольных животных (рис. II-1). Высота пиков увеличения размера ядер у иммобилизованных крыс была в 1,3–1,4 раза больше, чем у интактных животных. Как указывалось выше, такая пропорция увеличения размера, согласно геометрическим расчетам, свидетельствует об удвоении поверхности и характеризует активное функциональное состояние ядра [311]. По мнению О. Кириллова, в коре надпочечников, где все ядра являются диплоидными, функциональная гипертрофия представляет основную форму увеличения их объема [72].
Если стрессорное раздражение крыс проводилось на фоне введения тиамина (подкожные инъекции по 200 мг/кг за сутки до начала иммобилизации и за 2 ч до забоя животных), то, как видно из рис. II-1, ядра кортикоцитов укрупняются уже в значительно меньшей степени (увеличение всего в 1,15 раза по сравнению с контролем), а вариационные кривые их объема «дрейфуют» на кариограмме в обратную сторону, т. е. влево от кривых, характеризующих ситуацию при иммобилизационном стрессе данной экспозиции. Исходя из имеющихся в литературе данных о том, что изменение диаметра ядер в коре надпочечников, как правило, синхронизируется с изменением клеточных размеров [46], т. е. гипертрофия ядер является достоверным индикатором гипертрофии клеток [373], можно заключить, что витамин В1 уменьшает гипертрофию кортикоцитов при иммобилизационном стрессе.
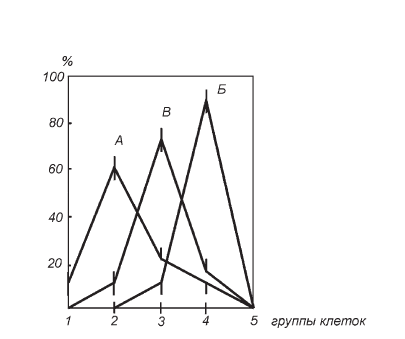
Рис. II-1. Распределение групп спонгиоцитов пучковой зоны коры надпочечников крыс с разным диаметром ядер: 1 – до 4 мкМ; 2 – от 4 до 5 мкМ; 3 – от 5 до 6 мкМ; 4 – от 6 до 7 мкМ; 5 – выше 7 мкМ. А – контроль, Б – иммобилизационный стресс, В – тиамин + иммобилизационный стресс
Из данных, представленных на рис. II-2, следует, что степень гипертрофии ядер кортикоцитов в разные сроки опыта не была одинаковой. Прогрессивное укрупнение ядер имело место до 24 ч опыта, причем с большей скоростью нарастание их объема происходило в первой половине этого срока. В следующие сутки (между 24 и 48 ч) иммобилизации размер ядер уменьшался и вновь увеличивался к 72-му часу опыта. Волна гипертрофии ядер клеток коры надпочечников четко накладывается на фазы иммобилизационного стресса, обозначенные Г. Селье: до 12 ч – стадия тревоги, между 24 и 48 ч – стадия резистентности, после 48 ч – стадия истощения [411].
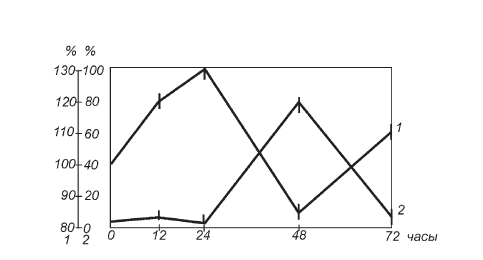
Рис. II-2. Динамика усредненных кариометрических параметров спонгиоцитов пучковой зоны коры надпочечников в различные сроки иммобилизационного стресса: 1 – диаметр ядер (в процентах к контролю), 2 – атипизм ядер (процент некруглых)
Динамика кариометрических сдвигов (рис. II-2) хорошо согласуется с динамикой 11-ОКС (рис. II-4) в процессе развертывания стрессорной реакции во времени. Это подтверждает известный тезис о том, что гипертрофия секреторных элементов коры надпочечников является мерой их функции [72]. Следовательно, можно согласиться с О. Кирилловым и в том, что фазовые колебания степени гипертрофии ядер при стрессе отражают фазовые колебания функциональной активности пучковой зоны [71].
Использованная нами компьютерная программа АСТА-5 на основании данных телеметрии ядра позволяла автоматически вычислять не только его основные кариометрические параметры, но и выявлять отклонения формы ядра от правильной окружности, т. е. признаки его атипии и полиморфизма. Фактически этот показатель, выраженный в процентах, отражает количество клеток с ядрами некруглой формы.
Как видно из рис. II-2, процент клеток с атипичными ядрами в пучковой зоне коры надпочечников имеет выраженную тенденцию к повышению в первые часы иммобилизационного стресса, которая устойчиво сохраняется до 12 ч и сходит на нет к концу первых суток опыта с тем, чтобы в последующие двое суток сформировать новую, уже гораздо более высокую волну с вершиной на 48 ч.
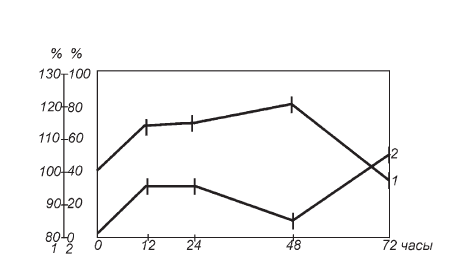
Рис. II-3. Влияние тиамина на динамику усредненных кариометрических параметров спонгиоцитов пучковой зоны коры надпочечников в различные сроки иммобилизационного стресса: 1 – диаметр ядер (в процентах к контролю), 2 – атипизм ядер (процент некруглых)
Зеркальный ход кривых 1, 2, представленных на рис. II-2, и их равноамплитудная реципрокная динамика, которая наиболее отчетливо проявляется начиная с 24 ч опыта, по всей вероятности, указывают на превращение гипертрофированных кортикоцитов с пузырько-видными ядрами в сморщенные клетки и наоборот. Действительно, колебания выбранного показателя ядерного атипизма во временной шкале опыта очевидно отражают динамику содержания компактных темных клеток с деформированным ядром в тех же гистологических препаратах, о чем свидетельствует практически полное совпадение кривых 2 на рис. II-2 и II-4 при их наложении друг на друга.
В принципе, судя по литературным данным [152], подобная метаморфоза возможна в рамках осуществления функционального клеточного цикла с периодической трансформацией крупных светлых клеток в мелкие темные и обратно, в зависимости от падающей на них рабочей нагрузки. Здесь смущают только два обстоятельства: первое – это генерализованный характер реакции на 24–48 – 72 ч опыта и второе – то, что она реализуется в фазу истощения стресса. Скорее всего эти обстоятельства обусловлены биологически целесообразным механизмом утомления кортикоцитов [22], защищающего их от функционального перераздражения и тотальной деструкции, путем массового выключения из секреторного акта. К утомлению секреторных элементов коры надпочечников, морфологическим маркером которого может быть максимальное набухание клеток и соответственно их ядер к 24 ч опыта (рис. II-2, кривая 1), очевидно, приводит фатальная активация стероидогенеза в конце фазы резистентности (рис. II-4).
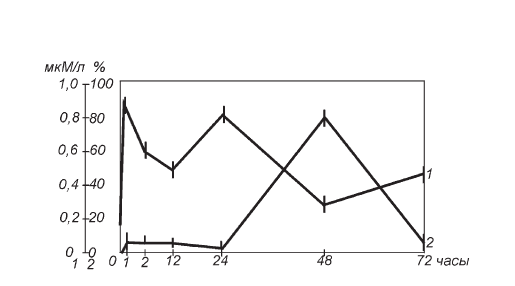
Рис. II-4. Динамика содержания 11-ОКС в крови (1) и процент темных клеток (2) в пучковой зоне коры надпочечников крыс в различные сроки иммобилизационного стресса
Защитный эффект утомления демонстрируется приростом уровня 11-ОКС в крови (рис. II-4), а также увеличением размеров ядер к 72 ч опыта (рис. II-2, кривая 1), т. е. восстановлением пула более крупных (умеренно темных и светлых) кортикоцитов в пучковой зоне, за счет пропорционального уменьшения темных клеток (рис. II-4), объективным показателем трансформации которых является синхронное снижение количества атипичных ядер (рис. II-2, кривая 2).
Отмеченный выше феномен уменьшения гипертрофии ядер в клетках пучковой зоны коры надпочечников при стрессе под влиянием витамина В1 (рис. II-1) становится более отчетливым при отслеживании этого эффекта в динамике развития реакции напряжения. Из рис. II-3 видно, что кривая 1, отражающая колебания размеров ядер во временной шкале опыта, имеет несколько важных отличий от аналогичной кривой, полученной при иммобилизационном стрессе без применения тиамина (рис. II-2). В первой трети опыта (до 24 ч) ее амплитуда существенно ниже, чем у иммобилизованных крыс, во второй трети (24–48 ч) кривая имеет тенденцию к росту, в то время как у крыс, не получавших тиамин, кариометрические параметры ядер стремительно падают, и, наконец, в последней трети (48–72 ч), когда в группе сравнения ядра кортикоцитов снова укрупняются, здесь их размеры только еще начинают снижаться. Следовательно, тиамин не только уменьшает степень гипертрофии кортикоцитов, но и на сутки отодвигает наступление критической фазы развития иммобилизационного стресса.
Из сравнения рис. II-3 и II-4 видно, что полученные разными способами функциональные характеристики поведения кортикоцитов в принятых условиях опыта совпадают: динамика изменений объема их ядер отчетливо дублирует сдвиги в уровне 11-ОКС в крови и в обоих случаях амплитуда этих флуктуаций значительно меньше, чем у животных, не получавших тиамин (рис. II-2 и рис. II-4), что морфологически и биохимически подтверждает факт его антистрессорного влияния. Тиамин увеличивает в пучковой зоне пул темных клеток (рис. II-4) с атипичными ядрами (рис. II-3), который, очевидно, служит функциональным резервом коры надпочечников, что позволяет железам дольше выдерживать рабочие перегрузки в условиях иммобилизационного стресса, отодвигая наступление его критической фазы.
Большинство авторов, изучавших ультраструктуру спонгиоцитов в динамике истощающего стресса, как правило, анализируют сдвиги на уровне внутриклеточных структур, лимитирующих гормоносинтез. При этом набухание митохондрий, утрата их целостности и кристного материала, вакуолизация эндоплазматического ретикулума и последующее исчезновение его канальцев, изменение объемных плотностей соответствующих органелл и т. п. часто оцениваются как издержки функционального перенапряжения секреторных элементов, проявляющиеся деструкцией морфологического субстрата. Однако такие оценки не учитывают возможных колебаний количественных параметров или тонкого строения органелл в зависимости от особенностей их функционального состояния и гетерогенности пула клеток пучковой зоны. Совершенно различные по виду органеллы могут быть абсолютно нормальными компонентами внутренней среды спонгиоцитов, находящихся в разных фазах клеточного цикла. Поэтому здесь вряд ли можно говорить об дезинтеграции или деструкции инфраструктуры клеток, но и вообще не имеет смысла отслеживать какую-либо усредненную динамику ультраструктурных сдвигов тех или иных внутриклеточных органелл в процессе развития стрессорной реакции, так как, в лучшем случае, в принятых условиях можно получить информацию о преобладании того или иного типа клеток.
На рис. II-4 представлены результаты подсчета количества темных клеток в пучковой зоне коры надпочечников и измерения уровня 11-ОКС в крови крыс при моделировании истощающего иммобилизационного стресса по Г. Селье.
Четкая обратная корреляция (зеркальность) кривых начиная с 1-го часа иммобилизации, очевидно, отражает известную реципрокность функции (работы) и пластики (восстановления), поскольку темные клетки фактически выключаются из активного стероидогенеза [22].
Особенно интересен процесс формирования волны темных клеток пучково-сетчатой зоны коры надпочечников в терминальный период стресса (фаза истощения), где вначале после суточной иммобилизации они почти полностью исчезают из поля зрения, затем через двое суток начинают в нем доминировать, а к третьим суткам опыта их количество снова снижается до исходного уровня. Пикантность ситуации заключается в том, что фактически эта динамика явно противоречит основополагающему постулату концепции Г. Селье об истощении как логическом финале стресса. Действительно, какое может быть истощение при таком громадном росте функционального резерва секреторных элементов, каковым в коре
надпочечников являются темные клетки. Массовое появление темных клеток обычно связывают с дегидратацией тканей. Обезвоживание организма животных в динамике иммобилизационного стресса по Г. Селье является твердо установленным фактом [400].
Однако волновая динамика, т. е. подъем, а затем снижение содержания темных клеток в коре надпочечников на фоне прогрессирующей дегидратации в терминальной фазе стресса [22], заставляет искать другие объяснения этому феномену. Исходя из результатов электронномикроскопического исследования желез и типажирования спонгиоцитов по их ультраструктуре в принятых условиях, где к 24-му часу опыта выявлен значительный рост числа просветленных клеток, к 48-му часу – мозаичных и темных, а к 72-му часу – умеренно темных и светлых, можно предположить, что появление темных клеток обусловлено генерализацией процесса утомления секреторных элементов [22] в результате предшествующей мобилизации всех наличных функциональных ресурсов желез для обеспечения повторного всплеска стероидогенеза, который имел место к концу первых суток экспозиции стресса. Утомление – это защитный механизм, с помощью которого клетки коры надпочечников удерживаются на орбите жизненного цикла и тем самым предохраняются от тотального разрушения в условиях истощающих рабочих нагрузок [22]. Утомление – это преходящее функциональное состояние просветленных клеток, которые затем последовательно трансформируются в мозаичные – темные – умеренно темные и, наконец, светлые клетки, которые не только полностью восстанавливают исходную ультраструктуру, но и способны снова включаться в секреторный акт, что обеспечивает некоторый подъем уровня 11-ОКС в крови к 72-му часу опыта по сравнению с предыдущим сроком (рис. II-4).
Защитную роль утомления секреторных элементов коры надпочечников [22] логически трудно совместить с предагональным состоянием животных в терминальном периоде иммобилизационного стресса. Поэтому правомочность такой постановки вопроса необходимо было доказать адекватным гарантированным внеагональным экспериментом с предварительным утомлением спонгиоцитов и последующим наслоением на него стандартной истощающей нагрузки. Для моделирования подобного состояния мы использовали стрессогенные свойства витамина РР [20]. Ранее было показано, что активация гормонообразовательной функции коры надпочечников под влиянием никотинамида носит дозозависимый характер, по динамическим параметрам не отличается от аналогичного действия экзогенного АКТГ и реализуется по стрессорному механизму, что подтверждается ее отсутствием у гипофизэктомированных животных [20]. Исходя из этих данных, предполагалось, что, поддерживая постоянную рабочую нагрузку на надпочечники, систематическим введением достаточно большой дозы ниацина можно будет постепенно перевести спонгиоциты в режим утомления. Однако при анализе электронограмм надпочечников, полученных после однократного введения 200 мг/кг никотинамида, неожиданно выяснилось, что в пучково-сетчатой зоне явно нарастает содержание мозаичных клеток, которые наряду с просветленными являются морфологическими репликами состояния утомления. Это сразу минимизировало схему эксперимента, сведя ее до разовой нагрузки витамином РР.
Подсчет темных клеток выявил характерную динамику нарастания их количества в поле зрения с максимумом к 6-му часу и последующей его стабилизацией вплоть до 72 ч опыта (рис. II-5). Электронномикроскопически, начиная с 6-часовой экспозиции действия никотинамида, среди темных клеток преобладали мозаичные. Поскольку всплеск стероидогенеза в принятых условиях был относительно небольшим по амплитуде и непродолжительным по времени (максимум к 1-му часу и полная нормализация к 6 ч опыта), выявленное увеличение содержания темных клеток, которое в два раза превышает аналогичный подъем при гораздо более мощном иммобилизационном стрессе (рис. II-4), очевидно, должно объясняться не функциональным перераздражением секреторных элементов, а какими-то другими причинами, например метаболической перегрузкой спонгиоцитов при утилизации больших количеств никотинамида в железистой ткани [23].
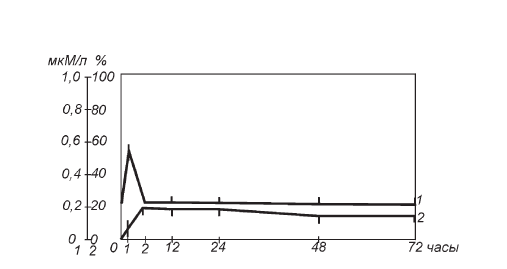
Рис. II-5. Динамика содержания 11-ОКС (1) в крови и процент темных клеток (2) в пучковой зоне коры надпочечников крыс при однократном введении никотинамида
При воспроизведении у крыс истощающего стресса по схеме Г. Селье на фоне суточной экспозиции действия инъекции 200 мг/кг никотинамида выявлен четкий сдвиг вправо в динамике морфобиохимических проявлений его терминальной фазы. Состояние утомления секреторных элементов в коре надпочечников, связанное с исчезновением темных клеток и ростом числа просветленных, развивается не через 24 ч, как раньше (рис. II-4), а только через 48 ч. На сутки сдвинут и последующий всплеск количества темных клеток, где также преобладают мозаичные. Соответственно растянута во временной шкале опыта и динамика 11-ОКС в крови (рис. II-6).
В течение 72 ч истощающего стресса фактов гибели в группе животных, получивших накануне большую дозу витамина РР, не зафиксировано, в то время как в контрольной группе она составляла 50 %. Обусловленная никотинамидом отсрочка наступления фатальных событий в принятых условиях опыта свидетельствует о его защитной роли. Согласно представлениям Г. Селье о перекрестной адаптации, однократное применение стресс-реакции может предотвращать развитие некрозов миокарда и соответственно гибель животных [153]. По нашим данным, превентивная нагрузка животных большой дозой никотинамида (200 мг/кг), обладающего стрессогенным действием, существенно снижает развитие дистрофических процессов в морфофункциональном комплексе (капиллярное русло и эндокринная паренхима), обычно имеющих место при 72-часовой иммобилизации. Констатация защитного действия никотинамида, вызывающего массовое появление темных клеток, одновременно свидетельствует о том, что последние действительно представляют собой функциональный резерв секреторных элементов коры надпочечников, и означает, что они прошли полный цикл регенерации, который всегда реализуется через активацию генома и новообразование РНК – ДНК.
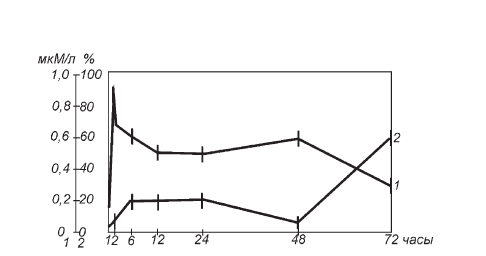
Рис. II-6. Влияние никотинамида на динамику содержания 11-ОКС в крови (1) и процент темных клеток (2) в пучковой зоне коры надпочечников крыс в различные сроки иммобилизационного стресса
Известно, что дозированным стрессом можно предотвратить развитие инфаркта миокарда [153], некроза переохлажденных тканей, аллергических реакций, адреналинового отека легких [86а]. Во всех случаях, когда действие добавочных неспецифических раздражителей (скипидар, формалин, электрический ток и др.) предшествовало влиянию патогенного раздражителя, наблюдалось резкое угнетение патологических процессов [86а, 153]. По мнению Г. Косицкого, неспецифический раздражитель определенной силы создает в центральной нервной системе очаг доминантного возбуждения, благодаря которому в большей или меньшей степени угнетаются остальные рефлекторные реакции организма, в том числе и рефлекторные компоненты всех указанных выше патологических процессов, что способствовало предупреждению их развития [86а].
Однако Г. Селье считает, что повышение резистентности и предотвращение развития патологических процессов в принятых условиях зависят от усиления генерации адаптивных гормонов в ситеме гипофиз – кора надпочечников, которые лимитируют устойчивость организма не только по отношению к действию этих же стрессоров (прямая резистентность), но и других патогенных раздражителей (перекрестная резистентность) [153]. Действительно, предварительное введение АКТГ повышает выживаемость животных и в значительной мере предотвращает деструктивные изменения секреторных элементов коры надпочечников при истощающем иммобилизационном стрессе [22]. Не вдаваясь в полемику между Г. Косицким и Г. Селье о том, чей вариант объяснения индуцированной резистентности предпочтительнее, в качестве исходной посылки примем оба (поскольку никотинамид обладает выраженным стрессогенным действием [23], то не исключено, что повышение устойчивости организма крыс к иммобилизации после массированной витаминной нагрузки может реализоваться либо через создание в центральной нервной системе очага доминантного возбуждения, либо через гуморальный механизм перекрестной адаптации) и попытаемся предложить еще один – антистрессорный.
Дело в том, что, применяя вместо никотинамида витамин В1 (инъекции по 200 мг/кг за 24 ч до начала опыта, затем через каждые сутки иммобилизации и последний раз – за 2 ч до забоя), обладающий антистрессорным действием (рис. II-7), можно добиться такого же полного выживания животных при 72-часовой экспозиции. Существенное ограничение тиамином стероидогенной реакции надпочечников при иммобилизационном стрессе автоматически снимает варианты объяснения повышения резистентности организма в принятых условиях, связанные с формированием превентивной доминанты [86а] или перекрестной адаптации [153]. Ранее было показано, что антистрессорные эффекты тиамина опосредуются инсулином, являющимся мощным стресслимитирующим фактором, который не только уравновешивает многочисленные метаболические эффекты стресс-гормонов, но и тормозит их образование в надпочечниках [18].
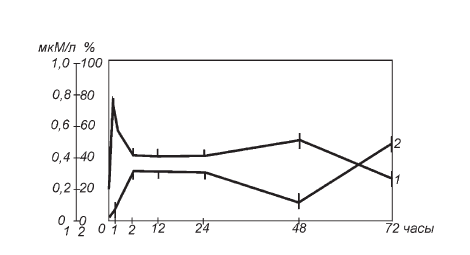
Рис. II-7. Влияние тиамина на динамику содержания 11-ОКС в крови (1) и процент темных клеток (2) в пучковой зоне коры надпочечников крыс в различные сроки иммобилизационного стресса
Тиамин активирует инсулинсинтетическую функцию поджелудочной железы, повышает уровень иммунореактивного инсулина в крови при стрессе и оказывает выраженное инсулиноподобное действие на обмен веществ, в том числе и в отношении процессов, являющихся маркерными на действие инсулина [22]. В свою очередь, инсулин, снижая соотношение цАМФ/цГМФ в секреторных элементах коры надпочечников, блокирует их органоспецифическую функцию и одновременно через описанный выше механизм переключения генетического триггера дифференцированных клеток активирует аутосинтетические гены, обеспечивающие постсекреторную реабилитацию, т. е. превращение светлых кортикоцитов в темные.
Обычно повышенный уровень иммунореактивного инсулина в крови в ответ на стрессорное раздражение несколько запаздывает по сравнению с «выходом» пика кортикостероидов и является непродолжительным [23]. Тиамин способствует временной синхронизации максимумов гормонообразования в коре надпочечников и инсулоцитах при стрессе [23], тем самым определяя синфазную динамику нарастания в первые часы иммобилизации 11-ОКС в крови и темных клеток в эндокринной паренхиме адреналовых желез (рис. II-7).
Из сравнения данных, представленных на рис. II-4, II-6 и II-7, видно, что через повышение уровня темных клеток тиамин, как и никотинамид, «отодвигает» наступление драматических событий в морфодинамике эндокринной паренхимы при иммобилизационном стрессе (сдвиг вправо по временной шкале опыта).
Зависимость защитного эффекта от глубины реакции напряжения, т. е. степени раздражения секреторных элементов коры надпочечников, и величины дозы вводимого витамина исследовалась на модели мощного болевого стресса. Венозный гемостаз, развивающийся в дистальном участке хвоста крысы после наложения мягкой проволочной лигатуры (не сдавливающей артерии), является сильнейшим раздражителем гипофизадреналовой системы. Об этом свидетельствует не только нарастающее во времени возбуждение животных, приводящее обычно к «отгрызанию» (ампутации) перевязанного участка хвоста, но и более чем четырехкратная активация стероидогенеза к 24-му часу опыта (рис. II-8). Чтобы вызвать сколько-нибудь ощутимое ограничение стероидогенной реакции в принятых условиях, нужны по крайней мере две последовательные инъекции тиамина по 4 мг/кг за 48 и 24 ч до забоя животных. При такой степени раздражения надпочечников разовой нагрузки витамином явно недостаточно. Защитная роль тиамина особенно отчетливо выявляется в условиях хронического эксперимента с неоднократным воспроизведением венозного гемостаза на все более проксимальных участках хвоста крысы. Из рис. II-9 видно, что в контрольной группе животных после наложения 7-й лигатуры, т. е. спустя неделю от начала опыта, функциональные резервы надпочечников находятся на грани истощения. Железы уже неспособны ответить на наложение очередной (8-й по счету) лигатуры таким же резким увеличением стероидогенеза, как на первую. Из сравнения рис. II-8 и II-9 следует, что одинаковое стрессорное воздействие в конце опыта стимулирует функцию надпочечников всего на 50 %, т. е. в 8 раз меньше, чем в начале. Ежедневное парентеральное введение тиамина в течение всего эксперимента заметно препятствует истощению функциональных резервов желез.
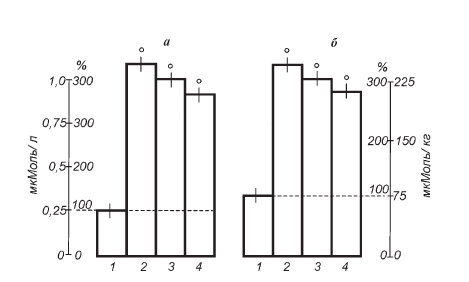
Рис. II-8. Влияние тиамина на стероидогенную реакцию надпочечников крыс при мощном болевом раздражении. Значения М±m для кортикостероидов крови (а – мкмоль/л) и надпочечников (б – мкмоль/кг). 1 – контроль, 2 – стресс, 3 и 4 – стресс на фоне однократного и двукратного введения тиамина
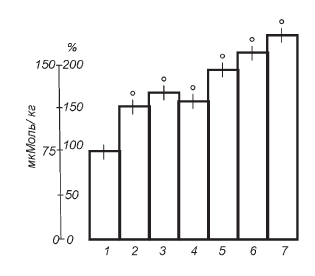
Рис. II-9. Влияние тиамина на функциональные резервы коры надпочечников при длительном мощном болевом раздражении: 1 – контроль, 2 – стресс, 3, 4 – стресс на фоне семидневного введения тиамина в дозах (мг/кг) (3 – 0,2, 4 – 0,5), 5 – 1,0, 6 – 2,0, 7 – 4,0
Защитный эффект тиамина отчетливо зависит от дозы: чем больше вводилось витамина, тем выше секреторный ответ надпочечников на стрессорное воздействие в конце опыта. Так, в аналогичных условиях раздражения степень увеличения функциональной активности надпочечников у крыс, получавших 4 мг/кг тиамина, оказалась в 1,5 раза выше, чем у животных, которым витамин не вводился. Вместе с тем дозозависимость сдвигов и отсутствие плато, т. е. неуклонное нарастание защитного эффекта в широком диапазоне применявшихся концентраций тиамина (рис. II-9), указывают на наличие неиспользованных резервов биологического действия витамина, которые, очевидно, могут быть реализованы при дальнейшем увеличении его дозы. Сохранение к концу опыта определенного запаса функциональной емкости желез у животных, получавших тиамин, может рассматриваться как прямое доказательство тезиса о предохранении витамином секреторных элементов коры надпочечников от функционального перераздражения в условиях стресса.






