ПАТОГЕНЕЗ
При ОА патологические изменения происходят в гиалиновом хряще и субхондральных отделах эпифизов костей.
Суставные концы костей окружены гладкой блестящей хрящевой тканью, которая помогает им скользить, смягчать толчки, их удары друг о друга. Строение хряща сходно с губкой. Он получает питание путем диффузии из капилляров синовиальной оболочки и субхондральной кости через синовиальную жидкость и матрикс хряща. В покое он впитывает окружающую его жидкость, поступающую в сустав. При движении сустава (сгибании или разгибании) хрящ эту жидкость выдавливает. Хрящевые клетки — хондроциты — находятся внутри основного вещества хряща. Они осуществляют биосинтез коллагеновых волокон и протеогликанов, так же как и ферментов, разрушающих матрикс (катепсин D, нейтральные протеазы, коллагеназа). Так как хрящевая ткань лишена сосудов, то обладающие интенсивной метаболической активностью высокоактивные в молодом возрасте хондроциты чрезвычайно чувствительны к нарушению кровоснабжения в суставе.
Внеклеточный матрикс хряща состоит из коллагеновых волокон и протеогликанов. Коллаген II типа представляет собой большое число коллагеновых молекул, которые формируются в виде коллагенового волокна. Протеогликаны — макромолекулы, синтезируемые хондроцитами из стержневого белка. Протеогликан состоит из глюкозаминогликанов, хондроитинсульфата (ХС) и кератосульфата, которые выступают из сердцевины белка, придавая этой молекуле конфигурацию щетки для чистки бутылок. Большая часть молекул протеогликана существует в виде агрегатов (отдельные молекулы связаны длинной цепочкой гиалуроновой кислоты). Крупные агрегаты гидрофильны, они связывают воду и обеспечивают ее диффузию. Особая роль в способности удерживать влагу принадлежит хондроитинсульфату. ХС 4 типа преобладает в «молодом хряще» и имеет способность удерживать большое количество молекул воды. В старшем возрасте уменьшено количество ХС 4 типа за счет увеличения ХС 6 типа. Вода составляет 80 % массы суставного хряща. Интерстициальная вода обладает способностью перемещаться в пределах матрикса хряща. Она вытесняется из участка, испытывающего давление, чтобы вновь возвращаться в него после прекращения воздействия. Благодаря своей несжимаемости, вода обеспечивает тургор хрящевой ткани. Большие, наполненные водой соединения протеогликанов переплетены друг с другом и стянуты сетью волокон коллагена II типа, придавая хрящу эластичность. Они же создают плотную трехмерную сетку, обеспечивающую прочность пространственной структуры. Все это делает хрящ твердым, эластичным, гладким и устойчивым к механическим воздействиям (Джиллиленд Б. К., 1996). Здоровый, полноценный гиалиновый хрящ, который испытывает нормальное давление, почти не изнашивается (Каррей Х. Л. Ф., 1990).
При расстройстве функции хондроцитов или их гибели происходит репаративная регенерация, пролиферация неполноценных хондроцитов. Они вырабатывают уменьшенное количество протеогликанов с измененным составом. Неполноценные и нестабильные протеогликаны менее агрегированы, что позволяет им легко покидать матрикс. Кроме повреждения протеогликанов, частично разрушается и коллагеновая сеть, которая уже не восстанавливается. Наряду с коллагеном II типа, поврежденные хондроциты продуцируют короткий, не образующий фибрилл, коллаген I типа. В хряще возникают вертикальные щели и изъязвления. Продукты распада и суставная жидкость распространяются до базального слоя, что приводит к появлению мелких участков остеонекроза и субхондральных кист (Watt I., 2000). Таким образом, изменение состава основного вещества хряща приводит к разволокнению и расщеплению матрикса. Уменьшается гидрофильность хряща. Формируется так называемая хондроидная ткань. Способность новообразованной хондроидной ткани к растяжению, компрессии снижена. Клетки ее склонны к эндогенной оссификации (Твердынин М. С. [и др.], 1987). При гибели хряща хондроидная ткань разрастается по краям суставных поверхностей для компенсаторного перераспределения механической нагрузки, формируя хондрофиты, которые в дальнейшем, окостеневая, превращаются в остеофиты (Коваленко В. Н., 2003). Постепенная атрофия хрящевой ткани на рентгенограммах отражена в виде уменьшения суставной щели. Даже незначительное уменьшение высоты хряща вызывает повреждение и компрессию трабекул, склерозирование субхондральной костной ткани (Benske J. [et al.], 1989). При ОА находят усиление костеобразования — эбурнацию (Джиллиленд Б. К., 1996) — в субхондральных участках: утолщение костных трабекул, субхондральный склероз, эностоз, кисты с ободком остеосклероза, остеофиты. В отличие от уменьшения костной ткани при остеопорозе старых людей, у больных ОА пожилого возраста отмечают увеличение костной массы.
По данным J. H. Kellgren, J. S. Lawrence (1957), уточненным нами рентгенографией с прямым многократным увеличением в обработке аналоговыми ЭВМ (Тарасов А. Н., Заболотных И. И. [и др.], 1989), ОА рентгенологически подразделяют на четыре стадии:
I стадия — кистовидная перестройка субхондральных отделов по периферии эпифизов и рядом расположенные заострения суставных концов или намечающиеся остеофиты (рис. 6а, 6б).
II стадия — четкие остеофиты, кистовидная перестройка, участки неравномерного субхондрального склероза при нормальной суставной щели (рис. 7).
III стадия — массивные остеофиты, деформация суставных концов костей, неравномерное сужение суставной щели, выраженный субхондральный склероз. Более выраженному развитию окостеневающей хондроидной ткани по периферии способствует близость к синовиальной оболочке, васкуляризация (Астапенко М. Г., 1989). Отчетливо видны участки субхондрального склероза и мелкие эностозы. Типично неравномерное сужение суставной щели. Целостность замыкающей пластинки не нарушена, хотя контуры ее выглядят неровными. Эпифизы теряют свою равномерную трабекулярную структуру, костные трабекулы истончены, ячейки деформированы, увеличены в размерах (рис. 8).
IV стадия — резко выраженная деформация эпифизов, более значительная в суставной впадине, значительное неравномерное сужение суставной щели с возможным разрушением кортикального слоя эпифизов, подвывихами суставов. В IV стадии деформация эпифизов более значительна в суставной впадине. Крупные разрушенные остеофиты окружают суставную поверхность. Расположены остеофиты в основном по тыльным и боковым поверхностям фаланг, в меньшей степени — по ладонной плоскости. Смежные отделы костей склерозированы, с множественной кистовидной перестройкой как по периферии, так и по оси сустава. Суставная щель значительно неравномерно сужена (рис. 9, 10).
Необработанное увеличение: выраженное неравномерное сужение суставной щели разной толщины и расположенный отдельными участками субхондральный склероз, остеофит основания и умеренная кистовидная перестройка головки (см. рис. 10, а); резко выраженный остеофит и крупный отломок остеофита, множественная кистовидная перестройка, неравномерный субхондральный склероз и значительное сужение суставной щели (см. рис. 10, б).
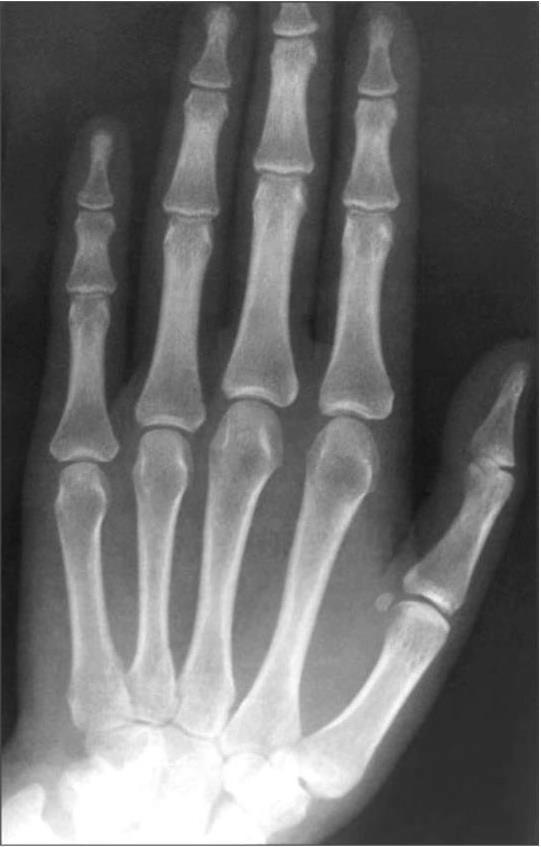
Рис. 6а
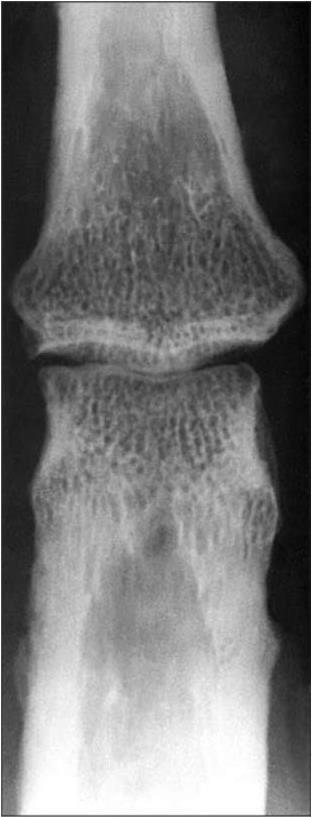
Рис. 6б. Прямое 8 кратное увеличение рентгеновского изображения. Видна кистовидная перестройка структуры суставных концов, окостеневающая хондроидная ткань (остеофит) у основания дистальной фаланги
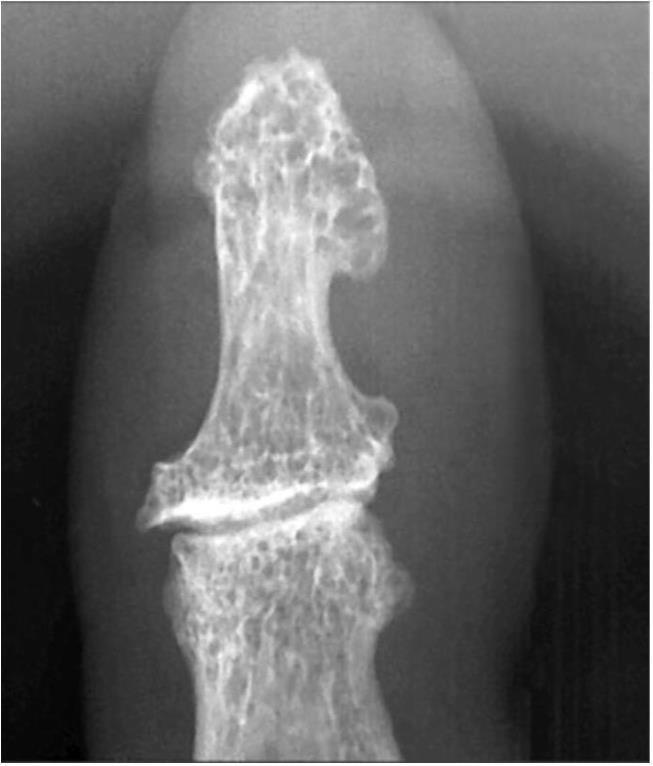
Рис. 7. Рентгенограмма дистального и проксимального межфаланговых суставов кисти больного со II стадией первичного остеоартроза Прямое 5 кратное увеличение рентгеновского изображения. Кистовидная перестройка субхондральных отделов возле участка разросшейся окостеневающей хондроидной ткани — остеофит. Неравномерно выраженный субхондральный склероз, преимущественно в суставной впадине, эностоз
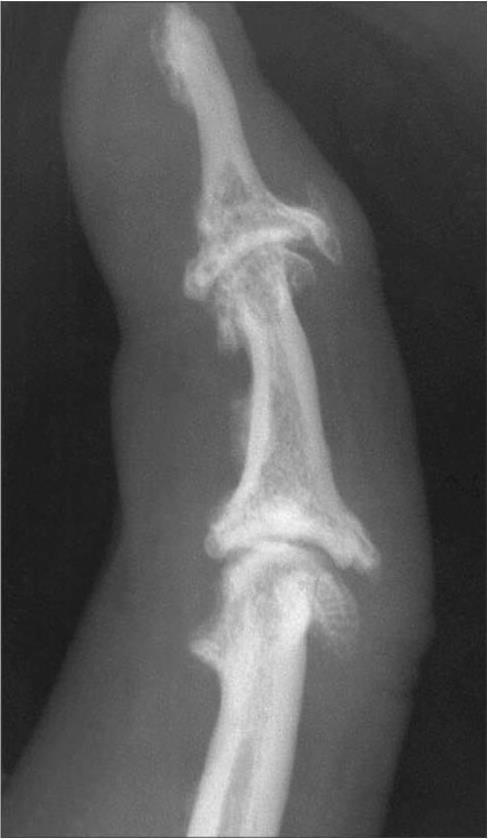
Рис. 8
Резко выраженные остеофиты в суставных впадинах и головках на фоне множественной кистовидной перестройки. Резко выражен субхондральный склероз. Неравномерное сужение суставной щели
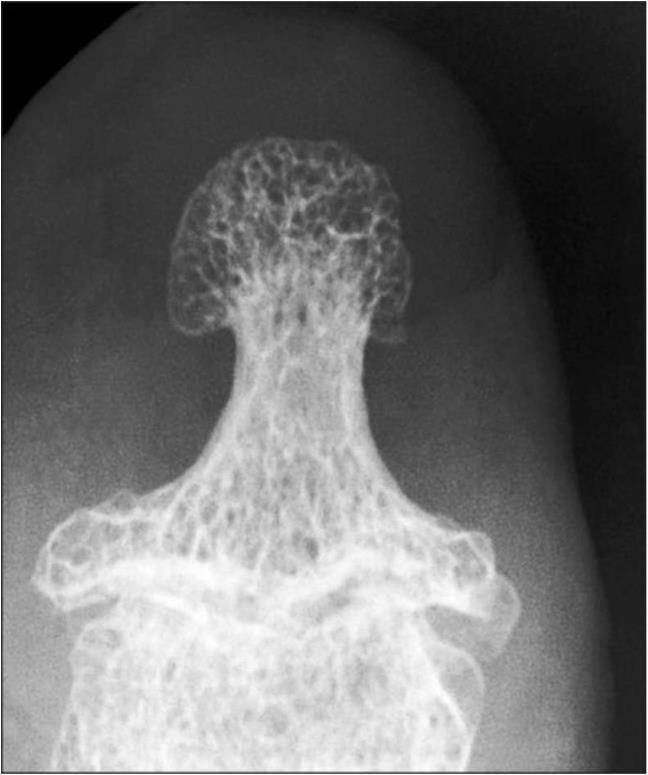
Рис. 9
Прямое 7-кратное увеличение рентгеновского изображения. Значительное неравномерное сужение суставной щели. Расположенный отдельными участками субхондральный склероз, эностоз. Множественная кистовидная перестройка. Резко выраженное разрастание окостеневающей хондроидной ткани — остеофиты
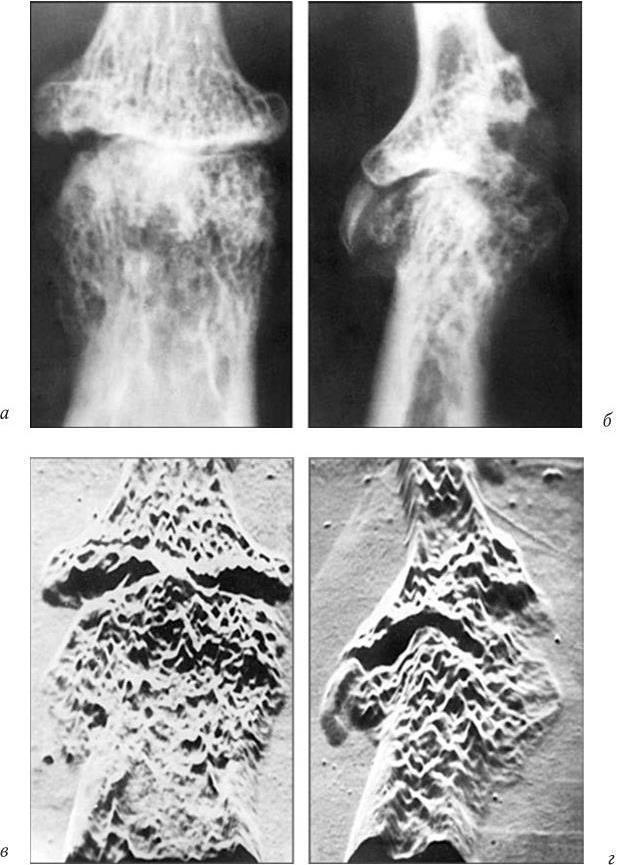
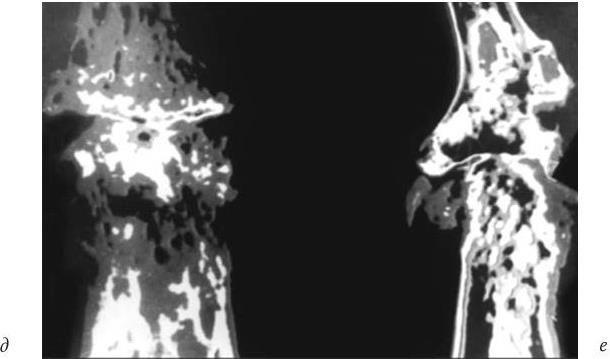
Рис. 10
а, в — прямая проекция; б, г — боковая проекция. Пояснения в тексте Рентгенограмма дистального межфалангового сустава III пальца больного IV стадией первичного остеоартроза (5-кратное увеличение рентгеновского изображения) (окончание):
д — прямая проекция; е — боковая проекция
Обработка изображения на ЭВМ методом амплитудного рельефа: четко представлена деформация костных балок (новообразованная костная ткань накладывается холмами на поверхность кости), толстый слой неравномерного субхондрального склероза, мелкие кисты с костной стенкой, не обнаруженные даже при прямом многократном увеличении, и видоизмененная полость сустава (см. рис. 10, в); значительная деструкция костных балок эпифизов, склероз подхрящевых отделов, слоистая структура остеофита и трансформированная полость сустава (см. рис. 10, г).
Обработка изображения на ЭВМ методом эквиденситных полей: видно грубое преобразование всей трабекулярной структуры, в зонах перестройки теряется трабекулярность (неодинаковой формы и размеров очаги костной плотности), костная ткань распределена по всей ширине кости, отмечается резкое изменение трабекулярной структуры и деформация зоны ядра эпифиза, отсутствует плотная часть, соответствующая костномозговому каналу (см. рис. 10, д, е). Используя магнитно-резонансный томограф, можно определить толщину, объем, геометрию и топографию поверхности хряща, выявить кистовидные изменения в субхондральной зоне. Но обнаружена лишь частичная конкордантность повреждений хряща при МРТ (Коваленко В. Н., 2003). Автор отмечает возможность точного измерения толщины суставного хряща при использовании высокочастотного УЗИ, но показывает, что наиболее достоверное измерение толщины хряща и суставных тканей дает артроскопия.
Вторичный остеоартроз (ВОА) развивается после повреждения хряща вследствие механической травмы, перенесенного ранее воспаления сустава, статической перегрузки (укорочения конечности), при генерализованной гипермобильности, подвывихах тазобедренных суставов при родах, а также в результате термических воздействий.
Самыми частыми причинами ВОА являются профессиональные травмы и микротравмы с разрывом связочного аппарата и появлением гипермобильности сустава, что обусловливает неравномерность нагрузки на площадь опоры, нарушение нормального соотношения суставных поверхностей (конгруэнтность) с последующим перераспределением нагрузки на них, с концентрацией давления на определенном участке. Возникает несоответствие между механическим давлением на суставную поверхность хряща и возможностью хряща сопротивляться данной нагрузке. ВОА развивается при часто повторяющихся стереотипных движениях (Хитров В. В. [и др.], 1999). Вследствие этого появляются дегенеративные изменения хондроцитов, испытывающих избыточную или недостаточную нагрузку, уменьшение кровоснабжения. Клиника ВОА манифестирует в пожилом возрасте.
Коленные суставы страдают у грузчиков, лучезапястные — у плотников, локтевые и плечевые — у маляров, шоферов, шахтеров. Развивается ОА коленных суставов у футболистов, хоккеистов, при прыжках в высоту, в длину, с парашютом. У гимнастов, борцов и легкоатлетов выявляют ОА в плечевых, у волейболистов — в лучезапястных суставах. Артроз мелких суставов кистей диагностируют у доярок, гальванщиц, ткачих и секретарей-машинисток; голеностопных — у балерин (Трнавски К., 1994).
При ВОА и повреждение, и патологический процесс локализованы. Лишь при резко выраженных изменениях заболевание распространяется на компенсирующие суставы (симметричные или смежные). При отсутствии в анамнезе дефектов развития опорно-двигательного аппарата, значительных травм или профессиональных микротравм, перенесенных воспалений, а также других явных причин повреждения хряща и возникновении генерализованного поражения трех и более различных суставных групп (верхних, нижних конечностей и позвоночника) диагностируют деформирующий первичный остеоартроз (ПОА). Он составляет около половины всех случаев ОА (ПОА — 40–50 %; ВОА — 50–60 %) (Астапенко М. Г., 1989).
Генерализованное заболевание многих суставов позволяет предполагать, что возникновение и течение ПОА определяют не столько внешние, сколько внутренние факторы (наследственная предрасположенность, нервно-эндокринные нарушения, изменения общего обмена и кровообращения) (Астапенко М. Г., 1989). Ведущая роль в развитии ПОА принадлежит нарушению региональной гемодинамики и микроциркуляции с последующим присоединением элементов тканевой гипоксии (Заболотных И. И., 1989; Швед Н. Т. [и др.], 1991;
Беляева А. А., Истомина И. С., 1991). Y. Etherington, T. D. Spector (1995) подчеркивают неправомерность объяснения развития ПОА в результате чисто механического воздействия.
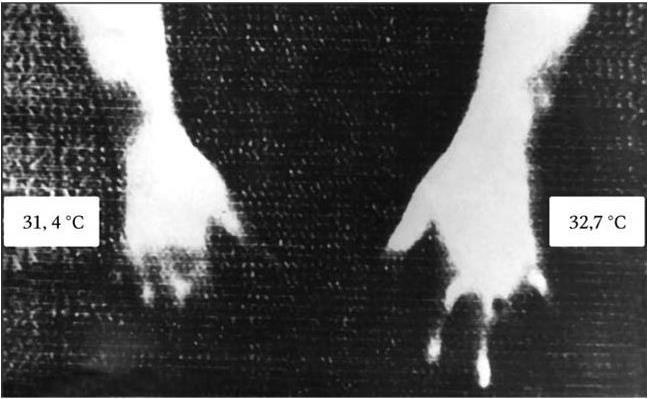
Рис. 11
Значительная термоасимметрия как по данным электротермии (у здоровых людей до 0,4 °C), так и на теплограмме. Резко выраженный симптом термоампутации пальцев справа на уровне суставов запястья. Слева — на уровне пястно-фаланговых суставов в IV и V пальцах
У больных ПОА, как правило в детские или юношеские годы, было перенесено значительное, запомнившееся охлаждение, которое во многих случаях совпадало с отрицательными эмоциями (падение в прорубь, ходьба по болоту поздней осенью, длительное пребывание на морозе и т. д.) (Заболотных И. И., 1989). Охлаждение чаще было однократным, но у некоторых больных повторялось (у разведчиков, блокадников, метеорологов на Крайнем Севере или в Антарктиде, летчиков самолетов с открытой кабиной). В основном это были охлаждения I стадии (без снижения общей температуры ниже нормы) или II стадии (со снижением температуры ниже нормы при сохранности активного дыхания, кровообращения).
При повреждении тканей суставов вследствие влияния низкой температуры происходит нарушение обмена хондроцитов с последующей их дистрофией и гибелью, а также возникают расстройства микроциркуляции в сосудах синовиальной оболочки и субхондральных отделов эпифизов. В последних развиваются микроинфаркты, которые в дальнейшем превращаются в кисты (Копьева Т. Н., 1988; Ficat P., Arlet J., 1977). Ишемия и некроз субхондральной кости с прогрессирующей облитерацией ее сосудов нарушают питание хряща со стороны спонгиозной кости и являются одним из важнейших факторов дегенерации хондроцитов. Об этом свидетельствует тот факт, что именно рядом с участками эпифизов со значительной кистовидной перестройкой, т. е. с наиболее выраженным расстройством кровообращения, отмечено наибольшее разрастание новообразованной окостеневающей хондроидной ткани, как это особенно отчетливо видно на рис. 7. Кистовидная перестройка субхондральных отделов локализована преимущественно по периферии, где влияние охлаждения более значительно, а ишемия усугубляется нарушением кровотока в синовиальной оболочке.
Расстройству сосудистого кровообращения в суставах способствует гиперадреналинемия, обусловленная холодом. Она же повышает чувствительность сосудов к прессорным веществам. Тем самым запускается процесс нарушения обмена хряща, постепенной гибели хрящевых клеток. Расстройству циркуляции крови также способствуют эмоциональный стресс и нервно-психическое напряжение, часто совпадающие (по данным анамнеза) с охлаждением. Они провоцируют или усиливают сосудистую дистонию, которая служит основой нарушения кровоснабжения конечностей, суставов. Важная роль сосудистых расстройств в развитии ПОА подкреплена связью отрицательных эмоций с возникновением клинических проявлений заболевания.
По данным анамнеза, начальные клинические проявления ПОА у 87 % больных возникали спустя некоторое время (недели, месяцы) после значительного эмоционального стресса (смерть родственников, судебный процесс, крупные неприятности в семье, в квартире, на работе). Патогномонично для ПОА усиление болей в суставах после волнений.
Использование электротермометрии, реовазографии, тепловидения и рентгенографии с прямым многократным увеличением показало существенную роль нарушения тонуса сосудов, кровоснабжения суставов в развитии дегенеративных процессов в хряще и эпифизах суставов, в выраженности болевого суставного синдрома (Заболотных И. И., 1989). В участках максимальной боли у больных ПОА выявлена наибольшая асимметрия как при кожной электротермометрии, так и при тепловидении (рис. 11).
Симптомы термоампутации конечностей свидетельствовали о нарушении кровоснабжения исследуемых областей вследствие спазма сосудов, так как теплоизлучение возрастало после приема нитроглицерина. Более выраженный гипертонус выявлен на реовазограмме той конечности, в суставах которой боль была наиболее сильной в момент исследования. Значение сосудистого фактора доказано улучшением состояния больных после лечения сосудорасширяющими и седативными препаратами (Заболотных И. И., 1989).
Возрастное увеличение частоты выявляемости ОА связано с нарушением трофики всех тканей и ускорением процесса дегенерации хряща. С возрастом усиливаются как разволокнение коллагенового каркаса хряща, так и дефекты агрегации протеогликанов (Хитров Н. А. [и др.], 1999). У пожилых больных остеоартрозом не только прогрессирует патологический процесс в суставе, но и возрастает число пораженных суставов, особенно при ПОА, возникает их нестабильность, хотя интенсивность болевого синдрома ослабевает (Горбачев В. В., 1991). В возрасте 50–60 лет на фоне ОА может возникнуть другая патология суставов (подагра), что способствует более быстрому его прогрессированию. И наоборот, ОА способен осложнить воспалительные и деструктивные процессы в суставе (РА, подагру и др.). З. В. Хетагурова [и др.] (1991) отметили у больных в возрасте старше 50 лет сочетание ОА с ревматоидным артритом в 3,4 % случаев, псориатической артропатией — в 1,6 %.






